第三章《晶体结构与性质》单元测试卷(含答案)2022-2023学年下学期高二化学沪科版(2020)选择性必修2物质结构与性质
文档属性
| 名称 | 第三章《晶体结构与性质》单元测试卷(含答案)2022-2023学年下学期高二化学沪科版(2020)选择性必修2物质结构与性质 |  | |
| 格式 | docx | ||
| 文件大小 | 877.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-17 09:25:32 | ||
图片预览



文档简介
第三章《晶体结构与性质》单元测试卷
一、单选题
1.我国科学家用激光将置于铁室中石墨靶上的碳原子炸松,再用射频电火花喷射氮气,获得超硬新材料β-氮化碳薄膜,结构如图,下列有关β-氮化碳的说法错误的是
A.碳原子采取sp3杂化、氮原子采取sp2杂化
B.氮化碳属于共价晶体
C.氮化碳的化学式为C3N4
D.氮化碳硬度超过金刚石晶体
2.下列叙述中,错误的是
A.液晶具有液体的流动性,在某些物理性质方面还具有类似晶体的各向异性
B.某物质固态能导电,则它不一定是金属单质
C.超分子具有分子识别与自组装的特征
D.生成晶体的速率越快越好
3.下列说法正确的是
A.北京冬奥会采用石墨烯材料制造户外保暖穿戴设备,石墨烯属于共价化合物
B.晶体X射线衍射实验可以用于键长、键角和晶体结构的测定
C.金属的导电性、导热性和延展性都与金属键有关,金属光泽与金属键无关
D.液晶可用于制造显示器,是一类分子晶体
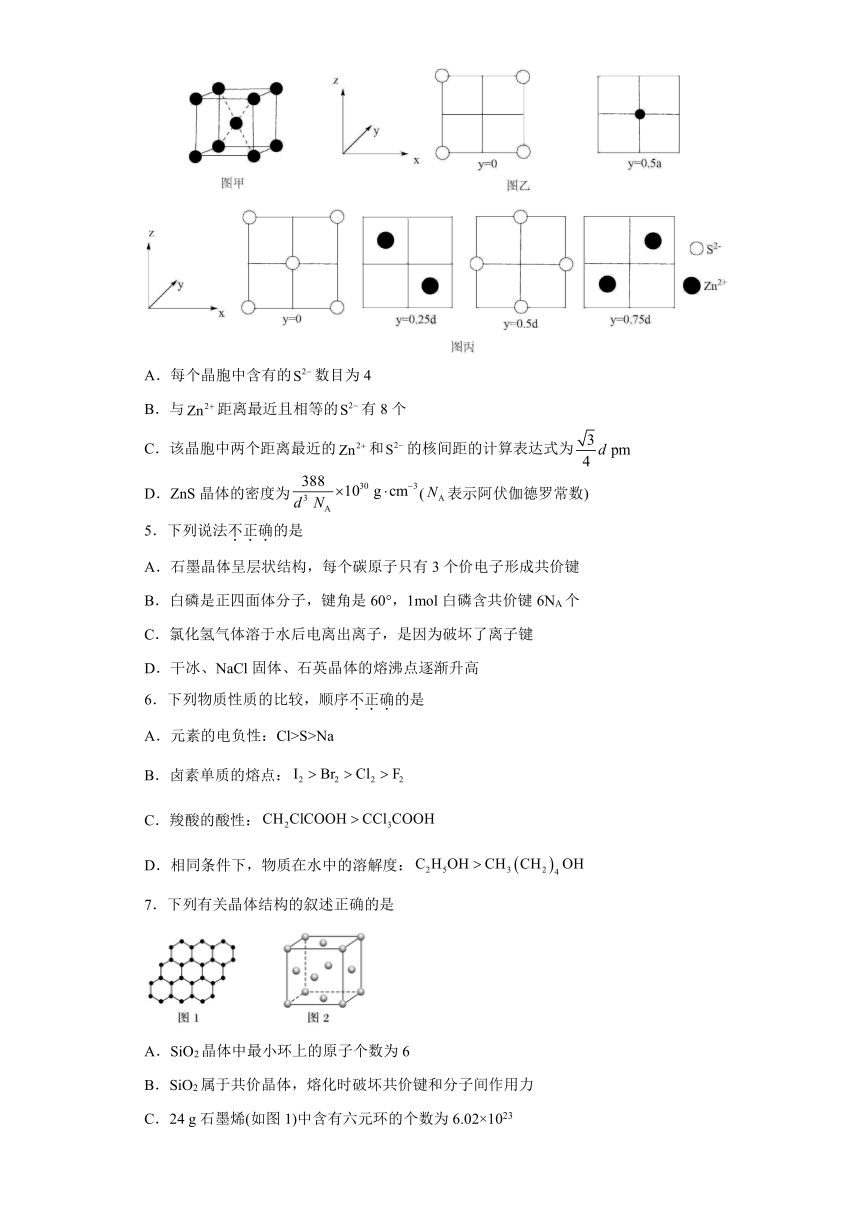
4.已知图甲为金属钠的晶胞,晶胞边长为,其晶胞截面如图乙所示。图丙为ZnS晶胞截面,已知ZnS属立方晶体,假设晶胞边长为。下列关于ZnS晶胞的描述错误的是
A.每个晶胞中含有的数目为4
B.与距离最近且相等的有8个
C.该晶胞中两个距离最近的和的核间距的计算表达式为
D.ZnS晶体的密度为(表示阿伏伽德罗常数)
5.下列说法不正确的是
A.石墨晶体呈层状结构,每个碳原子只有3个价电子形成共价键
B.白磷是正四面体分子,键角是60°,1mol白磷含共价键6NA个
C.氯化氢气体溶于水后电离出离子,是因为破坏了离子键
D.干冰、NaCl固体、石英晶体的熔沸点逐渐升高
6.下列物质性质的比较,顺序不正确的是
A.元素的电负性:Cl>S>Na
B.卤素单质的熔点:
C.羧酸的酸性:
D.相同条件下,物质在水中的溶解度:
7.下列有关晶体结构的叙述正确的是
A.SiO2晶体中最小环上的原子个数为6
B.SiO2属于共价晶体,熔化时破坏共价键和分子间作用力
C.24 g石墨烯(如图1)中含有六元环的个数为6.02×1023
D.720 g C60晶体中含有0.5×6.02×1023个晶胞(如图2)
8.下列说法正确的是
A.晶体中若存在阴离子,就一定存在阳离子
B.离子晶体不一定是化合物
C.离子晶体都易溶于水
D.离子晶体一定是由活泼金属和活泼非金属形成的
9.中国传统文化博大精深,蕴含着丰富的化学知识。下列说法错误的是
A.“烟花巷陌,依约丹青屏障”中烟花绽放出的绚丽色彩跟原子核外电子跃迁有关
B.(本草经集注)中记载了区分硝石和朴唒的方法。和均属于离子晶体
C.《淮南万毕术》中记载,“曾青得铁则化为铜”,铁位于元素周期表的第四周期第Ⅷ族
D.(石灰吟)中记载,“要留清白在人间”其中的结构示意图为
10.下列有关化学用语使用正确的是
A.基态Se原子的简化电子排布式:
B.甲基正离子的电子式:
C.石英的分子式:
D.氮原子核外电子排布的轨道表示式:
11.我国科学家率先利用作为客体分子进行组装,得到新型碳纳米管片段材料,合成效率优于石墨片层卷曲,此材料具有显著的光电效应。下列说法正确的是
A.中的碳原子为杂化 B.由形成碳纳米管为物理变化
C.石墨和均为分子晶体 D.碳纳米管导电的原因是形成了金属键
12.下列叙述正确的是
①在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
②C60晶体的晶胞是面心立方结构
③As是第VA族的元素,属于p区元素
④熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类,HgCl2是一种共价化合物、非电解质、盐、分子晶体
A.①② B.②③ C.①③ D.②④
13.下列关于金属及金属键的说法正确的是
A.金属键具有方向性与饱和性
B.金属具有光泽是因为金属阳离子吸收并放出可见光
C.金属能导电是因为金属在外加电场作用下产生了自由电子
D.金属键是金属阳离子与自由电子间的相互作用
14.下列说法中,正确的是
A.冰融化时,分子中氢氧键发生断裂
B.共价晶体中共价键越强,晶体的熔点和沸点越高
C.分子晶体中共价键键能越大,该分子晶体的熔点和沸点一定也越高
D.分子晶体中分子间作用力越大,该物质越稳定
15.下列关于晶体的说法不正确的是
A.共价晶体硬度通常比分子晶体大
B.离子晶体一般熔、沸点较高,熔融时能导电
C.分子晶体大多不溶于水,熔融时不能导电
D.金属晶体一般具有良好的导电性、导热性和延展性
二、填空题
16.按熔点由高到低的顺序排列为_______,熔点差异的原因是_______。
17.三草酸合铁酸钾是制备铁触媒上的主要原料。在光照下分解:
。回答下列问题:
(1)基态原子的电子排布式为___________,基态与中未成对电子的数目之比为___________。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________(填元素符号,下同),电负性最大的是___________。
(3)1个与1个分子中键数目之比为___________,分子的立体构型为___________。
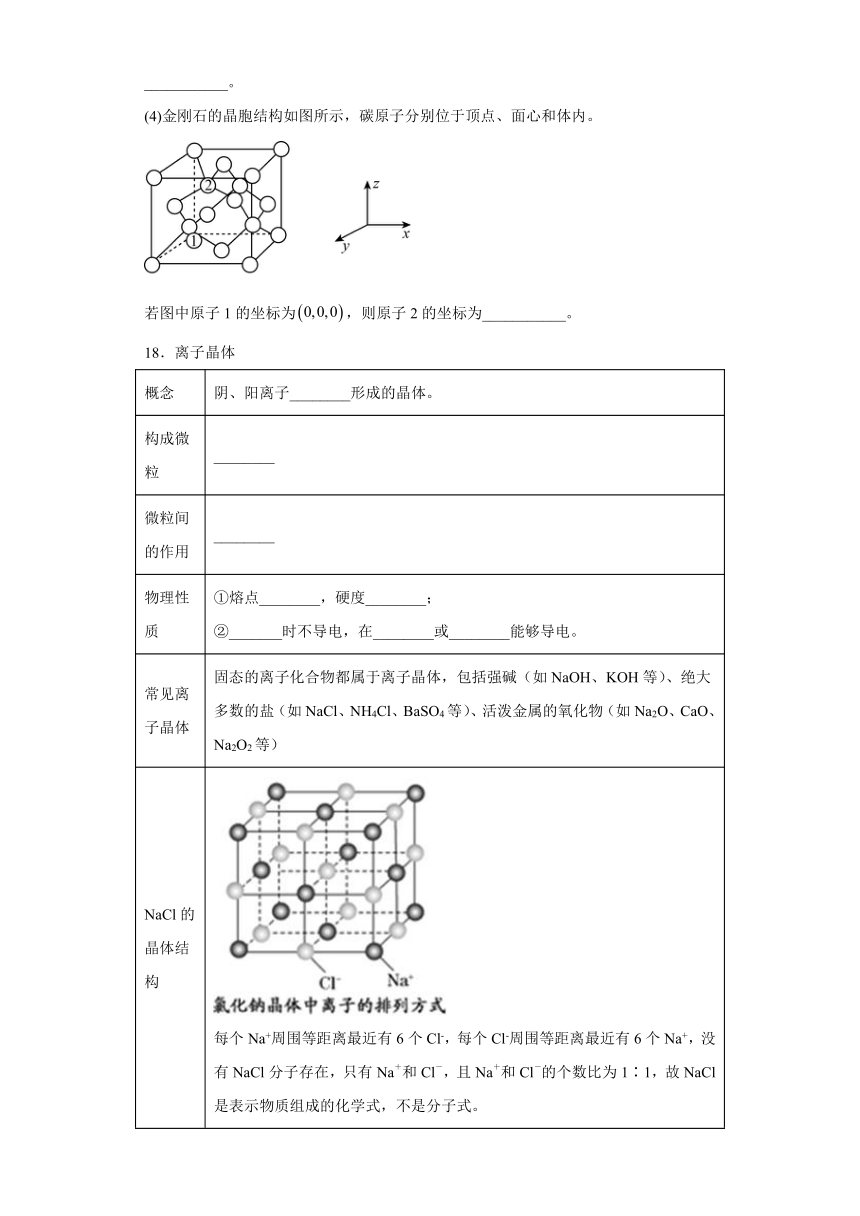
(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。
若图中原子1的坐标为,则原子2的坐标为___________。
18.离子晶体
概念 阴、阳离子________形成的晶体。
构成微粒 ________
微粒间的作用 ________
物理性质 ①熔点________,硬度________; ②_______时不导电,在________或________能够导电。
常见离子晶体 固态的离子化合物都属于离子晶体,包括强碱(如NaOH、KOH等)、绝大多数的盐(如NaCl、NH4Cl、BaSO4等)、活泼金属的氧化物(如Na2O、CaO、Na2O2等)
NaCl的晶体结构 每个Na+周围等距离最近有6个Cl-,每个Cl-周围等距离最近有6个Na+,没有NaCl分子存在,只有Na+和Cl-,且Na+和Cl-的个数比为1∶1,故NaCl是表示物质组成的化学式,不是分子式。
三、计算题
19.TiO2-aNb、Cu(In1-xGaxSe2)是常见的光学活性物质。请回答下列问题:TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。
①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为_______g·cm-3。
②图乙TiO2-aNb晶体中a:b=_______。
20.填空。
(1)某镍铜合金的立方晶胞结构如图所示。若该晶胞的棱长为anm(1nm=1×10-7cm),ρ=_______g·cm-3(NA表示阿伏伽德罗常数,列出计算式)。
(2)已知室温时,Ksp[Mg(OH)2]=4.0×10 11.在0.1mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_______(已知lg2=0.3)。(已知:当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全)
21.过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:Ni和As形成某种晶体的晶胞图如图所示。其中,大球为Ni,小球为As,距离As最近的Ni构成正三支柱,其中晶胞下方As原子坐标为(,,)。
(1)Ni的配位数为_______。
(2)已知晶胞底面边长为apm,高为cpm,NA为阿伏加德罗常数。则晶胞密度为_______。
四、实验题
22.碱式碳酸铜[Cu2(OH)2CO3](Mr=222)是一种草绿色晶体,可用于铜盐、油漆和烟花的制备。实验室制备碱式碳酸铜的步骤如下:
I.分别配制0.50mol L-1CuSO4溶液和0.50mol L-1Na2CO3溶液。
II.将30mLCuSO4溶液和36mL Na2CO3溶液混合、搅拌均匀。
III.将II的混合溶液加热至75℃,搅拌15min。
IV.静置使产物沉淀完全后,抽滤、洗涤、干燥、称重,分析样品组成和晶体结构。
回答下列问题:
(1)步骤I中,配制0.50mol L-1CuSO4溶液时,不需要使用下列仪器中的_______(填仪器名称)。
(2)步骤II中,若误将CuSO4溶液与Na2CO3溶液等体积混合,二者恰好完全反应,生成蓝色的Cu4(SO4)(OH)6 2H2O晶体,其反应的离子方程式为_______。
(3)步骤III中,若温度高于90℃,产品中混有的黑色固体是_______。
(4)步骤IV中,检验沉淀是否洗涤干净的试剂是_______;称得产品的质量为1.332g,则该实验所得碱式碳酸铜的产率是_______。
(5)对样品进行热重分析得到的曲线如下图所示,则铜元素的质量分数是_______,与理论值相差不大。使用_______实验可进一步测定样品的晶体结构。
23.获得晶体的途径
(1)实验探究
实验内容 实验操作及现象
获取硫黄晶体 硫黄粉熔融态硫_____色的________硫黄晶体
获取碘晶体 加热时,烧杯内产生大量_____________气体,没有出现液态的碘,停止加热,烧杯内的_____________气体渐渐消褪,最后消失,表面皿底部出现__________色晶体颗粒
获取氯化钠晶体 在烧杯底部慢慢析出立方体的__________晶体颗粒
(2)获得晶体的三条途径
①_____________物质凝固。
②_____________物质冷却不经液态直接________(凝华)。
③_____________从溶液中析出。
24.三氯化硼(BCl3)是一种重要的化工原料,实验室采用三氟化硼(BF3)与氯化铝(AlCl3)加热的方法制备BCl3,装置如下图所示(夹持装置及加热装置略)。
已知:1.三氟化硼(BF3)易与水反应:三氯化硼(BCl3)易潮解:三氯化铝(AlCl3)沸点低、易升华。Ⅱ.部分物质的常点如下表所示。
物质 BF3 BCl3 AlCl3
沸点/℃ -101 12.5 180
回答下列问题:
(1)BF3中B的杂化方式为______,AlCl3属于______晶体,C中仪器a的名称为______(每空1分,共3分)
(2)将氟硼酸钾(KBF4)和硼酐(B2O3)一起研磨均匀加入A中的圆底烧瓶,滴入浓硫酸并加热,除产生气体外,还生成一种酸式盐,分别写出气体和酸式盐的化学式______、______。
(3)实验开始时,两处加热装置应先加热______(填“A”或“C”)。
(4)装置B中盛放的是浓硫酸,其作用是______。
(5)装置D的作用是______。
(6)C中2.50 g无水氯化铝完全反应后,取下U形管并注入水,完全反应生成盐酸和硼酸(H3BO3是一元弱酸)将所得溶液加水稀释到250 mL,取10 mL加入锥形瓶中滴入2滴酚酞溶液,用0.1000 mol/L的NaOH溶液滴定至终点,消耗NaOH溶液的体积为28.00 mL,则BCl3的产率为______%(保留四位有效数字)。
试卷第4页,共9页
参考答案:
1.A
【详解】A.由β-氮化碳的结构示意图可知,晶体中形成4个共价键的饱和碳原子和形成3个共价键的饱和氮原子都为sp3杂化,故A错误;
B.由β-氮化碳薄膜为超硬新材料可知,氮化碳属于硬度很高的共价晶体,故B正确;
C.由β-氮化碳的结构示意图可知,虚线部分为晶体的最小结构单元,位于正方形顶点和边上的碳原子个数为4×+4×=3,位于正方形内的氮原子个数为4,则氮化碳的化学式为C3N4,故C正确;
D.由β-氮化碳薄膜为超硬新材料可知,氮化碳属于硬度很高的共价晶体,氮原子的原子半径小于碳原子,则碳氮键的共价键强于碳碳键,所以氮化碳硬度超过金刚石晶体,故D正确;
故选A。
2.D
【详解】A.液晶同时具有液体和晶体特性,即液晶具有液体的流动性,同时具有晶体的各向异性,A正确;
B.某物质固态能导电,则它不一定是金属单质如晶体硅是良好的半导体,能够导电,其属于原子(共价) 晶体,石墨能够导电,其属于过渡型晶体,B正确;
C.超分子是由两种或两种以上的分子通过相互作用形成的分子聚集体,具有分子识别与自组装的特征,C正确;
D.晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等,但并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,D错误;
故答案为:D。
3.B
【详解】A.石墨烯属于碳的单质,故A错误;
B.判断晶体与非晶体最科学的方法是X 射线衍射实验,X 射线衍射实验可以用于键长、键角和晶体结构的测定,故B正确;
C.金属的导电性、导热性、延展性与金属键有关,由于自由电子可吸收所有频率的光,然后很快释放出各种频率的光,因此绝大多数金属具有银白色或钢灰色光泽,因此金属光泽都与金属键有关,故C错误;
D.液晶可用于制造显示器,液晶不是晶体,故D错误。
综上所述,答案为B。
4.B
【分析】由晶胞截面图可知,硫离子位于晶胞的顶点和面心,晶胞中离子个数为8×+6×=4,Zn离子位于S2-的正四面体空隙内,晶胞中离子个数为4。
【详解】A.由分析可知每个晶胞中含有的数目为4,A正确;
B.Zn2+位于S2-的正四面体空隙,与距离最近且相等的有4个,B错误;
C.与顶点S2-距离最近的Zn2+位于体对角线的处,则核间距的计算表达式为pm ,C正确;
D.ZnS晶胞密度ρ===,D正确;
故答案为:B。
5.C
【详解】A.石墨晶体呈层状结构,层内是正六边形,层与层之间是通过范德华力结合,层内每个碳原子只有3个价电子形成共价键,故A正确;
B.白磷是正四面体分子,磷原子在正四面体的四个顶点,键角是60°,1mol白磷含共价键6NA个,故B正确;
C.氯化氢是共价化合物,氯化氢气体溶于水后电离出离子,是因为破坏了共价键,故C错误;
D.一般来说晶体的熔沸点是原子晶体>离子晶体>分子晶体,干冰是分子晶体,NaCl固体是离子晶体,石英晶体是原子晶体,因此干冰、NaCl固体、石英晶体的熔沸点逐渐升高,故D正确。
综上所述,答案为C。
6.C
【详解】A.同周期从左到右元素的电负性逐渐增大,因此元素的电负性:Cl>S>Na,故A正确;
B.卤素单质为分子晶体,相对分子质量越大熔沸点越高,因此卤素单质的熔点:,故B正确;
C.Cl原子为吸引电子的基团,能使-OH上的氢活泼性增强,则CCl3COOH更易电离出氢离子,酸性:CH2ClCOOHD.一元醇中,烃基为疏水基,烃基基团越大,其溶解性越小,因此相同条件下,物质在水中的溶解度:C2H5OH>CH3(CH2)4OH,故D正确;
故选:C。
7.C
【详解】A.SiO2晶体中每个Si原子连接4个O原子,每个O原子连接2个Si原子,最小环上有12个原子,其中包括6个Si原子,6个O原子,故A错误;
B.SiO2属于共价晶体,熔化时破坏共价键,晶体中不存在分子间作用力,故B错误;
C.石墨烯中每个碳原子被3个环共用,对一个环的贡献是,则平均每个六元环含碳原子为6×=2个,24g石墨烯的物质的量为2mol,2mol碳原子含有六元环的个数为6.02×1023,故C正确;
D.C60为分子晶体,根据均摊法可以确定如图晶胞单元中含有C60分子的个数为8×+4×=4个,则1mol晶胞中含有C60分子的个数为4NA,720g C60晶体的物质的量为1mol,则720g C60晶体含有0.25NA个如图中晶胞单元,即0.25×6.02×1023个晶胞,故D错误;
故选C。
8.A
【详解】A.离子晶体的构成微粒是阴离子与阳离子,选项A正确;
B.离子晶体中存在离子键,存在电子得失,一定是化合物,选项B错误;
C.CaCO3、BaSO4等离子晶体难溶于水,选项C错误;
D.NH4Cl晶体全部由非金属元素组成,选项D错误;
答案选A。
9.D
【详解】A.烟花绽放出的绚丽色彩是原子核外电子跃迁发出的不同颜色的光,故A正确;
B.和均由金属阳离子和酸根阴离子构成,属于离子晶体,故B正确;
C.铁是26号元素,位于元素周期表的第四周期第Ⅷ族,故C正确;
D.的质子数为20,的结构示意图为,故D错误;
选D。
10.D
【详解】A.Se是34号元素,基态Se原子的简化电子排布式为[Ar]3d104s24p4,是价电子排布式,故A错误;
B.甲基正离子()是-CH3失去一个电子形成的阳离子,其电子式为 ,故B错误;
C.石英为共价晶体,不存在分子,其化学式为SiO2,不能称为分子式,故C错误;
D.氮为7号元素,原子核外电子排布的轨道表示式为 ,故D正确;
故选D。
11.A
【详解】A.C60分子中每个碳原子均与周围相邻的其他3个碳原子相连,所以碳是sp2杂化,故A正确;
B.C60与碳纳米管是不同物质,为化学变化,故B错误;
C.C60是分子间通过分子间作用力结合而成的晶体,属于分子晶体,石墨中含有分子间作用力、共价键和金属键,所以其质软,石墨为混合型晶体,故C错误;
D.碳纳米管中碳原子存在多个碳原子共用电子形成的π键,电子可以在层内移动,类似于金属键,没有金属阳离子,不能构成金属键,故D错误;
故选:A。
12.B
【详解】①在基态多电子原子中,同一能层的p轨道电子的能量高于s轨道电子的能量,不同能层的p轨道电子的能量不一定高于s轨道电子的能量,如2p轨道电子的能量低于3s轨道电子的能量,①错误;
②在C60晶体的晶胞中,在晶胞的顶点和面心上各有一个C60分子,是面心立方结构,②正确;
③As是ⅤA族元素,其外围电子排布式为4s24p3,属于p区元素,③正确;
④HgCl2的稀溶液有弱的导电能力,说明其属于电解质,④错误;
综上所述,②③正确,B符合题意;
答案选B。
13.D
【详解】A.金属键不是存在于相邻原子之间的作用力,而是属于整块金属,因此没有方向性和饱和性,A错误;
B.金属具有光泽是因为自由电子能够吸收可见光,但不能放出可见光,B错误;
C.金属中存在金属阳离子和自由电子,当给金属通电时,自由电子定向移动而导电,C错误;
D.金属键是存在于金属阳离子和自由电子之间的强的相互作用,这些自由电子为所有的阳离子所共用,D正确;
答案选D。
14.B
【详解】A.冰融化时,水分子没有改变,改变的是分子间的距离,所以分子中H-O键没有发生断裂,A错误;
B.共价晶体中,共价键的键能越大,破坏共价键所需的能量越大,该晶体的熔点越高,B正确;
C.分子晶体熔化或沸腾时,只改变分子间的距离,不需要破坏分子内的共价键,所以该晶体的熔沸点高低与键能无关,C错误;
D.分子晶体中,物质的稳定性与分子内原子间的共价键有关,与分子间作用力无关,D错误;
故选B。
15.C
【详解】A.共价晶体硬度通常比分子晶体大,故A不符合题意;
B.离子晶体一般熔、沸点较高,熔融时能导电,故B不符合题意;
C.分子晶体有些难溶于水(如大多数有机物),有些能溶于水(如CO2、 SO2、SO3,C2H5OH、CH3COOH、葡萄糖等),故C符合题意;
D.金属晶体一般具有良好的导电性、导热性和延展性,故D不符合题意;
故选C。
16. 为离子晶体,均为分子晶体,分子间存在氢键
【详解】固态KH为离子晶体,固态H2O、PH为分子晶体,故熔点:KH大于H2O、 PH3, 由于水分间能形成氢键,所以其熔点比PH3高,则三者熔点由高到底顺序为:;熔点差异的原因为:为离子晶体,均为分子晶体,分子间存在氢键。
17.(1) (或) 4∶5
(2) O O
(3) 1∶1 V形
(4)
【详解】(1)Fe是26号元素,基态原子的电子排布式为,基态的价电子排布图是、基态的价电子排布图是,未成对电子的数目之比为4:5。
(2)三草酸合铁酸钾所含元素中,氧元素非金属性最强,所以第一电离能最大的是O,电负性最大的是O。
(3)的结构式为O=C=O,的结构式为H-O-H,单键为键,双键中有1个键和1个π键,则1个与1个分子中键数目之比为1:1;分子中O原子价电子对数是4,有2个孤电子对,立体构型为V形。
(4)根据原子1的坐标为,可知原子2的坐标为;
18. 按一定方式有规则排列 阴、阳离子 离子键 较高 较大 固态 熔融状态下 水溶液中
【解析】略
19. 7:2
【详解】①根据TiO2晶胞结构,Ti原子在晶胞的8个顶点、4个面心和1个在体内,1个晶胞中含有Ti的个数为8×+4×+1=4,O原子8个在棱上、8个在面上、2个在体内,1个晶胞中含有O的个数为8×+8×+2==8,则1mol晶胞的质量为48×4+16×8g=320g,1mol晶胞的体积为NA×a2c×10-30cm3,所以密度ρ==g/cm3,故答案为:;
②由晶胞结构示意图可知,TiO2-aNb晶胞中N原子数为1×=,O原子数为7×+7×+1=,Ti原子数为4,故b=×=,2 a=×,解得a=,a:b=:=7:2,故答案为:7:2。
20.(1)
(2)11.3
【解析】(1)
由晶胞结构可知,晶胞中位于顶点的镍原子个数为8×=1,位于面心的铜原子个数为6×=3,则晶胞的化学式为Cu3Ni,由晶胞的质量公式可得:=(a×10—7)3ρ,解得ρ=,故答案为:;
(2)
由溶度积可知,镁离子完全沉淀时,溶液中氢氧根离子浓度为=2.0×—3,则溶液的pH为14—3+lg2=11.3,故答案为:11.3。
21.(1)6
(2)
【详解】(1)晶胞含原子2个,原子2个,化学式为,配位数之比应为1∶1;与配位的形成正三棱柱,的配位数是6,所以的配位数为6;
(2)由配位的形成正三棱柱可判断,该三棱柱底面为正三角形,晶胞底面夹角为和,底面积为 ,所以晶胞密度为 。
22.(1)坩埚
(2)4Cu2+++3+5H2O=Cu4(SO4)(OH)6 2H2O↓+3CO2↑
(3)CuO
(4) 盐酸、氯化钡溶液 80%
(5) 56% X射线衍射
【分析】本实验的目的,制备碱式碳酸铜[Cu2(OH)2CO3]。分别配制0.50mol L-1CuSO4溶液和0.50mol L-1Na2CO3溶液,然后将30mLCuSO4溶液和36mL Na2CO3溶液混合、搅拌均匀;将混合溶液加热至75℃,搅拌15min,即可获得碱式碳酸铜晶体。
【详解】(1)步骤I中,配制0.50mol L-1CuSO4溶液时,需要使用容量瓶、烧杯、天平,玻璃棒等,不需要使用的仪器是:坩埚。答案为:坩埚;
(2)步骤II中,将CuSO4溶液与Na2CO3溶液等体积混合,二者恰好完全反应,生成Cu4(SO4)(OH)6 2H2O晶体,同时生成CO2,反应的离子方程式为4Cu2+++3+5H2O=Cu4(SO4)(OH)6 2H2O↓+3CO2↑。答案为:4Cu2+++3+5H2O=Cu4(SO4)(OH)6 2H2O↓+3CO2↑;
(3)步骤III中,若温度高于90℃,Cu2(OH)2CO3发生分解,生成CuO、CO2和水,则产品中混有的黑色固体是CuO。答案为:CuO;
(4)步骤IV中,沉淀表面容易吸附溶液中的,检验的试剂是盐酸、氯化钡溶液。制取碱式碳酸铜的离子方程式为2Cu2++2+H2O=Cu2(OH)2CO3↓+CO2↑,则理论上,30mL0.50mol L-1CuSO4溶液和36mL 0.50mol L-1Na2CO3溶液反应,生成Cu2(OH)2CO30.0075mol,则碱式碳酸铜的产率是=80%。答案为:盐酸、氯化钡溶液;80%;
(5)从图中可以看出,样品灼烧后,所得固体为CuO,质量保留百分数为70%,则铜元素的质量分数是=56%。测定晶体结构时,通常使用X射线衍射实验,所以使用X射线衍射实验可进一步测定样品的晶体结构。答案为:56%;X射线衍射。
【点睛】Cu2(OH)2CO3的分解温度低于水的沸点,所以在水溶液中加热,Cu2(OH)2CO3就可发生分解。
23. 淡黄 菱形 紫色 紫色 紫黑 无色 熔融态 气态 凝固 溶质
【解析】略
24.(1) sp2 分子 球形冷凝管
(2) BF3 KHSO4
(3)A
(4)干燥除水,观察气泡,控制气体流速
(5)冷凝收集BCl3
(6)93.45
【分析】三氟化硼(BF3)与氯化铝(AlCl3)加热的方法制备BCl3,装置A中利用氟硼酸钾(KBF4)、硼酐(B2O3)和浓硫酸反应制取BF3气体,经装置B中浓硫酸干燥后进入装置C与AlCl3反应,AlCl3易升华,所以用装置a冷凝回流,装置D中冷凝收集BCl3,为防止BCl3水解,装置E中盛放碱石灰吸收水蒸气,装置F处理尾气。
【详解】(1)BF3分子中B原子形成3个共价键,B原子上无孤对电子,所以B原子杂化类型是sp2杂化;
AlCl3的物质沸点是180℃,沸点比较低,故氯化铝属于分子晶体;
装置C中仪器a的名称是球形冷凝管;
(2)装置A中发生的反应为非氧化还原反应,且产生一种酸式盐,可判断酸式盐为KHSO4,气体为BF3;
(3)BCl3是强酸弱碱盐,易水解,先加热A处,可以利用A处产生的BF3气体排除装置内空气,防正水蒸气干扰实验;
(4)装置B中盛有浓硫酸作干燥剂,同时也可以通过观察装置B中产生的气流大小来控制气体流速;
(5)装置D采用用冰水浴,其作用是冷凝收集BCl3;
(6)2.50 g无水AlCl3的物质的量n(AlCl3)=,则理论上制取Cl元素守恒,可知制取BCl3的物质的量n(BCl3)=,BCl3和水反应产生H3BO3、HCl,该反应的化学方程式为BCl3+3H2O=H3BO3+3HCl,所以得到的溶液中H3BO3和HCl的物质的量之比为1:3,10 mL待测液共消耗NaOH的物质的量n(NaOH)=0.1000 mol/L×0.028 L=0.0028 mol,所以10 mL待测液中含有H3BO3的物质的量n(H3BO3)=n(NaOH)=0.0007 mol,250 mL待测液中含有H3BO3的物质的量n(H3BO3)=0.0007 mol×=0.0175 mol,根据B元素守恒可知BCl3的物质的量为0.0175 mol,所以产率为
一、单选题
1.我国科学家用激光将置于铁室中石墨靶上的碳原子炸松,再用射频电火花喷射氮气,获得超硬新材料β-氮化碳薄膜,结构如图,下列有关β-氮化碳的说法错误的是
A.碳原子采取sp3杂化、氮原子采取sp2杂化
B.氮化碳属于共价晶体
C.氮化碳的化学式为C3N4
D.氮化碳硬度超过金刚石晶体
2.下列叙述中,错误的是
A.液晶具有液体的流动性,在某些物理性质方面还具有类似晶体的各向异性
B.某物质固态能导电,则它不一定是金属单质
C.超分子具有分子识别与自组装的特征
D.生成晶体的速率越快越好
3.下列说法正确的是
A.北京冬奥会采用石墨烯材料制造户外保暖穿戴设备,石墨烯属于共价化合物
B.晶体X射线衍射实验可以用于键长、键角和晶体结构的测定
C.金属的导电性、导热性和延展性都与金属键有关,金属光泽与金属键无关
D.液晶可用于制造显示器,是一类分子晶体
4.已知图甲为金属钠的晶胞,晶胞边长为,其晶胞截面如图乙所示。图丙为ZnS晶胞截面,已知ZnS属立方晶体,假设晶胞边长为。下列关于ZnS晶胞的描述错误的是
A.每个晶胞中含有的数目为4
B.与距离最近且相等的有8个
C.该晶胞中两个距离最近的和的核间距的计算表达式为
D.ZnS晶体的密度为(表示阿伏伽德罗常数)
5.下列说法不正确的是
A.石墨晶体呈层状结构,每个碳原子只有3个价电子形成共价键
B.白磷是正四面体分子,键角是60°,1mol白磷含共价键6NA个
C.氯化氢气体溶于水后电离出离子,是因为破坏了离子键
D.干冰、NaCl固体、石英晶体的熔沸点逐渐升高
6.下列物质性质的比较,顺序不正确的是
A.元素的电负性:Cl>S>Na
B.卤素单质的熔点:
C.羧酸的酸性:
D.相同条件下,物质在水中的溶解度:
7.下列有关晶体结构的叙述正确的是
A.SiO2晶体中最小环上的原子个数为6
B.SiO2属于共价晶体,熔化时破坏共价键和分子间作用力
C.24 g石墨烯(如图1)中含有六元环的个数为6.02×1023
D.720 g C60晶体中含有0.5×6.02×1023个晶胞(如图2)
8.下列说法正确的是
A.晶体中若存在阴离子,就一定存在阳离子
B.离子晶体不一定是化合物
C.离子晶体都易溶于水
D.离子晶体一定是由活泼金属和活泼非金属形成的
9.中国传统文化博大精深,蕴含着丰富的化学知识。下列说法错误的是
A.“烟花巷陌,依约丹青屏障”中烟花绽放出的绚丽色彩跟原子核外电子跃迁有关
B.(本草经集注)中记载了区分硝石和朴唒的方法。和均属于离子晶体
C.《淮南万毕术》中记载,“曾青得铁则化为铜”,铁位于元素周期表的第四周期第Ⅷ族
D.(石灰吟)中记载,“要留清白在人间”其中的结构示意图为
10.下列有关化学用语使用正确的是
A.基态Se原子的简化电子排布式:
B.甲基正离子的电子式:
C.石英的分子式:
D.氮原子核外电子排布的轨道表示式:
11.我国科学家率先利用作为客体分子进行组装,得到新型碳纳米管片段材料,合成效率优于石墨片层卷曲,此材料具有显著的光电效应。下列说法正确的是
A.中的碳原子为杂化 B.由形成碳纳米管为物理变化
C.石墨和均为分子晶体 D.碳纳米管导电的原因是形成了金属键
12.下列叙述正确的是
①在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
②C60晶体的晶胞是面心立方结构
③As是第VA族的元素,属于p区元素
④熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类,HgCl2是一种共价化合物、非电解质、盐、分子晶体
A.①② B.②③ C.①③ D.②④
13.下列关于金属及金属键的说法正确的是
A.金属键具有方向性与饱和性
B.金属具有光泽是因为金属阳离子吸收并放出可见光
C.金属能导电是因为金属在外加电场作用下产生了自由电子
D.金属键是金属阳离子与自由电子间的相互作用
14.下列说法中,正确的是
A.冰融化时,分子中氢氧键发生断裂
B.共价晶体中共价键越强,晶体的熔点和沸点越高
C.分子晶体中共价键键能越大,该分子晶体的熔点和沸点一定也越高
D.分子晶体中分子间作用力越大,该物质越稳定
15.下列关于晶体的说法不正确的是
A.共价晶体硬度通常比分子晶体大
B.离子晶体一般熔、沸点较高,熔融时能导电
C.分子晶体大多不溶于水,熔融时不能导电
D.金属晶体一般具有良好的导电性、导热性和延展性
二、填空题
16.按熔点由高到低的顺序排列为_______,熔点差异的原因是_______。
17.三草酸合铁酸钾是制备铁触媒上的主要原料。在光照下分解:
。回答下列问题:
(1)基态原子的电子排布式为___________,基态与中未成对电子的数目之比为___________。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________(填元素符号,下同),电负性最大的是___________。
(3)1个与1个分子中键数目之比为___________,分子的立体构型为___________。
(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。
若图中原子1的坐标为,则原子2的坐标为___________。
18.离子晶体
概念 阴、阳离子________形成的晶体。
构成微粒 ________
微粒间的作用 ________
物理性质 ①熔点________,硬度________; ②_______时不导电,在________或________能够导电。
常见离子晶体 固态的离子化合物都属于离子晶体,包括强碱(如NaOH、KOH等)、绝大多数的盐(如NaCl、NH4Cl、BaSO4等)、活泼金属的氧化物(如Na2O、CaO、Na2O2等)
NaCl的晶体结构 每个Na+周围等距离最近有6个Cl-,每个Cl-周围等距离最近有6个Na+,没有NaCl分子存在,只有Na+和Cl-,且Na+和Cl-的个数比为1∶1,故NaCl是表示物质组成的化学式,不是分子式。
三、计算题
19.TiO2-aNb、Cu(In1-xGaxSe2)是常见的光学活性物质。请回答下列问题:TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。
①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为_______g·cm-3。
②图乙TiO2-aNb晶体中a:b=_______。
20.填空。
(1)某镍铜合金的立方晶胞结构如图所示。若该晶胞的棱长为anm(1nm=1×10-7cm),ρ=_______g·cm-3(NA表示阿伏伽德罗常数,列出计算式)。
(2)已知室温时,Ksp[Mg(OH)2]=4.0×10 11.在0.1mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_______(已知lg2=0.3)。(已知:当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全)
21.过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:Ni和As形成某种晶体的晶胞图如图所示。其中,大球为Ni,小球为As,距离As最近的Ni构成正三支柱,其中晶胞下方As原子坐标为(,,)。
(1)Ni的配位数为_______。
(2)已知晶胞底面边长为apm,高为cpm,NA为阿伏加德罗常数。则晶胞密度为_______。
四、实验题
22.碱式碳酸铜[Cu2(OH)2CO3](Mr=222)是一种草绿色晶体,可用于铜盐、油漆和烟花的制备。实验室制备碱式碳酸铜的步骤如下:
I.分别配制0.50mol L-1CuSO4溶液和0.50mol L-1Na2CO3溶液。
II.将30mLCuSO4溶液和36mL Na2CO3溶液混合、搅拌均匀。
III.将II的混合溶液加热至75℃,搅拌15min。
IV.静置使产物沉淀完全后,抽滤、洗涤、干燥、称重,分析样品组成和晶体结构。
回答下列问题:
(1)步骤I中,配制0.50mol L-1CuSO4溶液时,不需要使用下列仪器中的_______(填仪器名称)。
(2)步骤II中,若误将CuSO4溶液与Na2CO3溶液等体积混合,二者恰好完全反应,生成蓝色的Cu4(SO4)(OH)6 2H2O晶体,其反应的离子方程式为_______。
(3)步骤III中,若温度高于90℃,产品中混有的黑色固体是_______。
(4)步骤IV中,检验沉淀是否洗涤干净的试剂是_______;称得产品的质量为1.332g,则该实验所得碱式碳酸铜的产率是_______。
(5)对样品进行热重分析得到的曲线如下图所示,则铜元素的质量分数是_______,与理论值相差不大。使用_______实验可进一步测定样品的晶体结构。
23.获得晶体的途径
(1)实验探究
实验内容 实验操作及现象
获取硫黄晶体 硫黄粉熔融态硫_____色的________硫黄晶体
获取碘晶体 加热时,烧杯内产生大量_____________气体,没有出现液态的碘,停止加热,烧杯内的_____________气体渐渐消褪,最后消失,表面皿底部出现__________色晶体颗粒
获取氯化钠晶体 在烧杯底部慢慢析出立方体的__________晶体颗粒
(2)获得晶体的三条途径
①_____________物质凝固。
②_____________物质冷却不经液态直接________(凝华)。
③_____________从溶液中析出。
24.三氯化硼(BCl3)是一种重要的化工原料,实验室采用三氟化硼(BF3)与氯化铝(AlCl3)加热的方法制备BCl3,装置如下图所示(夹持装置及加热装置略)。
已知:1.三氟化硼(BF3)易与水反应:三氯化硼(BCl3)易潮解:三氯化铝(AlCl3)沸点低、易升华。Ⅱ.部分物质的常点如下表所示。
物质 BF3 BCl3 AlCl3
沸点/℃ -101 12.5 180
回答下列问题:
(1)BF3中B的杂化方式为______,AlCl3属于______晶体,C中仪器a的名称为______(每空1分,共3分)
(2)将氟硼酸钾(KBF4)和硼酐(B2O3)一起研磨均匀加入A中的圆底烧瓶,滴入浓硫酸并加热,除产生气体外,还生成一种酸式盐,分别写出气体和酸式盐的化学式______、______。
(3)实验开始时,两处加热装置应先加热______(填“A”或“C”)。
(4)装置B中盛放的是浓硫酸,其作用是______。
(5)装置D的作用是______。
(6)C中2.50 g无水氯化铝完全反应后,取下U形管并注入水,完全反应生成盐酸和硼酸(H3BO3是一元弱酸)将所得溶液加水稀释到250 mL,取10 mL加入锥形瓶中滴入2滴酚酞溶液,用0.1000 mol/L的NaOH溶液滴定至终点,消耗NaOH溶液的体积为28.00 mL,则BCl3的产率为______%(保留四位有效数字)。
试卷第4页,共9页
参考答案:
1.A
【详解】A.由β-氮化碳的结构示意图可知,晶体中形成4个共价键的饱和碳原子和形成3个共价键的饱和氮原子都为sp3杂化,故A错误;
B.由β-氮化碳薄膜为超硬新材料可知,氮化碳属于硬度很高的共价晶体,故B正确;
C.由β-氮化碳的结构示意图可知,虚线部分为晶体的最小结构单元,位于正方形顶点和边上的碳原子个数为4×+4×=3,位于正方形内的氮原子个数为4,则氮化碳的化学式为C3N4,故C正确;
D.由β-氮化碳薄膜为超硬新材料可知,氮化碳属于硬度很高的共价晶体,氮原子的原子半径小于碳原子,则碳氮键的共价键强于碳碳键,所以氮化碳硬度超过金刚石晶体,故D正确;
故选A。
2.D
【详解】A.液晶同时具有液体和晶体特性,即液晶具有液体的流动性,同时具有晶体的各向异性,A正确;
B.某物质固态能导电,则它不一定是金属单质如晶体硅是良好的半导体,能够导电,其属于原子(共价) 晶体,石墨能够导电,其属于过渡型晶体,B正确;
C.超分子是由两种或两种以上的分子通过相互作用形成的分子聚集体,具有分子识别与自组装的特征,C正确;
D.晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等,但并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,D错误;
故答案为:D。
3.B
【详解】A.石墨烯属于碳的单质,故A错误;
B.判断晶体与非晶体最科学的方法是X 射线衍射实验,X 射线衍射实验可以用于键长、键角和晶体结构的测定,故B正确;
C.金属的导电性、导热性、延展性与金属键有关,由于自由电子可吸收所有频率的光,然后很快释放出各种频率的光,因此绝大多数金属具有银白色或钢灰色光泽,因此金属光泽都与金属键有关,故C错误;
D.液晶可用于制造显示器,液晶不是晶体,故D错误。
综上所述,答案为B。
4.B
【分析】由晶胞截面图可知,硫离子位于晶胞的顶点和面心,晶胞中离子个数为8×+6×=4,Zn离子位于S2-的正四面体空隙内,晶胞中离子个数为4。
【详解】A.由分析可知每个晶胞中含有的数目为4,A正确;
B.Zn2+位于S2-的正四面体空隙,与距离最近且相等的有4个,B错误;
C.与顶点S2-距离最近的Zn2+位于体对角线的处,则核间距的计算表达式为pm ,C正确;
D.ZnS晶胞密度ρ===,D正确;
故答案为:B。
5.C
【详解】A.石墨晶体呈层状结构,层内是正六边形,层与层之间是通过范德华力结合,层内每个碳原子只有3个价电子形成共价键,故A正确;
B.白磷是正四面体分子,磷原子在正四面体的四个顶点,键角是60°,1mol白磷含共价键6NA个,故B正确;
C.氯化氢是共价化合物,氯化氢气体溶于水后电离出离子,是因为破坏了共价键,故C错误;
D.一般来说晶体的熔沸点是原子晶体>离子晶体>分子晶体,干冰是分子晶体,NaCl固体是离子晶体,石英晶体是原子晶体,因此干冰、NaCl固体、石英晶体的熔沸点逐渐升高,故D正确。
综上所述,答案为C。
6.C
【详解】A.同周期从左到右元素的电负性逐渐增大,因此元素的电负性:Cl>S>Na,故A正确;
B.卤素单质为分子晶体,相对分子质量越大熔沸点越高,因此卤素单质的熔点:,故B正确;
C.Cl原子为吸引电子的基团,能使-OH上的氢活泼性增强,则CCl3COOH更易电离出氢离子,酸性:CH2ClCOOH
故选:C。
7.C
【详解】A.SiO2晶体中每个Si原子连接4个O原子,每个O原子连接2个Si原子,最小环上有12个原子,其中包括6个Si原子,6个O原子,故A错误;
B.SiO2属于共价晶体,熔化时破坏共价键,晶体中不存在分子间作用力,故B错误;
C.石墨烯中每个碳原子被3个环共用,对一个环的贡献是,则平均每个六元环含碳原子为6×=2个,24g石墨烯的物质的量为2mol,2mol碳原子含有六元环的个数为6.02×1023,故C正确;
D.C60为分子晶体,根据均摊法可以确定如图晶胞单元中含有C60分子的个数为8×+4×=4个,则1mol晶胞中含有C60分子的个数为4NA,720g C60晶体的物质的量为1mol,则720g C60晶体含有0.25NA个如图中晶胞单元,即0.25×6.02×1023个晶胞,故D错误;
故选C。
8.A
【详解】A.离子晶体的构成微粒是阴离子与阳离子,选项A正确;
B.离子晶体中存在离子键,存在电子得失,一定是化合物,选项B错误;
C.CaCO3、BaSO4等离子晶体难溶于水,选项C错误;
D.NH4Cl晶体全部由非金属元素组成,选项D错误;
答案选A。
9.D
【详解】A.烟花绽放出的绚丽色彩是原子核外电子跃迁发出的不同颜色的光,故A正确;
B.和均由金属阳离子和酸根阴离子构成,属于离子晶体,故B正确;
C.铁是26号元素,位于元素周期表的第四周期第Ⅷ族,故C正确;
D.的质子数为20,的结构示意图为,故D错误;
选D。
10.D
【详解】A.Se是34号元素,基态Se原子的简化电子排布式为[Ar]3d104s24p4,是价电子排布式,故A错误;
B.甲基正离子()是-CH3失去一个电子形成的阳离子,其电子式为 ,故B错误;
C.石英为共价晶体,不存在分子,其化学式为SiO2,不能称为分子式,故C错误;
D.氮为7号元素,原子核外电子排布的轨道表示式为 ,故D正确;
故选D。
11.A
【详解】A.C60分子中每个碳原子均与周围相邻的其他3个碳原子相连,所以碳是sp2杂化,故A正确;
B.C60与碳纳米管是不同物质,为化学变化,故B错误;
C.C60是分子间通过分子间作用力结合而成的晶体,属于分子晶体,石墨中含有分子间作用力、共价键和金属键,所以其质软,石墨为混合型晶体,故C错误;
D.碳纳米管中碳原子存在多个碳原子共用电子形成的π键,电子可以在层内移动,类似于金属键,没有金属阳离子,不能构成金属键,故D错误;
故选:A。
12.B
【详解】①在基态多电子原子中,同一能层的p轨道电子的能量高于s轨道电子的能量,不同能层的p轨道电子的能量不一定高于s轨道电子的能量,如2p轨道电子的能量低于3s轨道电子的能量,①错误;
②在C60晶体的晶胞中,在晶胞的顶点和面心上各有一个C60分子,是面心立方结构,②正确;
③As是ⅤA族元素,其外围电子排布式为4s24p3,属于p区元素,③正确;
④HgCl2的稀溶液有弱的导电能力,说明其属于电解质,④错误;
综上所述,②③正确,B符合题意;
答案选B。
13.D
【详解】A.金属键不是存在于相邻原子之间的作用力,而是属于整块金属,因此没有方向性和饱和性,A错误;
B.金属具有光泽是因为自由电子能够吸收可见光,但不能放出可见光,B错误;
C.金属中存在金属阳离子和自由电子,当给金属通电时,自由电子定向移动而导电,C错误;
D.金属键是存在于金属阳离子和自由电子之间的强的相互作用,这些自由电子为所有的阳离子所共用,D正确;
答案选D。
14.B
【详解】A.冰融化时,水分子没有改变,改变的是分子间的距离,所以分子中H-O键没有发生断裂,A错误;
B.共价晶体中,共价键的键能越大,破坏共价键所需的能量越大,该晶体的熔点越高,B正确;
C.分子晶体熔化或沸腾时,只改变分子间的距离,不需要破坏分子内的共价键,所以该晶体的熔沸点高低与键能无关,C错误;
D.分子晶体中,物质的稳定性与分子内原子间的共价键有关,与分子间作用力无关,D错误;
故选B。
15.C
【详解】A.共价晶体硬度通常比分子晶体大,故A不符合题意;
B.离子晶体一般熔、沸点较高,熔融时能导电,故B不符合题意;
C.分子晶体有些难溶于水(如大多数有机物),有些能溶于水(如CO2、 SO2、SO3,C2H5OH、CH3COOH、葡萄糖等),故C符合题意;
D.金属晶体一般具有良好的导电性、导热性和延展性,故D不符合题意;
故选C。
16. 为离子晶体,均为分子晶体,分子间存在氢键
【详解】固态KH为离子晶体,固态H2O、PH为分子晶体,故熔点:KH大于H2O、 PH3, 由于水分间能形成氢键,所以其熔点比PH3高,则三者熔点由高到底顺序为:;熔点差异的原因为:为离子晶体,均为分子晶体,分子间存在氢键。
17.(1) (或) 4∶5
(2) O O
(3) 1∶1 V形
(4)
【详解】(1)Fe是26号元素,基态原子的电子排布式为,基态的价电子排布图是、基态的价电子排布图是,未成对电子的数目之比为4:5。
(2)三草酸合铁酸钾所含元素中,氧元素非金属性最强,所以第一电离能最大的是O,电负性最大的是O。
(3)的结构式为O=C=O,的结构式为H-O-H,单键为键,双键中有1个键和1个π键,则1个与1个分子中键数目之比为1:1;分子中O原子价电子对数是4,有2个孤电子对,立体构型为V形。
(4)根据原子1的坐标为,可知原子2的坐标为;
18. 按一定方式有规则排列 阴、阳离子 离子键 较高 较大 固态 熔融状态下 水溶液中
【解析】略
19. 7:2
【详解】①根据TiO2晶胞结构,Ti原子在晶胞的8个顶点、4个面心和1个在体内,1个晶胞中含有Ti的个数为8×+4×+1=4,O原子8个在棱上、8个在面上、2个在体内,1个晶胞中含有O的个数为8×+8×+2==8,则1mol晶胞的质量为48×4+16×8g=320g,1mol晶胞的体积为NA×a2c×10-30cm3,所以密度ρ==g/cm3,故答案为:;
②由晶胞结构示意图可知,TiO2-aNb晶胞中N原子数为1×=,O原子数为7×+7×+1=,Ti原子数为4,故b=×=,2 a=×,解得a=,a:b=:=7:2,故答案为:7:2。
20.(1)
(2)11.3
【解析】(1)
由晶胞结构可知,晶胞中位于顶点的镍原子个数为8×=1,位于面心的铜原子个数为6×=3,则晶胞的化学式为Cu3Ni,由晶胞的质量公式可得:=(a×10—7)3ρ,解得ρ=,故答案为:;
(2)
由溶度积可知,镁离子完全沉淀时,溶液中氢氧根离子浓度为=2.0×—3,则溶液的pH为14—3+lg2=11.3,故答案为:11.3。
21.(1)6
(2)
【详解】(1)晶胞含原子2个,原子2个,化学式为,配位数之比应为1∶1;与配位的形成正三棱柱,的配位数是6,所以的配位数为6;
(2)由配位的形成正三棱柱可判断,该三棱柱底面为正三角形,晶胞底面夹角为和,底面积为 ,所以晶胞密度为 。
22.(1)坩埚
(2)4Cu2+++3+5H2O=Cu4(SO4)(OH)6 2H2O↓+3CO2↑
(3)CuO
(4) 盐酸、氯化钡溶液 80%
(5) 56% X射线衍射
【分析】本实验的目的,制备碱式碳酸铜[Cu2(OH)2CO3]。分别配制0.50mol L-1CuSO4溶液和0.50mol L-1Na2CO3溶液,然后将30mLCuSO4溶液和36mL Na2CO3溶液混合、搅拌均匀;将混合溶液加热至75℃,搅拌15min,即可获得碱式碳酸铜晶体。
【详解】(1)步骤I中,配制0.50mol L-1CuSO4溶液时,需要使用容量瓶、烧杯、天平,玻璃棒等,不需要使用的仪器是:坩埚。答案为:坩埚;
(2)步骤II中,将CuSO4溶液与Na2CO3溶液等体积混合,二者恰好完全反应,生成Cu4(SO4)(OH)6 2H2O晶体,同时生成CO2,反应的离子方程式为4Cu2+++3+5H2O=Cu4(SO4)(OH)6 2H2O↓+3CO2↑。答案为:4Cu2+++3+5H2O=Cu4(SO4)(OH)6 2H2O↓+3CO2↑;
(3)步骤III中,若温度高于90℃,Cu2(OH)2CO3发生分解,生成CuO、CO2和水,则产品中混有的黑色固体是CuO。答案为:CuO;
(4)步骤IV中,沉淀表面容易吸附溶液中的,检验的试剂是盐酸、氯化钡溶液。制取碱式碳酸铜的离子方程式为2Cu2++2+H2O=Cu2(OH)2CO3↓+CO2↑,则理论上,30mL0.50mol L-1CuSO4溶液和36mL 0.50mol L-1Na2CO3溶液反应,生成Cu2(OH)2CO30.0075mol,则碱式碳酸铜的产率是=80%。答案为:盐酸、氯化钡溶液;80%;
(5)从图中可以看出,样品灼烧后,所得固体为CuO,质量保留百分数为70%,则铜元素的质量分数是=56%。测定晶体结构时,通常使用X射线衍射实验,所以使用X射线衍射实验可进一步测定样品的晶体结构。答案为:56%;X射线衍射。
【点睛】Cu2(OH)2CO3的分解温度低于水的沸点,所以在水溶液中加热,Cu2(OH)2CO3就可发生分解。
23. 淡黄 菱形 紫色 紫色 紫黑 无色 熔融态 气态 凝固 溶质
【解析】略
24.(1) sp2 分子 球形冷凝管
(2) BF3 KHSO4
(3)A
(4)干燥除水,观察气泡,控制气体流速
(5)冷凝收集BCl3
(6)93.45
【分析】三氟化硼(BF3)与氯化铝(AlCl3)加热的方法制备BCl3,装置A中利用氟硼酸钾(KBF4)、硼酐(B2O3)和浓硫酸反应制取BF3气体,经装置B中浓硫酸干燥后进入装置C与AlCl3反应,AlCl3易升华,所以用装置a冷凝回流,装置D中冷凝收集BCl3,为防止BCl3水解,装置E中盛放碱石灰吸收水蒸气,装置F处理尾气。
【详解】(1)BF3分子中B原子形成3个共价键,B原子上无孤对电子,所以B原子杂化类型是sp2杂化;
AlCl3的物质沸点是180℃,沸点比较低,故氯化铝属于分子晶体;
装置C中仪器a的名称是球形冷凝管;
(2)装置A中发生的反应为非氧化还原反应,且产生一种酸式盐,可判断酸式盐为KHSO4,气体为BF3;
(3)BCl3是强酸弱碱盐,易水解,先加热A处,可以利用A处产生的BF3气体排除装置内空气,防正水蒸气干扰实验;
(4)装置B中盛有浓硫酸作干燥剂,同时也可以通过观察装置B中产生的气流大小来控制气体流速;
(5)装置D采用用冰水浴,其作用是冷凝收集BCl3;
(6)2.50 g无水AlCl3的物质的量n(AlCl3)=,则理论上制取Cl元素守恒,可知制取BCl3的物质的量n(BCl3)=,BCl3和水反应产生H3BO3、HCl,该反应的化学方程式为BCl3+3H2O=H3BO3+3HCl,所以得到的溶液中H3BO3和HCl的物质的量之比为1:3,10 mL待测液共消耗NaOH的物质的量n(NaOH)=0.1000 mol/L×0.028 L=0.0028 mol,所以10 mL待测液中含有H3BO3的物质的量n(H3BO3)=n(NaOH)=0.0007 mol,250 mL待测液中含有H3BO3的物质的量n(H3BO3)=0.0007 mol×=0.0175 mol,根据B元素守恒可知BCl3的物质的量为0.0175 mol,所以产率为
