5.2氨气的制备 课件(共28张PPT) 2022-2023学年高一化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2氨气的制备 课件(共28张PPT) 2022-2023学年高一化学人教版(2019)必修第二册 |  | |
| 格式 | zip | ||
| 文件大小 | 43.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-17 14:56:10 | ||
图片预览






文档简介
(共28张PPT)
POWERPOINT
化学实验
高中化学人教版必修二
氨气的制备
环节一 复习旧知,导入新课
雷雨发庄稼
N2
O2 ,放电
NO
O2
NO2
H2O
HNO3
矿物质
硝酸盐
促进农作物生长
环节一 复习旧知,导入新课
铵盐的性质
绝大多数铵盐易溶于水
1.物理性质
2.化学性质
不稳定性
与碱反应
NH4Cl NH3↑+HCl↑
Δ
NH4HCO3 NH3↑+HCl↑+H2O
Δ
NH4Cl+NaOH NH3↑+NaCl+H2O
环节二 建构思维,形成认识模型
制备原理
装置选择
操作及注意事项
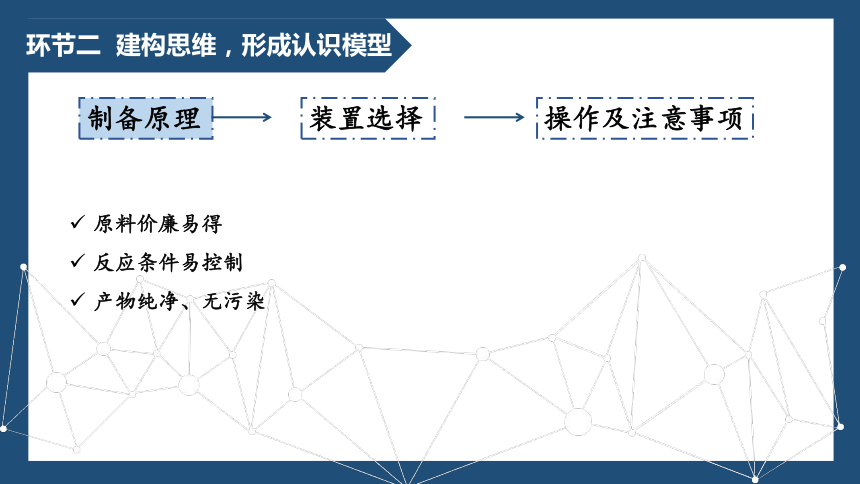
环节二 建构思维,形成认识模型
原料价廉易得
反应条件易控制
产物纯净、无污染
制备原理
装置选择
操作及注意事项
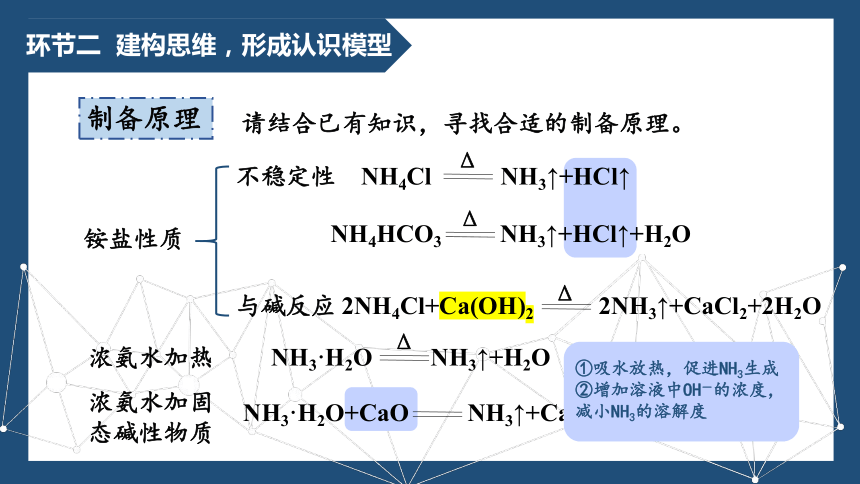
环节二 建构思维,形成认识模型
制备原理
不稳定性
与碱反应
NH4Cl NH3↑+HCl↑
Δ
NH4HCO3 NH3↑+HCl↑+H2O
Δ
NH4Cl+NaOH NH3↑+NaCl+H2O
铵盐性质
请结合已有知识,寻找合适的制备原理。
环节二 建构思维,形成认识模型
制备原理
2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
Δ
不稳定性
与碱反应
NH4Cl NH3↑+HCl↑
Δ
NH4HCO3 NH3↑+HCl↑+H2O
Δ
铵盐性质
请结合已有知识,寻找合适的制备原理。
环节二 建构思维,形成认识模型
制备原理
浓氨水加热
NH3·H2O NH3↑+H2O
Δ
2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
Δ
不稳定性
与碱反应
NH4Cl NH3↑+HCl↑
Δ
NH4HCO3 NH3↑+HCl↑+H2O
Δ
铵盐性质
浓氨水加固态碱性物质
NH3·H2O+CaO NH3↑+Ca(OH)2
①吸水放热,促进NH3生成
②增加溶液中OH-的浓度,减小NH3的溶解度
请结合已有知识,寻找合适的制备原理。
环节二 建构思维,形成认识模型
制备原理
浓氨水加热
NH3·H2O NH3↑+H2O
Δ
2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
Δ
不稳定性
与碱反应
NH4Cl NH3↑+HCl↑
Δ
NH4HCO3 NH3↑+HCl↑+H2O
Δ
铵盐性质
浓氨水加固态碱性物质
NH3·H2O+CaO NH3↑+Ca(OH)2
请结合已有知识,寻找合适的制备原理。
环节二 建构思维,形成认识模型
制备原理
装置选择
操作及注意事项
实验室制备纯净干燥氯气的装置示意图如下:
环节二 建构思维,形成认识模型
制备原理
装置选择
操作及注意事项
发生装置
除杂干燥
收集装置
尾气处理
生成气体
纯净干燥
收集气体
环境保护
环节二 建构思维,形成认识模型
气体 发生装置 除杂干燥 收集装置 尾气处理
氯气 (Cl2)
装置选择
固-液加热
饱和食盐水除HCl
浓硫酸液体干燥
与水反应;
密度大于空气
有毒;
能与碱反应
环节二 建构思维,形成认识模型
装置选择
发生装置
反应物状态
反应条件
固-固加热装置
固-液(液-液)
加热装置
固-液不加热装置
除杂干燥
依据气体和杂质性质选择除杂试剂
试剂的状态
环节二 建构思维,形成认识模型
装置选择
液体干燥剂
固体干燥剂
固体加热
浓硫酸
无水氯化钙,碱石灰,P2O5
金属铜
NH3
碱性气体
反应角度
不能使用酸性干燥剂,
如浓硫酸、P2O5
不能使用无水CaCl2,会发生反应产生CaCl2·8H2O
收集装置
气体溶解性
是否与水反应
气体密度
环节二 建构思维,形成认识模型
装置选择
NH3
水溶性
密度
极易溶于水且与水反应,
不能用排水法
不与空气中的成分反应,密度小于空气
排水法
向上排空气法
向下排空气法
尾气处理
气体的性质
环节二 建构思维,形成认识模型
装置选择
尾气处理装置
NH3
水溶性
碱性
极易溶于水且与水反应,
可用水吸收
与硫酸反应,
可用浓硫酸吸收
尾气处理
气体的性质
环节二 建构思维,形成认识模型
装置选择
尾气处理装置
吸收式需防倒吸
改进装置
环节二 建构思维,形成认识模型
制备原理
装置选择
操作及注意事项
生成气体
纯净干燥
收集气体
环境保护
发生装置
反应物状态
反应条件
除杂干燥
依据气体和杂质性质选择除杂试剂
试剂的状态
收集装置
气体溶解性
是否与水反应
气体密度
尾气处理
气体的性质
环节二 建构思维,形成认识模型
操作及注意事项
——实验室常用制备氨气
实验原理
环节二 建构思维,形成认识模型
操作及注意事项
——实验室常用制备氨气
实验原理
上部干燥:减少NH3与空气的对流;
下部蘸有水或稀硫酸:吸收多余的NH3,防止污染空气。
环节二 建构思维,形成认识模型
操作及注意事项
——实验室常用制备氨气
实验原理
验满方法
①把湿润的红色石蕊试纸置于试管口,试纸变蓝 ;(碱性)
②将蘸有浓盐酸的玻璃棒置于试管口,有 白烟 产生。(与挥发性酸生成白烟)
环节二 建构思维,形成认识模型
操作及注意事项
——实验室快速制备少量氨气
环节三 变式训练,迁移应用
巩固强化
①氨气的发生装置可以选择上图中的_________,反应的化学方程式为______________________________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→___________________________(按气流方向,用小写字母表示)。
环节三 变式训练,迁移应用
陌生情境
请设计实验装置制备氨气,并将制得的纯净干燥的氨气通入装有氧化铜固体的硬质玻璃管中,探究氨气的还原性。请画出你设计的实验装置。
环节四 回顾历史,科学前沿
工业合成氨
19世纪以前,农业生产所需氮肥的来源,主要是有机物的副产物和动植物的废物,如粪便、种子饼、腐鱼、屠宰废料、腐烂动植物等。
勒夏特列
能斯特
哈伯
环节四 回顾历史,科学前沿
工业合成氨
环节四 回顾历史,科学前沿
绿色合成氨
工业化电化学合成氨技术的研究
锂介导的高效电合成氨
POWERPOINT
化学实验
高中化学人教版必修二
氨气的制备
授课教师:大连市一〇三中学 肖新宜
POWERPOINT
化学实验
高中化学人教版必修二
氨气的制备
环节一 复习旧知,导入新课
雷雨发庄稼
N2
O2 ,放电
NO
O2
NO2
H2O
HNO3
矿物质
硝酸盐
促进农作物生长
环节一 复习旧知,导入新课
铵盐的性质
绝大多数铵盐易溶于水
1.物理性质
2.化学性质
不稳定性
与碱反应
NH4Cl NH3↑+HCl↑
Δ
NH4HCO3 NH3↑+HCl↑+H2O
Δ
NH4Cl+NaOH NH3↑+NaCl+H2O
环节二 建构思维,形成认识模型
制备原理
装置选择
操作及注意事项
环节二 建构思维,形成认识模型
原料价廉易得
反应条件易控制
产物纯净、无污染
制备原理
装置选择
操作及注意事项
环节二 建构思维,形成认识模型
制备原理
不稳定性
与碱反应
NH4Cl NH3↑+HCl↑
Δ
NH4HCO3 NH3↑+HCl↑+H2O
Δ
NH4Cl+NaOH NH3↑+NaCl+H2O
铵盐性质
请结合已有知识,寻找合适的制备原理。
环节二 建构思维,形成认识模型
制备原理
2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
Δ
不稳定性
与碱反应
NH4Cl NH3↑+HCl↑
Δ
NH4HCO3 NH3↑+HCl↑+H2O
Δ
铵盐性质
请结合已有知识,寻找合适的制备原理。
环节二 建构思维,形成认识模型
制备原理
浓氨水加热
NH3·H2O NH3↑+H2O
Δ
2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
Δ
不稳定性
与碱反应
NH4Cl NH3↑+HCl↑
Δ
NH4HCO3 NH3↑+HCl↑+H2O
Δ
铵盐性质
浓氨水加固态碱性物质
NH3·H2O+CaO NH3↑+Ca(OH)2
①吸水放热,促进NH3生成
②增加溶液中OH-的浓度,减小NH3的溶解度
请结合已有知识,寻找合适的制备原理。
环节二 建构思维,形成认识模型
制备原理
浓氨水加热
NH3·H2O NH3↑+H2O
Δ
2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
Δ
不稳定性
与碱反应
NH4Cl NH3↑+HCl↑
Δ
NH4HCO3 NH3↑+HCl↑+H2O
Δ
铵盐性质
浓氨水加固态碱性物质
NH3·H2O+CaO NH3↑+Ca(OH)2
请结合已有知识,寻找合适的制备原理。
环节二 建构思维,形成认识模型
制备原理
装置选择
操作及注意事项
实验室制备纯净干燥氯气的装置示意图如下:
环节二 建构思维,形成认识模型
制备原理
装置选择
操作及注意事项
发生装置
除杂干燥
收集装置
尾气处理
生成气体
纯净干燥
收集气体
环境保护
环节二 建构思维,形成认识模型
气体 发生装置 除杂干燥 收集装置 尾气处理
氯气 (Cl2)
装置选择
固-液加热
饱和食盐水除HCl
浓硫酸液体干燥
与水反应;
密度大于空气
有毒;
能与碱反应
环节二 建构思维,形成认识模型
装置选择
发生装置
反应物状态
反应条件
固-固加热装置
固-液(液-液)
加热装置
固-液不加热装置
除杂干燥
依据气体和杂质性质选择除杂试剂
试剂的状态
环节二 建构思维,形成认识模型
装置选择
液体干燥剂
固体干燥剂
固体加热
浓硫酸
无水氯化钙,碱石灰,P2O5
金属铜
NH3
碱性气体
反应角度
不能使用酸性干燥剂,
如浓硫酸、P2O5
不能使用无水CaCl2,会发生反应产生CaCl2·8H2O
收集装置
气体溶解性
是否与水反应
气体密度
环节二 建构思维,形成认识模型
装置选择
NH3
水溶性
密度
极易溶于水且与水反应,
不能用排水法
不与空气中的成分反应,密度小于空气
排水法
向上排空气法
向下排空气法
尾气处理
气体的性质
环节二 建构思维,形成认识模型
装置选择
尾气处理装置
NH3
水溶性
碱性
极易溶于水且与水反应,
可用水吸收
与硫酸反应,
可用浓硫酸吸收
尾气处理
气体的性质
环节二 建构思维,形成认识模型
装置选择
尾气处理装置
吸收式需防倒吸
改进装置
环节二 建构思维,形成认识模型
制备原理
装置选择
操作及注意事项
生成气体
纯净干燥
收集气体
环境保护
发生装置
反应物状态
反应条件
除杂干燥
依据气体和杂质性质选择除杂试剂
试剂的状态
收集装置
气体溶解性
是否与水反应
气体密度
尾气处理
气体的性质
环节二 建构思维,形成认识模型
操作及注意事项
——实验室常用制备氨气
实验原理
环节二 建构思维,形成认识模型
操作及注意事项
——实验室常用制备氨气
实验原理
上部干燥:减少NH3与空气的对流;
下部蘸有水或稀硫酸:吸收多余的NH3,防止污染空气。
环节二 建构思维,形成认识模型
操作及注意事项
——实验室常用制备氨气
实验原理
验满方法
①把湿润的红色石蕊试纸置于试管口,试纸变蓝 ;(碱性)
②将蘸有浓盐酸的玻璃棒置于试管口,有 白烟 产生。(与挥发性酸生成白烟)
环节二 建构思维,形成认识模型
操作及注意事项
——实验室快速制备少量氨气
环节三 变式训练,迁移应用
巩固强化
①氨气的发生装置可以选择上图中的_________,反应的化学方程式为______________________________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→___________________________(按气流方向,用小写字母表示)。
环节三 变式训练,迁移应用
陌生情境
请设计实验装置制备氨气,并将制得的纯净干燥的氨气通入装有氧化铜固体的硬质玻璃管中,探究氨气的还原性。请画出你设计的实验装置。
环节四 回顾历史,科学前沿
工业合成氨
19世纪以前,农业生产所需氮肥的来源,主要是有机物的副产物和动植物的废物,如粪便、种子饼、腐鱼、屠宰废料、腐烂动植物等。
勒夏特列
能斯特
哈伯
环节四 回顾历史,科学前沿
工业合成氨
环节四 回顾历史,科学前沿
绿色合成氨
工业化电化学合成氨技术的研究
锂介导的高效电合成氨
POWERPOINT
化学实验
高中化学人教版必修二
氨气的制备
授课教师:大连市一〇三中学 肖新宜
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
