【备考2023】浙教版科学中考“临阵磨枪”专题训练(二十九):物质的组成和结构【word,含答案】
文档属性
| 名称 | 【备考2023】浙教版科学中考“临阵磨枪”专题训练(二十九):物质的组成和结构【word,含答案】 |

|
|
| 格式 | doc | ||
| 文件大小 | 265.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-04-15 00:00:00 | ||
图片预览



文档简介
1.锶是人体不可缺少的微量元素。下列说法错误的是( )
A.锶是一种金属元素 B.锶原子的质子数为38
C.锶的元素符号是Sr D.锶的相对原子质量为87.62g
2.1897年,英国科学家汤姆生发现了原子内有带负电的电子,而原子是电中性的。由此推测,原子内还有带正电的物质。在此基础上,经过卢瑟福、玻尔等科学家不断完善和修正,建立了现代原子结构模型。如图是小柯整理的物质微观构成知识网络图,则汤姆生当年推测的“带正电的物质”相当于图中的( )
A.甲 B.乙 C.丙 D.丁
3.从下图所示微粒结构示意图中,获取信息正确的是
A.图示①中的“2”表示核电荷数 B.图示②和③代表的元素位于元素周期表的同一周期
C.图示④表示的微粒符号是Mg2+ D.它们属于四种元素
4.下列化学用语中表示的意义不正确的是
A.Ca:表示钙元素 B.2OH-:表示2个氢氧根离子
C.2N:表示2个氮分子 D.2K:表示2个钾原子
5.如图为某原子的结构示意图,该原子的原子核中有( )
A.6个质子和8个中子 B.8个质子和6个中子
C.6个质子和8个电子 D.8个质子和6个电子
6.高氯酸钾(化学式为KClO4)是烟花中常用的氧化剂,可增加烟花的亮度。高氯酸钾中氯元素的化合价为( )
A.-7 B.-1 C.+5 D.+7
7.某金属氧化物的组成为MO,如果在其氯化物中金属的化合价与该氧化物中的化合价相等,则该金属氯化物的组成为( )
A.MCl B.MCl2
C.M2Cl D.M2Cl2
8.构建化学基本观念是学好化学的基础。下列对化学基本观念的认识,不正确的是( )
A.结构观:H2O和H2O2化学性质不同,因为它们分子的构成不同
B.分类观:根据组成元素的异同,可将纯净物分为单质和化合物
C.变化观:在一定条件下,CO2和CO可以相互转化
D.微粒观:所有原子的原子核都是由质子和中子构成的
9.南京理工大学胡炳成团队用新方法制得了 NaN5·3H2O,该化合物中含有 N等微粒,已知N为7号元素,则下列有关说法正确的是( )
A.N是一种单质
B.1 个N带一个单位的正电荷
C.1 个N共含有35个质子
D.1 个N中共含有35个电子
10.某元素X的原子序数为a,能够形成Xn-,另一元素Y能够形成与Xn-具有相同电子层结构的Ym+,则Y元素的质子数是
A.a+m-n B.a+m+n C.a-m-n D.a-m+n
11.如果用符号“●”表示氧原子,用符号“○”表示氢原子,则下列模型表示化合物的是( )
12.下列化学符号中数字“2”表示的意义正确的是
①2Na ②2OH- ③NO2 ④ ⑤Fe2+ ⑥2CO ⑦H2
A.④⑤中的“2”均表示化合价 B.②⑤中的“2”均表示电荷数
C.③⑦中的“2”均表示分子中原子的个数 D.①⑥中的“2”均表示分子的个数
13.测得某溶液中仅含Cu2+、K+、Cl-、SO四种离子,且数量比为Cu2+∶K+∶ Cl-= 3∶4∶6,则SO∶Cl-的比值是( )
A.3∶2 B.1∶3
C.1∶8 D.2∶5
14.2017年5月,中国科学院等相关部门正式定名了4 种元素,其中2 种元素的信息如表。据此能得出的推论是( )
原子序数 中文名称 符号 相对原子质量
113 Nh 284
115 镆 Mc 288
A. 原子的中子数113
B.镆原子的核电荷数为288
C.镆原子比原子核外多2个电子
D.镆原子比原子质量大4g
15.为了应对全球爆发的新冠肺炎疫情,化学精灵用某主要成分是次氯酸钠(NaClO)的消毒剂对校园进行消毒。NaClO中钠元素为+1价,氧元素为﹣2价,则其中氯元素的化合价是
A.+1 B.﹣1 C.+2 D.﹣2
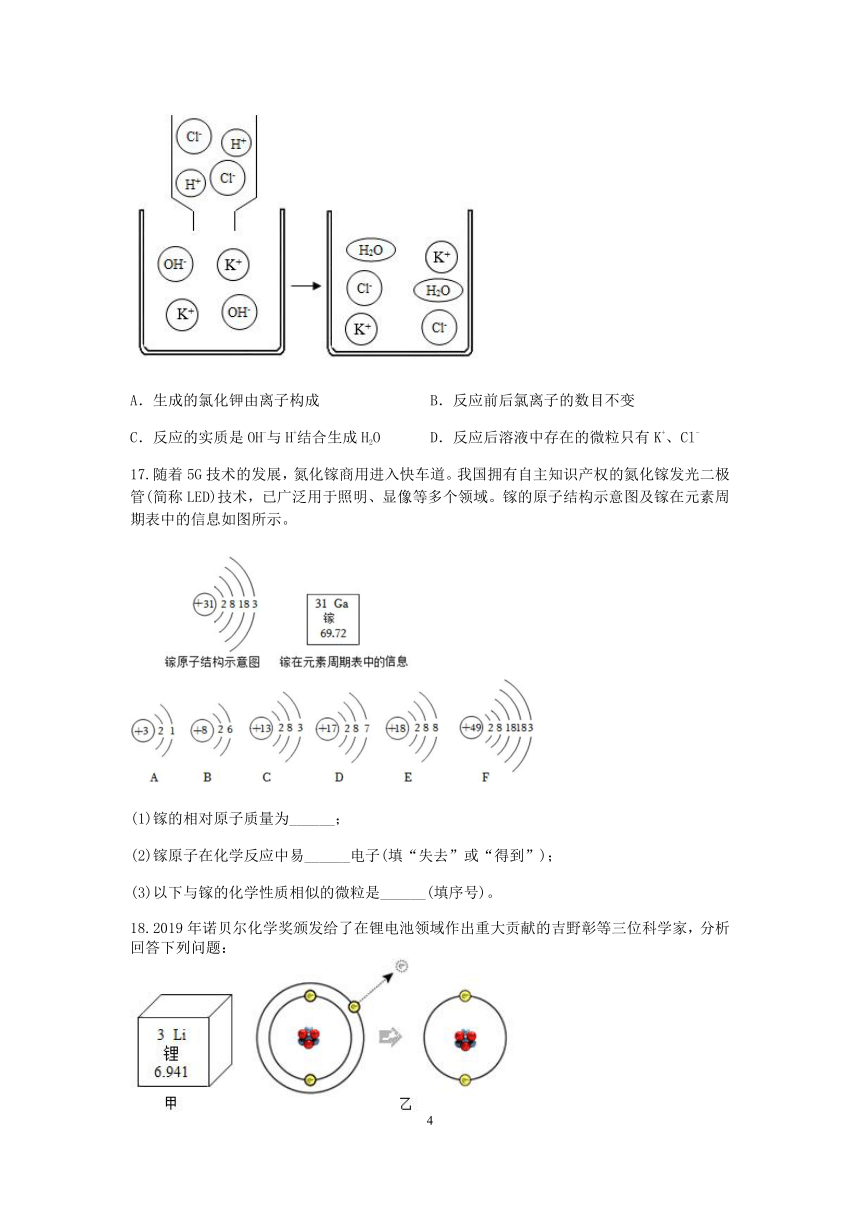
16.如图是氢氧化钾溶液与稀盐酸反应的微观示意图,下列有关该反应的说法错误的是
A.生成的氯化钾由离子构成 B.反应前后氯离子的数目不变
C.反应的实质是OH-与H+结合生成H2O D.反应后溶液中存在的微粒只有K+、Cl
17.随着5G技术的发展,氮化镓商用进入快车道。我国拥有自主知识产权的氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。镓的原子结构示意图及镓在元素周期表中的信息如图所示。
(1)镓的相对原子质量为______;
(2)镓原子在化学反应中易______电子(填“失去”或“得到”);
(3)以下与镓的化学性质相似的微粒是______(填序号)。
18.2019年诺贝尔化学奖颁发给了在锂电池领域作出重大贡献的吉野彰等三位科学家,分析回答下列问题:
(1)图甲是元素周期表中锂元素的相关信息,可知锂元素的原子核电荷数是________。
(2)图乙表示锂原子转变为锂离子的过程,锂离子符号可表示为________。
19.元素周期表是学习科学的重要工具。下表是元素周期表的一部分,请回答下列问题。
(1)不同种元素之间最本质的区别是________不同。
A.相对原子质量 B.质子数 C.中子数
(2)第3号元素属于________(选填“金属”或“非金属”)元素。
(3)第12号元素和第17号元素组成化合物的化学式是________。
20.如图,密闭玻璃瓶内的水恒温放置几天后,液态水不会减少也不会增加,并不是瓶内的水既不汽化也不液化,而是瓶内存在着汽化和液化的动态平衡过程。
(1)请你从分子的角度简要解释瓶内液态水体积保持不变的原因。______________________。
(2)自然界中存在很多这样的动态平衡,如一个稳定的生态系统,存在物质和能量的输入和输出的动态平衡。请你根据所学知识,再举1个类似的动态平衡例子。______________________________________________。
答案及解析
1.D
【解析】A、由元素周期表中的一格可知,中间的汉字表示该元素的名称,锶是金字旁,所以锶是一种金属元素,故A正确;
B、由元素周期表中的一格可知,左上角是原子序数,即锶的原子序数为38,在原子中,核电荷数=核内质子数=核外电子数=原子序数=38,所以锶原子的质子数为38 ,故B正确;
C、由元素周期表中的一格可知,右上角表示元素符号,即锶的元素符号是Sr,故C正确;
D、由元素周期表中的一格可知,汉子下方的数字表示相对原子质量,即锶的相对原子质量为87.62,相对原子质量的单位是1,通常省略,不是克,故D错误;
2.B
【解析】原子由原子核和核外电子构成,原子核由质子和中子构成,质子带正电,中子不带电,所以原子核带正电。因汤姆生发现的原子是电子和“带正电的物质”两部分组成,所以“带正电的物质”相当于图中的乙(原子核)。
3.B
【解析】A、原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数。图示①中的“2”表示该微粒第一层上电子数,不是表示核电荷数,错误;
B、图示②和③分别 表示钠离子和镁离子,它们的原子核外都有三层电子,在元素周期表中,电子层数相同的原子位于同一周期,图示②和③代表的元素位于元素周期表的同一周期,正确;
C、图示④中,核电荷数=核外电子数,表示镁原子,其微粒符号是Mg,错误;
D.决定元素种类的是核内质子数,图中4种微粒中有3种质子数,它们属于三种元素,错误。
4.C
【解析】A. 书写元素符号注意“一大二小”;Ca:表示钙元素,正确;
B. 子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略;表示多个该离子,在其符号前加上相应的数字;2OH-:表示2个氢氧根离子,正确;
C. 原子的表示方法用元素符号表示,表示微粒的个数在微粒前面加对应数字;2N:表示2个氮原子,错误;
D. 2K:表示2个钾原子,正确;
故选C。
5.A
【解析】由该原子的结构示意图可知,其原子核外有6个电子,原子核内有6个质子和8个中子,原子核是由质子和中子构成的。
6.D
【解析】在 KClO4 中,K的化合价为+1价,O的化合价为-2价,根据正负化合价的和为0得到:+1+x+(-2)×4=0,那么高氯酸钾中氯元素的化合价为+7价,故D正确。
7.B
【解析】根据金属氧化物组成的化学式为MO,可判断M的化合价为+2价,氯离子的化合价为-1价,所以其氯化物化学式应为MCl2。
8.D
【解析】A、分子是保持物质化学性质的最小微粒,水由水分子构成,过氧化氢由过氧化氢分子构成,则两者化学性质不同,故选项说法正确;
B、单质是指由同种元素组成的纯净物;化合物是指由两种或两种以上的元素组成的纯净物,则根据组成元素的异同,可将纯净物分为单质和化合物,故选项说法正确;
C、C与CO2在高温下反应生成CO,CO与O2燃烧生成CO2,则在一定条件下,CO2和CO可以相互转化,故选项说法正确;
D、氢原子核中没有中子,故选项说法错误。
故选D。
9.C
【解析】N是带一个单位负电荷的阴离子,不是单质;每个N原子有7个质子,故1个N中含有35个质子,35个正电荷;1 个N有35个质子,36个电子。
10.B
【解析】在原子中,核电荷数=核内质子数=核外电子数,X元素原子的原子序数为a,故质子数为a,X得到n个电子后变为Xn-,Xn-的核外电子数是;Y失去m个电子后变为Ym+,设元素Y的核电荷数即质子数是,Ym+的核外电子数是;Y能够形成与Xn-具有相同电子层结构的Ym+,即核外电子数相同,故,则;故选:B。
11.A
【解析】A图中每一个粒子(水分子)都是由一个氧原子和两个氢原子构成,表示化合物。B图表示水和氢气的混合物。C图表示氢气和氧气的混合物。D图表示氢气单质。
12.C
【解析】A、化合价的表示方法:在元素符号正上方标注元素显示的化合价,正负号在前,数字在后,④中的“2”均表示化合价;离子的表示方法:在元素符号右上方标注离子显示的化合价,数字在前,正负号在后,数字为“1”省略不写,⑤中的“2”均表示离子所带的电荷,表示的意义错误;
B、在元素符号右上方标注离子所带电荷数及电性,数字在前,正负号在后,数字为“1”省略不写,离子前面的数字表示离子的个数,②中的“2”均表示离子的个数,⑤中的“2”均表示电荷数,表示的意义错误;
C、由分子构成的物质,元素符号右下角的数字表示该分子中这种原子的个数,③⑦中的“2”均表示分子中原子的个数,表示的意义正确;
D、元素符号前面的数字表示原子的个数,①中的“2”均表示原子的个数;由分子构成的物质,化学式前面的数字表示分子的个数,⑥中的“2”均表示分子的个数,表示的意义错误;
答案:C。
13.B
【解析】整个溶液呈电中性,即四种离子所带正、负电荷数相等。设离子的数量比Cu2+∶K+∶Cl-∶SO=3∶4∶6∶n,则+2×3+1×4-1×6-2×n=0,解得:n=2,所以离子数量比SO∶Cl-=2∶6=1∶3。
14.C
【解析】原子核内的中子数为相对原子质量与原子序数的差,所以原子的中子数为171;原子的核电荷数等于原子序数即核内质子数,所以镆原子的核电荷数为115;原子的核外电子数就等于核电荷数,所以镆原子比原子核外多2 个电子;镆原子的相对原子质量比原子大4。
15.A
【解析】NaClO中钠元素为+1价,氧元素为-2价,设NaClO中氯元素化合价为x,根据化合物中各元素正、负化合价代数和为零,则(+1)+x+(-2)=0,解得x=+1,故其中氯元素的化合价是+1价。
16.D
【解析】A. 从图可知发生的反应是氢氧化钾和盐酸反应生成氯化钾和水,氯化钾是由钾离子和氯离子构成的,正确。
B. 从图中可知,反应前后氯元素均以氯离子的形式存在,氯离子的数目不变。正确。
C. 从图中可知,反应前后氢离子和氢氧根离子减少,水分子增加,反应实质是OH-和H+结合生成H2O。正确。
D. 反应后溶液中存在的微粒有K+、Cl-、H2O。错误。
故选:D。
17.(1)69.72 (2)失去 (3)CF
【解析】(1)根据镓在元素周期表中的信息可知,镓的相对原子质量为69.72。
(2)根据镓的原子结构示意图可知,原子最外层有3个电子,在化学反应中易失去电子。
(3)元素的化学性质是由原子的最外层电子数决定的,在元素周期表中,元素最外层电子数相同,具有相似的化学性质;根据镓的原子结构示意图可知,原子最外层有3个电子,镓原子在化学反应中易失去电子;因此与镓原子的化学性质相似的微粒是CF。
18.(1)3 (2)Li+
【解析】(1)在元素周期表中,元素名称左上角的数字就是原子序数,而原子序数=质子数=核电荷数;
(2)在原子变成离子过程中,失去电子带正电荷,得到电子带负电荷,所带电荷数与得失电子的个数有关。
【解答】(1)根据甲图可知,锂元素的原子序数为3;根据核电荷数=原子序数得到,锂元素的原子核电荷数为3.
(2)根据乙图可知,锂原子失去一个电子得到锂离子,因此锂离子带一个单位的正电荷,那么符号为: Li+ 。
19.(1)B (2)金属 (3)MgCl2
【解析】(1)不同种元素之间最本质的区别是质子数不同;
(2)第3号元素为锂元素,属于金属元素;
(3)第12号元素和第17号元素组成化合物是氯化镁,化学式为 MgCl2 ;
20.(1)水分子在不停地做无规则运动,液态水中的分子有一部分运动到上方的空气中,空气中的水分子有一部分运动到液态水中,两者的数量保持一致
(2)人体体温的恒定,是由于人体内产热与散热的动态平衡(或饱和溶液中存在溶解和结晶的动态平衡;人体内的水盐平衡;血糖浓度能保持相对稳定;大气成分的稳定等)
【解析】从分子的角度,水分子数量与外界没有交换,保持一致
如体温调节,水盐平衡等。
物质的组成和结构
A.锶是一种金属元素 B.锶原子的质子数为38
C.锶的元素符号是Sr D.锶的相对原子质量为87.62g
2.1897年,英国科学家汤姆生发现了原子内有带负电的电子,而原子是电中性的。由此推测,原子内还有带正电的物质。在此基础上,经过卢瑟福、玻尔等科学家不断完善和修正,建立了现代原子结构模型。如图是小柯整理的物质微观构成知识网络图,则汤姆生当年推测的“带正电的物质”相当于图中的( )
A.甲 B.乙 C.丙 D.丁
3.从下图所示微粒结构示意图中,获取信息正确的是
A.图示①中的“2”表示核电荷数 B.图示②和③代表的元素位于元素周期表的同一周期
C.图示④表示的微粒符号是Mg2+ D.它们属于四种元素
4.下列化学用语中表示的意义不正确的是
A.Ca:表示钙元素 B.2OH-:表示2个氢氧根离子
C.2N:表示2个氮分子 D.2K:表示2个钾原子
5.如图为某原子的结构示意图,该原子的原子核中有( )
A.6个质子和8个中子 B.8个质子和6个中子
C.6个质子和8个电子 D.8个质子和6个电子
6.高氯酸钾(化学式为KClO4)是烟花中常用的氧化剂,可增加烟花的亮度。高氯酸钾中氯元素的化合价为( )
A.-7 B.-1 C.+5 D.+7
7.某金属氧化物的组成为MO,如果在其氯化物中金属的化合价与该氧化物中的化合价相等,则该金属氯化物的组成为( )
A.MCl B.MCl2
C.M2Cl D.M2Cl2
8.构建化学基本观念是学好化学的基础。下列对化学基本观念的认识,不正确的是( )
A.结构观:H2O和H2O2化学性质不同,因为它们分子的构成不同
B.分类观:根据组成元素的异同,可将纯净物分为单质和化合物
C.变化观:在一定条件下,CO2和CO可以相互转化
D.微粒观:所有原子的原子核都是由质子和中子构成的
9.南京理工大学胡炳成团队用新方法制得了 NaN5·3H2O,该化合物中含有 N等微粒,已知N为7号元素,则下列有关说法正确的是( )
A.N是一种单质
B.1 个N带一个单位的正电荷
C.1 个N共含有35个质子
D.1 个N中共含有35个电子
10.某元素X的原子序数为a,能够形成Xn-,另一元素Y能够形成与Xn-具有相同电子层结构的Ym+,则Y元素的质子数是
A.a+m-n B.a+m+n C.a-m-n D.a-m+n
11.如果用符号“●”表示氧原子,用符号“○”表示氢原子,则下列模型表示化合物的是( )
12.下列化学符号中数字“2”表示的意义正确的是
①2Na ②2OH- ③NO2 ④ ⑤Fe2+ ⑥2CO ⑦H2
A.④⑤中的“2”均表示化合价 B.②⑤中的“2”均表示电荷数
C.③⑦中的“2”均表示分子中原子的个数 D.①⑥中的“2”均表示分子的个数
13.测得某溶液中仅含Cu2+、K+、Cl-、SO四种离子,且数量比为Cu2+∶K+∶ Cl-= 3∶4∶6,则SO∶Cl-的比值是( )
A.3∶2 B.1∶3
C.1∶8 D.2∶5
14.2017年5月,中国科学院等相关部门正式定名了4 种元素,其中2 种元素的信息如表。据此能得出的推论是( )
原子序数 中文名称 符号 相对原子质量
113 Nh 284
115 镆 Mc 288
A. 原子的中子数113
B.镆原子的核电荷数为288
C.镆原子比原子核外多2个电子
D.镆原子比原子质量大4g
15.为了应对全球爆发的新冠肺炎疫情,化学精灵用某主要成分是次氯酸钠(NaClO)的消毒剂对校园进行消毒。NaClO中钠元素为+1价,氧元素为﹣2价,则其中氯元素的化合价是
A.+1 B.﹣1 C.+2 D.﹣2
16.如图是氢氧化钾溶液与稀盐酸反应的微观示意图,下列有关该反应的说法错误的是
A.生成的氯化钾由离子构成 B.反应前后氯离子的数目不变
C.反应的实质是OH-与H+结合生成H2O D.反应后溶液中存在的微粒只有K+、Cl
17.随着5G技术的发展,氮化镓商用进入快车道。我国拥有自主知识产权的氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。镓的原子结构示意图及镓在元素周期表中的信息如图所示。
(1)镓的相对原子质量为______;
(2)镓原子在化学反应中易______电子(填“失去”或“得到”);
(3)以下与镓的化学性质相似的微粒是______(填序号)。
18.2019年诺贝尔化学奖颁发给了在锂电池领域作出重大贡献的吉野彰等三位科学家,分析回答下列问题:
(1)图甲是元素周期表中锂元素的相关信息,可知锂元素的原子核电荷数是________。
(2)图乙表示锂原子转变为锂离子的过程,锂离子符号可表示为________。
19.元素周期表是学习科学的重要工具。下表是元素周期表的一部分,请回答下列问题。
(1)不同种元素之间最本质的区别是________不同。
A.相对原子质量 B.质子数 C.中子数
(2)第3号元素属于________(选填“金属”或“非金属”)元素。
(3)第12号元素和第17号元素组成化合物的化学式是________。
20.如图,密闭玻璃瓶内的水恒温放置几天后,液态水不会减少也不会增加,并不是瓶内的水既不汽化也不液化,而是瓶内存在着汽化和液化的动态平衡过程。
(1)请你从分子的角度简要解释瓶内液态水体积保持不变的原因。______________________。
(2)自然界中存在很多这样的动态平衡,如一个稳定的生态系统,存在物质和能量的输入和输出的动态平衡。请你根据所学知识,再举1个类似的动态平衡例子。______________________________________________。
答案及解析
1.D
【解析】A、由元素周期表中的一格可知,中间的汉字表示该元素的名称,锶是金字旁,所以锶是一种金属元素,故A正确;
B、由元素周期表中的一格可知,左上角是原子序数,即锶的原子序数为38,在原子中,核电荷数=核内质子数=核外电子数=原子序数=38,所以锶原子的质子数为38 ,故B正确;
C、由元素周期表中的一格可知,右上角表示元素符号,即锶的元素符号是Sr,故C正确;
D、由元素周期表中的一格可知,汉子下方的数字表示相对原子质量,即锶的相对原子质量为87.62,相对原子质量的单位是1,通常省略,不是克,故D错误;
2.B
【解析】原子由原子核和核外电子构成,原子核由质子和中子构成,质子带正电,中子不带电,所以原子核带正电。因汤姆生发现的原子是电子和“带正电的物质”两部分组成,所以“带正电的物质”相当于图中的乙(原子核)。
3.B
【解析】A、原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数。图示①中的“2”表示该微粒第一层上电子数,不是表示核电荷数,错误;
B、图示②和③分别 表示钠离子和镁离子,它们的原子核外都有三层电子,在元素周期表中,电子层数相同的原子位于同一周期,图示②和③代表的元素位于元素周期表的同一周期,正确;
C、图示④中,核电荷数=核外电子数,表示镁原子,其微粒符号是Mg,错误;
D.决定元素种类的是核内质子数,图中4种微粒中有3种质子数,它们属于三种元素,错误。
4.C
【解析】A. 书写元素符号注意“一大二小”;Ca:表示钙元素,正确;
B. 子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略;表示多个该离子,在其符号前加上相应的数字;2OH-:表示2个氢氧根离子,正确;
C. 原子的表示方法用元素符号表示,表示微粒的个数在微粒前面加对应数字;2N:表示2个氮原子,错误;
D. 2K:表示2个钾原子,正确;
故选C。
5.A
【解析】由该原子的结构示意图可知,其原子核外有6个电子,原子核内有6个质子和8个中子,原子核是由质子和中子构成的。
6.D
【解析】在 KClO4 中,K的化合价为+1价,O的化合价为-2价,根据正负化合价的和为0得到:+1+x+(-2)×4=0,那么高氯酸钾中氯元素的化合价为+7价,故D正确。
7.B
【解析】根据金属氧化物组成的化学式为MO,可判断M的化合价为+2价,氯离子的化合价为-1价,所以其氯化物化学式应为MCl2。
8.D
【解析】A、分子是保持物质化学性质的最小微粒,水由水分子构成,过氧化氢由过氧化氢分子构成,则两者化学性质不同,故选项说法正确;
B、单质是指由同种元素组成的纯净物;化合物是指由两种或两种以上的元素组成的纯净物,则根据组成元素的异同,可将纯净物分为单质和化合物,故选项说法正确;
C、C与CO2在高温下反应生成CO,CO与O2燃烧生成CO2,则在一定条件下,CO2和CO可以相互转化,故选项说法正确;
D、氢原子核中没有中子,故选项说法错误。
故选D。
9.C
【解析】N是带一个单位负电荷的阴离子,不是单质;每个N原子有7个质子,故1个N中含有35个质子,35个正电荷;1 个N有35个质子,36个电子。
10.B
【解析】在原子中,核电荷数=核内质子数=核外电子数,X元素原子的原子序数为a,故质子数为a,X得到n个电子后变为Xn-,Xn-的核外电子数是;Y失去m个电子后变为Ym+,设元素Y的核电荷数即质子数是,Ym+的核外电子数是;Y能够形成与Xn-具有相同电子层结构的Ym+,即核外电子数相同,故,则;故选:B。
11.A
【解析】A图中每一个粒子(水分子)都是由一个氧原子和两个氢原子构成,表示化合物。B图表示水和氢气的混合物。C图表示氢气和氧气的混合物。D图表示氢气单质。
12.C
【解析】A、化合价的表示方法:在元素符号正上方标注元素显示的化合价,正负号在前,数字在后,④中的“2”均表示化合价;离子的表示方法:在元素符号右上方标注离子显示的化合价,数字在前,正负号在后,数字为“1”省略不写,⑤中的“2”均表示离子所带的电荷,表示的意义错误;
B、在元素符号右上方标注离子所带电荷数及电性,数字在前,正负号在后,数字为“1”省略不写,离子前面的数字表示离子的个数,②中的“2”均表示离子的个数,⑤中的“2”均表示电荷数,表示的意义错误;
C、由分子构成的物质,元素符号右下角的数字表示该分子中这种原子的个数,③⑦中的“2”均表示分子中原子的个数,表示的意义正确;
D、元素符号前面的数字表示原子的个数,①中的“2”均表示原子的个数;由分子构成的物质,化学式前面的数字表示分子的个数,⑥中的“2”均表示分子的个数,表示的意义错误;
答案:C。
13.B
【解析】整个溶液呈电中性,即四种离子所带正、负电荷数相等。设离子的数量比Cu2+∶K+∶Cl-∶SO=3∶4∶6∶n,则+2×3+1×4-1×6-2×n=0,解得:n=2,所以离子数量比SO∶Cl-=2∶6=1∶3。
14.C
【解析】原子核内的中子数为相对原子质量与原子序数的差,所以原子的中子数为171;原子的核电荷数等于原子序数即核内质子数,所以镆原子的核电荷数为115;原子的核外电子数就等于核电荷数,所以镆原子比原子核外多2 个电子;镆原子的相对原子质量比原子大4。
15.A
【解析】NaClO中钠元素为+1价,氧元素为-2价,设NaClO中氯元素化合价为x,根据化合物中各元素正、负化合价代数和为零,则(+1)+x+(-2)=0,解得x=+1,故其中氯元素的化合价是+1价。
16.D
【解析】A. 从图可知发生的反应是氢氧化钾和盐酸反应生成氯化钾和水,氯化钾是由钾离子和氯离子构成的,正确。
B. 从图中可知,反应前后氯元素均以氯离子的形式存在,氯离子的数目不变。正确。
C. 从图中可知,反应前后氢离子和氢氧根离子减少,水分子增加,反应实质是OH-和H+结合生成H2O。正确。
D. 反应后溶液中存在的微粒有K+、Cl-、H2O。错误。
故选:D。
17.(1)69.72 (2)失去 (3)CF
【解析】(1)根据镓在元素周期表中的信息可知,镓的相对原子质量为69.72。
(2)根据镓的原子结构示意图可知,原子最外层有3个电子,在化学反应中易失去电子。
(3)元素的化学性质是由原子的最外层电子数决定的,在元素周期表中,元素最外层电子数相同,具有相似的化学性质;根据镓的原子结构示意图可知,原子最外层有3个电子,镓原子在化学反应中易失去电子;因此与镓原子的化学性质相似的微粒是CF。
18.(1)3 (2)Li+
【解析】(1)在元素周期表中,元素名称左上角的数字就是原子序数,而原子序数=质子数=核电荷数;
(2)在原子变成离子过程中,失去电子带正电荷,得到电子带负电荷,所带电荷数与得失电子的个数有关。
【解答】(1)根据甲图可知,锂元素的原子序数为3;根据核电荷数=原子序数得到,锂元素的原子核电荷数为3.
(2)根据乙图可知,锂原子失去一个电子得到锂离子,因此锂离子带一个单位的正电荷,那么符号为: Li+ 。
19.(1)B (2)金属 (3)MgCl2
【解析】(1)不同种元素之间最本质的区别是质子数不同;
(2)第3号元素为锂元素,属于金属元素;
(3)第12号元素和第17号元素组成化合物是氯化镁,化学式为 MgCl2 ;
20.(1)水分子在不停地做无规则运动,液态水中的分子有一部分运动到上方的空气中,空气中的水分子有一部分运动到液态水中,两者的数量保持一致
(2)人体体温的恒定,是由于人体内产热与散热的动态平衡(或饱和溶液中存在溶解和结晶的动态平衡;人体内的水盐平衡;血糖浓度能保持相对稳定;大气成分的稳定等)
【解析】从分子的角度,水分子数量与外界没有交换,保持一致
如体温调节,水盐平衡等。
物质的组成和结构
同课章节目录
