3.4.2沉淀溶解平衡的应用 课时作业(含解析)
文档属性
| 名称 | 3.4.2沉淀溶解平衡的应用 课时作业(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 558.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-18 11:25:37 | ||
图片预览



文档简介
3.4.2沉淀溶解平衡的应用 课时作业
一、单选题
1.常温下,某研究小组用数字传感器探究的沉淀溶解平衡。实验测得悬浊液中氯离子浓度变化如图所示,其中a点表示溶于溶液形成的悬浊液。下列说法正确的是
A.图中b点可能是滴加溶液 B.图中c点后无黄色沉淀生成
C.图中d点 D.由图可知:
2.T K时,现有25mL含KC1和KCN的溶液,用0.1000mol·L-1的硝酸银标准溶液对该混合液进行电位滴定(CN-与H+的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V)的电位滴定曲线如图所示,曲线上的转折点即为化学计量点。已知:
Ⅰ、Ag+与CN-反应过程为:①Ag++2CN-=[Ag(CN)2]- ②[Ag(CN)2]-+Ag+=2AgCN↓。
Ⅱ、TK时,Ksp(AgCN)=2×10-16,Ksp(AgC1)=2×10-10。
下列说法不正确的是
A.V1=5.00,B点时生成AgCN
B.c(KCN)=0.02000mol·L-1,c(KC1)=0.03000mol·L-1
C.反应①的平衡常数为K1,反应②的平衡常数为K2,则K1+K2=2Ksp(AgCN)
D.C点时,溶液中
3.下列化学原理的应用,不能用沉淀溶解平衡原理来解释的是
A.热纯碱溶液的洗涤油污能力强
B.误将当作食盐食用时,常用0.5%的溶液解毒
C.溶洞、珊瑚的形成
D.牙膏中添加氟化物能起到预防龋齿的作用
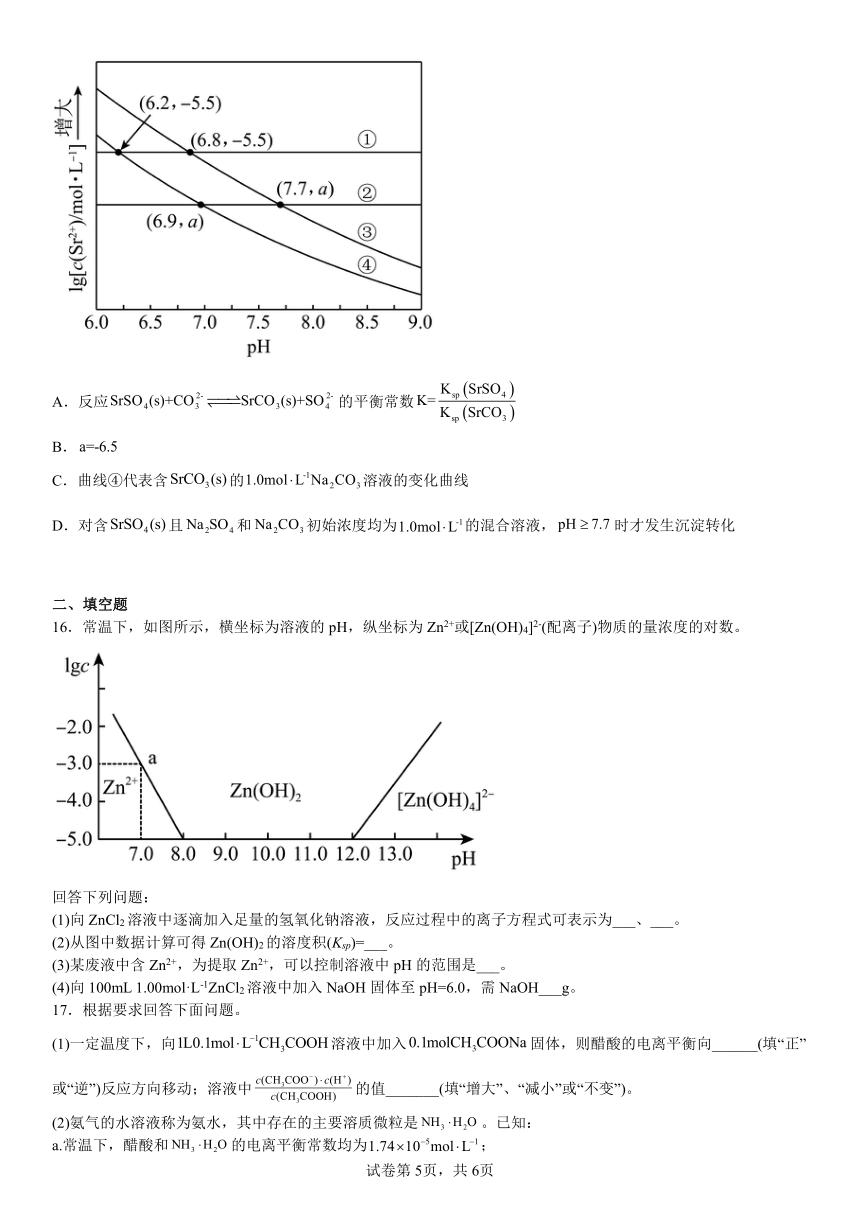
4.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 结论
A 向溶液X中加入Na2O2粉末,出现红褐色沉淀和无色气体 X中不一定含有Fe3+
B 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/LNa2CO3溶液的pH 酸性:HA>H2CO3
C 将铝与氧化铁发生铝热反应后的熔融物在稀盐酸中充分溶解,再滴加几滴KSCN溶液,溶液未变红 熔融物中不含有+3价铁
D 向2支均盛有2mL1.0mol·L-1KOH溶液的试管中分别加入2滴浓度均为0.1mol·L-1的AlCl3和MgCl2溶液,一支试管出现白色沉淀,另一支无明显现象 Ksp[Al(OH)3]>Ksp[Mg(OH)2]
A.A B.B C.C D.D
5.由下列实验操作和现象能得出相应结论的是
操作 现象 结论
A 向醋酸溶液中滴加Na2CO3溶液 有气泡产生 醋酸是弱酸
B 充满NO2的密闭玻璃球浸泡在热水中 玻璃球中红棕色加深的 的△H<0
C FeCl3溶液加入到浑浊的天然淡水中 静置后水变澄清 Fe3+具有吸附性
D 取1 mL0.1 mol/LMgCl2溶液,向其中滴加1滴2 mol/LNaOH溶液,再滴加2滴0.1 mol/LFeCl3溶液 先出现白色沉淀,后部分转变成红褐色 溶解度:Fe(OH)3>Mg(OH)2
A.A B.B C.C D.D
6.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 实验 现象 结论
A 在少量浓硝酸中加入大量铁屑,充分反应后滴加 KSCN 溶液 后来溶液无血红色 Fe 被氧化为 Fe2+
B 少量 Zn 粉加到 1.0mol·L-1Fe2(SO4)3 溶液中 溶液颜色变浅 金属 Zn 比 Fe 活泼
C 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 无液态铝滴落下来 金属铝的熔点较高
D 向浓度均为 0.1mol·L-1 的 CuSO4 和 MgSO4 混合溶液中滴加少量NaOH 溶液 只出现浅蓝色沉淀 Cu(OH)2 的溶度积比Mg(OH)2 的小
A.A B.B C.C D.D
7.下列实验对应的离子方程式正确的是
A.向饱和食盐水中加浓盐酸析出固体:Na++Cl NaCl↓
B.在铜片表面滴几滴稀硝酸产生无色气体:Cu+2H+=Cu2++H2↑
C.向Na2CO3溶液中滴加少量氯水:CO+2Cl2+H2O=CO2↑+2Cl +2HClO
D.向血红色Fe(SCN)3溶液中加入过量铁粉至溶液褪色:2Fe3++Fe=3Fe2+
8.以石灰石矿(主要成分为,含少量等)为原料制备高纯轻质碳酸钙的一种工艺流程如下。
已知:固体B中含有及
下列说法不正确的是
A.过程Ⅱ中,溶液浸出而非是因为
B.过程Ⅲ中,反应的离子方程式为
C.过程Ⅱ和过程Ⅲ的操作均应在较高温度下进行
D.整个流程中,“变废为宝、循环利用”的物质是
9.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
实验步骤 现象 结论
A 2mL0.1mol·L-1MgCl2溶液中滴加2滴1mol·L-1NaOH溶液,再滴加2滴0.1mol·L-1FeCl3溶液 先生成白色沉淀,后生成红褐色沉淀 Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
B 用pH试纸测定饱和碳酸钠溶液和饱和碳酸氢钠溶液的pH值 碳酸钠溶液的pH大于碳酸氢钠溶液的pH, 碳酸钠水解能力大于碳酸氢钠
C 溴乙烷中加入氢氧化钠的醇溶液,加热,产生的气体通入酸性高锰酸钾溶液中 紫色褪去 反应一定产生了乙烯气体
D 向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物X溶液,加热 未出现砖红色沉淀 X不可能是葡萄糖
A.A B.B C.C D.D
10.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 除去Al2O3中的Fe2O3 向固体中先加入过量NaOH溶液,过滤后向滤液中加入过量盐酸
B 验证Cu和浓硫酸反应生成CuSO4 向反应后溶液中加入水,观察到溶液变蓝色
C 证明二氧化硫具有还原性 将二氧化硫通入Ba(NO3)2溶液中,有白色沉淀生成
D 验证:Ksp(AgI)A.A B.B C.C D.D
11.下列实验操作能达到目的的是
选项 操作 目的
A 将混合气体通过饱和溶液后干燥 除去中的少量
B 测定相同浓度的溶液、溶液的pH 比较Cl和N的非金属性强弱
C 向AgCl浊液中滴加几滴溶液 比较AgCl和AgI的大小
D 向淀粉水解液中加入少量银氨溶液,水浴加热 证明淀粉水解液中含有葡萄糖
A.A B.B C.C D.D
12.下列实验装 置正确且能达到实验目的的是
A.用图I装置探究反应物浓度对化学反应速率的影响
B.用图II所示装置探究温度对化学反应速率的影响
C.用图III测定NaOH溶液的浓度,滴定过程中眼睛要注视滴定管
D.用图IV装置比较Mg(OH)2与Fe(OH)3溶解度的相对大小
13.下列说法正确的是
A.向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解,说明部分Na2SO3被氧化
B.向0.1mol·L 1H2O2溶液中滴加0.1mol·L 1KMnO4溶液,溶液褪色,说明H2O2具有氧化性
C.向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成,说明Ksp(AgCl)>Ksp(AgI)
D.向某溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色,说明该溶液中含有Fe2+
14.为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是( )
A.NaOH B.Mg(OH)2 C.氨水 D.铁粉
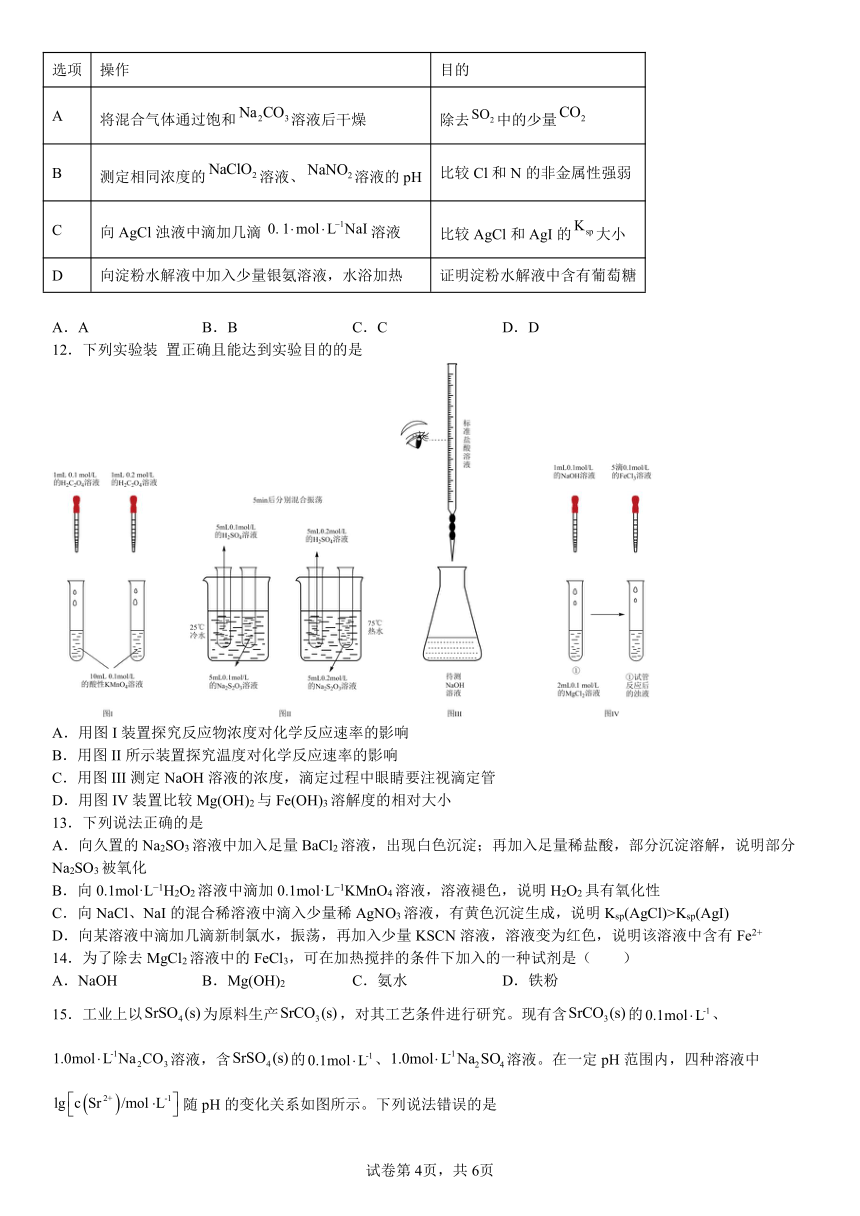
15.工业上以为原料生产,对其工艺条件进行研究。现有含的、溶液,含的、溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是
A.反应的平衡常数
B.
C.曲线④代表含的溶液的变化曲线
D.对含且和初始浓度均为的混合溶液,时才发生沉淀转化
二、填空题
16.常温下,如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-(配离子)物质的量浓度的对数。
回答下列问题:
(1)向ZnCl2溶液中逐滴加入足量的氢氧化钠溶液,反应过程中的离子方程式可表示为___、___。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=___。
(3)某废液中含Zn2+,为提取Zn2+,可以控制溶液中pH的范围是___。
(4)向100mL 1.00mol·L-1ZnCl2溶液中加入NaOH固体至pH=6.0,需NaOH___g。
17.根据要求回答下面问题。
(1)一定温度下,向溶液中加入固体,则醋酸的电离平衡向______(填“正”或“逆”)反应方向移动;溶液中的值_______(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是。已知:
a.常温下,醋酸和的电离平衡常数均为;
b.。
则溶液呈_______性(填“酸”、“碱”或“中”,下同),溶液呈_______性,溶液中物质的量浓度最大的离子是________(填化学式)。
(3)某浓缩液中主要含有、等离子,取一定量的浓缩液,向其中滴加溶液,当开始沉淀时,溶液中为____。(已知,。)
三、实验题
18.碱式氯化铜 [Cum(OH)xCly]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持置已省略)。
(1)实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是_______(填名称);仪器b的作用是_______。
(2)反应过程中,在装置A中除观察到溶液蓝绿色褪去外,还可能观察到的现象是_______。
(3)若滴入稀盐酸过量会导致碱式氯化铜的产量_______(填“偏高”、“偏低”或“无影响”)。
(4)反应结束后,将装置A 中反应容器内的混合物过滤,滤渣经提纯得产品无水碱式氯化铜;从滤液中还可以获得的一种副产品,该副产品的用途是_______(写出一种即可)。
Ⅱ.无水碱式氯化铜组成的测定。称取产品12.87 g,加稀硝酸溶解,并加水定容至500 mL,得到待测液。
(5)铜的测定:取50mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为1.176g。则称取的样品中n(Cu2+)为_______mol。
(6)采用沉淀滴定法测定氯,步骤如下:
a.准确量取25.00mL待测液于锥形瓶中,加入20ml 0.2 mol/L AgNO3溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂NH4Fe(SO4)2,用NH4SCN标准溶液滴定过量的AgNO3溶液;
d.重复实验操作三次,消耗0.1 mol/L NH4SCN溶液的体积平均为10.00 mL。
已知Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12
其中加入硝基苯的作用是_______。
(7)根据上述实验结果可推知该碱式氯化铜的化学式为_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.Ksp(AgCl)= c(Ag+ )·c(Cl-),b点后c(Cl―)降低,则可知c(Ag+)升高,故b点滴加的可能是AgNO3溶液,而不可能是KCl溶液,故A错误;
B.c点滴加KI溶液后,Cl―浓度升高然后达到一个比起始时略高的值,则说明此时溶液中Ag+浓度减小,而部分Ag+转化为AgI沉淀,因此c点后有黄色沉淀生成,故B错误;
C.d点时Cl―浓度大于起始时的Cl―浓度,而起始时有a点表示的AgCl溶于KNO3溶液形成的悬浊液中存在沉淀溶解平衡Ksp(AgCl)= c(Ag+ )·c(Cl-),此时应有c(Ag+ ) = c(Cl-),故d点c(Ag+ )D.由B选项的分析可知,c点后产生了AgI,故应有Ksp(AgI)故选:C。
2.C
【分析】AgCN与AgCl的类型相同,Ksp(AgCN)=2×10-16 Ksp(AgC1)=2×10-10,故向含KC1和KCN的溶液滴加AgNO3标准溶液,先生成AgCN沉淀,后生成AgCl沉淀;曲线上的转折点即为化学计量点,结合已知I,0~2.50mL发生的反应为Ag++2CN-=[Ag(CN)2]-、AB段发生的反应为[Ag(CN)2]-+Ag+=2AgCN↓,BC段发生的反应为Ag++Cl-=AgCl↓;据此分析,结合反应的方程式和AgCN、AgCl的Ksp解答。
【详解】A.A点加入2.50mLAgNO3标准溶液,根据反应Ag++2CN-=[Ag(CN)2]-,原溶液中n(CN-)=2×0.1000mol·L-1×2.50×10-3L=5×10-4mol,生成的[Ag(CN)2]-物质的量为2.5×10-4mol,AB段发生的反应为[Ag(CN)2]-+Ag+=2AgCN↓,2.5×10-4mol[Ag(CN)2]-消耗2.5×10-4molAg+转化成AgCN沉淀,所耗标准AgNO3溶液的体积为2.5×10-4mol÷0.1000mol·L-1=2.5×10-3L=2.50mL,则B点的V1=2.50+2.50=5.00,A正确;
B.根据A项计算,原溶液中n(CN-)=2×0.1000mol·L-1×2.50×10-3L=5×10-4mol,c(KCN)= 5×10-4mol ÷0.025L=0.02000mol·L-1,BC段发生的反应为Ag++Cl-=AgCl↓,BC段消耗的标准AgNO3溶液的体积为12.50mL-5.00mL=7.50mL,则原溶液中n(Cl-)=0.1000mol·L-1×7.50×10-3L=7.5×10-4mol,c(KC1)= 7.5×10-4mol÷0.025L=0.03000mol·L-1,B正确;
C.①Ag++2CN-=[Ag(CN)2]-的平衡常数为K1=,②[Ag(CN)2]-+Ag+=2AgCN↓的平衡常数为K2=,Ksp(AgCN)=c(Ag+)·c(CN-),则K1×K2=,C错误;
D.C点,溶液中====106,D正确;
答案选C。
3.A
【详解】A.纯碱为Na2CO3,水溶液中存在CO+H2OHCO+OH-,溶液显碱性,升高温度,促进水解,碱性增强,去污能力提高,该原理为温度对盐类水解的影响,与溶解平衡无关,故A符合题意;
B.BaSO4为难溶物,不溶于盐酸,BaCl2与Na2SO4反应生成BaSO4沉淀,符合沉淀溶解平衡的应用,故B不符合题意;
C.CaCO3悬浊液中存在CaCO3(s)Ca2+(aq)+CO(aq),空气中CO2、H2O与CO反应CO2+H2O+CO=HCO,c(CO)不断减小,溶液中c(CO)与c(Ca2+)积小于碳酸钙的溶度积,导致平衡向溶解方向进行,故C不符合题意;
D.存在Ca5(PO4)3OH(s)+F-(aq)Ca5(PO4)3F(s)+OH-(aq),使用含氟牙膏,促进平衡向正反应方向进行,生成氟磷灰石,氟磷灰石的溶解度比羟基磷灰石的小,而且更能抵抗酸的侵蚀,符合沉淀溶解平衡应用,故D不符合题意;
答案为A。
4.A
【详解】
A.过氧化钠可氧化亚铁离子,且与水反应生成氧气,由现象可知溶液中可能含Fe2+,不一定含有Fe3+,故A正确;
B.常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/LNa2CO3溶液的pH,可以证明酸性:HA>HCO,但不能证明HA和H2CO3的酸性强弱,故B错误;
C.将铝与氧化铁发生铝热反应后的熔融物在稀盐酸中充分溶解,再滴加几滴KSCN溶液,溶液未变红,因存在:Fe+2Fe3+=3Fe2+,所以只能说明与稀盐酸反应后的溶液中不存在Fe3+,故C错误;
D.KOH过量,氯化铝生成偏铝酸钾,无沉淀生成,氯化镁生成氢氧化镁沉淀,不能比较Ksp大小,故D错误;
答案选A。
5.B
【详解】A.向醋酸溶液中滴加Na2CO3溶液,有气泡产生,说明醋酸与碳酸钠发生反应产生了CO2气体,证明醋酸的酸性比碳酸强,但不能证明醋酸是强酸还是弱酸,A错误;
B.充满NO2的密闭玻璃球浸泡在热水中,玻璃球中红棕色加深,说明升高温度后c(NO2)增大,则生成NO2的反应为吸热反应,从而证明玻璃球中存在化学平衡:△H<0,B正确;
C.FeCl3溶液加入到浑浊的天然淡水中,静置后水变澄清,是由于FeCl3是强酸弱碱盐,在溶液中Fe3+水解产生的Fe(OH)3表面积大,吸引力强,具有净水作用,而不能说Fe3+具有吸附性,C错误;
D.取1 mL0.1 mol/L MgCl2溶液,向其中滴加1滴2 mol/L NaOH溶液,MgCl2溶液过量,NaOH不足量为完全反应,反应出现白色沉淀。后向其中再滴加2滴0.1 mol/LFeCl3溶液,看到有部分白色沉淀转变成红褐色,说明Mg(OH)2尽管难溶,也有一定的溶解度,在水中存在沉淀溶解平衡,溶解电离产生的OH-与加入的Fe3+形成Fe(OH)3红褐色沉淀,从而证明Fe(OH)3更难溶,因此说明物质的溶解度:Fe(OH)3<Mg(OH)2,D错误;
故合理选项是B。
6.D
【详解】A.常温下,铁在浓硝酸中钝化,生成致密的氧化膜阻止反应的进一步发生,无 Fe3+生成,结论不合理,故A错误;
B.锌粉加1.0 mol L-1 Fe2(SO4)3溶液中,生成硫酸锌、硫酸亚铁,Zn(少量)+2Fe3+ = 2Fe2++Zn2+,无法证明 Zn 与 Fe 的活泼性,故B错误;
C.铝箔受热表面生成熔点较高的氧化铝,包裹在Al的外面,则熔化后的液态铝不会滴落,结论不合理,故C错误;
D.相同浓度的 Cu2+和 Mg2+中加入 OH-,只出现浅蓝色沉淀,是因为先析出物质的溶解度小,因此Cu(OH)2的溶度积比Mg(OH)2的小,故D正确;
故选D。
7.A
【详解】A.向饱和食盐水中加浓盐酸,由于同离子效应,析出NaCl固体,离子方程式应为Na++Cl NaCl↓,A正确;
B.该气体应为NO,离子方程式为3Cu+8H++2NO=3Cu2++2NO↑+4H2O,B错误;
C.氯水少量,不会产生CO2,离子方程式为CO+Cl2+H2O=HCO+Cl +HClO,C错误;
D.Fe(SCN)3为络合物,不能拆成离子,正确离子方程式为2Fe(SCN)3+Fe=3Fe2++6SCN-,D错误;
综上所述答案为A。
8.C
【分析】煅烧石灰石矿(主要成分为,含少量等),、分解分别生成CaO和MgO ,并放出CO2,煅烧后固体 CaO、MgO,加氯化铵浸取,溶解CaO,得到含氯化钙和 的滤液A,过滤,固体B中含有及,滤液A中通CO2,,生成沉淀CaCO3。
【详解】A.过程Ⅱ中,溶液浸出而非,因为,A正确;
B.过程Ⅲ中,CO2和氯化钙和反应生成CaCO3,的离子方程式为,B正确;
C.过程Ⅱ的反应物氯化铵受热易分解,过程Ⅲ中受热易分解、易挥发,不能在较高温度下进行,C错误;
D.过程Ⅰ产生的是过程Ⅲ的反应物,过程Ⅲ中的生成物是过程Ⅱ的反应物,所以可循环利用,D正确;
故答案选C。
9.A
【详解】A.2mL0.1mol·L-1MgCl2溶液中滴加2滴1mol·L-1NaOH溶液,再滴加2滴0.1mol·L-1FeCl3溶液,生成红褐色沉淀Fe(OH)3,说明氢氧化镁转化为更难溶的氢氧化铁沉淀,说明Ksp[Mg(OH)2]>Ksp[Fe(OH)3],故 A正确;
B.两种饱和溶液的浓度不同,不能据此判断水解强弱,故B错误;
C.乙醇也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以乙醇干扰乙烯的检验,在将生成的气体通入酸性高锰酸钾溶液之前应该先除去乙醇,故C错误;
D.加入的NaOH不足,不能与葡萄糖反应生成砖红色沉淀,故D错误;
故选A。
10.C
【详解】A. 除去Al2O3中的Fe2O3,向固体中先加入过量NaOH溶液,过滤后向滤液中通入足量二氧化碳,过滤,灼烧,故A错误;
B. 验证Cu和浓硫酸反应生成CuSO4,将反应后的溶液加入到水中,观察到溶液变蓝色,故B错误;
C.将二氧化硫通入Ba(NO3)2溶液中,有白色沉淀生成,白色沉淀为硫酸钡,发生氧化还原反应,证明二氧化硫具有还原性,故C正确;
D. 向盛有1mL 0.1mol·L-1AgNO3溶液的试管中滴加10滴0.1mol·L-1NaCl溶液,有白色沉淀生成,向其中继续滴加0.1mol·L-1KI溶液,由于有过量AgNO3,因此会有黄色沉淀产生,因此不能验证:Ksp(AgI)综上所述,答案为C。
【点睛】浓硫酸与铜反应后,溶液中还含有浓硫酸,稀释时要遵循浓硫酸稀释原则。
11.C
【详解】A.二氧化碳和碳酸钠反应生成碳酸氢钠,所以不能用其除去二氧化碳中的二氧化硫,A错误;
B.应比较非金属最高价氧化物对应水化物的酸性或其强碱的盐的碱性,中氯不是最高价,不能比较 ,B错误;
C.氯化银浊液中加入碘化钠生成碘化银沉淀,说明氯化银的溶度积大于碘化银,C正确;
D.淀粉在硫酸条件下水解,水解后溶液中应加入氢氧化钠中和酸,再加入银氨溶液,水浴加热,看是否用银镜证明水解产物有葡萄糖,D错误;
故选C。
12.D
【详解】A.酸性高锰酸钾溶液过量,应控制酸性高锰酸钾溶液不足,且草酸浓度不同来探究浓度对化学反应速率的影响,故A错误;
B.温度、浓度均不同,两个变量,不能探究温度对反应速率的影响,故B错误;
C.眼睛要观察锥形瓶中颜色的变化,达到滴定终点后,再读数,故C错误; .
D.氢氧化镁白色沉淀转化为更难溶的氢氧化铁红褐色沉淀,则可比较Mg(OH)2与Fe(OH)3溶解度的相对大小,故D正确;
故选D。
13.A
【详解】A.加入足量稀盐酸,部分沉淀溶解,沉淀含硫酸钡、亚硫酸钡,则说明部分Na2SO3被氧化,故A正确;
B.过氧化氢被高锰酸钾氧化,高锰酸钾表现氧化性,过氧化氢表现还原性,故B错误;
C.沉淀析出与溶液中离子浓度、溶度积有关,NaCl、NaI的混合液的浓度未知,不能比较Ksp大小,故C错误;
D.只能说明加入氯水后溶液中含有Fe3+,氯水可以氧化亚铁离子,原溶液可能含有Fe2+,也可能含有Fe3+,或是二者都含有,检验Fe2+离子时先加KSCN无现象,后加氯水,溶液变血红色,可以确定Fe2+离子的存在,故D错误;
故选:A。
14.B
【详解】FeCl3易水解生成氢氧化铁,而氢氧化铁溶解度小于氢氧化镁的溶解度,加入Mg(OH)2消耗FeCl3水解生成的HCl,促进FeCl3的水解,同时Mg(OH)2转化为MgCl2,不引入新的杂质,若加入NaOH、氨水,则镁离子也会生成Mg(OH)2沉淀,若加入铁粉,Fe与FeCl3反应生成FeCl2,不能除杂,故B选项符合题意。
答案选B。
【点睛】本题除杂试剂还可以是MgO或MgCO3,同样都转化为MgCl2,不引入新的杂质,能达到除杂目的。
15.D
【分析】溶液pH变化,含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,pH相同时,溶液中硫酸根离子越大,锶离子浓度越小,所以曲线①代表含硫酸锶固体的0.1mol/L硫酸钠溶液的变化曲线,曲线②代表含硫酸锶固体的1mol/L硫酸钠溶液的变化曲线;碳酸是弱酸,溶液pH减小,溶液中碳酸根离子离子浓度越小,锶离子浓度越大,pH相同时,1mol/L碳酸钠溶液中碳酸根离子浓度大于0.1mol/L碳酸钠溶液,则曲线③表示含碳酸锶固体的0.1mol/L碳酸钠溶液的变化曲线,曲线④表示含碳酸锶固体的1mol/L碳酸钠溶液的变化曲线。
【详解】A.反应SrSO4(s)+COSrCO3(s)+SO的平衡常数K===,A正确;
B.由分析可知,曲线①代表含硫酸锶固体的0.1mol/L硫酸钠溶液的变化曲线,则硫酸锶的溶度积Ksp(SrSO4)=10—5.5×0.1=10—6.5,温度不变,溶度积不变,则溶液pH为7.7时,锶离子的浓度为=10—6.5,则a为-6.5,B正确;
C.由分析可知,曲线④表示含碳酸锶固体的1mol/L碳酸钠溶液的变化曲线,C正确;
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0mol·L-1的混合溶液中锶离子的浓度为10-6, 5,根据图示,锶离子的降低,所以发生沉淀转化,D错误;
故选D。
16. Zn2++2OH-=Zn(OH)2↓ Zn(OH)2+2OH-=[Zn(OH)4]2- 1×10-17 8.0~12.0 7.2
【详解】(1)向ZnCl2溶液中逐滴加入足量的氢氧化钠溶液,反应先产生Zn(OH)2沉淀,沉淀再生成配离子而溶解,则反应过程的离子方程式可表示为:Zn2++2OH-=Zn(OH)2↓,Zn(OH)2+2OH-=[Zn(OH)4]2-;
(2)根据图中数据,当pH为7.0时,lgc(Zn2+)=-3.0,则溶液中c(Zn2+)= 10-3mol/L,c(OH-)= 10-7 mol/L,所以Zn( OH)2的溶度积Ksp=c(Zn2+)c2(OH-)= 1×10-17;
(3)某废液中含Zn2+,为提取Zn2+,可形成沉淀过滤处理,先是开始沉淀,再是达到饱和溶液,但不能形成配离子再次溶解在溶液中,根据图象,则可以控制 pH的范围在8.0~ 12.0的范围内,可以达到目的;
(4)向100mL 1.00mol·L-1ZnCl2溶液中加入NaOH固体至pH=6.0,则溶液中,已知Zn(OH)2的溶度积Ksp = 1×10-17,则达到平衡时,溶液中,根据反应关系n(OH-)=2×(1-0.1)mol/L×0.1L=0.18mol,则需NaOH质量为0.18mol×40g/mol=7.2g。
17.(1) 逆 不变
(2) 中 碱
(3)
【解析】(1)
一定温度下,向溶液中加入固体,醋酸根浓度增大,则醋酸的电离平衡向逆反应方向移动;电离平衡常数只与温度有关,与浓度无关,因此溶液中的值不变;故答案为:逆;不变。
(2)
醋酸和一水合氨的电离程度相同,则铵根离子和醋酸根水解程度相同,因此溶液呈中性,根据得到酸强弱顺序是:醋酸大于碳酸,则碳酸氢根的水解程度大于铵根水解程度,铵根离子浓度大于碳酸氢根离子浓度,因此溶液呈碱性,溶液中物质的量浓度最大的离子是;故答案为:中;碱;。
(3)
根据题意,当开始沉淀时,溶液中;故答案为:。
18.(1) 碱石来或固体氢氧化钠 导气,并且防止倒吸
(2)有绿色或墨绿色的固体产生,b中液面先上升后下降
(3)偏低
(4)作氮肥
(5)0.12
(6)沉淀表面被有机物覆盖,防止滴加NH4SCN溶液时将AgCl转化为AgSCN
(7)Cu2(OH)3Cl
【分析】用浓氨水和氧化钙反应制备氨气,向CuCl2溶液中通入NH3,同时滴加稀盐酸,氯化铜、氨气、盐酸反应生成墨绿色碱式氯化铜沉淀,反应结束后,将三颈烧瓶中的混合物过滤,洗涤、干燥得无水碱式氯化铜,以此来解析;
【详解】(1)将浓氨水逐滴滴加到碱石灰或者生石灰中即可制得氨气,因此利用装置B制取氨气时,圆底烧瓶中盛放的固体药品可能是碱石灰或生石灰;仪器b为球形干燥管,在实验中起到导气,防倒吸的作用;
(2)装置B中将浓氨水滴加到碱石灰或生石灰中制得氨气,向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,制得碱式氯化铜晶体,根据题中信息可知,碱式氯化铜为绿色或墨绿色的结晶性粉末,难溶于水,因此装置A中观察到溶液蓝绿色褪去,产生大量绿色或墨绿色沉淀,由于氨气极易溶于水,会引起倒吸现象,仪器b中液体先上升后下降;
(3)由于碱式氯化铜溶于稀酸和氨水,若滴入稀盐酸过量,会导致碱式氯化铜的产量偏低;
(4)通入的氨气和盐酸反应产生氯化铵,所以反应结束后,将三颈烧瓶中的混合物过滤,滤液中还可以获得的副产品是NH4Cl,NH4Cl可以用作农作物肥料;
(5)取50mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为1.176g,得到的蓝色固体为氢氧化铜,= =0.012mol,,则称取的样品中 n(Cu2+)=0.012mol×=0.12mol;
(6)防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀,滴NH4SCN溶液前可加入硝基苯使沉淀表面被有机物覆盖,如果不进行此操作,则会有AgCl部分电离,消耗的NH4SCN溶液偏多,导致样品中氯元素的含量偏小;
(7)测定无水碱式氯化铜组成时,称取产品12.87g,已知铜离子的物质的量为0.12mol,10.00mL 0.1mol/L的NH4SCN的物质的量为0.1mol/L×0.01L=0.001mol,共加入20mL 0.2mol/L的硝酸银,由NH4SCN~AgNO3可知,与氯离子反应的硝酸银的物质的量为0.02L×0.2mol/L-0.001mol=0.003mol,由Cl-~Ag+可知,n(Cl-)=0.003mol,样品配成的是500mL溶液,滴定时只取了25mL,则样品中的氯离子的物质的量0.003mol×20=0.06mol; 无水碱式氯化铜中根据电荷守恒有2n(Cu2+)=n(Cl-)+n(OH-),则2×0.12mol=0.06mol+n(OH-),解得n(OH-)=0.18mol,则无水碱式氯化铜中n(Cu2+):n(OH-):n(Cl-)=0.12:0.18:0.06=2:3:1,其化学式为Cu2(OH)3Cl;
答案第1页,共2页
答案第1页,共2页
一、单选题
1.常温下,某研究小组用数字传感器探究的沉淀溶解平衡。实验测得悬浊液中氯离子浓度变化如图所示,其中a点表示溶于溶液形成的悬浊液。下列说法正确的是
A.图中b点可能是滴加溶液 B.图中c点后无黄色沉淀生成
C.图中d点 D.由图可知:
2.T K时,现有25mL含KC1和KCN的溶液,用0.1000mol·L-1的硝酸银标准溶液对该混合液进行电位滴定(CN-与H+的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V)的电位滴定曲线如图所示,曲线上的转折点即为化学计量点。已知:
Ⅰ、Ag+与CN-反应过程为:①Ag++2CN-=[Ag(CN)2]- ②[Ag(CN)2]-+Ag+=2AgCN↓。
Ⅱ、TK时,Ksp(AgCN)=2×10-16,Ksp(AgC1)=2×10-10。
下列说法不正确的是
A.V1=5.00,B点时生成AgCN
B.c(KCN)=0.02000mol·L-1,c(KC1)=0.03000mol·L-1
C.反应①的平衡常数为K1,反应②的平衡常数为K2,则K1+K2=2Ksp(AgCN)
D.C点时,溶液中
3.下列化学原理的应用,不能用沉淀溶解平衡原理来解释的是
A.热纯碱溶液的洗涤油污能力强
B.误将当作食盐食用时,常用0.5%的溶液解毒
C.溶洞、珊瑚的形成
D.牙膏中添加氟化物能起到预防龋齿的作用
4.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 结论
A 向溶液X中加入Na2O2粉末,出现红褐色沉淀和无色气体 X中不一定含有Fe3+
B 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/LNa2CO3溶液的pH 酸性:HA>H2CO3
C 将铝与氧化铁发生铝热反应后的熔融物在稀盐酸中充分溶解,再滴加几滴KSCN溶液,溶液未变红 熔融物中不含有+3价铁
D 向2支均盛有2mL1.0mol·L-1KOH溶液的试管中分别加入2滴浓度均为0.1mol·L-1的AlCl3和MgCl2溶液,一支试管出现白色沉淀,另一支无明显现象 Ksp[Al(OH)3]>Ksp[Mg(OH)2]
A.A B.B C.C D.D
5.由下列实验操作和现象能得出相应结论的是
操作 现象 结论
A 向醋酸溶液中滴加Na2CO3溶液 有气泡产生 醋酸是弱酸
B 充满NO2的密闭玻璃球浸泡在热水中 玻璃球中红棕色加深的 的△H<0
C FeCl3溶液加入到浑浊的天然淡水中 静置后水变澄清 Fe3+具有吸附性
D 取1 mL0.1 mol/LMgCl2溶液,向其中滴加1滴2 mol/LNaOH溶液,再滴加2滴0.1 mol/LFeCl3溶液 先出现白色沉淀,后部分转变成红褐色 溶解度:Fe(OH)3>Mg(OH)2
A.A B.B C.C D.D
6.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 实验 现象 结论
A 在少量浓硝酸中加入大量铁屑,充分反应后滴加 KSCN 溶液 后来溶液无血红色 Fe 被氧化为 Fe2+
B 少量 Zn 粉加到 1.0mol·L-1Fe2(SO4)3 溶液中 溶液颜色变浅 金属 Zn 比 Fe 活泼
C 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 无液态铝滴落下来 金属铝的熔点较高
D 向浓度均为 0.1mol·L-1 的 CuSO4 和 MgSO4 混合溶液中滴加少量NaOH 溶液 只出现浅蓝色沉淀 Cu(OH)2 的溶度积比Mg(OH)2 的小
A.A B.B C.C D.D
7.下列实验对应的离子方程式正确的是
A.向饱和食盐水中加浓盐酸析出固体:Na++Cl NaCl↓
B.在铜片表面滴几滴稀硝酸产生无色气体:Cu+2H+=Cu2++H2↑
C.向Na2CO3溶液中滴加少量氯水:CO+2Cl2+H2O=CO2↑+2Cl +2HClO
D.向血红色Fe(SCN)3溶液中加入过量铁粉至溶液褪色:2Fe3++Fe=3Fe2+
8.以石灰石矿(主要成分为,含少量等)为原料制备高纯轻质碳酸钙的一种工艺流程如下。
已知:固体B中含有及
下列说法不正确的是
A.过程Ⅱ中,溶液浸出而非是因为
B.过程Ⅲ中,反应的离子方程式为
C.过程Ⅱ和过程Ⅲ的操作均应在较高温度下进行
D.整个流程中,“变废为宝、循环利用”的物质是
9.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
实验步骤 现象 结论
A 2mL0.1mol·L-1MgCl2溶液中滴加2滴1mol·L-1NaOH溶液,再滴加2滴0.1mol·L-1FeCl3溶液 先生成白色沉淀,后生成红褐色沉淀 Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
B 用pH试纸测定饱和碳酸钠溶液和饱和碳酸氢钠溶液的pH值 碳酸钠溶液的pH大于碳酸氢钠溶液的pH, 碳酸钠水解能力大于碳酸氢钠
C 溴乙烷中加入氢氧化钠的醇溶液,加热,产生的气体通入酸性高锰酸钾溶液中 紫色褪去 反应一定产生了乙烯气体
D 向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物X溶液,加热 未出现砖红色沉淀 X不可能是葡萄糖
A.A B.B C.C D.D
10.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 除去Al2O3中的Fe2O3 向固体中先加入过量NaOH溶液,过滤后向滤液中加入过量盐酸
B 验证Cu和浓硫酸反应生成CuSO4 向反应后溶液中加入水,观察到溶液变蓝色
C 证明二氧化硫具有还原性 将二氧化硫通入Ba(NO3)2溶液中,有白色沉淀生成
D 验证:Ksp(AgI)
11.下列实验操作能达到目的的是
选项 操作 目的
A 将混合气体通过饱和溶液后干燥 除去中的少量
B 测定相同浓度的溶液、溶液的pH 比较Cl和N的非金属性强弱
C 向AgCl浊液中滴加几滴溶液 比较AgCl和AgI的大小
D 向淀粉水解液中加入少量银氨溶液,水浴加热 证明淀粉水解液中含有葡萄糖
A.A B.B C.C D.D
12.下列实验装 置正确且能达到实验目的的是
A.用图I装置探究反应物浓度对化学反应速率的影响
B.用图II所示装置探究温度对化学反应速率的影响
C.用图III测定NaOH溶液的浓度,滴定过程中眼睛要注视滴定管
D.用图IV装置比较Mg(OH)2与Fe(OH)3溶解度的相对大小
13.下列说法正确的是
A.向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解,说明部分Na2SO3被氧化
B.向0.1mol·L 1H2O2溶液中滴加0.1mol·L 1KMnO4溶液,溶液褪色,说明H2O2具有氧化性
C.向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成,说明Ksp(AgCl)>Ksp(AgI)
D.向某溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色,说明该溶液中含有Fe2+
14.为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是( )
A.NaOH B.Mg(OH)2 C.氨水 D.铁粉
15.工业上以为原料生产,对其工艺条件进行研究。现有含的、溶液,含的、溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是
A.反应的平衡常数
B.
C.曲线④代表含的溶液的变化曲线
D.对含且和初始浓度均为的混合溶液,时才发生沉淀转化
二、填空题
16.常温下,如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-(配离子)物质的量浓度的对数。
回答下列问题:
(1)向ZnCl2溶液中逐滴加入足量的氢氧化钠溶液,反应过程中的离子方程式可表示为___、___。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=___。
(3)某废液中含Zn2+,为提取Zn2+,可以控制溶液中pH的范围是___。
(4)向100mL 1.00mol·L-1ZnCl2溶液中加入NaOH固体至pH=6.0,需NaOH___g。
17.根据要求回答下面问题。
(1)一定温度下,向溶液中加入固体,则醋酸的电离平衡向______(填“正”或“逆”)反应方向移动;溶液中的值_______(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是。已知:
a.常温下,醋酸和的电离平衡常数均为;
b.。
则溶液呈_______性(填“酸”、“碱”或“中”,下同),溶液呈_______性,溶液中物质的量浓度最大的离子是________(填化学式)。
(3)某浓缩液中主要含有、等离子,取一定量的浓缩液,向其中滴加溶液,当开始沉淀时,溶液中为____。(已知,。)
三、实验题
18.碱式氯化铜 [Cum(OH)xCly]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持置已省略)。
(1)实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是_______(填名称);仪器b的作用是_______。
(2)反应过程中,在装置A中除观察到溶液蓝绿色褪去外,还可能观察到的现象是_______。
(3)若滴入稀盐酸过量会导致碱式氯化铜的产量_______(填“偏高”、“偏低”或“无影响”)。
(4)反应结束后,将装置A 中反应容器内的混合物过滤,滤渣经提纯得产品无水碱式氯化铜;从滤液中还可以获得的一种副产品,该副产品的用途是_______(写出一种即可)。
Ⅱ.无水碱式氯化铜组成的测定。称取产品12.87 g,加稀硝酸溶解,并加水定容至500 mL,得到待测液。
(5)铜的测定:取50mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为1.176g。则称取的样品中n(Cu2+)为_______mol。
(6)采用沉淀滴定法测定氯,步骤如下:
a.准确量取25.00mL待测液于锥形瓶中,加入20ml 0.2 mol/L AgNO3溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂NH4Fe(SO4)2,用NH4SCN标准溶液滴定过量的AgNO3溶液;
d.重复实验操作三次,消耗0.1 mol/L NH4SCN溶液的体积平均为10.00 mL。
已知Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12
其中加入硝基苯的作用是_______。
(7)根据上述实验结果可推知该碱式氯化铜的化学式为_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.Ksp(AgCl)= c(Ag+ )·c(Cl-),b点后c(Cl―)降低,则可知c(Ag+)升高,故b点滴加的可能是AgNO3溶液,而不可能是KCl溶液,故A错误;
B.c点滴加KI溶液后,Cl―浓度升高然后达到一个比起始时略高的值,则说明此时溶液中Ag+浓度减小,而部分Ag+转化为AgI沉淀,因此c点后有黄色沉淀生成,故B错误;
C.d点时Cl―浓度大于起始时的Cl―浓度,而起始时有a点表示的AgCl溶于KNO3溶液形成的悬浊液中存在沉淀溶解平衡Ksp(AgCl)= c(Ag+ )·c(Cl-),此时应有c(Ag+ ) = c(Cl-),故d点c(Ag+ )
2.C
【分析】AgCN与AgCl的类型相同,Ksp(AgCN)=2×10-16 Ksp(AgC1)=2×10-10,故向含KC1和KCN的溶液滴加AgNO3标准溶液,先生成AgCN沉淀,后生成AgCl沉淀;曲线上的转折点即为化学计量点,结合已知I,0~2.50mL发生的反应为Ag++2CN-=[Ag(CN)2]-、AB段发生的反应为[Ag(CN)2]-+Ag+=2AgCN↓,BC段发生的反应为Ag++Cl-=AgCl↓;据此分析,结合反应的方程式和AgCN、AgCl的Ksp解答。
【详解】A.A点加入2.50mLAgNO3标准溶液,根据反应Ag++2CN-=[Ag(CN)2]-,原溶液中n(CN-)=2×0.1000mol·L-1×2.50×10-3L=5×10-4mol,生成的[Ag(CN)2]-物质的量为2.5×10-4mol,AB段发生的反应为[Ag(CN)2]-+Ag+=2AgCN↓,2.5×10-4mol[Ag(CN)2]-消耗2.5×10-4molAg+转化成AgCN沉淀,所耗标准AgNO3溶液的体积为2.5×10-4mol÷0.1000mol·L-1=2.5×10-3L=2.50mL,则B点的V1=2.50+2.50=5.00,A正确;
B.根据A项计算,原溶液中n(CN-)=2×0.1000mol·L-1×2.50×10-3L=5×10-4mol,c(KCN)= 5×10-4mol ÷0.025L=0.02000mol·L-1,BC段发生的反应为Ag++Cl-=AgCl↓,BC段消耗的标准AgNO3溶液的体积为12.50mL-5.00mL=7.50mL,则原溶液中n(Cl-)=0.1000mol·L-1×7.50×10-3L=7.5×10-4mol,c(KC1)= 7.5×10-4mol÷0.025L=0.03000mol·L-1,B正确;
C.①Ag++2CN-=[Ag(CN)2]-的平衡常数为K1=,②[Ag(CN)2]-+Ag+=2AgCN↓的平衡常数为K2=,Ksp(AgCN)=c(Ag+)·c(CN-),则K1×K2=,C错误;
D.C点,溶液中====106,D正确;
答案选C。
3.A
【详解】A.纯碱为Na2CO3,水溶液中存在CO+H2OHCO+OH-,溶液显碱性,升高温度,促进水解,碱性增强,去污能力提高,该原理为温度对盐类水解的影响,与溶解平衡无关,故A符合题意;
B.BaSO4为难溶物,不溶于盐酸,BaCl2与Na2SO4反应生成BaSO4沉淀,符合沉淀溶解平衡的应用,故B不符合题意;
C.CaCO3悬浊液中存在CaCO3(s)Ca2+(aq)+CO(aq),空气中CO2、H2O与CO反应CO2+H2O+CO=HCO,c(CO)不断减小,溶液中c(CO)与c(Ca2+)积小于碳酸钙的溶度积,导致平衡向溶解方向进行,故C不符合题意;
D.存在Ca5(PO4)3OH(s)+F-(aq)Ca5(PO4)3F(s)+OH-(aq),使用含氟牙膏,促进平衡向正反应方向进行,生成氟磷灰石,氟磷灰石的溶解度比羟基磷灰石的小,而且更能抵抗酸的侵蚀,符合沉淀溶解平衡应用,故D不符合题意;
答案为A。
4.A
【详解】
A.过氧化钠可氧化亚铁离子,且与水反应生成氧气,由现象可知溶液中可能含Fe2+,不一定含有Fe3+,故A正确;
B.常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/LNa2CO3溶液的pH,可以证明酸性:HA>HCO,但不能证明HA和H2CO3的酸性强弱,故B错误;
C.将铝与氧化铁发生铝热反应后的熔融物在稀盐酸中充分溶解,再滴加几滴KSCN溶液,溶液未变红,因存在:Fe+2Fe3+=3Fe2+,所以只能说明与稀盐酸反应后的溶液中不存在Fe3+,故C错误;
D.KOH过量,氯化铝生成偏铝酸钾,无沉淀生成,氯化镁生成氢氧化镁沉淀,不能比较Ksp大小,故D错误;
答案选A。
5.B
【详解】A.向醋酸溶液中滴加Na2CO3溶液,有气泡产生,说明醋酸与碳酸钠发生反应产生了CO2气体,证明醋酸的酸性比碳酸强,但不能证明醋酸是强酸还是弱酸,A错误;
B.充满NO2的密闭玻璃球浸泡在热水中,玻璃球中红棕色加深,说明升高温度后c(NO2)增大,则生成NO2的反应为吸热反应,从而证明玻璃球中存在化学平衡:△H<0,B正确;
C.FeCl3溶液加入到浑浊的天然淡水中,静置后水变澄清,是由于FeCl3是强酸弱碱盐,在溶液中Fe3+水解产生的Fe(OH)3表面积大,吸引力强,具有净水作用,而不能说Fe3+具有吸附性,C错误;
D.取1 mL0.1 mol/L MgCl2溶液,向其中滴加1滴2 mol/L NaOH溶液,MgCl2溶液过量,NaOH不足量为完全反应,反应出现白色沉淀。后向其中再滴加2滴0.1 mol/LFeCl3溶液,看到有部分白色沉淀转变成红褐色,说明Mg(OH)2尽管难溶,也有一定的溶解度,在水中存在沉淀溶解平衡,溶解电离产生的OH-与加入的Fe3+形成Fe(OH)3红褐色沉淀,从而证明Fe(OH)3更难溶,因此说明物质的溶解度:Fe(OH)3<Mg(OH)2,D错误;
故合理选项是B。
6.D
【详解】A.常温下,铁在浓硝酸中钝化,生成致密的氧化膜阻止反应的进一步发生,无 Fe3+生成,结论不合理,故A错误;
B.锌粉加1.0 mol L-1 Fe2(SO4)3溶液中,生成硫酸锌、硫酸亚铁,Zn(少量)+2Fe3+ = 2Fe2++Zn2+,无法证明 Zn 与 Fe 的活泼性,故B错误;
C.铝箔受热表面生成熔点较高的氧化铝,包裹在Al的外面,则熔化后的液态铝不会滴落,结论不合理,故C错误;
D.相同浓度的 Cu2+和 Mg2+中加入 OH-,只出现浅蓝色沉淀,是因为先析出物质的溶解度小,因此Cu(OH)2的溶度积比Mg(OH)2的小,故D正确;
故选D。
7.A
【详解】A.向饱和食盐水中加浓盐酸,由于同离子效应,析出NaCl固体,离子方程式应为Na++Cl NaCl↓,A正确;
B.该气体应为NO,离子方程式为3Cu+8H++2NO=3Cu2++2NO↑+4H2O,B错误;
C.氯水少量,不会产生CO2,离子方程式为CO+Cl2+H2O=HCO+Cl +HClO,C错误;
D.Fe(SCN)3为络合物,不能拆成离子,正确离子方程式为2Fe(SCN)3+Fe=3Fe2++6SCN-,D错误;
综上所述答案为A。
8.C
【分析】煅烧石灰石矿(主要成分为,含少量等),、分解分别生成CaO和MgO ,并放出CO2,煅烧后固体 CaO、MgO,加氯化铵浸取,溶解CaO,得到含氯化钙和 的滤液A,过滤,固体B中含有及,滤液A中通CO2,,生成沉淀CaCO3。
【详解】A.过程Ⅱ中,溶液浸出而非,因为,A正确;
B.过程Ⅲ中,CO2和氯化钙和反应生成CaCO3,的离子方程式为,B正确;
C.过程Ⅱ的反应物氯化铵受热易分解,过程Ⅲ中受热易分解、易挥发,不能在较高温度下进行,C错误;
D.过程Ⅰ产生的是过程Ⅲ的反应物,过程Ⅲ中的生成物是过程Ⅱ的反应物,所以可循环利用,D正确;
故答案选C。
9.A
【详解】A.2mL0.1mol·L-1MgCl2溶液中滴加2滴1mol·L-1NaOH溶液,再滴加2滴0.1mol·L-1FeCl3溶液,生成红褐色沉淀Fe(OH)3,说明氢氧化镁转化为更难溶的氢氧化铁沉淀,说明Ksp[Mg(OH)2]>Ksp[Fe(OH)3],故 A正确;
B.两种饱和溶液的浓度不同,不能据此判断水解强弱,故B错误;
C.乙醇也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以乙醇干扰乙烯的检验,在将生成的气体通入酸性高锰酸钾溶液之前应该先除去乙醇,故C错误;
D.加入的NaOH不足,不能与葡萄糖反应生成砖红色沉淀,故D错误;
故选A。
10.C
【详解】A. 除去Al2O3中的Fe2O3,向固体中先加入过量NaOH溶液,过滤后向滤液中通入足量二氧化碳,过滤,灼烧,故A错误;
B. 验证Cu和浓硫酸反应生成CuSO4,将反应后的溶液加入到水中,观察到溶液变蓝色,故B错误;
C.将二氧化硫通入Ba(NO3)2溶液中,有白色沉淀生成,白色沉淀为硫酸钡,发生氧化还原反应,证明二氧化硫具有还原性,故C正确;
D. 向盛有1mL 0.1mol·L-1AgNO3溶液的试管中滴加10滴0.1mol·L-1NaCl溶液,有白色沉淀生成,向其中继续滴加0.1mol·L-1KI溶液,由于有过量AgNO3,因此会有黄色沉淀产生,因此不能验证:Ksp(AgI)
【点睛】浓硫酸与铜反应后,溶液中还含有浓硫酸,稀释时要遵循浓硫酸稀释原则。
11.C
【详解】A.二氧化碳和碳酸钠反应生成碳酸氢钠,所以不能用其除去二氧化碳中的二氧化硫,A错误;
B.应比较非金属最高价氧化物对应水化物的酸性或其强碱的盐的碱性,中氯不是最高价,不能比较 ,B错误;
C.氯化银浊液中加入碘化钠生成碘化银沉淀,说明氯化银的溶度积大于碘化银,C正确;
D.淀粉在硫酸条件下水解,水解后溶液中应加入氢氧化钠中和酸,再加入银氨溶液,水浴加热,看是否用银镜证明水解产物有葡萄糖,D错误;
故选C。
12.D
【详解】A.酸性高锰酸钾溶液过量,应控制酸性高锰酸钾溶液不足,且草酸浓度不同来探究浓度对化学反应速率的影响,故A错误;
B.温度、浓度均不同,两个变量,不能探究温度对反应速率的影响,故B错误;
C.眼睛要观察锥形瓶中颜色的变化,达到滴定终点后,再读数,故C错误; .
D.氢氧化镁白色沉淀转化为更难溶的氢氧化铁红褐色沉淀,则可比较Mg(OH)2与Fe(OH)3溶解度的相对大小,故D正确;
故选D。
13.A
【详解】A.加入足量稀盐酸,部分沉淀溶解,沉淀含硫酸钡、亚硫酸钡,则说明部分Na2SO3被氧化,故A正确;
B.过氧化氢被高锰酸钾氧化,高锰酸钾表现氧化性,过氧化氢表现还原性,故B错误;
C.沉淀析出与溶液中离子浓度、溶度积有关,NaCl、NaI的混合液的浓度未知,不能比较Ksp大小,故C错误;
D.只能说明加入氯水后溶液中含有Fe3+,氯水可以氧化亚铁离子,原溶液可能含有Fe2+,也可能含有Fe3+,或是二者都含有,检验Fe2+离子时先加KSCN无现象,后加氯水,溶液变血红色,可以确定Fe2+离子的存在,故D错误;
故选:A。
14.B
【详解】FeCl3易水解生成氢氧化铁,而氢氧化铁溶解度小于氢氧化镁的溶解度,加入Mg(OH)2消耗FeCl3水解生成的HCl,促进FeCl3的水解,同时Mg(OH)2转化为MgCl2,不引入新的杂质,若加入NaOH、氨水,则镁离子也会生成Mg(OH)2沉淀,若加入铁粉,Fe与FeCl3反应生成FeCl2,不能除杂,故B选项符合题意。
答案选B。
【点睛】本题除杂试剂还可以是MgO或MgCO3,同样都转化为MgCl2,不引入新的杂质,能达到除杂目的。
15.D
【分析】溶液pH变化,含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,pH相同时,溶液中硫酸根离子越大,锶离子浓度越小,所以曲线①代表含硫酸锶固体的0.1mol/L硫酸钠溶液的变化曲线,曲线②代表含硫酸锶固体的1mol/L硫酸钠溶液的变化曲线;碳酸是弱酸,溶液pH减小,溶液中碳酸根离子离子浓度越小,锶离子浓度越大,pH相同时,1mol/L碳酸钠溶液中碳酸根离子浓度大于0.1mol/L碳酸钠溶液,则曲线③表示含碳酸锶固体的0.1mol/L碳酸钠溶液的变化曲线,曲线④表示含碳酸锶固体的1mol/L碳酸钠溶液的变化曲线。
【详解】A.反应SrSO4(s)+COSrCO3(s)+SO的平衡常数K===,A正确;
B.由分析可知,曲线①代表含硫酸锶固体的0.1mol/L硫酸钠溶液的变化曲线,则硫酸锶的溶度积Ksp(SrSO4)=10—5.5×0.1=10—6.5,温度不变,溶度积不变,则溶液pH为7.7时,锶离子的浓度为=10—6.5,则a为-6.5,B正确;
C.由分析可知,曲线④表示含碳酸锶固体的1mol/L碳酸钠溶液的变化曲线,C正确;
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0mol·L-1的混合溶液中锶离子的浓度为10-6, 5,根据图示,锶离子的降低,所以发生沉淀转化,D错误;
故选D。
16. Zn2++2OH-=Zn(OH)2↓ Zn(OH)2+2OH-=[Zn(OH)4]2- 1×10-17 8.0~12.0 7.2
【详解】(1)向ZnCl2溶液中逐滴加入足量的氢氧化钠溶液,反应先产生Zn(OH)2沉淀,沉淀再生成配离子而溶解,则反应过程的离子方程式可表示为:Zn2++2OH-=Zn(OH)2↓,Zn(OH)2+2OH-=[Zn(OH)4]2-;
(2)根据图中数据,当pH为7.0时,lgc(Zn2+)=-3.0,则溶液中c(Zn2+)= 10-3mol/L,c(OH-)= 10-7 mol/L,所以Zn( OH)2的溶度积Ksp=c(Zn2+)c2(OH-)= 1×10-17;
(3)某废液中含Zn2+,为提取Zn2+,可形成沉淀过滤处理,先是开始沉淀,再是达到饱和溶液,但不能形成配离子再次溶解在溶液中,根据图象,则可以控制 pH的范围在8.0~ 12.0的范围内,可以达到目的;
(4)向100mL 1.00mol·L-1ZnCl2溶液中加入NaOH固体至pH=6.0,则溶液中,已知Zn(OH)2的溶度积Ksp = 1×10-17,则达到平衡时,溶液中,根据反应关系n(OH-)=2×(1-0.1)mol/L×0.1L=0.18mol,则需NaOH质量为0.18mol×40g/mol=7.2g。
17.(1) 逆 不变
(2) 中 碱
(3)
【解析】(1)
一定温度下,向溶液中加入固体,醋酸根浓度增大,则醋酸的电离平衡向逆反应方向移动;电离平衡常数只与温度有关,与浓度无关,因此溶液中的值不变;故答案为:逆;不变。
(2)
醋酸和一水合氨的电离程度相同,则铵根离子和醋酸根水解程度相同,因此溶液呈中性,根据得到酸强弱顺序是:醋酸大于碳酸,则碳酸氢根的水解程度大于铵根水解程度,铵根离子浓度大于碳酸氢根离子浓度,因此溶液呈碱性,溶液中物质的量浓度最大的离子是;故答案为:中;碱;。
(3)
根据题意,当开始沉淀时,溶液中;故答案为:。
18.(1) 碱石来或固体氢氧化钠 导气,并且防止倒吸
(2)有绿色或墨绿色的固体产生,b中液面先上升后下降
(3)偏低
(4)作氮肥
(5)0.12
(6)沉淀表面被有机物覆盖,防止滴加NH4SCN溶液时将AgCl转化为AgSCN
(7)Cu2(OH)3Cl
【分析】用浓氨水和氧化钙反应制备氨气,向CuCl2溶液中通入NH3,同时滴加稀盐酸,氯化铜、氨气、盐酸反应生成墨绿色碱式氯化铜沉淀,反应结束后,将三颈烧瓶中的混合物过滤,洗涤、干燥得无水碱式氯化铜,以此来解析;
【详解】(1)将浓氨水逐滴滴加到碱石灰或者生石灰中即可制得氨气,因此利用装置B制取氨气时,圆底烧瓶中盛放的固体药品可能是碱石灰或生石灰;仪器b为球形干燥管,在实验中起到导气,防倒吸的作用;
(2)装置B中将浓氨水滴加到碱石灰或生石灰中制得氨气,向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,制得碱式氯化铜晶体,根据题中信息可知,碱式氯化铜为绿色或墨绿色的结晶性粉末,难溶于水,因此装置A中观察到溶液蓝绿色褪去,产生大量绿色或墨绿色沉淀,由于氨气极易溶于水,会引起倒吸现象,仪器b中液体先上升后下降;
(3)由于碱式氯化铜溶于稀酸和氨水,若滴入稀盐酸过量,会导致碱式氯化铜的产量偏低;
(4)通入的氨气和盐酸反应产生氯化铵,所以反应结束后,将三颈烧瓶中的混合物过滤,滤液中还可以获得的副产品是NH4Cl,NH4Cl可以用作农作物肥料;
(5)取50mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为1.176g,得到的蓝色固体为氢氧化铜,= =0.012mol,,则称取的样品中 n(Cu2+)=0.012mol×=0.12mol;
(6)防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀,滴NH4SCN溶液前可加入硝基苯使沉淀表面被有机物覆盖,如果不进行此操作,则会有AgCl部分电离,消耗的NH4SCN溶液偏多,导致样品中氯元素的含量偏小;
(7)测定无水碱式氯化铜组成时,称取产品12.87g,已知铜离子的物质的量为0.12mol,10.00mL 0.1mol/L的NH4SCN的物质的量为0.1mol/L×0.01L=0.001mol,共加入20mL 0.2mol/L的硝酸银,由NH4SCN~AgNO3可知,与氯离子反应的硝酸银的物质的量为0.02L×0.2mol/L-0.001mol=0.003mol,由Cl-~Ag+可知,n(Cl-)=0.003mol,样品配成的是500mL溶液,滴定时只取了25mL,则样品中的氯离子的物质的量0.003mol×20=0.06mol; 无水碱式氯化铜中根据电荷守恒有2n(Cu2+)=n(Cl-)+n(OH-),则2×0.12mol=0.06mol+n(OH-),解得n(OH-)=0.18mol,则无水碱式氯化铜中n(Cu2+):n(OH-):n(Cl-)=0.12:0.18:0.06=2:3:1,其化学式为Cu2(OH)3Cl;
答案第1页,共2页
答案第1页,共2页
