实验活动5 制作简单的燃料电池 课时作业(含解析)
文档属性
| 名称 | 实验活动5 制作简单的燃料电池 课时作业(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 674.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-18 11:31:09 | ||
图片预览




文档简介
实验活动5 制作简单的燃料电池 课时作业
一、单选题
1.将两个铂电极放置在KOH溶液中,然后向两极分别通入C3H8与O2,即可产生电流。下列叙述正确的是
①通入C3H8的电极为正极 ②正极的电极反应式为O2+2H2O+4e-=4OH- ③通入C3H8的电极反应式为C3H8+5O2+20e-=3CO2+4H2O ④放电时溶液中的阳离子向正极方向移动 ⑤放电时溶液中的阴离子向正极方向移动
A.①② B.②③ C.②④ D.①⑤
2.工业上冶炼金属铝,经常采用的方法是
A.电解法 B.热分解法 C.热还原法 D.热氧化法
3.如图所示,将铁棒和石墨棒插入1 L 1 mol/L食盐水中。下列说法正确的是( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
4.关于下列各装置图的叙述不正确的是
A.用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B.图②装置的盐桥中KCl的Cl-移向乙烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
5.自热食品无需火电,将水倒在发热包上即可加热食物。发热包的主要成分是:铁粉、铝粉、焦炭粉、活性炭、生石灰、碳酸钠、焙烧硅藻土等,下列说法错误的是
A.生石灰和水反应放出热量
B.发热包用后所得产物的碱性增强
C.发热包用后的产物不环保,冷却后要进行回收处理
D.反应过程中有微小原电池形成,负极反应为:Fe-3e-==Fe3+
6.电池是种以海水为电解质溶液的水激活电池。下列叙述错误的是
A.负极反应式为
B.正极反应式为
C.不能被溶液激活
D.负极会发生副反应:
7.NA是阿伏伽德罗常数的值,下列说法正确的是
A.1L0.1mol/LNa2S溶液中S2-和H2S的数目之和小于0.1NA
B.反应3H2(g)+N2(g)2NH3(g)△H=-92kJ/mol,当放出9.2kJ热量时,转移电子0.3NA
C.电解精炼粗铜,阳极溶解铜6.4g时,阴极得电子数目为0.2NA
D.0.1molFeCl3完全水解形成Fe(OH)3胶体的胶粒数为0.1NA
8.硼酸为一元弱酸,已知与足量溶液反应的离子方程式为可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是
A.当电路中通过电子时,可得到
B.将电源的正、负极反接,工作原理不变
C.阴极室的电极反应式为
D.穿过阴膜进入阴极室,穿过阳膜进入产品室
9.氢氧燃料电池已用于航天飞机,以 30%KOH 溶液为电解质溶液的这种电池其工作原理如图所示。关于该燃料电池的说法正确的是
A.该电池总方程式为2H2 +O2 = 2H2O
B.该电池工作时,热能转化为电能
C.电流从a 电极经外电路流向 b 电极
D.燃料电池的能量转化率可达100%
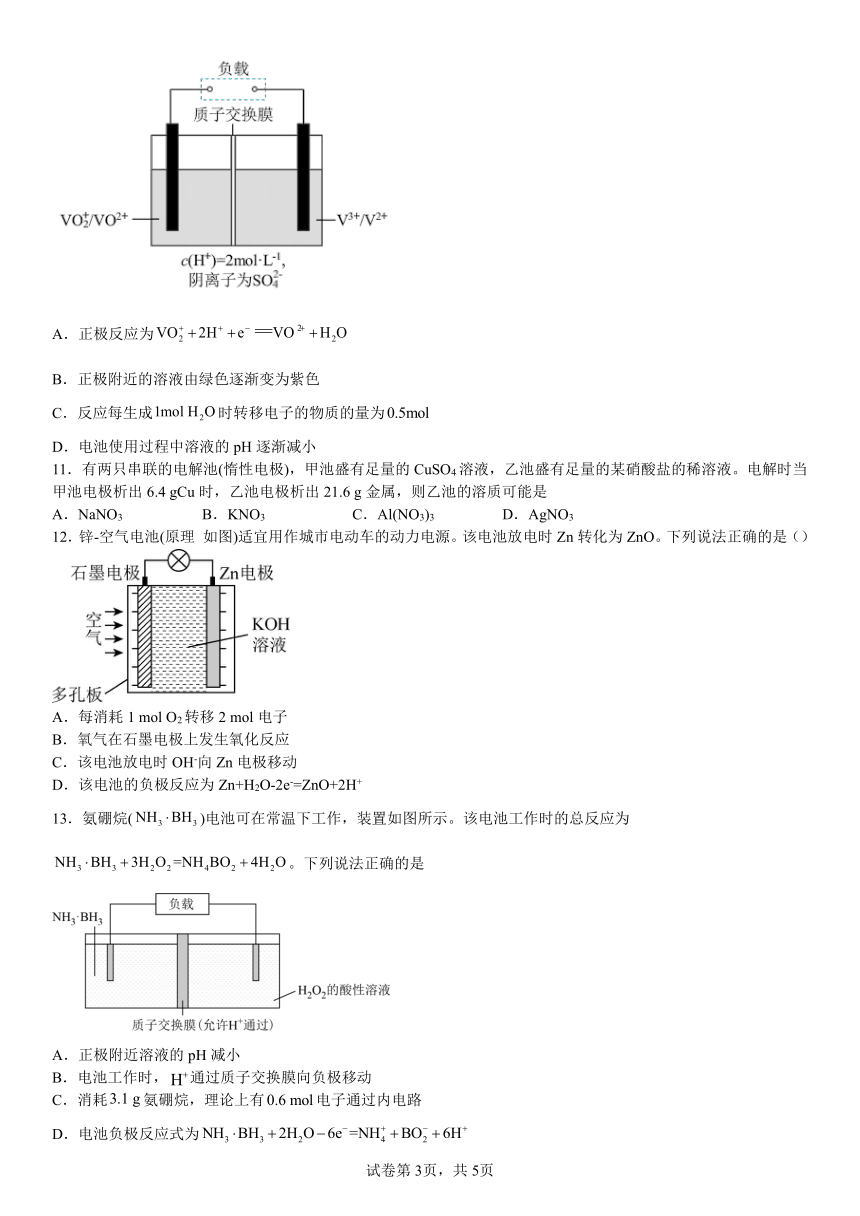
10.全钒电池以惰性材料作电极,在电解质溶液中发生的原电池反应为(黄色)(绿色)(蓝色)(紫色)。下列说法正确的是
A.正极反应为
B.正极附近的溶液由绿色逐渐变为紫色
C.反应每生成时转移电子的物质的量为
D.电池使用过程中溶液的pH逐渐减小
11.有两只串联的电解池(惰性电极),甲池盛有足量的CuSO4溶液,乙池盛有足量的某硝酸盐的稀溶液。电解时当甲池电极析出6.4 gCu时,乙池电极析出21.6 g金属,则乙池的溶质可能是
A.NaNO3 B.KNO3 C.Al(NO3)3 D.AgNO3
12.锌-空气电池(原理 如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。下列说法正确的是()
A.每消耗1 mol O2转移2 mol电子
B.氧气在石墨电极上发生氧化反应
C.该电池放电时OH-向Zn电极移动
D.该电池的负极反应为Zn+H2O-2e-=ZnO+2H+
13.氨硼烷()电池可在常温下工作,装置如图所示。该电池工作时的总反应为。下列说法正确的是
A.正极附近溶液的pH减小
B.电池工作时,通过质子交换膜向负极移动
C.消耗氨硼烷,理论上有电子通过内电路
D.电池负极反应式为
14.有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3—Na2O,O2-可以在其中自由移动。下列有关叙述正确的是( )
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O
D.当固体电解质中有1molO2-通过时,电子转移4mol
15.为探究锌与稀硫酸的反应速率[以v(H2)表示]。向反应混合物中加入某些物质,下列判断正确的是( )
A.加入NH4HSO4固体,v(H2)不变 B.加入少量锌,v(H2)增大
C.加入CH3COONa固体,v(H2)减小 D.滴加少量CuSO4溶液,v(H2)减小
二、填空题
16.电化学自伏打电堆开始,便不断地推进化学学科的发展。伏打电堆示意图如图所示:
(1)将Zn片和Ag片用浸泡有盐溶液的纸片隔开,就可以产生电流,该装置的电流方向是_________(填“Zn→Ag”或“Ag→Zn”)
(2)利用伏打电堆产生的电流,戴维开创了电化学研究,制得并发现系列新元素,请写出电解制Na的化学方程式:______________。
(3)已知铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+ 2H2O,现设计如下图所示装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时,铁电极的质量减少11.2 g。
则A是铅蓄电池的_____(填“正”或“负”)极,写出铅蓄电池放电时的正极反应式:______,如图2表示电解时某个量(纵坐标x)随时间变化的曲线,这个量x最有可能表示的是_____(填序号)。
a.两个U形管中析出的气体体积
b.两个U形管中阳极质量的减少量
c.两个U形管中阴极质量的增加量
17.科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生的化学反应方程式:_________。
(2)此电池的正极发生的电极反应:________,负极发生的电极反应:________。
(3)电解液中H+向___极移动,向外电路释放电子的电极是_____。
(4)使用该燃料电池的另一个好处是________。
三、实验题
18.某研究性学习小组为探究铁与稀盐酸反应,取同质量、体积的铁片、同浓度的盐酸做了下列平行实验:实验①:把纯铁片投入到盛有稀盐酸的试管中,发现放出氢气的速率变化如图所示:
实验②:把铁片投入到含FeCl3的同浓度稀盐酸中,发现放出氢气的量减少。
实验③:在稀盐酸中滴入几滴CuCl2溶液,用铁片做实验,发现生成氢气的速率加快。
试回答下列问题:
(1)分析实验①中t1~t2速率变化的主要原因是______,t2~t3速率变化的主要原因是______。
(2)实验②放出氢气的量减少的原因是______(用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是形成了原电池,你认为是否正确?______(正确填“a”,不正确填“b”)。请回答下列相应的a或b问题。
a.若正确,则写出实验③中原电池的正、负极电极反应式______。b.若不正确,请说明原因。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】
【详解】根据题意,形成了C3H8碱性燃料电池,总反应为:C3H8+5O2+6OH-=3CO32-+7H2O;根据在原电池中正极发生还原反应、负极发生氧化反应规律进行分析,通入C3H8的电极为负极,电极反应式为:C3H8+26OH--20e-=3CO32-+17H2O,故①③错误;通入O2的电极为正极,电极反应式为O2+2H2O+4e-=4OH-,故②正确;放电时溶液(原电池内电路)中的阳离子向正极移动,阴离子向负极移动,故④正确、⑤错误。综上,②④正确;
故选C。
2.A
【详解】铝是活泼的金属,冶炼的方法是电解熔融的氧化铝,答案选A。
【点睛】该题的关键是明确金属冶炼的原理和方法,即金属的冶炼一般是依据金属的活泼性选择相应的方法,常见金属冶炼的方法有:1.热分解法:适用于不活泼的金属,如汞可用氧化汞加热制得;2.热还原法:用还原剂(氢气,焦炭,一氧化碳,活泼金属等)还原;3.电解法:适用于K、Ca、Na、Mg、Al等活泼金属;4.其他方法:如CuSO4+Fe=Cu+FeSO4。
3.D
【详解】A、若电键K与N连接,则形成原电池,铁作负极,铁被腐蚀,故A错误;
B、若电键K与N连接,形成原电池,铁作负极,发生吸氧腐蚀,正极反应式是:O2+2H2O+4e-=4OH-,故B错误;
C、若电键K与M连接,则形成电解池,将石墨棒换成铜棒,若要在铁棒上镀铜,电解质溶液不能用食盐水,而应用硫酸铜溶液,故C错误;
D、若电键K与M连接,则形成电解池,电解食盐水时,根据反应方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑可得,1 mol氯化钠全部被电解时产生1 mol NaOH和标准状况下22.4 LH2、Cl2混合气体,而现在产生的气体为28 L,表明电解完氯化钠后继续电解水,根据钠元素守恒,生成氢氧化钠的物质的量不变,即生成1mol NaOH,故D正确;
答案选D。
4.B
【详解】A.用图①装置精炼铜,粗铜为阳极,纯铜为阴极,粗铜被氧化,粗铜与电源正极相连,纯铜与电源负极相连,故a极为粗铜,b为精铜,故A正确;
B.锌为负极,盐桥中KCl的Cl﹣移向负极,即移向甲烧杯,故B错误;
C.图③装置中钢闸门应与外接电源的负极相连接,为外加电源的阴极保护法,故C正确;
D.图④负极分别为铝、锌,转移相同电量时,消耗的电极质量不同,故D正确;
答案选B。
5.D
【详解】A.CaO与水反应生成Ca(OH)2,是放热反应,A正确,不选;
B.CaO与水反应会生成Ca(OH)2,产物碱性会增强,B正确,不选;
C.发热包使用后,仍会有焦炭,碳酸钠,硅藻土,以及Fe、Al的化合物等,直接遗弃不环保,应回收处理,C正确,不选;
D.加入水后,铁、焦炭、水溶液可以形成微小原电池,负极反应为Fe-2e-=Fe2+,D错误,符合题意;
答案选D。
6.C
【详解】A.电池中镁作负极,电极反应式为, A正确;
B.电池中氯化银作正极,电极反应式为,B正确;
C.由题给信息可知,电池以海水为电解质溶液,海水中盐类的主要成分是氯化钠,则可推知氯化钾溶液也能激活该电池,C错误;
D.镁是活泼金属,会与水发生副反应,D正确;
故选C。
7.A
【详解】A.根据物料守恒,1L0.1mol/LNa2S溶液中S2-、HS-和H2S的数目之和等于0.1NA,所以S2-和H2S的数目之和小于0.1NA,故A正确;
B.根据热化学方程式,当放出92kJ热量时,消耗1mol氮气,转移6mol电子,所以当放出9.2kJ热量时,转移电子为0.6NA,故B错误;
C.电解精炼粗铜时,阳极除了铜失去电子外,比铜活泼的金属杂质也会失去电子,所以当阳极溶解6.4g铜时,转移的电子的物质的量不一定为0.2mol,那么阴极得到的电子的物质的量也不一定为0.2mol,故C错误;
D.Fe(OH)3胶体的胶粒是多个Fe(OH)3分子聚集而成的,所以0.1molFeCl3完全水解形成Fe(OH)3胶体的胶粒数小于0.1NA,故D错误;
故选A。
8.A
【分析】由装置图可知,与电源正极相连的为阳极,与电源负极相连的为阴极,阳极氢氧根失电子发生氧化反应,电极反应式为2H2O-4e-═O2↑+4H+,则氢离子穿过阳膜进入产品H3BO3室;阴极氢离子得电子发生还原反应,电极反应式为4H2O+4e-═2H2↑+4OH-,Na+穿过阳膜进入阴极室,所以阴极室NaOH溶液浓度增大,穿过阴膜进入产品H3BO3室,与氢离子结合生成H3BO3,据此分析解答。
【详解】A.阳极发生失去电子的氧化反应,电极反应式为,电路中通过电子时有生成,硼酸为一元弱酸,生成硼酸需要,所以电路中通过电子时,可得到,故A正确;
B.根据以上分析可知,如果将电源的正、负极反接,工作原理将发生变化,故B错误;
C.电解时阴极发生得电子的还原反应,电极反应式为,故C错误;
D.阳极电极反应式为,阴极电极反应式为,阳极室中的氢离子穿过阳膜进入产品室,原料室中的穿过阴膜进入产品室,发生反应:,原料室中的穿过阳膜进入阴极室,故D错误;
答案选A。
9.A
【分析】碱性氢氧燃料电池中,通入燃料氢气的一极为负极,则a为负极,电极反应为2H2+4OH--4e-=4H2O;通入氧气的一极为正极,则b为正极,电极反应为:O2+2H2O+4e-=4OH-,据此分析解答。
【详解】A.根据分析,负极电极反应为2H2+4OH--4e-=4H2O,正电极反应为:O2+2H2O+4e-=4OH-,正极反应式和负极反应式相加即可得总反应式,则电池的总反应为:2H2+O2=2H2O,故A正确;
B.氢氧燃料电池是原电池装置,原电池装置中是将化学能转化为电能,故B错误;
C.原电池中,电流由正极经外电路流向负极,a为负极,b为正极,则电流从b电极经外电路流向a电极,故C错误;
D.燃料电池是将化学能转变为电能的装置,还会伴有热能等能量的释放,能量转化率不会达到100%,故D错误;
答案选A。
10.A
【分析】由原电池反应(黄色)(绿色)(蓝色)(紫色)可知,所在电极为正极,所在电极为负极,结合原电池相关知识解答。
【详解】A.结合分析可知放电过程中,正极发生还原反应,极反应为,A正确;
B.正极附近的溶液由(黄色)变化为(蓝色),B错误;
C.结合正极反应式可知,每生成1molH2O时转移电子的物质的量为1mol,C错误;
D.由原电池反应可知,电池使用过程中消耗氢离子,溶液的pH增大,D错误。
答案选A。
11.D
【分析】用惰性电极电解不活泼金属盐溶液时阴极有金属析出。
【详解】A.用惰性电极电解NaNO3溶液时,阴极有氢气生成,不可能有金属析出,故A错误;
B.用惰性电极电解KNO3溶液时,阴极有氢气生成,不可能有金属析出,故B错误;
C.用惰性电极电解Al(NO3)3溶液时,阴极有氢气生成,不可能有金属析出,故C错误;
D.用惰性电极电解AgNO3溶液时,阴极有Ag析出,且==0.2mol,即甲、乙两池析出金属时转移电子数目相等,故D正确;
故答案为D。
12.C
【分析】放电时Zn转化为ZnO,锌作负极,负极上电极反应式为:Zn+2OH--2e-═ZnO+H2O,正极上通入空气,其电极反应式为O2+2H2O+4e-=4OH-,再结合离子移动方向分析解答。
【详解】A.O2在正极参与电极反应,电极反应式为O2+4e-+2H2O=4OH-,则每消耗1 mol O2转移4 mol电子,故A错误;
B.氧气在石墨电极上得电子,发生还原反应,故B错误;
C.原电池工作时,溶液中的阴离子向负极移动,即OH-向Zn极移动,故C正确;
D.锌作负极,碱性条件下,负极上电极反应式为:Zn+2OH--2e-═ZnO+H2O,故D错误;
故答案为C。
13.D
【详解】A.根据电池总反应可知,正极上发生还原反应;,正极附近减小,溶液pH增大,A项错误;
B.原电池工作时,阳离子向正极移动,故通过质子交换膜向正极移动,B项错误;
C.转化为,N的化合价不变,B的化合价升高,根据,可知,消耗氨硼烷,反应中转移电子,但电子不通过内电路,C项错误;
D.根据电池总反应,负极上氨硼烷发生氧化反应:,D项正确;
故选D。
14.C
【详解】A.电池外电路中电子由负极流向正极,氧气得电子,b极为正极,电子由电极a流向电极b,选项A错误;
B.电极b氧气得电子,生成O2-,O2-由正极(电极b)流向负极(电极a),选项B错误;
C.甲烷所在电极a为负极,电极反应为CH4+4O2--8e-=CO2+2H2O,选项C正确;
D.1 mol O2得4 mol电子生成2 mol O2-,故当固体电解质中有1 mol O2-通过时,电子转移2 mol,选项D错误。
答案选C。
15.C
【详解】A.加入NH4HSO4固体,NH4HSO4溶解,溶液中氢离子浓度增大,反应速率v(H2)增大,故A错误;
B.锌为固体,固体的浓度为定值,增加固体的化学反应速率不变,则加入少量锌,反应速率v(H2)不变,故B错误;
C.加入CH3COONa固体,醋酸钠与稀硫酸反应生成弱酸醋酸,溶液中氢离子浓度减小,反应速率v(H2)减小,故C正确;
D.滴加少量CuSO4溶液,锌与硫酸铜溶液发生置换反应生成铜,构成锌铜原电池,化学反应速率v(H2)增大,故D错误;
故选C。
16. Ag→Zn 2NaCl(熔融)=2Na+Cl2↑ 负 PbO2+2e-+SO42-+4H+=PbSO4+2H2O b
【详解】(1)Zn片和Ag片浸泡在盐溶液中,Zn比Ag活泼,Zn失电子,作负极,Ag作正极,在原电池中,电流由正极经外电路流向负极,即电流方向Ag→Zn;
(2)通过电解熔融的NaCl制备Na,化学方程式为2NaCl(熔融)2Na+Cl2↑;
(3) 铁电极的质量减少11.2 g,铁作阳极,Ag作阴极,A是负极,B为正极,铅蓄电池中,PbO2得电子,电极方程式PbO2+2e-+SO42-+4H+=PbSO4+2H2O;左边的U形管,阳极Fe-2e-=Fe2+,阴极2H++2e-=H2↑;右边的U形管,阳极Cu-2e-=Cu2+,阴极Cu2++2e-=Cu;
a.右边U形管不析出气体,左边U形管析出气体,所以稀硫酸析出气体体积大于硫酸铜溶液,故错误;
b.当转移相同电子时,溶解金属的物质的量相等,铜的摩尔质量大于铁,所以右边U形管阳极减少的质量大于左边U 形管阳极减小的质量,故正确;
c.当转移相同电子时,析出物质的物质的量相等,但铜的摩尔质量大于氢气,所以左边U形管析出氢气的质量小于右边U形管析出铜的质量,故错误;
答案选b。
17. 2CH3OH+3O2=2CO2+4H2O 3O2+12H++12e-=6H2O 2CH3OH+2H2O-12e-=2CO2+12H+ 正 负极 对环境无污染
【详解】(1)燃料电池的电池反应为燃料的氧化反应,在酸性条件下生成的CO2不与H2SO4反应,故电池总反应式为2CH3OH+3O2=2CO2+4H2O;
(2)电池的正极O2得电子,由于是酸性环境,所以会生成H2O,电极反应式为3O2+12H++12e-=6H2O;用电池总反应式减去正极反应式即可得出负极的电极反应式为2CH3OH+2H2O-12e-=2CO2+12H+;
(3)原电池中阳离子移向正极,即H+移向正极,在正极生成水;原电池中负极失电子;
(4)产物是CO2和H2O,不会对环境造成污染。
18. 反应放热,溶液温度升高,反应速率加快 随反应进行,盐酸的浓度减小,反应速度减慢 2Fe3++Fe=3Fe2+ a 正极:2H++2e-=H2↑;负极:Fe 2e-=Fe2+
【分析】(1)根据影响反应速率的因素分析;
(2)Fe3+氧化性大于H+,所以铁粉先与Fe3+反应生成Fe2+;
(3)铁置换出CuCl2中的Cu,铁、铜、盐酸构成原电池。
【详解】(1)铁与稀盐酸反应放热,溶液温度升高,所以实验①中t1~t2速率加快;随反应进行,盐酸的浓度减小,所以t2~t3反应速度减慢;
(2) 铁与FeCl3反应生成氯化亚铁,与盐酸反应的铁减少,所以放出的氢气减少;铁与FeCl3反应生成氯化亚铁的离子方程式是2Fe3++Fe=3Fe2+;
(3)铁置换出CuCl2中的铜,铜、铁、盐酸构成原电池加快铁与盐酸反应的速率,铁作负极、铜作正极。正极电极反应式是2H++2e =H2↑,负极电极反应式是Fe 2e =Fe2+。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.将两个铂电极放置在KOH溶液中,然后向两极分别通入C3H8与O2,即可产生电流。下列叙述正确的是
①通入C3H8的电极为正极 ②正极的电极反应式为O2+2H2O+4e-=4OH- ③通入C3H8的电极反应式为C3H8+5O2+20e-=3CO2+4H2O ④放电时溶液中的阳离子向正极方向移动 ⑤放电时溶液中的阴离子向正极方向移动
A.①② B.②③ C.②④ D.①⑤
2.工业上冶炼金属铝,经常采用的方法是
A.电解法 B.热分解法 C.热还原法 D.热氧化法
3.如图所示,将铁棒和石墨棒插入1 L 1 mol/L食盐水中。下列说法正确的是( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
4.关于下列各装置图的叙述不正确的是
A.用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B.图②装置的盐桥中KCl的Cl-移向乙烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
5.自热食品无需火电,将水倒在发热包上即可加热食物。发热包的主要成分是:铁粉、铝粉、焦炭粉、活性炭、生石灰、碳酸钠、焙烧硅藻土等,下列说法错误的是
A.生石灰和水反应放出热量
B.发热包用后所得产物的碱性增强
C.发热包用后的产物不环保,冷却后要进行回收处理
D.反应过程中有微小原电池形成,负极反应为:Fe-3e-==Fe3+
6.电池是种以海水为电解质溶液的水激活电池。下列叙述错误的是
A.负极反应式为
B.正极反应式为
C.不能被溶液激活
D.负极会发生副反应:
7.NA是阿伏伽德罗常数的值,下列说法正确的是
A.1L0.1mol/LNa2S溶液中S2-和H2S的数目之和小于0.1NA
B.反应3H2(g)+N2(g)2NH3(g)△H=-92kJ/mol,当放出9.2kJ热量时,转移电子0.3NA
C.电解精炼粗铜,阳极溶解铜6.4g时,阴极得电子数目为0.2NA
D.0.1molFeCl3完全水解形成Fe(OH)3胶体的胶粒数为0.1NA
8.硼酸为一元弱酸,已知与足量溶液反应的离子方程式为可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是
A.当电路中通过电子时,可得到
B.将电源的正、负极反接,工作原理不变
C.阴极室的电极反应式为
D.穿过阴膜进入阴极室,穿过阳膜进入产品室
9.氢氧燃料电池已用于航天飞机,以 30%KOH 溶液为电解质溶液的这种电池其工作原理如图所示。关于该燃料电池的说法正确的是
A.该电池总方程式为2H2 +O2 = 2H2O
B.该电池工作时,热能转化为电能
C.电流从a 电极经外电路流向 b 电极
D.燃料电池的能量转化率可达100%
10.全钒电池以惰性材料作电极,在电解质溶液中发生的原电池反应为(黄色)(绿色)(蓝色)(紫色)。下列说法正确的是
A.正极反应为
B.正极附近的溶液由绿色逐渐变为紫色
C.反应每生成时转移电子的物质的量为
D.电池使用过程中溶液的pH逐渐减小
11.有两只串联的电解池(惰性电极),甲池盛有足量的CuSO4溶液,乙池盛有足量的某硝酸盐的稀溶液。电解时当甲池电极析出6.4 gCu时,乙池电极析出21.6 g金属,则乙池的溶质可能是
A.NaNO3 B.KNO3 C.Al(NO3)3 D.AgNO3
12.锌-空气电池(原理 如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。下列说法正确的是()
A.每消耗1 mol O2转移2 mol电子
B.氧气在石墨电极上发生氧化反应
C.该电池放电时OH-向Zn电极移动
D.该电池的负极反应为Zn+H2O-2e-=ZnO+2H+
13.氨硼烷()电池可在常温下工作,装置如图所示。该电池工作时的总反应为。下列说法正确的是
A.正极附近溶液的pH减小
B.电池工作时,通过质子交换膜向负极移动
C.消耗氨硼烷,理论上有电子通过内电路
D.电池负极反应式为
14.有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3—Na2O,O2-可以在其中自由移动。下列有关叙述正确的是( )
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O
D.当固体电解质中有1molO2-通过时,电子转移4mol
15.为探究锌与稀硫酸的反应速率[以v(H2)表示]。向反应混合物中加入某些物质,下列判断正确的是( )
A.加入NH4HSO4固体,v(H2)不变 B.加入少量锌,v(H2)增大
C.加入CH3COONa固体,v(H2)减小 D.滴加少量CuSO4溶液,v(H2)减小
二、填空题
16.电化学自伏打电堆开始,便不断地推进化学学科的发展。伏打电堆示意图如图所示:
(1)将Zn片和Ag片用浸泡有盐溶液的纸片隔开,就可以产生电流,该装置的电流方向是_________(填“Zn→Ag”或“Ag→Zn”)
(2)利用伏打电堆产生的电流,戴维开创了电化学研究,制得并发现系列新元素,请写出电解制Na的化学方程式:______________。
(3)已知铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+ 2H2O,现设计如下图所示装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时,铁电极的质量减少11.2 g。
则A是铅蓄电池的_____(填“正”或“负”)极,写出铅蓄电池放电时的正极反应式:______,如图2表示电解时某个量(纵坐标x)随时间变化的曲线,这个量x最有可能表示的是_____(填序号)。
a.两个U形管中析出的气体体积
b.两个U形管中阳极质量的减少量
c.两个U形管中阴极质量的增加量
17.科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生的化学反应方程式:_________。
(2)此电池的正极发生的电极反应:________,负极发生的电极反应:________。
(3)电解液中H+向___极移动,向外电路释放电子的电极是_____。
(4)使用该燃料电池的另一个好处是________。
三、实验题
18.某研究性学习小组为探究铁与稀盐酸反应,取同质量、体积的铁片、同浓度的盐酸做了下列平行实验:实验①:把纯铁片投入到盛有稀盐酸的试管中,发现放出氢气的速率变化如图所示:
实验②:把铁片投入到含FeCl3的同浓度稀盐酸中,发现放出氢气的量减少。
实验③:在稀盐酸中滴入几滴CuCl2溶液,用铁片做实验,发现生成氢气的速率加快。
试回答下列问题:
(1)分析实验①中t1~t2速率变化的主要原因是______,t2~t3速率变化的主要原因是______。
(2)实验②放出氢气的量减少的原因是______(用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是形成了原电池,你认为是否正确?______(正确填“a”,不正确填“b”)。请回答下列相应的a或b问题。
a.若正确,则写出实验③中原电池的正、负极电极反应式______。b.若不正确,请说明原因。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】
【详解】根据题意,形成了C3H8碱性燃料电池,总反应为:C3H8+5O2+6OH-=3CO32-+7H2O;根据在原电池中正极发生还原反应、负极发生氧化反应规律进行分析,通入C3H8的电极为负极,电极反应式为:C3H8+26OH--20e-=3CO32-+17H2O,故①③错误;通入O2的电极为正极,电极反应式为O2+2H2O+4e-=4OH-,故②正确;放电时溶液(原电池内电路)中的阳离子向正极移动,阴离子向负极移动,故④正确、⑤错误。综上,②④正确;
故选C。
2.A
【详解】铝是活泼的金属,冶炼的方法是电解熔融的氧化铝,答案选A。
【点睛】该题的关键是明确金属冶炼的原理和方法,即金属的冶炼一般是依据金属的活泼性选择相应的方法,常见金属冶炼的方法有:1.热分解法:适用于不活泼的金属,如汞可用氧化汞加热制得;2.热还原法:用还原剂(氢气,焦炭,一氧化碳,活泼金属等)还原;3.电解法:适用于K、Ca、Na、Mg、Al等活泼金属;4.其他方法:如CuSO4+Fe=Cu+FeSO4。
3.D
【详解】A、若电键K与N连接,则形成原电池,铁作负极,铁被腐蚀,故A错误;
B、若电键K与N连接,形成原电池,铁作负极,发生吸氧腐蚀,正极反应式是:O2+2H2O+4e-=4OH-,故B错误;
C、若电键K与M连接,则形成电解池,将石墨棒换成铜棒,若要在铁棒上镀铜,电解质溶液不能用食盐水,而应用硫酸铜溶液,故C错误;
D、若电键K与M连接,则形成电解池,电解食盐水时,根据反应方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑可得,1 mol氯化钠全部被电解时产生1 mol NaOH和标准状况下22.4 LH2、Cl2混合气体,而现在产生的气体为28 L,表明电解完氯化钠后继续电解水,根据钠元素守恒,生成氢氧化钠的物质的量不变,即生成1mol NaOH,故D正确;
答案选D。
4.B
【详解】A.用图①装置精炼铜,粗铜为阳极,纯铜为阴极,粗铜被氧化,粗铜与电源正极相连,纯铜与电源负极相连,故a极为粗铜,b为精铜,故A正确;
B.锌为负极,盐桥中KCl的Cl﹣移向负极,即移向甲烧杯,故B错误;
C.图③装置中钢闸门应与外接电源的负极相连接,为外加电源的阴极保护法,故C正确;
D.图④负极分别为铝、锌,转移相同电量时,消耗的电极质量不同,故D正确;
答案选B。
5.D
【详解】A.CaO与水反应生成Ca(OH)2,是放热反应,A正确,不选;
B.CaO与水反应会生成Ca(OH)2,产物碱性会增强,B正确,不选;
C.发热包使用后,仍会有焦炭,碳酸钠,硅藻土,以及Fe、Al的化合物等,直接遗弃不环保,应回收处理,C正确,不选;
D.加入水后,铁、焦炭、水溶液可以形成微小原电池,负极反应为Fe-2e-=Fe2+,D错误,符合题意;
答案选D。
6.C
【详解】A.电池中镁作负极,电极反应式为, A正确;
B.电池中氯化银作正极,电极反应式为,B正确;
C.由题给信息可知,电池以海水为电解质溶液,海水中盐类的主要成分是氯化钠,则可推知氯化钾溶液也能激活该电池,C错误;
D.镁是活泼金属,会与水发生副反应,D正确;
故选C。
7.A
【详解】A.根据物料守恒,1L0.1mol/LNa2S溶液中S2-、HS-和H2S的数目之和等于0.1NA,所以S2-和H2S的数目之和小于0.1NA,故A正确;
B.根据热化学方程式,当放出92kJ热量时,消耗1mol氮气,转移6mol电子,所以当放出9.2kJ热量时,转移电子为0.6NA,故B错误;
C.电解精炼粗铜时,阳极除了铜失去电子外,比铜活泼的金属杂质也会失去电子,所以当阳极溶解6.4g铜时,转移的电子的物质的量不一定为0.2mol,那么阴极得到的电子的物质的量也不一定为0.2mol,故C错误;
D.Fe(OH)3胶体的胶粒是多个Fe(OH)3分子聚集而成的,所以0.1molFeCl3完全水解形成Fe(OH)3胶体的胶粒数小于0.1NA,故D错误;
故选A。
8.A
【分析】由装置图可知,与电源正极相连的为阳极,与电源负极相连的为阴极,阳极氢氧根失电子发生氧化反应,电极反应式为2H2O-4e-═O2↑+4H+,则氢离子穿过阳膜进入产品H3BO3室;阴极氢离子得电子发生还原反应,电极反应式为4H2O+4e-═2H2↑+4OH-,Na+穿过阳膜进入阴极室,所以阴极室NaOH溶液浓度增大,穿过阴膜进入产品H3BO3室,与氢离子结合生成H3BO3,据此分析解答。
【详解】A.阳极发生失去电子的氧化反应,电极反应式为,电路中通过电子时有生成,硼酸为一元弱酸,生成硼酸需要,所以电路中通过电子时,可得到,故A正确;
B.根据以上分析可知,如果将电源的正、负极反接,工作原理将发生变化,故B错误;
C.电解时阴极发生得电子的还原反应,电极反应式为,故C错误;
D.阳极电极反应式为,阴极电极反应式为,阳极室中的氢离子穿过阳膜进入产品室,原料室中的穿过阴膜进入产品室,发生反应:,原料室中的穿过阳膜进入阴极室,故D错误;
答案选A。
9.A
【分析】碱性氢氧燃料电池中,通入燃料氢气的一极为负极,则a为负极,电极反应为2H2+4OH--4e-=4H2O;通入氧气的一极为正极,则b为正极,电极反应为:O2+2H2O+4e-=4OH-,据此分析解答。
【详解】A.根据分析,负极电极反应为2H2+4OH--4e-=4H2O,正电极反应为:O2+2H2O+4e-=4OH-,正极反应式和负极反应式相加即可得总反应式,则电池的总反应为:2H2+O2=2H2O,故A正确;
B.氢氧燃料电池是原电池装置,原电池装置中是将化学能转化为电能,故B错误;
C.原电池中,电流由正极经外电路流向负极,a为负极,b为正极,则电流从b电极经外电路流向a电极,故C错误;
D.燃料电池是将化学能转变为电能的装置,还会伴有热能等能量的释放,能量转化率不会达到100%,故D错误;
答案选A。
10.A
【分析】由原电池反应(黄色)(绿色)(蓝色)(紫色)可知,所在电极为正极,所在电极为负极,结合原电池相关知识解答。
【详解】A.结合分析可知放电过程中,正极发生还原反应,极反应为,A正确;
B.正极附近的溶液由(黄色)变化为(蓝色),B错误;
C.结合正极反应式可知,每生成1molH2O时转移电子的物质的量为1mol,C错误;
D.由原电池反应可知,电池使用过程中消耗氢离子,溶液的pH增大,D错误。
答案选A。
11.D
【分析】用惰性电极电解不活泼金属盐溶液时阴极有金属析出。
【详解】A.用惰性电极电解NaNO3溶液时,阴极有氢气生成,不可能有金属析出,故A错误;
B.用惰性电极电解KNO3溶液时,阴极有氢气生成,不可能有金属析出,故B错误;
C.用惰性电极电解Al(NO3)3溶液时,阴极有氢气生成,不可能有金属析出,故C错误;
D.用惰性电极电解AgNO3溶液时,阴极有Ag析出,且==0.2mol,即甲、乙两池析出金属时转移电子数目相等,故D正确;
故答案为D。
12.C
【分析】放电时Zn转化为ZnO,锌作负极,负极上电极反应式为:Zn+2OH--2e-═ZnO+H2O,正极上通入空气,其电极反应式为O2+2H2O+4e-=4OH-,再结合离子移动方向分析解答。
【详解】A.O2在正极参与电极反应,电极反应式为O2+4e-+2H2O=4OH-,则每消耗1 mol O2转移4 mol电子,故A错误;
B.氧气在石墨电极上得电子,发生还原反应,故B错误;
C.原电池工作时,溶液中的阴离子向负极移动,即OH-向Zn极移动,故C正确;
D.锌作负极,碱性条件下,负极上电极反应式为:Zn+2OH--2e-═ZnO+H2O,故D错误;
故答案为C。
13.D
【详解】A.根据电池总反应可知,正极上发生还原反应;,正极附近减小,溶液pH增大,A项错误;
B.原电池工作时,阳离子向正极移动,故通过质子交换膜向正极移动,B项错误;
C.转化为,N的化合价不变,B的化合价升高,根据,可知,消耗氨硼烷,反应中转移电子,但电子不通过内电路,C项错误;
D.根据电池总反应,负极上氨硼烷发生氧化反应:,D项正确;
故选D。
14.C
【详解】A.电池外电路中电子由负极流向正极,氧气得电子,b极为正极,电子由电极a流向电极b,选项A错误;
B.电极b氧气得电子,生成O2-,O2-由正极(电极b)流向负极(电极a),选项B错误;
C.甲烷所在电极a为负极,电极反应为CH4+4O2--8e-=CO2+2H2O,选项C正确;
D.1 mol O2得4 mol电子生成2 mol O2-,故当固体电解质中有1 mol O2-通过时,电子转移2 mol,选项D错误。
答案选C。
15.C
【详解】A.加入NH4HSO4固体,NH4HSO4溶解,溶液中氢离子浓度增大,反应速率v(H2)增大,故A错误;
B.锌为固体,固体的浓度为定值,增加固体的化学反应速率不变,则加入少量锌,反应速率v(H2)不变,故B错误;
C.加入CH3COONa固体,醋酸钠与稀硫酸反应生成弱酸醋酸,溶液中氢离子浓度减小,反应速率v(H2)减小,故C正确;
D.滴加少量CuSO4溶液,锌与硫酸铜溶液发生置换反应生成铜,构成锌铜原电池,化学反应速率v(H2)增大,故D错误;
故选C。
16. Ag→Zn 2NaCl(熔融)=2Na+Cl2↑ 负 PbO2+2e-+SO42-+4H+=PbSO4+2H2O b
【详解】(1)Zn片和Ag片浸泡在盐溶液中,Zn比Ag活泼,Zn失电子,作负极,Ag作正极,在原电池中,电流由正极经外电路流向负极,即电流方向Ag→Zn;
(2)通过电解熔融的NaCl制备Na,化学方程式为2NaCl(熔融)2Na+Cl2↑;
(3) 铁电极的质量减少11.2 g,铁作阳极,Ag作阴极,A是负极,B为正极,铅蓄电池中,PbO2得电子,电极方程式PbO2+2e-+SO42-+4H+=PbSO4+2H2O;左边的U形管,阳极Fe-2e-=Fe2+,阴极2H++2e-=H2↑;右边的U形管,阳极Cu-2e-=Cu2+,阴极Cu2++2e-=Cu;
a.右边U形管不析出气体,左边U形管析出气体,所以稀硫酸析出气体体积大于硫酸铜溶液,故错误;
b.当转移相同电子时,溶解金属的物质的量相等,铜的摩尔质量大于铁,所以右边U形管阳极减少的质量大于左边U 形管阳极减小的质量,故正确;
c.当转移相同电子时,析出物质的物质的量相等,但铜的摩尔质量大于氢气,所以左边U形管析出氢气的质量小于右边U形管析出铜的质量,故错误;
答案选b。
17. 2CH3OH+3O2=2CO2+4H2O 3O2+12H++12e-=6H2O 2CH3OH+2H2O-12e-=2CO2+12H+ 正 负极 对环境无污染
【详解】(1)燃料电池的电池反应为燃料的氧化反应,在酸性条件下生成的CO2不与H2SO4反应,故电池总反应式为2CH3OH+3O2=2CO2+4H2O;
(2)电池的正极O2得电子,由于是酸性环境,所以会生成H2O,电极反应式为3O2+12H++12e-=6H2O;用电池总反应式减去正极反应式即可得出负极的电极反应式为2CH3OH+2H2O-12e-=2CO2+12H+;
(3)原电池中阳离子移向正极,即H+移向正极,在正极生成水;原电池中负极失电子;
(4)产物是CO2和H2O,不会对环境造成污染。
18. 反应放热,溶液温度升高,反应速率加快 随反应进行,盐酸的浓度减小,反应速度减慢 2Fe3++Fe=3Fe2+ a 正极:2H++2e-=H2↑;负极:Fe 2e-=Fe2+
【分析】(1)根据影响反应速率的因素分析;
(2)Fe3+氧化性大于H+,所以铁粉先与Fe3+反应生成Fe2+;
(3)铁置换出CuCl2中的Cu,铁、铜、盐酸构成原电池。
【详解】(1)铁与稀盐酸反应放热,溶液温度升高,所以实验①中t1~t2速率加快;随反应进行,盐酸的浓度减小,所以t2~t3反应速度减慢;
(2) 铁与FeCl3反应生成氯化亚铁,与盐酸反应的铁减少,所以放出的氢气减少;铁与FeCl3反应生成氯化亚铁的离子方程式是2Fe3++Fe=3Fe2+;
(3)铁置换出CuCl2中的铜,铜、铁、盐酸构成原电池加快铁与盐酸反应的速率,铁作负极、铜作正极。正极电极反应式是2H++2e =H2↑,负极电极反应式是Fe 2e =Fe2+。
答案第1页,共2页
答案第1页,共2页
