实验活动7 溶液酸碱性的检验 课时作业 (含解析)
文档属性
| 名称 | 实验活动7 溶液酸碱性的检验 课时作业 (含解析) |
|
|
| 格式 | zip | ||
| 文件大小 | 124.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-15 00:00:00 | ||
图片预览


文档简介
实验活动7 溶液酸碱性的检验 课时作业
一、单选题
1.紫甘蓝汁性质稳定,其颜色随pH改变而发生如下变化:
pH ﹤6.5 7.0—7.1 7.5—8.5 8.5—12.0 ﹥12.5
颜色 粉红色 紫色 蓝色 绿色 黄色
下列分析错误的是A.紫甘蓝汁可用作酸碱指示剂
B.将紫甘蓝汁加入到不同碱性溶液中,可能显示出多种颜色
C.与石蕊相比,紫甘蓝汁可更准确检验溶液的酸碱性强弱程度
D.向滴有紫甘蓝汁的氢氧化钠溶液中加入盐酸,若溶液变色则说明一定恰好完全反应
2.推理是学习化学的一种重要方法。下列推理正确的是( )
A.酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应
B.碱都含有氢元素,所以含有氢元素的化合物一定是碱
C.金属元素有正化合价,因此非金属元素一定没有正化合价
D.酸性溶液的PH<7,故PH<7的溶液一定是显酸性的溶液
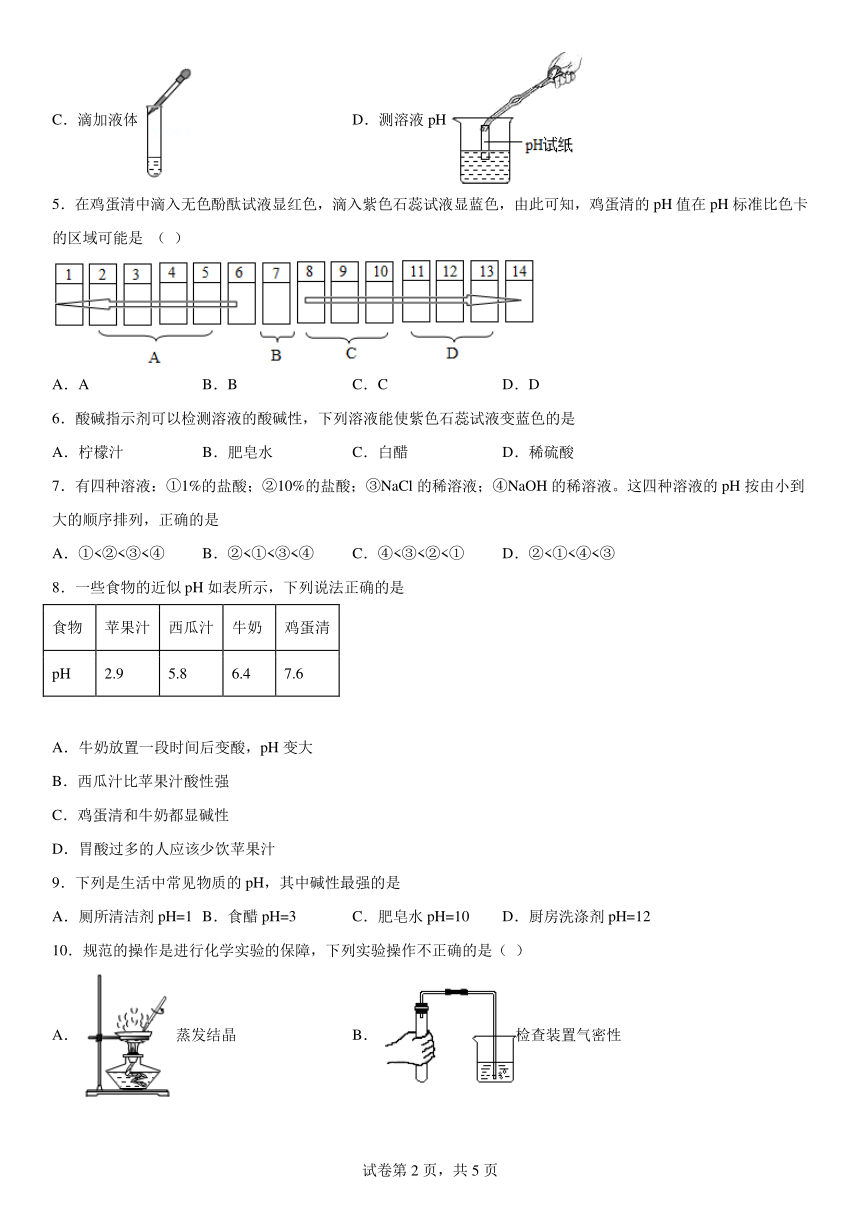
3.正确实验操作是保证实验成功的因素之一,下列实验操作正确的是
A.量取9.5mL液体 B.给液体加热
C.稀释浓硫酸 D.测溶液pH
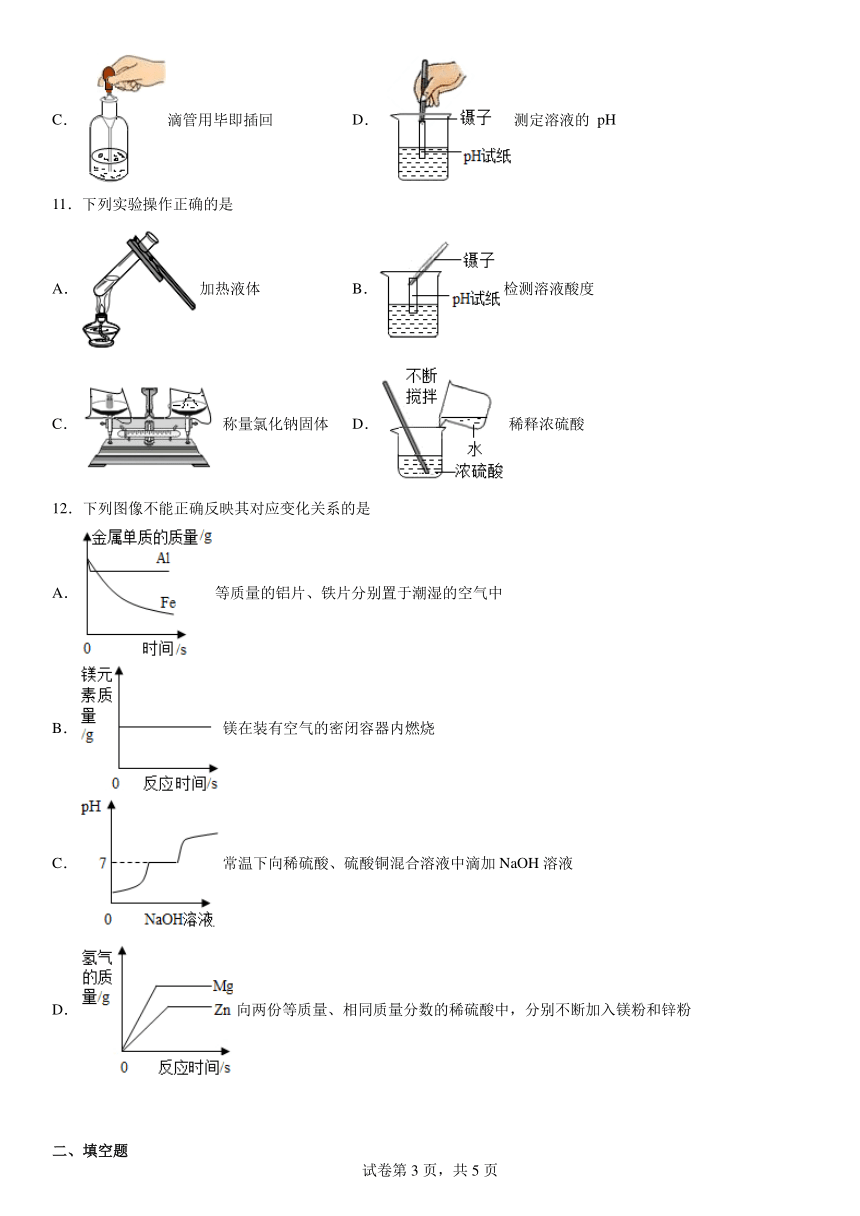
4.下列实验操作正确的是
A.量取液体 B.验满气体
C.滴加液体 D.测溶液pH
5.在鸡蛋清中滴入无色酚酞试液显红色,滴入紫色石蕊试液显蓝色,由此可知,鸡蛋清的pH值在pH标准比色卡的区域可能是 ( )
A.A B.B C.C D.D
6.酸碱指示剂可以检测溶液的酸碱性,下列溶液能使紫色石蕊试液变蓝色的是
A.柠檬汁 B.肥皂水 C.白醋 D.稀硫酸
7.有四种溶液:①1%的盐酸;②10%的盐酸;③NaCl的稀溶液;④NaOH的稀溶液。这四种溶液的pH按由小到大的顺序排列,正确的是
A.①<②<③<④ B.②<①<③<④ C.④<③<②<① D.②<①<④<③
8.一些食物的近似pH如表所示,下列说法正确的是
食物 苹果汁 西瓜汁 牛奶 鸡蛋清
pH 2.9 5.8 6.4 7.6
A.牛奶放置一段时间后变酸,pH变大
B.西瓜汁比苹果汁酸性强
C.鸡蛋清和牛奶都显碱性
D.胃酸过多的人应该少饮苹果汁
9.下列是生活中常见物质的pH,其中碱性最强的是
A.厕所清洁剂pH=1 B.食醋pH=3 C.肥皂水pH=10 D.厨房洗涤剂pH=12
10.规范的操作是进行化学实验的保障,下列实验操作不正确的是( )
A.蒸发结晶 B. 检查装置气密性
C. 滴管用毕即插回 D. 测定溶液的 pH
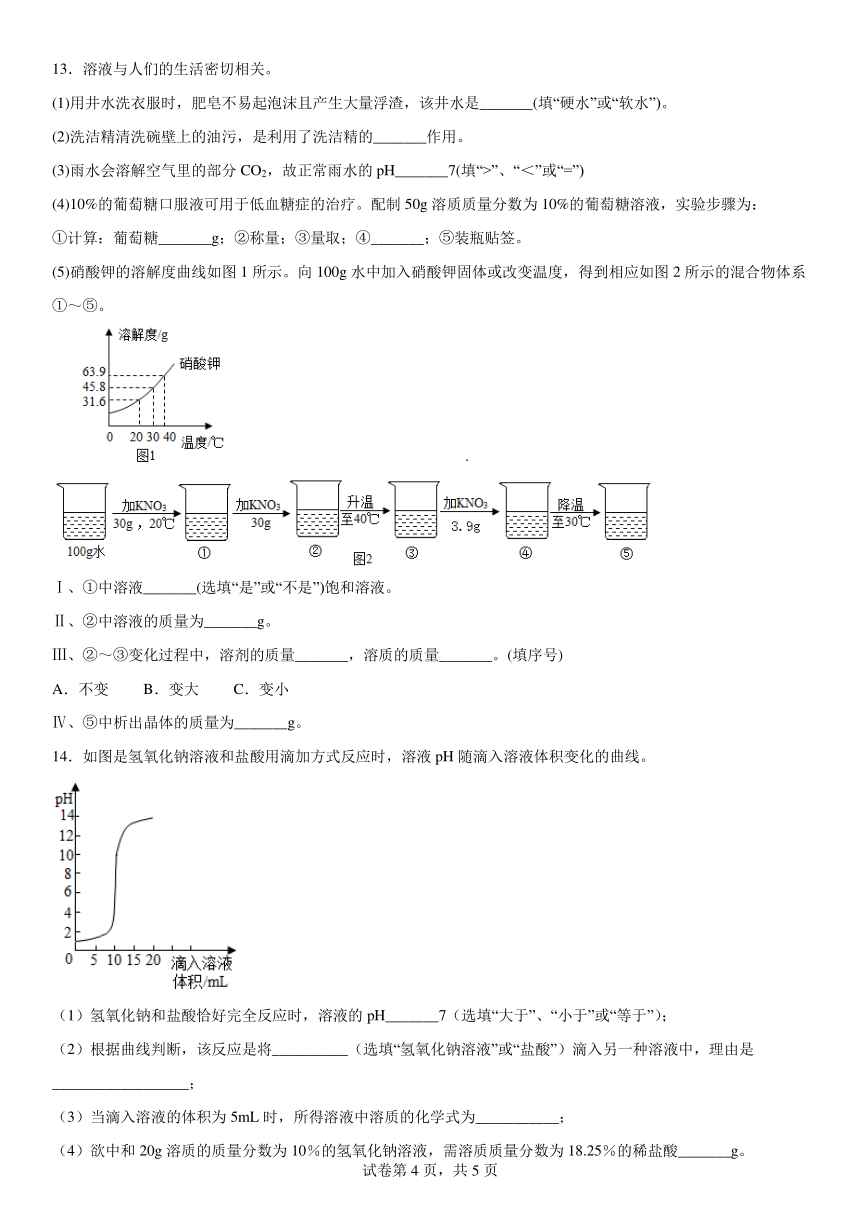
11.下列实验操作正确的是
A.加热液体 B.检测溶液酸度
C.称量氯化钠固体 D.稀释浓硫酸
12.下列图像不能正确反映其对应变化关系的是
A.等质量的铝片、铁片分别置于潮湿的空气中
B.镁在装有空气的密闭容器内燃烧
C.常温下向稀硫酸、硫酸铜混合溶液中滴加NaOH溶液
D.向两份等质量、相同质量分数的稀硫酸中,分别不断加入镁粉和锌粉
二、填空题
13.溶液与人们的生活密切相关。
(1)用井水洗衣服时,肥皂不易起泡沫且产生大量浮渣,该井水是_______(填“硬水”或“软水”)。
(2)洗洁精清洗碗壁上的油污,是利用了洗洁精的_______作用。
(3)雨水会溶解空气里的部分CO2,故正常雨水的pH_______7(填“>”、“<”或“=”)
(4)10%的葡萄糖口服液可用于低血糖症的治疗。配制50g溶质质量分数为10%的葡萄糖溶液,实验步骤为:
①计算:葡萄糖_______g;②称量;③量取;④_______;⑤装瓶贴签。
(5)硝酸钾的溶解度曲线如图1所示。向100g水中加入硝酸钾固体或改变温度,得到相应如图2所示的混合物体系①~⑤。
Ⅰ、①中溶液_______(选填“是”或“不是”)饱和溶液。
Ⅱ、②中溶液的质量为_______g。
Ⅲ、②~③变化过程中,溶剂的质量_______,溶质的质量_______。(填序号)
A.不变 B.变大 C.变小
Ⅳ、⑤中析出晶体的质量为_______g。
14.如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
(1)氢氧化钠和盐酸恰好完全反应时,溶液的pH_______7(选填“大于”、“小于”或“等于”);
(2)根据曲线判断,该反应是将__________(选填“氢氧化钠溶液”或“盐酸”)滴入另一种溶液中,理由是__________________;
(3)当滴入溶液的体积为5mL时,所得溶液中溶质的化学式为___________;
(4)欲中和20g溶质的质量分数为10%的氢氧化钠溶液,需溶质质量分数为18.25%的稀盐酸_______g。
三、推断题
15.A、B、C、D为初中常见的物质.A与B之间发生的化学反应可表示为:“A+B→C+D”.
(1)若C为氯化钠,D为氧化物,且在A溶液中加入铁粉能产生氢气,则A为_____.若A、B两溶液恰好完全反应,则反应后溶液的pH_____7(填“>”或“<”或“=”).
(2)若A和B均为黑色粉末,A与B反应时可观察到黑色粉末变为红色,同时生成能使澄清石灰水变浑浊的无色气体,则A与B反应的化学方程式为_____.
四、实验题
16.(1)云南很多地方都有温泉,小艳同学取某地温泉水样,冷却至室温后进行探究。
①测得温泉水样的pH=7.4,可知该温泉水样呈___________性。
②加入____________后振荡,发现泡沫较少,浮渣较多,说明该温泉水样为硬水。
③小艳同学发现长时间烧煮该温泉水的水壶中有水垢,她用厨房里的__________(填标号 )轻松将水垢除去。
A食盐水 B食醋 C料酒 D蚝油
(2)云南水资源丰富,但分布不均,节约用水,人人有责。下列不属于节水措施的是________(填标号 )。
A使用节水龙头
B洗衣服的水用来冲厕所
C淘米的水用来浇花
D公园草坪用大水漫灌
(3)请根据下列装置图回答问题:
电解水实验的化学方程式为_______________,气体a在电源的___________(填“正”或“负”)极产生。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、由于紫甘蓝汁在酸碱溶液中会显示不同的颜色,可做酸碱指示剂,选项A正确;
B、pH大于7的溶液呈碱性,由表中的信息可知不同pH的碱性溶液甘蓝汁显示的颜色不同,选项B正确;
C、甘蓝汁的变色的范围比紫色石蕊溶液更小,比紫色石蕊溶液更加具体,与石蕊相比,紫甘蓝汁可较准确检验溶液的酸碱性强弱程度,选项C正确;
D、根据表中的信息,氢氧化钠溶液中加入盐酸溶液变色,只是说明溶液的酸碱度发生了改变,但不能说明一定恰好反应,选项D错误。故选D。
2.D
【详解】A.生成盐和水的反应不一定是酸与碱的反应,如氢氧化钠与二氧化碳反应生成碳酸钠和水,反应后有盐与水生成,不是酸与碱的反应,选项错误;
B.含有氢元素的化合物不一定是碱,如水中含有氢元素,水属于氧化物,不属于碱,选项错误;
C.非金属元素不一定没有正化合价,如氢元素在化合物中的化合价为+1价,选项错误;
D. 酸性溶液的PH<7,所以PH<7的溶液一定是显酸性的溶液,选项正确,故选D。
3.B
【详解】A、量取9.5 mL液体应选择10 mL量筒,选用100 mL的量筒会造成较大的误差,A错误;
B、加热液体时,试管内液体体积不能超过试管容积的三分之一,试管夹夹在试管中上部,使用酒精灯外焰加热,并应先预热再集中加热,B正确;
C、稀释浓硫酸时,应将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌,若将水倒入浓硫酸中,由于水的密度较小,水会浮在浓硫酸上面,稀释过程中放出的热量会使水沸腾,导致液滴飞溅,非常危险,C错误;
D、测溶液pH时,应用玻璃棒蘸取(或胶头滴管吸取)少量待测液滴于pH试纸上,将试纸显示的颜色与标准比色卡对照,读出溶液的pH,若直接将pH试纸浸入待测液,会导致待测液被污染,D错误。
故选:B。
4.B
【详解】A、量筒读数时,视线要和凹液面最低处保持水平,故A不符合题意;
B、二氧化碳不支持燃烧,因此将燃着的木条放在瓶口,木条熄灭说明二氧化碳已经收集满,故B符合题意;
C、胶头滴管不能接触试管内壁,故C不符合题意;
D、测定pH时,不能将pH试纸伸入到溶液中,故D不符合题意;
故选B。
【点睛】
5.D
【详解】鸡蛋清中滴入无色酚酞溶液显红色,滴入紫色石蕊溶液显蓝色,说明鸡蛋清显碱性,PH大于7.故选D
6.B
【详解】碱性溶液能使紫色石蕊试剂变蓝色,柠檬汁、白醋、稀硫酸的溶液都呈酸性,肥皂水的溶液呈碱性;
故选B。
7.B
【详解】1%的盐酸的酸性比10%的盐酸的酸性弱,酸性溶液pH小7,pH越小,酸性越强,所以1%的盐酸的pH比10%的盐酸的pH大;
氯化钠溶液呈中性,溶液pH=7 ;
氢氧化钠溶液呈碱性,溶液pH大于7;
所以四种溶液的pH由小到大的顺序是:②<①<③<④,故答案选B.
8.D
【分析】溶液的pH等于7时,呈中性;当溶液的pH大于7时,呈碱性;当溶液的pH小于7时,呈酸性。当溶液的pH小于7时,随着pH的减小酸性增强。
【详解】A、牛奶放置一段时间后变酸,酸性增强,pH变小,故A不正确;
B、西瓜汁的pH值为5.8,苹果汁的pH值为2.9,西瓜汁比苹果汁酸性弱,故B不正确;
C、牛奶的pH值为6.4,小于7,显酸性,鸡蛋清的pH值为7.6,大于7,显碱性,故C不正确;
D、苹果汁的pH值为2.9,显酸性,则胃酸过多的人应该少饮苹果汁,故D正确。故选D。
9.D
【详解】pH <7,溶液呈酸性,且pH越小,酸性越强;pH =7时溶液呈中性;pH>7溶液呈碱性,pH越大,碱性越强。故选D。
10.D
【详解】A、蒸发结晶时,利用玻璃棒搅拌,防止液体受热不均匀发生飞溅,选项A正确;
B、检查装置气密时,先将导管放入烧杯内,然后用手握住试管,利用热胀冷缩原理,观察导管口有气泡冒出,则说明装置气密性良好,选项B正确;
C、试剂瓶专门配制的胶头滴管使用完毕后,立即放回试剂瓶,保证试剂不受污染,选项C正确;
D、测定溶液pH时,用玻璃棒蘸取试液滴加到干燥的pH试纸上,测定溶液pH,不得将试纸伸入溶液中,防止试纸污染溶液,选项D错误。故选D。
11.A
【详解】A、给试管中的液体加热时,液体体积不能超过试管容积的三分之一,用酒精灯的外焰加热,故A正确;
B、用pH试纸检测酸碱度时,用玻璃棒蘸取待测溶液,滴于干燥的pH试纸上,再将此pH试纸与标准比色卡比较,得出溶液pH,绝对不可以把pH试纸放入待测液中,以免污染试剂,故B错误;
C、托盘天平的使用要遵循“左物右码”的原则,图中物质与砝码放反了,故C错误;
D、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的扩散;一定不能把水注入浓硫酸中;如果将水倒入浓硫酸中,水会浮在上面,浓硫酸溶于水放出的热量足可以使水沸腾,会溅出伤人,故D错误;
故选A。
12.D
【详解】A、铝片表面有一层致密的氧化铝薄膜,使得铝片不易生锈,铝单质的质量不变,铁在潮湿的空气中易生锈,铁单质的质量减少,能正确反映其对应变化关系,不符合题意;
B、化学反应前后各种元素的质量不变,故镁在装有空气的密闭容器内燃烧,镁元素的质量不变,能正确反映其对应变化关系,不符合题意;
C、常温下向稀硫酸、硫酸铜混合溶液中滴加NaOH溶液,首先发生的反应为:2NaOH+H2SO4=Na2SO4+2H2O,溶液的酸性减弱,pH值增大,然后发生的反应为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,当恰好反应时,溶液的pH=7,继续滴加NaOH溶液,溶液的碱性增强,溶液的pH>7,能正确反映其对应变化关系,不符合题意;
D、向两份等质量、相同质量分数的稀硫酸中,分别不断加入镁粉和锌粉,最终参加反应的硫酸质量相等,、,等质量的硫酸生成等质量的氢气,不能正确反映其对应变化关系,符合题意。
故选D。
【点睛】图像问题主要是结合化学反应分析图的起点位置、变化趋势、转折点、终点位置是否正确。
13.(1)硬水
(2)乳化
(3)<
(4) 5 溶解
(5) 不是 131.6 A B 18.1
【详解】(1)水取样后加入肥皂水,振荡,产生较多泡沫较少浮渣的是软水,产生较少泡沫较多浮渣的是硬水,故填硬水;
(2)用洗洁精清洗碗上的油污,是利用了洗洁精具有乳化作用,能将大的油滴分散成细小的油滴随水冲走;故填乳化;
(3)二氧化碳能和水反应生成碳酸,碳酸溶液呈酸性,则pH<7,故填<;
(4)溶质质量=溶液质量×溶质质量分数,且天平精度为0.1g,则葡萄糖质量= ,故填5.0;
一定溶质质量分数的溶液配制过程中,称量好溶剂和溶质后需要放在烧杯内溶解,故填溶解;
(5)Ⅰ、由溶解度曲线可知,硝酸钾在20℃时的溶解度为31.6g,即20℃时100g水中最多溶解31.6g硝酸钾即可达到饱和状态。①中100g水中溶解的硝酸钾质量为30g,小于31.6g,故①为不饱和溶液,故填不是;
Ⅱ、②中溶液温度为20℃,该温度下100g水中最多溶解31.6g硝酸钾,此时②中加入了60g硝酸钾,只能溶解31.6g,则②溶液的溶液质量为100g+31.6g=131.6g,故填131.6;
Ⅲ、有溶解度曲线可知,40℃时硝酸钾溶解度增大到45.8g。所以由溶液②升温到溶液③过程中,溶剂水的质量不变,溶知质量增大,故填A;B;
Ⅳ、溶液③中含有溶质质量为60g,溶剂质量为100g,再在该温度下加入3.9g硝酸钾,溶液恰好达到饱和状态。硝酸钾在30℃时的溶解度为45.8g,则④溶液开始降温到30℃时,析出晶体质量为63.9g-45.8g=18.1g,故填18.1。
14. 等于 氢氧化钠溶液 溶液的pH逐渐变大 HCl和NaCl 10
【详解】(1)氢氧化钠和盐酸恰好完全反应时,溶液中只有氯化钠和水,溶液呈中性,pH等于7;
(2)由于曲线的起点溶液的pH小于7说明开始溶液为酸,然后随液体的加入氢氧化钠溶液的pH逐渐变大,最后呈碱性,溶液的pH逐渐变大,最后大于7,可知实验是将氢氧化钠溶液加入盐酸中;
(3)当滴入溶液的体积为5mL时,溶液显酸性,说明所得溶液中溶质为生成的氯化钠和剩余的氯化氢;
(4)设需溶质质量分数为18.25%的稀盐酸的质量为x
x=10g。
15. 盐酸 =
【分析】本题考查物质性质。
【详解】(1)A溶液中加入铁粉能产生氢气,说明A是一种酸;由于A、B反应生成氯化钠和一种氧化物,所以利用质量守恒定律可知,A是盐酸,氧化物为水,B为氢氧化钠;氢氧化钠与盐酸完全反应生成氯化钠和水,恰好完全反应时得到的溶液是氯化钠溶液,为中性溶液,其pH为7;
(2)能使澄清石粒水变浑浊的气体是二氧化碳,两种黑色固体的混合物受热后,变成红色,同时生成能二氧化碳,所以红色固体为铜,根据质量守恒定律,可知黑色固体中有一种为氧化铜,所以另一种黑色固体为碳,即该反应是碳和氧化铜反应生成铜和二氧化碳:
【点睛】结合物质性质推断。
16. 碱 肥皂水 B D 负
【详解】(1)①测得温泉水样的 pH=7.4,可知该温泉水样呈碱性。
②加入肥皂水后振荡,发现泡沫较少,浮渣较多,说明该温泉水样为硬水。
③小艳同学发现长时间烧煮该温泉水的水壶中有水垢,她用厨房里的食醋将水垢除去,这是因为食醋中的醋酸能和水垢中的碳酸钙、氢氧化镁反应。
故填:B。
(2)A.使用节水龙头可以节约用水,不符合题意;
B.洗衣服的水用来冲厕所可以节约用水,不符合题意;
C.淘米的水用来浇花可以节约用水,不符合题意;
D.公园草坪用大水漫灌会浪费水,符合题意。
故填:D。
(3)水电解生成氢气和氧气,反应的化学方程式:,,根据正氧负氢、氧一氢二,气体a体积为气体b的两倍,为氢气,在电源的负极产生。
【点睛】电解水生成氢气和氧气,说明水是由氢元素和氧元素组成的,同时说明在化学变化中分子可分,原子不可分。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.紫甘蓝汁性质稳定,其颜色随pH改变而发生如下变化:
pH ﹤6.5 7.0—7.1 7.5—8.5 8.5—12.0 ﹥12.5
颜色 粉红色 紫色 蓝色 绿色 黄色
下列分析错误的是A.紫甘蓝汁可用作酸碱指示剂
B.将紫甘蓝汁加入到不同碱性溶液中,可能显示出多种颜色
C.与石蕊相比,紫甘蓝汁可更准确检验溶液的酸碱性强弱程度
D.向滴有紫甘蓝汁的氢氧化钠溶液中加入盐酸,若溶液变色则说明一定恰好完全反应
2.推理是学习化学的一种重要方法。下列推理正确的是( )
A.酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应
B.碱都含有氢元素,所以含有氢元素的化合物一定是碱
C.金属元素有正化合价,因此非金属元素一定没有正化合价
D.酸性溶液的PH<7,故PH<7的溶液一定是显酸性的溶液
3.正确实验操作是保证实验成功的因素之一,下列实验操作正确的是
A.量取9.5mL液体 B.给液体加热
C.稀释浓硫酸 D.测溶液pH
4.下列实验操作正确的是
A.量取液体 B.验满气体
C.滴加液体 D.测溶液pH
5.在鸡蛋清中滴入无色酚酞试液显红色,滴入紫色石蕊试液显蓝色,由此可知,鸡蛋清的pH值在pH标准比色卡的区域可能是 ( )
A.A B.B C.C D.D
6.酸碱指示剂可以检测溶液的酸碱性,下列溶液能使紫色石蕊试液变蓝色的是
A.柠檬汁 B.肥皂水 C.白醋 D.稀硫酸
7.有四种溶液:①1%的盐酸;②10%的盐酸;③NaCl的稀溶液;④NaOH的稀溶液。这四种溶液的pH按由小到大的顺序排列,正确的是
A.①<②<③<④ B.②<①<③<④ C.④<③<②<① D.②<①<④<③
8.一些食物的近似pH如表所示,下列说法正确的是
食物 苹果汁 西瓜汁 牛奶 鸡蛋清
pH 2.9 5.8 6.4 7.6
A.牛奶放置一段时间后变酸,pH变大
B.西瓜汁比苹果汁酸性强
C.鸡蛋清和牛奶都显碱性
D.胃酸过多的人应该少饮苹果汁
9.下列是生活中常见物质的pH,其中碱性最强的是
A.厕所清洁剂pH=1 B.食醋pH=3 C.肥皂水pH=10 D.厨房洗涤剂pH=12
10.规范的操作是进行化学实验的保障,下列实验操作不正确的是( )
A.蒸发结晶 B. 检查装置气密性
C. 滴管用毕即插回 D. 测定溶液的 pH
11.下列实验操作正确的是
A.加热液体 B.检测溶液酸度
C.称量氯化钠固体 D.稀释浓硫酸
12.下列图像不能正确反映其对应变化关系的是
A.等质量的铝片、铁片分别置于潮湿的空气中
B.镁在装有空气的密闭容器内燃烧
C.常温下向稀硫酸、硫酸铜混合溶液中滴加NaOH溶液
D.向两份等质量、相同质量分数的稀硫酸中,分别不断加入镁粉和锌粉
二、填空题
13.溶液与人们的生活密切相关。
(1)用井水洗衣服时,肥皂不易起泡沫且产生大量浮渣,该井水是_______(填“硬水”或“软水”)。
(2)洗洁精清洗碗壁上的油污,是利用了洗洁精的_______作用。
(3)雨水会溶解空气里的部分CO2,故正常雨水的pH_______7(填“>”、“<”或“=”)
(4)10%的葡萄糖口服液可用于低血糖症的治疗。配制50g溶质质量分数为10%的葡萄糖溶液,实验步骤为:
①计算:葡萄糖_______g;②称量;③量取;④_______;⑤装瓶贴签。
(5)硝酸钾的溶解度曲线如图1所示。向100g水中加入硝酸钾固体或改变温度,得到相应如图2所示的混合物体系①~⑤。
Ⅰ、①中溶液_______(选填“是”或“不是”)饱和溶液。
Ⅱ、②中溶液的质量为_______g。
Ⅲ、②~③变化过程中,溶剂的质量_______,溶质的质量_______。(填序号)
A.不变 B.变大 C.变小
Ⅳ、⑤中析出晶体的质量为_______g。
14.如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
(1)氢氧化钠和盐酸恰好完全反应时,溶液的pH_______7(选填“大于”、“小于”或“等于”);
(2)根据曲线判断,该反应是将__________(选填“氢氧化钠溶液”或“盐酸”)滴入另一种溶液中,理由是__________________;
(3)当滴入溶液的体积为5mL时,所得溶液中溶质的化学式为___________;
(4)欲中和20g溶质的质量分数为10%的氢氧化钠溶液,需溶质质量分数为18.25%的稀盐酸_______g。
三、推断题
15.A、B、C、D为初中常见的物质.A与B之间发生的化学反应可表示为:“A+B→C+D”.
(1)若C为氯化钠,D为氧化物,且在A溶液中加入铁粉能产生氢气,则A为_____.若A、B两溶液恰好完全反应,则反应后溶液的pH_____7(填“>”或“<”或“=”).
(2)若A和B均为黑色粉末,A与B反应时可观察到黑色粉末变为红色,同时生成能使澄清石灰水变浑浊的无色气体,则A与B反应的化学方程式为_____.
四、实验题
16.(1)云南很多地方都有温泉,小艳同学取某地温泉水样,冷却至室温后进行探究。
①测得温泉水样的pH=7.4,可知该温泉水样呈___________性。
②加入____________后振荡,发现泡沫较少,浮渣较多,说明该温泉水样为硬水。
③小艳同学发现长时间烧煮该温泉水的水壶中有水垢,她用厨房里的__________(填标号 )轻松将水垢除去。
A食盐水 B食醋 C料酒 D蚝油
(2)云南水资源丰富,但分布不均,节约用水,人人有责。下列不属于节水措施的是________(填标号 )。
A使用节水龙头
B洗衣服的水用来冲厕所
C淘米的水用来浇花
D公园草坪用大水漫灌
(3)请根据下列装置图回答问题:
电解水实验的化学方程式为_______________,气体a在电源的___________(填“正”或“负”)极产生。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、由于紫甘蓝汁在酸碱溶液中会显示不同的颜色,可做酸碱指示剂,选项A正确;
B、pH大于7的溶液呈碱性,由表中的信息可知不同pH的碱性溶液甘蓝汁显示的颜色不同,选项B正确;
C、甘蓝汁的变色的范围比紫色石蕊溶液更小,比紫色石蕊溶液更加具体,与石蕊相比,紫甘蓝汁可较准确检验溶液的酸碱性强弱程度,选项C正确;
D、根据表中的信息,氢氧化钠溶液中加入盐酸溶液变色,只是说明溶液的酸碱度发生了改变,但不能说明一定恰好反应,选项D错误。故选D。
2.D
【详解】A.生成盐和水的反应不一定是酸与碱的反应,如氢氧化钠与二氧化碳反应生成碳酸钠和水,反应后有盐与水生成,不是酸与碱的反应,选项错误;
B.含有氢元素的化合物不一定是碱,如水中含有氢元素,水属于氧化物,不属于碱,选项错误;
C.非金属元素不一定没有正化合价,如氢元素在化合物中的化合价为+1价,选项错误;
D. 酸性溶液的PH<7,所以PH<7的溶液一定是显酸性的溶液,选项正确,故选D。
3.B
【详解】A、量取9.5 mL液体应选择10 mL量筒,选用100 mL的量筒会造成较大的误差,A错误;
B、加热液体时,试管内液体体积不能超过试管容积的三分之一,试管夹夹在试管中上部,使用酒精灯外焰加热,并应先预热再集中加热,B正确;
C、稀释浓硫酸时,应将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌,若将水倒入浓硫酸中,由于水的密度较小,水会浮在浓硫酸上面,稀释过程中放出的热量会使水沸腾,导致液滴飞溅,非常危险,C错误;
D、测溶液pH时,应用玻璃棒蘸取(或胶头滴管吸取)少量待测液滴于pH试纸上,将试纸显示的颜色与标准比色卡对照,读出溶液的pH,若直接将pH试纸浸入待测液,会导致待测液被污染,D错误。
故选:B。
4.B
【详解】A、量筒读数时,视线要和凹液面最低处保持水平,故A不符合题意;
B、二氧化碳不支持燃烧,因此将燃着的木条放在瓶口,木条熄灭说明二氧化碳已经收集满,故B符合题意;
C、胶头滴管不能接触试管内壁,故C不符合题意;
D、测定pH时,不能将pH试纸伸入到溶液中,故D不符合题意;
故选B。
【点睛】
5.D
【详解】鸡蛋清中滴入无色酚酞溶液显红色,滴入紫色石蕊溶液显蓝色,说明鸡蛋清显碱性,PH大于7.故选D
6.B
【详解】碱性溶液能使紫色石蕊试剂变蓝色,柠檬汁、白醋、稀硫酸的溶液都呈酸性,肥皂水的溶液呈碱性;
故选B。
7.B
【详解】1%的盐酸的酸性比10%的盐酸的酸性弱,酸性溶液pH小7,pH越小,酸性越强,所以1%的盐酸的pH比10%的盐酸的pH大;
氯化钠溶液呈中性,溶液pH=7 ;
氢氧化钠溶液呈碱性,溶液pH大于7;
所以四种溶液的pH由小到大的顺序是:②<①<③<④,故答案选B.
8.D
【分析】溶液的pH等于7时,呈中性;当溶液的pH大于7时,呈碱性;当溶液的pH小于7时,呈酸性。当溶液的pH小于7时,随着pH的减小酸性增强。
【详解】A、牛奶放置一段时间后变酸,酸性增强,pH变小,故A不正确;
B、西瓜汁的pH值为5.8,苹果汁的pH值为2.9,西瓜汁比苹果汁酸性弱,故B不正确;
C、牛奶的pH值为6.4,小于7,显酸性,鸡蛋清的pH值为7.6,大于7,显碱性,故C不正确;
D、苹果汁的pH值为2.9,显酸性,则胃酸过多的人应该少饮苹果汁,故D正确。故选D。
9.D
【详解】pH <7,溶液呈酸性,且pH越小,酸性越强;pH =7时溶液呈中性;pH>7溶液呈碱性,pH越大,碱性越强。故选D。
10.D
【详解】A、蒸发结晶时,利用玻璃棒搅拌,防止液体受热不均匀发生飞溅,选项A正确;
B、检查装置气密时,先将导管放入烧杯内,然后用手握住试管,利用热胀冷缩原理,观察导管口有气泡冒出,则说明装置气密性良好,选项B正确;
C、试剂瓶专门配制的胶头滴管使用完毕后,立即放回试剂瓶,保证试剂不受污染,选项C正确;
D、测定溶液pH时,用玻璃棒蘸取试液滴加到干燥的pH试纸上,测定溶液pH,不得将试纸伸入溶液中,防止试纸污染溶液,选项D错误。故选D。
11.A
【详解】A、给试管中的液体加热时,液体体积不能超过试管容积的三分之一,用酒精灯的外焰加热,故A正确;
B、用pH试纸检测酸碱度时,用玻璃棒蘸取待测溶液,滴于干燥的pH试纸上,再将此pH试纸与标准比色卡比较,得出溶液pH,绝对不可以把pH试纸放入待测液中,以免污染试剂,故B错误;
C、托盘天平的使用要遵循“左物右码”的原则,图中物质与砝码放反了,故C错误;
D、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的扩散;一定不能把水注入浓硫酸中;如果将水倒入浓硫酸中,水会浮在上面,浓硫酸溶于水放出的热量足可以使水沸腾,会溅出伤人,故D错误;
故选A。
12.D
【详解】A、铝片表面有一层致密的氧化铝薄膜,使得铝片不易生锈,铝单质的质量不变,铁在潮湿的空气中易生锈,铁单质的质量减少,能正确反映其对应变化关系,不符合题意;
B、化学反应前后各种元素的质量不变,故镁在装有空气的密闭容器内燃烧,镁元素的质量不变,能正确反映其对应变化关系,不符合题意;
C、常温下向稀硫酸、硫酸铜混合溶液中滴加NaOH溶液,首先发生的反应为:2NaOH+H2SO4=Na2SO4+2H2O,溶液的酸性减弱,pH值增大,然后发生的反应为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,当恰好反应时,溶液的pH=7,继续滴加NaOH溶液,溶液的碱性增强,溶液的pH>7,能正确反映其对应变化关系,不符合题意;
D、向两份等质量、相同质量分数的稀硫酸中,分别不断加入镁粉和锌粉,最终参加反应的硫酸质量相等,、,等质量的硫酸生成等质量的氢气,不能正确反映其对应变化关系,符合题意。
故选D。
【点睛】图像问题主要是结合化学反应分析图的起点位置、变化趋势、转折点、终点位置是否正确。
13.(1)硬水
(2)乳化
(3)<
(4) 5 溶解
(5) 不是 131.6 A B 18.1
【详解】(1)水取样后加入肥皂水,振荡,产生较多泡沫较少浮渣的是软水,产生较少泡沫较多浮渣的是硬水,故填硬水;
(2)用洗洁精清洗碗上的油污,是利用了洗洁精具有乳化作用,能将大的油滴分散成细小的油滴随水冲走;故填乳化;
(3)二氧化碳能和水反应生成碳酸,碳酸溶液呈酸性,则pH<7,故填<;
(4)溶质质量=溶液质量×溶质质量分数,且天平精度为0.1g,则葡萄糖质量= ,故填5.0;
一定溶质质量分数的溶液配制过程中,称量好溶剂和溶质后需要放在烧杯内溶解,故填溶解;
(5)Ⅰ、由溶解度曲线可知,硝酸钾在20℃时的溶解度为31.6g,即20℃时100g水中最多溶解31.6g硝酸钾即可达到饱和状态。①中100g水中溶解的硝酸钾质量为30g,小于31.6g,故①为不饱和溶液,故填不是;
Ⅱ、②中溶液温度为20℃,该温度下100g水中最多溶解31.6g硝酸钾,此时②中加入了60g硝酸钾,只能溶解31.6g,则②溶液的溶液质量为100g+31.6g=131.6g,故填131.6;
Ⅲ、有溶解度曲线可知,40℃时硝酸钾溶解度增大到45.8g。所以由溶液②升温到溶液③过程中,溶剂水的质量不变,溶知质量增大,故填A;B;
Ⅳ、溶液③中含有溶质质量为60g,溶剂质量为100g,再在该温度下加入3.9g硝酸钾,溶液恰好达到饱和状态。硝酸钾在30℃时的溶解度为45.8g,则④溶液开始降温到30℃时,析出晶体质量为63.9g-45.8g=18.1g,故填18.1。
14. 等于 氢氧化钠溶液 溶液的pH逐渐变大 HCl和NaCl 10
【详解】(1)氢氧化钠和盐酸恰好完全反应时,溶液中只有氯化钠和水,溶液呈中性,pH等于7;
(2)由于曲线的起点溶液的pH小于7说明开始溶液为酸,然后随液体的加入氢氧化钠溶液的pH逐渐变大,最后呈碱性,溶液的pH逐渐变大,最后大于7,可知实验是将氢氧化钠溶液加入盐酸中;
(3)当滴入溶液的体积为5mL时,溶液显酸性,说明所得溶液中溶质为生成的氯化钠和剩余的氯化氢;
(4)设需溶质质量分数为18.25%的稀盐酸的质量为x
x=10g。
15. 盐酸 =
【分析】本题考查物质性质。
【详解】(1)A溶液中加入铁粉能产生氢气,说明A是一种酸;由于A、B反应生成氯化钠和一种氧化物,所以利用质量守恒定律可知,A是盐酸,氧化物为水,B为氢氧化钠;氢氧化钠与盐酸完全反应生成氯化钠和水,恰好完全反应时得到的溶液是氯化钠溶液,为中性溶液,其pH为7;
(2)能使澄清石粒水变浑浊的气体是二氧化碳,两种黑色固体的混合物受热后,变成红色,同时生成能二氧化碳,所以红色固体为铜,根据质量守恒定律,可知黑色固体中有一种为氧化铜,所以另一种黑色固体为碳,即该反应是碳和氧化铜反应生成铜和二氧化碳:
【点睛】结合物质性质推断。
16. 碱 肥皂水 B D 负
【详解】(1)①测得温泉水样的 pH=7.4,可知该温泉水样呈碱性。
②加入肥皂水后振荡,发现泡沫较少,浮渣较多,说明该温泉水样为硬水。
③小艳同学发现长时间烧煮该温泉水的水壶中有水垢,她用厨房里的食醋将水垢除去,这是因为食醋中的醋酸能和水垢中的碳酸钙、氢氧化镁反应。
故填:B。
(2)A.使用节水龙头可以节约用水,不符合题意;
B.洗衣服的水用来冲厕所可以节约用水,不符合题意;
C.淘米的水用来浇花可以节约用水,不符合题意;
D.公园草坪用大水漫灌会浪费水,符合题意。
故填:D。
(3)水电解生成氢气和氧气,反应的化学方程式:,,根据正氧负氢、氧一氢二,气体a体积为气体b的两倍,为氢气,在电源的负极产生。
【点睛】电解水生成氢气和氧气,说明水是由氢元素和氧元素组成的,同时说明在化学变化中分子可分,原子不可分。
答案第1页,共2页
答案第1页,共2页
同课章节目录
