3.1.2弱电解质的电离平衡 课时作业(含解析)
文档属性
| 名称 | 3.1.2弱电解质的电离平衡 课时作业(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 208.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-18 21:32:11 | ||
图片预览



文档简介
3.1.2弱电解质的电离平衡 课时作业
1.已知下面三个数据:7.2×10-4、4.6 ×10-4、4.9×10-10分别是下列有关的三种酸的电离常数(25℃), 若已知下列反应可以发生:NaCN+HNO2= HCN+ NaNO2 NaCN+ HF=HCN + NaF NaNO2+HF=HNO2+NaF。由此可判断下列叙述中不正确的是
A.Ka(HF)= 7.2 ×10-4
B.Ka(HNO2)= 4.9×10-10
C.根据两个反应即可得出一元弱酸的强弱顺序: HF>HNO2>HCN
D.氢氟酸的酸性弱于盐酸
2.下列说法错误的是
A.将0.1mol·L-1的CH3COOH溶液加水稀释,变大
B.向0.1mol·L-1的氨水中通氨气,则NH3·H2O的电离程度增大
C.已知[Cu(H2O)4]2+(蓝色)+4Cl-[CuCl4]2-(黄色)+4H2O,加水,溶液颜色变蓝
D.分别向甲容器(恒温恒容)中充入lmolPCl5,乙容器(绝热恒容)充入PCl3和Cl2各lmol,发生反应PCl5PCl3(g)+Cl2(g)△H>0,平衡时K(甲)3.常温下,向100mL0.1mol·L-1H2S溶液中缓慢通入SO2气体,可发生反应2H2S+SO2=3S↓+2H2O。下列关于该过程的说法错误的是
A.pH先增大后减小,最终保持不变
B.恰好完全反应时,反应消耗112mLSO2(标准状况)
C.的值减小
D.0.1mol·L-1H2S溶液中:c(H+)=c(HS-)+2c(S2-)+c(OH-)
4.下列物质的电离方程式书写正确的是
A.碳酸氢钠:
B.过氧化钠:
C.氯酸钠:
D.次氯酸:
5.下列说法正确的是
A.常温下pH=2的CH3COOH溶液和pH=2的H2SO4溶液,c(CH3COO-)=2c(SO)
B.在相同温度下,pH相等的氨水和NaOH溶液,n(OH-)相等
C.稀释1 mol·L-1的HCl溶液,溶液中的所有离子浓度均下降
D.常温下pH=2的HClO溶液与pH=12的NaOH溶液等体积混合,充分反应后溶液pH>7
6.已知:25℃时,HCOOH的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7、K2=4.7×10-11。下列说法不正确的是( )
A.向Na2CO3溶液中加入甲酸有气泡产生
B.25℃时,向甲酸溶液中加入NaOH溶液,HCOOH的电离程度和K均增大
C.向甲酸溶液中加入蒸馏水,c(H+)减小
D.向碳酸溶液中加入NaHCO3固体,c(H+)减小
7.已知电离平衡常数H2SO3:H2SO3 HSO+H+ K1=1.54×10-2 ,HSO SO+ H+ K2=1.02×10-7; H2CO3:H2CO3 HCO+ H+ K1=4.4×10-7,HCO CO+ H+ K2=4.7×10-11,则溶液中不可以大量共存的离子组是( )
A.HSO、CO B.HSO、HCO
C.SO、HCO D.SO、CO
8.弱电解质在水溶液中的电离过程是一个可逆过程。常温下,下列说法正确的是
A.0.1mol/L醋酸溶液加水稀释,溶液中减小
B.水是极弱的电解质,将金属Na加入水中,水的电离程度减小
C.的醋酸溶液加一定量的盐酸,醋酸的电离平衡不发生移动
D.若电离平衡向正向移动,则弱电解质的电离度一定增大
9.体积相同,pH相等的两种酸HA与HB溶液分别加水稀释,溶液pH随加水体积的关系如图所示。下列说法正确的是
A.HA为强酸,HB为弱
B.a点时两种溶液的浓度
C.加水稀释到pH相同时,加水量
D.两溶液稀释100倍,分别与足量NaOH溶液反应消耗的NaOH溶液体积
10.下列说法错误的是
A.0.1的溶液加适量水稀释后,溶液中变大
B.为了使溶液中接近,可加入适量的固体
C.40℃时,在氨水体系中不断通入随着的通入,不断增大
D.常温下,1L的溶液中水电离出的数目为
11.常温下,在20mL0.lmol/LNa2CO3溶液中逐滴加入40mL0.l mol/L 稀盐酸,溶液中含碳元素各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是
A.曲线a表示H2CO3的变化曲线
B.H2CO3、HCO3-、CO32-可大量共存于同一溶液中
C.pH=11时,c(HCO3-)>c(Cl-)
D.碳酸钠溶液的水解平衡常数为1.0×10-11
12.下列说法不正确的是
A.向CH3COOH溶液中加入少量CH3COONa固体,电离常数不变
B.pH相同的氨水和氢氧化钠加水稀释相同倍数后,c(NH)>c(Na+)
C.同温下,强酸溶液的pH不一定小于弱酸溶液的pH
D.足量的锌分别与等体积等浓度的稀硫酸和醋酸完全反应,在相同条件下产生的氢气体积相同
二、填空题
13.已知在25℃时,亚硝酸、次氯酸和氢硫酸的电离常数分别为:
亚硝酸 Ki=4.6×10 4
次氯酸 Ki=3.0×10 8
氢硫酸 Ki1=9.1×10 8 Ki2=1.1×10 12
①写出氢硫酸的第一级电离平衡常数表达式:K i1=__。
②在相同条件下,试比较H2S、HS 、HClO和HNO2的酸性强弱:__>__>__>__。
③保持温度不变,在氢硫酸溶液中加入少量盐酸,下列量会变小的是__(填序号)。
A.c(S2 ) B.c(H+)
C.氢硫酸电离平衡常数 D.氢硫酸的电离度
14.甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比___________(填“大于”、“等于”或“小于”)10。请说明理由:___________。
三、实验题
15.Ⅰ.碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。
(1)探究不同条件下空气中氧气氧化KI的速率。
组别 温度 KI溶液 H2SO4溶液 蒸馏水 淀粉溶液
c(KI) V c(H2SO4) V
1 298 K 0.1 mol/L 5 mL 0.1 mol/L 5 mL 10 mL 3滴
2 313 K 0.1 mol/L 5 mL 0.1 mol/L 5 mL 10 mL 3滴
3 298 K 0.1 mol/L 10 mL 0.1 mol/L 5 mL 5 mL 3滴
①酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为_______。
②设计实验组别3的目的是_______。
(2)探究反应“2Fe3++2I-=2Fe2++I2”为可逆反应。
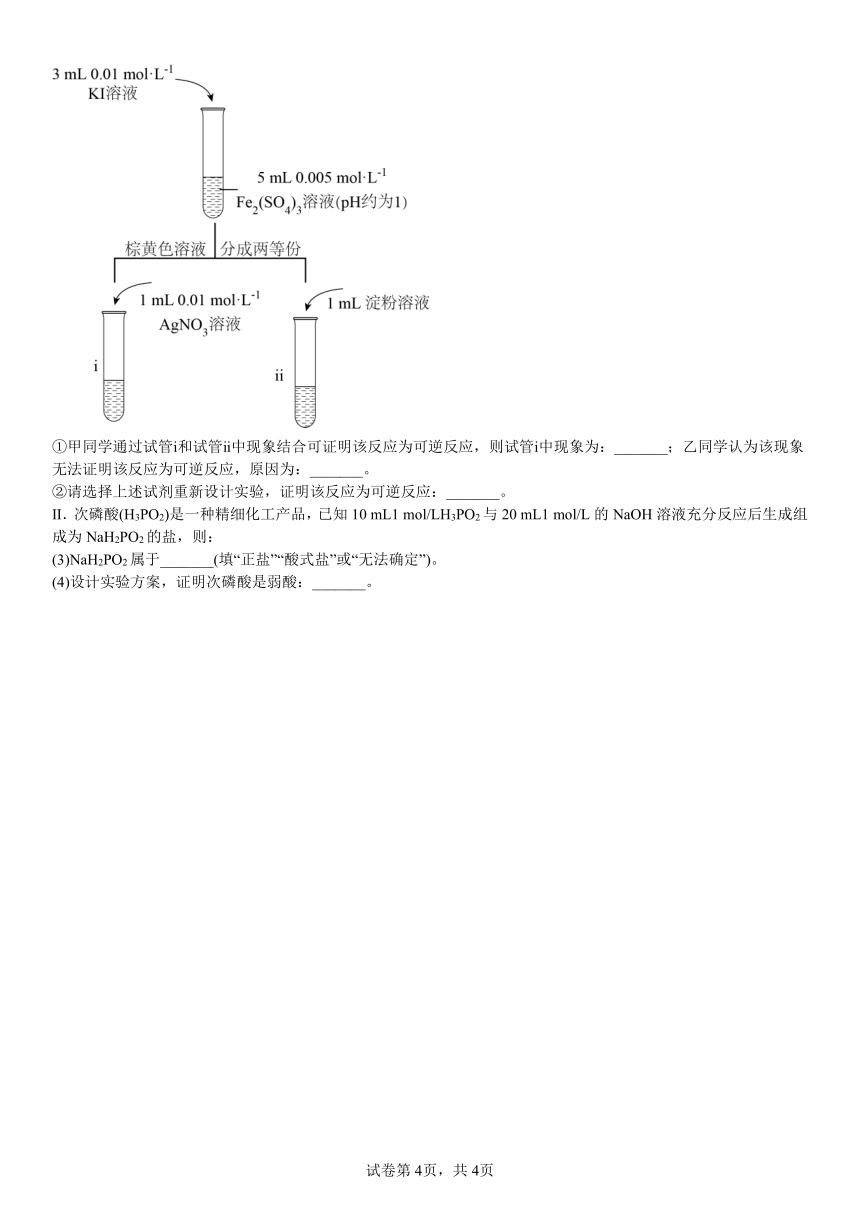
试剂:0.01 mol/LKI溶液,0.005 mol/LFe2(SO4)3溶液,淀粉溶液,0.01 mol/LAgNO3溶液,KSCN溶液。实验如图:
①甲同学通过试管ⅰ和试管ⅱ中现象结合可证明该反应为可逆反应,则试管ⅰ中现象为:_______;乙同学认为该现象无法证明该反应为可逆反应,原因为:_______。
②请选择上述试剂重新设计实验,证明该反应为可逆反应:_______。
Ⅱ.次磷酸(H3PO2)是一种精细化工产品,已知10 mL1 mol/LH3PO2与20 mL1 mol/L的NaOH溶液充分反应后生成组成为NaH2PO2的盐,则:
(3)NaH2PO2属于_______(填“正盐”“酸式盐”或“无法确定”)。
(4)设计实验方案,证明次磷酸是弱酸:_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】在酸与盐的反应中,反应物中酸的酸性大于生成物中酸的酸性,即满足强酸制弱酸的关系;由已知反应:NaCN+HNO2=HCN+NaNO2、NaCN+HF=HCN+NaF、NaNO2+HF=HNO2+NaF,可以得出酸性关系:HF>HNO2>HCN。相同温度下,酸的酸性越强,电离常数越大。
【详解】A.由分析可知,HF的酸性最强,电离常数最大,则K(HF)=7.2×10-4,A项正确;
B.因为酸性HF>HNO2>HCN,所以K(HNO2)= 4.6×10-4,B项错误;
C.由以上分析可知,一元弱酸HF、HNO2、HCN的酸性强弱顺序为HF>HNO2>HCN,C项正确;
D.盐酸的酸性大于氢氟酸,D项正确;
答案选B。
2.B
【详解】A.CH3COOH溶液加水稀释,平衡向正反应方向移动,c(CH3COO-)浓度减小,变大,A正确;
B.向氨水中通入NH3,一水合氨浓度增大,一水合氨的电离程度减小,B错误;
C.加水即增大生成物浓度,平衡逆向移动,[Cu(H2O)4]2+浓度增大,溶液颜色变蓝,C正确;
D.乙容器充入PCl3和Cl2即为PCl3(g)+Cl2(g)PCl5 △H<0,该反应是放热反应,在绝热恒容条件下进行,升温使平衡逆向移动,则平衡时乙容器中PCl3和Cl2浓度大于甲容器,K(甲)故选B。
3.C
【详解】A.随着反应的进行,硫化氢逐渐被消耗,反应中生成单质硫和水,当二氧化硫过量,并达到饱和以后,pH不再发生变化,所以pH先增大后减小,最终保持不变,A正确;
B.硫化氢的物质的量是0.01mol,恰好完全反应时消耗0.005mol二氧化硫,在标况下的体积为0.005mol×22.4L/mol=0.112L=112mLSO2,B正确;
C.,温度不变,平衡常数不变,其值不变,C错误;
D.0.1mol·L-1H2S溶液中依据电荷守恒可知:c(H+)=c(HS-)+2c(S2-)+c(OH-),D正确;
答案选C。
4.D
【详解】A.碳酸氢钠是电解质,在溶液中完全电离出钠离子和碳酸氢根离子,电离方程式为,故A错误;
B.过氧化钠是电解质,在熔融状态下能电离出钠离子和过氧根离子,电离方程式为,故B错误;
C.氯酸钠是电解质,在溶液中完全电离出钠离子和氯酸根离子,电离方程式为,故C错误;
D.次氯酸是一元弱酸,在溶液中部分电离出氢离子和次氯酸根离子,电离方程式为,故D正确;
故选D。
5.A
【详解】A.醋酸溶液中,pH=2,则,pH=2的溶液,,,所以,故A正确;
B.pH相等的氨水和NaOH溶液,氢氧根浓度相同,但是两者体积不一定相等,根据n=cV,故n(OH-)不一定相等,故B错误;
C.酸浓度越大,对水的抑制能力越强,稀释1mol/L盐酸时,溶液中氢离子浓度下降,根据,增加,故C错误;
D.HClO是弱酸,在溶液中不完全电离,pH=2的HClO溶液,其中,pH=2的NaOH溶液,,故两者等体积混合后酸过量,溶液呈酸性,故D错误;
故选A。
6.B
【详解】A.电离常数越大,酸性越强,酸性强的可以制酸性弱的,甲酸的酸性大于碳酸,所以向Na2CO3溶液中加入甲酸会生成二氧化碳气体,故A不符合题意;
B.电离常数只与温度有关,25℃时,向甲酸中加入NaOH溶液,NaOH消耗了氢离子,氢离子浓度减小,HCOOH的电离程度增大,K值只受温度的影响,K不变,故B符合题意;
C.甲酸的稀溶液中加水稀释,促进甲酸的电离,氢离子的物质的量增大,溶液的体积也增大,由于体积增大的多,所以氢离子浓度减小,故C不符合题意;
D.向碳酸溶液中加入NaHCO3固体,NaHCO3电离出的碳酸氢根离子抑制碳酸的电离,溶液中氢离子浓度减小,故D不符合题意;
答案选B。
7.A
【详解】A.H2SO3的K2=1.02×10-7>H2CO3的K2=4.7×10-11,则HSO+ CO= HCO+ SO,A不能大量共存;
B.H2SO3的K1=1.54×10-2>H2CO3的K2=4.7×10-11,HCO和HSO不能反应生成H2SO3,H2CO3的K1=4.4×10-7>H2SO3的K2=1.02×10-7,HCO和HSO不能反应生成H2CO3,B能大量共存;
C.H2SO3的K2=1.02×10-7>H2CO3的K2,SO和HCO不能反应生成HSO,C能大量共存;
D.SO和CO不能反应,D能大量共存。
答案选A。
8.C
【详解】A.0.1mol/L醋酸溶液加水稀释,促进醋酸的电离平衡向正向移动,则溶液中氢离子个数增多,醋酸个数减小,,其值会增大,A错误;
B.将金属Na加入水中,消耗水电离的氢离子,使水的电离程度增大,B错误;
C.的醋酸溶液加一定量的盐酸,氢离子浓度保持不变,醋酸电离平衡不发生移动,C正确;
D.若增大弱电解质的浓度,其电离平衡向正向移动,但弱电解质的电离度减小,D错误;
故选C。
9.B
【详解】A.pH相同的一元酸稀释相同的倍数,pH值变化大的酸酸性较强,根据图知,pH相同的不同一元弱酸稀释相同的倍数,HA的pH值变化较大,则酸性:HA>HB,由于没有具体数据,不能说明HA为强酸,故A错误;
B.酸的酸性越强,其相对应的酸根离子水解程度越小,根据A知,酸性HA>HB,a点pH相同,则,故B正确;
C.pH相同的一元弱酸加水稀释到pH相同时,加水稀释促进弱酸电离,则较弱的酸加入水的体积较大,根据A知,酸性HA>HB,则要使稀释后pH相等,则HA加入的酸较少,即,故C错误;
D.由于起点,则与NaOH溶液反应消耗的NaOH溶液体积,故D错误;
故选:B。
10.C
【详解】A.溶液加水稀释,结合越稀越水解,加水稀释后,水解程度增大,增大、减小,溶液中,数值增大,选项A正确;
B.溶液中由于发生水解:,使得大于2,加入,增大,抑制的水解,可使比值接近,选项B正确;
C.,温度不变,不变,但通入的会消耗溶液中的,使氨水的电离平衡正向移动,不断增大,则比值不断减小,选项C错误;
D.常温下的溶液中,且全部来自水的电离,所以1L的溶液中水电离出的数目为,选项D正确。
答案选C。
11.C
【分析】随着酸液的加入,含碳组分a逐渐减少,含碳组分b逐渐增多,此时发生反应,则a代表碳酸根离子,b代表碳酸氢根离子,c为碳酸分子。
【详解】A. 根据分析,a代表碳酸根离子,c为碳酸分子,A错误;
B. H2CO3和CO32-会发生反应,无法大量共存,B错误;
C. 当不考虑盐类水解时,需要以2:1的比例向碳酸钠中加入盐酸,会实现,此时,但是由于存在盐类水解,且碳酸根离子的水解能力特别强,故不需要加入那么多盐酸即可实现,此时,C正确;
D. 碳酸钠溶液的水解平衡常数的计算公式为,可选取图象中pH=11的点,此时,故,故D错误;
故答案选C。
12.D
【详解】A.电离常数只受温度的影响,温度不变,则电离常数不变,向CH3COOH溶液中加入少量CH3COONa固体,电离常数不变,故A正确;
B.pH相同的氨水和氢氧化钠加水稀释相同倍数后,强碱溶液的pH变化大,稀释时促进一水合氨的电离,则c(NH)>c(Na+),故B正确;
C.溶液的pH和酸性强弱无必然关系,还和溶液的浓度和酸是几元酸有关,故强酸溶液的pH不一定小于弱酸溶液的pH,故C正确;
D.等体积等浓度的稀硫酸和醋酸,酸的物质的量相同,溶液中氢离子物质的量不同,Zn足量时生成氢气不同,故D错误。
故选:D。
13. Ki1= HNO2 H2S HClO HS AD
【分析】注意③,温度不变,说明氢硫酸的电离常数不变,根据氢硫酸的电离平衡:H2S H++HS 、HS H++S2 ,进行分析。
【详解】①氢硫酸的第一步电离方程式为:H2S H++HS ,其第一级电离平衡常数表达式为:Ki1=。答案为:Ki1=;
②根据弱酸的电离平衡常数越大,弱酸的电离程度就越大,溶液浓度相同时c(H+)越大,弱酸的酸性越强,可知,H2S、HS 、HClO和HNO2的酸性强弱为:HNO2>H2S>HClO>HS ;答案为:HNO2;H2S;HClO;HS ;
③A.在氢硫酸溶液中加入少量盐酸,c(H+)增大,电离平衡:HS H++S2 向逆反应方向移动。c(S2 )减小,A项正确;
B.在氢硫酸溶液中加入少量盐酸,c(H+)增大,B项错误;
C.电离常数只随温度变化而变化,温度不变,电离常数也不变,C项错误;
D.在氢硫酸溶液中加入少量盐酸,c(H+)增大,抑制了H2S的电离,氢硫酸的电离度减小,D项正确;
答案选AD。
14. 小于 NH3·H2O是弱碱,溶液越稀,NH3·H2O的电离程度越大
【详解】NH3·H2O是弱碱,1 mol·L-1的NH3·H2O加水稀释10倍,浓度变为0.1 mol·L-1;若不考虑NH3·H2ONH+OH-平衡移动,c(OH-)浓度变为原来的;加水稀释,电离平衡NH3·H2ONH+OH-右移,所以甲、乙两瓶氨水中c(OH-)之比小于10。
15.(1) 4I-+4H++O2=2I2+2H2O 对照实验
(2) 产生黄色沉淀 含有I2的溶液中加入AgNO3溶液也能产生黄色沉淀 向5 mL(过量)0.01 mol/LKI溶液中加入3 mL(少量) Fe2(SO4)3溶液,再向其中加入KSCN溶液,溶液变红色,说明含有过量I-的溶液中存在Fe3+,即可证明反应为可逆反应。
(3)正盐
(4)测定NaH2PO2溶液的pH,若溶液pH>7,则证明H3PO2是弱酸。
【分析】有离子参加的氧化还原反应中要同时符合电子守恒、电荷守恒及原子守恒,据此书写反应的离子方程式。要探究外界条件对化学反应的影响应该采用控制变量方法研究。只有可逆反应才能建立化学平衡,故要想证明化学平衡“2Fe3++2I-2Fe2++I2”的存在,即需证明此反应为可逆反应,不能进行彻底。可以通过检验不足量的物质微粒在反应后的溶液中存在即可。弱酸在溶液中存在电离平衡,其电离产生的离子浓度小于酸的浓度;或根据生成的钠盐溶液的酸碱性判断酸为弱酸。
【详解】(1)①在酸性条件下KI能被空气中氧气氧化产生I2,O2得到电子被还原产生H2O,发生反应的离子方程式为:4I-+4H++O2=2I2+2H2O;
②采用对照方法进行实验时应该只改变一个外界条件。实验1、2是探究温度对化学反应速率的影响;实验1、3是探究浓度对化学反应速率的影响,故设计实验组别3的目的是作对照实验,便于比较;
(2)若反应“2Fe3++2I-=2Fe2++I2”为可逆反应,由于溶液混合时加入3 mL0.01 mol/LKI溶液和5 mL0.005 mol/LFe2(SO4)3溶液,二者发生反应:2Fe3++2I-=2Fe2++I2的物质的量的比是1:1。可知Fe3+过量,反应后溶液中含有I2及过量Fe3+。向试管i中加入AgNO3溶液时,I2与水反应产生HI、HIO,HI电离产生H+、I-,使溶液中含有少量I-,Ag+与I-反应产生AgI沉淀,故看到试管i中现象是:产生黄色沉淀;试管ii中I2与淀粉溶液反应使溶液变为蓝色,由于I2与水反应会产生I-,Ag+与I-反应产生AgI沉淀因此乙同学认为不能通过上述实验证明通过2Fe3++2I-=2Fe2++I2”为可逆反应;
②利用上述试剂要证明反应为可逆反应,可以是使溶液中KI过量,通过滴加KSCN溶液溶液变为红色,通过检验Fe3+来确定,实验操作可以是:向5 mL(过量)0.01 mol/LKI溶液中加入3 mL(少量) 0.005 mol/L Fe2(SO4)3溶液,再向其中加入KSCN溶液,溶液变红色,说明含有过量I-的溶液中存在Fe3+,即可证明反应为可逆反应。
(3)10 mL1 mol/LH3PO2与20 mL1 mol/L的NaOH溶液充分反应生成盐NaH2PO2,由于酸、碱混合物质的量的比是1:2,碱过量,若反应后生成组成为NaH2PO2的盐属于酸式盐,在碱性环境中不能存在,因此反应生成的NaH2PO2属于正盐;
(4)要证明次磷酸是弱酸,进行的实验方案可以是:通过测定NaH2PO2溶液的pH,若溶液pH>7,则证明NaH2PO2是强碱弱酸盐,水解消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),使溶液显碱性,因此可证明H3PO2是弱酸。
答案第1页,共2页
答案第1页,共2页
1.已知下面三个数据:7.2×10-4、4.6 ×10-4、4.9×10-10分别是下列有关的三种酸的电离常数(25℃), 若已知下列反应可以发生:NaCN+HNO2= HCN+ NaNO2 NaCN+ HF=HCN + NaF NaNO2+HF=HNO2+NaF。由此可判断下列叙述中不正确的是
A.Ka(HF)= 7.2 ×10-4
B.Ka(HNO2)= 4.9×10-10
C.根据两个反应即可得出一元弱酸的强弱顺序: HF>HNO2>HCN
D.氢氟酸的酸性弱于盐酸
2.下列说法错误的是
A.将0.1mol·L-1的CH3COOH溶液加水稀释,变大
B.向0.1mol·L-1的氨水中通氨气,则NH3·H2O的电离程度增大
C.已知[Cu(H2O)4]2+(蓝色)+4Cl-[CuCl4]2-(黄色)+4H2O,加水,溶液颜色变蓝
D.分别向甲容器(恒温恒容)中充入lmolPCl5,乙容器(绝热恒容)充入PCl3和Cl2各lmol,发生反应PCl5PCl3(g)+Cl2(g)△H>0,平衡时K(甲)
A.pH先增大后减小,最终保持不变
B.恰好完全反应时,反应消耗112mLSO2(标准状况)
C.的值减小
D.0.1mol·L-1H2S溶液中:c(H+)=c(HS-)+2c(S2-)+c(OH-)
4.下列物质的电离方程式书写正确的是
A.碳酸氢钠:
B.过氧化钠:
C.氯酸钠:
D.次氯酸:
5.下列说法正确的是
A.常温下pH=2的CH3COOH溶液和pH=2的H2SO4溶液,c(CH3COO-)=2c(SO)
B.在相同温度下,pH相等的氨水和NaOH溶液,n(OH-)相等
C.稀释1 mol·L-1的HCl溶液,溶液中的所有离子浓度均下降
D.常温下pH=2的HClO溶液与pH=12的NaOH溶液等体积混合,充分反应后溶液pH>7
6.已知:25℃时,HCOOH的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7、K2=4.7×10-11。下列说法不正确的是( )
A.向Na2CO3溶液中加入甲酸有气泡产生
B.25℃时,向甲酸溶液中加入NaOH溶液,HCOOH的电离程度和K均增大
C.向甲酸溶液中加入蒸馏水,c(H+)减小
D.向碳酸溶液中加入NaHCO3固体,c(H+)减小
7.已知电离平衡常数H2SO3:H2SO3 HSO+H+ K1=1.54×10-2 ,HSO SO+ H+ K2=1.02×10-7; H2CO3:H2CO3 HCO+ H+ K1=4.4×10-7,HCO CO+ H+ K2=4.7×10-11,则溶液中不可以大量共存的离子组是( )
A.HSO、CO B.HSO、HCO
C.SO、HCO D.SO、CO
8.弱电解质在水溶液中的电离过程是一个可逆过程。常温下,下列说法正确的是
A.0.1mol/L醋酸溶液加水稀释,溶液中减小
B.水是极弱的电解质,将金属Na加入水中,水的电离程度减小
C.的醋酸溶液加一定量的盐酸,醋酸的电离平衡不发生移动
D.若电离平衡向正向移动,则弱电解质的电离度一定增大
9.体积相同,pH相等的两种酸HA与HB溶液分别加水稀释,溶液pH随加水体积的关系如图所示。下列说法正确的是
A.HA为强酸,HB为弱
B.a点时两种溶液的浓度
C.加水稀释到pH相同时,加水量
D.两溶液稀释100倍,分别与足量NaOH溶液反应消耗的NaOH溶液体积
10.下列说法错误的是
A.0.1的溶液加适量水稀释后,溶液中变大
B.为了使溶液中接近,可加入适量的固体
C.40℃时,在氨水体系中不断通入随着的通入,不断增大
D.常温下,1L的溶液中水电离出的数目为
11.常温下,在20mL0.lmol/LNa2CO3溶液中逐滴加入40mL0.l mol/L 稀盐酸,溶液中含碳元素各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是
A.曲线a表示H2CO3的变化曲线
B.H2CO3、HCO3-、CO32-可大量共存于同一溶液中
C.pH=11时,c(HCO3-)>c(Cl-)
D.碳酸钠溶液的水解平衡常数为1.0×10-11
12.下列说法不正确的是
A.向CH3COOH溶液中加入少量CH3COONa固体,电离常数不变
B.pH相同的氨水和氢氧化钠加水稀释相同倍数后,c(NH)>c(Na+)
C.同温下,强酸溶液的pH不一定小于弱酸溶液的pH
D.足量的锌分别与等体积等浓度的稀硫酸和醋酸完全反应,在相同条件下产生的氢气体积相同
二、填空题
13.已知在25℃时,亚硝酸、次氯酸和氢硫酸的电离常数分别为:
亚硝酸 Ki=4.6×10 4
次氯酸 Ki=3.0×10 8
氢硫酸 Ki1=9.1×10 8 Ki2=1.1×10 12
①写出氢硫酸的第一级电离平衡常数表达式:K i1=__。
②在相同条件下,试比较H2S、HS 、HClO和HNO2的酸性强弱:__>__>__>__。
③保持温度不变,在氢硫酸溶液中加入少量盐酸,下列量会变小的是__(填序号)。
A.c(S2 ) B.c(H+)
C.氢硫酸电离平衡常数 D.氢硫酸的电离度
14.甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比___________(填“大于”、“等于”或“小于”)10。请说明理由:___________。
三、实验题
15.Ⅰ.碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。
(1)探究不同条件下空气中氧气氧化KI的速率。
组别 温度 KI溶液 H2SO4溶液 蒸馏水 淀粉溶液
c(KI) V c(H2SO4) V
1 298 K 0.1 mol/L 5 mL 0.1 mol/L 5 mL 10 mL 3滴
2 313 K 0.1 mol/L 5 mL 0.1 mol/L 5 mL 10 mL 3滴
3 298 K 0.1 mol/L 10 mL 0.1 mol/L 5 mL 5 mL 3滴
①酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为_______。
②设计实验组别3的目的是_______。
(2)探究反应“2Fe3++2I-=2Fe2++I2”为可逆反应。
试剂:0.01 mol/LKI溶液,0.005 mol/LFe2(SO4)3溶液,淀粉溶液,0.01 mol/LAgNO3溶液,KSCN溶液。实验如图:
①甲同学通过试管ⅰ和试管ⅱ中现象结合可证明该反应为可逆反应,则试管ⅰ中现象为:_______;乙同学认为该现象无法证明该反应为可逆反应,原因为:_______。
②请选择上述试剂重新设计实验,证明该反应为可逆反应:_______。
Ⅱ.次磷酸(H3PO2)是一种精细化工产品,已知10 mL1 mol/LH3PO2与20 mL1 mol/L的NaOH溶液充分反应后生成组成为NaH2PO2的盐,则:
(3)NaH2PO2属于_______(填“正盐”“酸式盐”或“无法确定”)。
(4)设计实验方案,证明次磷酸是弱酸:_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】在酸与盐的反应中,反应物中酸的酸性大于生成物中酸的酸性,即满足强酸制弱酸的关系;由已知反应:NaCN+HNO2=HCN+NaNO2、NaCN+HF=HCN+NaF、NaNO2+HF=HNO2+NaF,可以得出酸性关系:HF>HNO2>HCN。相同温度下,酸的酸性越强,电离常数越大。
【详解】A.由分析可知,HF的酸性最强,电离常数最大,则K(HF)=7.2×10-4,A项正确;
B.因为酸性HF>HNO2>HCN,所以K(HNO2)= 4.6×10-4,B项错误;
C.由以上分析可知,一元弱酸HF、HNO2、HCN的酸性强弱顺序为HF>HNO2>HCN,C项正确;
D.盐酸的酸性大于氢氟酸,D项正确;
答案选B。
2.B
【详解】A.CH3COOH溶液加水稀释,平衡向正反应方向移动,c(CH3COO-)浓度减小,变大,A正确;
B.向氨水中通入NH3,一水合氨浓度增大,一水合氨的电离程度减小,B错误;
C.加水即增大生成物浓度,平衡逆向移动,[Cu(H2O)4]2+浓度增大,溶液颜色变蓝,C正确;
D.乙容器充入PCl3和Cl2即为PCl3(g)+Cl2(g)PCl5 △H<0,该反应是放热反应,在绝热恒容条件下进行,升温使平衡逆向移动,则平衡时乙容器中PCl3和Cl2浓度大于甲容器,K(甲)
3.C
【详解】A.随着反应的进行,硫化氢逐渐被消耗,反应中生成单质硫和水,当二氧化硫过量,并达到饱和以后,pH不再发生变化,所以pH先增大后减小,最终保持不变,A正确;
B.硫化氢的物质的量是0.01mol,恰好完全反应时消耗0.005mol二氧化硫,在标况下的体积为0.005mol×22.4L/mol=0.112L=112mLSO2,B正确;
C.,温度不变,平衡常数不变,其值不变,C错误;
D.0.1mol·L-1H2S溶液中依据电荷守恒可知:c(H+)=c(HS-)+2c(S2-)+c(OH-),D正确;
答案选C。
4.D
【详解】A.碳酸氢钠是电解质,在溶液中完全电离出钠离子和碳酸氢根离子,电离方程式为,故A错误;
B.过氧化钠是电解质,在熔融状态下能电离出钠离子和过氧根离子,电离方程式为,故B错误;
C.氯酸钠是电解质,在溶液中完全电离出钠离子和氯酸根离子,电离方程式为,故C错误;
D.次氯酸是一元弱酸,在溶液中部分电离出氢离子和次氯酸根离子,电离方程式为,故D正确;
故选D。
5.A
【详解】A.醋酸溶液中,pH=2,则,pH=2的溶液,,,所以,故A正确;
B.pH相等的氨水和NaOH溶液,氢氧根浓度相同,但是两者体积不一定相等,根据n=cV,故n(OH-)不一定相等,故B错误;
C.酸浓度越大,对水的抑制能力越强,稀释1mol/L盐酸时,溶液中氢离子浓度下降,根据,增加,故C错误;
D.HClO是弱酸,在溶液中不完全电离,pH=2的HClO溶液,其中,pH=2的NaOH溶液,,故两者等体积混合后酸过量,溶液呈酸性,故D错误;
故选A。
6.B
【详解】A.电离常数越大,酸性越强,酸性强的可以制酸性弱的,甲酸的酸性大于碳酸,所以向Na2CO3溶液中加入甲酸会生成二氧化碳气体,故A不符合题意;
B.电离常数只与温度有关,25℃时,向甲酸中加入NaOH溶液,NaOH消耗了氢离子,氢离子浓度减小,HCOOH的电离程度增大,K值只受温度的影响,K不变,故B符合题意;
C.甲酸的稀溶液中加水稀释,促进甲酸的电离,氢离子的物质的量增大,溶液的体积也增大,由于体积增大的多,所以氢离子浓度减小,故C不符合题意;
D.向碳酸溶液中加入NaHCO3固体,NaHCO3电离出的碳酸氢根离子抑制碳酸的电离,溶液中氢离子浓度减小,故D不符合题意;
答案选B。
7.A
【详解】A.H2SO3的K2=1.02×10-7>H2CO3的K2=4.7×10-11,则HSO+ CO= HCO+ SO,A不能大量共存;
B.H2SO3的K1=1.54×10-2>H2CO3的K2=4.7×10-11,HCO和HSO不能反应生成H2SO3,H2CO3的K1=4.4×10-7>H2SO3的K2=1.02×10-7,HCO和HSO不能反应生成H2CO3,B能大量共存;
C.H2SO3的K2=1.02×10-7>H2CO3的K2,SO和HCO不能反应生成HSO,C能大量共存;
D.SO和CO不能反应,D能大量共存。
答案选A。
8.C
【详解】A.0.1mol/L醋酸溶液加水稀释,促进醋酸的电离平衡向正向移动,则溶液中氢离子个数增多,醋酸个数减小,,其值会增大,A错误;
B.将金属Na加入水中,消耗水电离的氢离子,使水的电离程度增大,B错误;
C.的醋酸溶液加一定量的盐酸,氢离子浓度保持不变,醋酸电离平衡不发生移动,C正确;
D.若增大弱电解质的浓度,其电离平衡向正向移动,但弱电解质的电离度减小,D错误;
故选C。
9.B
【详解】A.pH相同的一元酸稀释相同的倍数,pH值变化大的酸酸性较强,根据图知,pH相同的不同一元弱酸稀释相同的倍数,HA的pH值变化较大,则酸性:HA>HB,由于没有具体数据,不能说明HA为强酸,故A错误;
B.酸的酸性越强,其相对应的酸根离子水解程度越小,根据A知,酸性HA>HB,a点pH相同,则,故B正确;
C.pH相同的一元弱酸加水稀释到pH相同时,加水稀释促进弱酸电离,则较弱的酸加入水的体积较大,根据A知,酸性HA>HB,则要使稀释后pH相等,则HA加入的酸较少,即,故C错误;
D.由于起点,则与NaOH溶液反应消耗的NaOH溶液体积,故D错误;
故选:B。
10.C
【详解】A.溶液加水稀释,结合越稀越水解,加水稀释后,水解程度增大,增大、减小,溶液中,数值增大,选项A正确;
B.溶液中由于发生水解:,使得大于2,加入,增大,抑制的水解,可使比值接近,选项B正确;
C.,温度不变,不变,但通入的会消耗溶液中的,使氨水的电离平衡正向移动,不断增大,则比值不断减小,选项C错误;
D.常温下的溶液中,且全部来自水的电离,所以1L的溶液中水电离出的数目为,选项D正确。
答案选C。
11.C
【分析】随着酸液的加入,含碳组分a逐渐减少,含碳组分b逐渐增多,此时发生反应,则a代表碳酸根离子,b代表碳酸氢根离子,c为碳酸分子。
【详解】A. 根据分析,a代表碳酸根离子,c为碳酸分子,A错误;
B. H2CO3和CO32-会发生反应,无法大量共存,B错误;
C. 当不考虑盐类水解时,需要以2:1的比例向碳酸钠中加入盐酸,会实现,此时,但是由于存在盐类水解,且碳酸根离子的水解能力特别强,故不需要加入那么多盐酸即可实现,此时,C正确;
D. 碳酸钠溶液的水解平衡常数的计算公式为,可选取图象中pH=11的点,此时,故,故D错误;
故答案选C。
12.D
【详解】A.电离常数只受温度的影响,温度不变,则电离常数不变,向CH3COOH溶液中加入少量CH3COONa固体,电离常数不变,故A正确;
B.pH相同的氨水和氢氧化钠加水稀释相同倍数后,强碱溶液的pH变化大,稀释时促进一水合氨的电离,则c(NH)>c(Na+),故B正确;
C.溶液的pH和酸性强弱无必然关系,还和溶液的浓度和酸是几元酸有关,故强酸溶液的pH不一定小于弱酸溶液的pH,故C正确;
D.等体积等浓度的稀硫酸和醋酸,酸的物质的量相同,溶液中氢离子物质的量不同,Zn足量时生成氢气不同,故D错误。
故选:D。
13. Ki1= HNO2 H2S HClO HS AD
【分析】注意③,温度不变,说明氢硫酸的电离常数不变,根据氢硫酸的电离平衡:H2S H++HS 、HS H++S2 ,进行分析。
【详解】①氢硫酸的第一步电离方程式为:H2S H++HS ,其第一级电离平衡常数表达式为:Ki1=。答案为:Ki1=;
②根据弱酸的电离平衡常数越大,弱酸的电离程度就越大,溶液浓度相同时c(H+)越大,弱酸的酸性越强,可知,H2S、HS 、HClO和HNO2的酸性强弱为:HNO2>H2S>HClO>HS ;答案为:HNO2;H2S;HClO;HS ;
③A.在氢硫酸溶液中加入少量盐酸,c(H+)增大,电离平衡:HS H++S2 向逆反应方向移动。c(S2 )减小,A项正确;
B.在氢硫酸溶液中加入少量盐酸,c(H+)增大,B项错误;
C.电离常数只随温度变化而变化,温度不变,电离常数也不变,C项错误;
D.在氢硫酸溶液中加入少量盐酸,c(H+)增大,抑制了H2S的电离,氢硫酸的电离度减小,D项正确;
答案选AD。
14. 小于 NH3·H2O是弱碱,溶液越稀,NH3·H2O的电离程度越大
【详解】NH3·H2O是弱碱,1 mol·L-1的NH3·H2O加水稀释10倍,浓度变为0.1 mol·L-1;若不考虑NH3·H2ONH+OH-平衡移动,c(OH-)浓度变为原来的;加水稀释,电离平衡NH3·H2ONH+OH-右移,所以甲、乙两瓶氨水中c(OH-)之比小于10。
15.(1) 4I-+4H++O2=2I2+2H2O 对照实验
(2) 产生黄色沉淀 含有I2的溶液中加入AgNO3溶液也能产生黄色沉淀 向5 mL(过量)0.01 mol/LKI溶液中加入3 mL(少量) Fe2(SO4)3溶液,再向其中加入KSCN溶液,溶液变红色,说明含有过量I-的溶液中存在Fe3+,即可证明反应为可逆反应。
(3)正盐
(4)测定NaH2PO2溶液的pH,若溶液pH>7,则证明H3PO2是弱酸。
【分析】有离子参加的氧化还原反应中要同时符合电子守恒、电荷守恒及原子守恒,据此书写反应的离子方程式。要探究外界条件对化学反应的影响应该采用控制变量方法研究。只有可逆反应才能建立化学平衡,故要想证明化学平衡“2Fe3++2I-2Fe2++I2”的存在,即需证明此反应为可逆反应,不能进行彻底。可以通过检验不足量的物质微粒在反应后的溶液中存在即可。弱酸在溶液中存在电离平衡,其电离产生的离子浓度小于酸的浓度;或根据生成的钠盐溶液的酸碱性判断酸为弱酸。
【详解】(1)①在酸性条件下KI能被空气中氧气氧化产生I2,O2得到电子被还原产生H2O,发生反应的离子方程式为:4I-+4H++O2=2I2+2H2O;
②采用对照方法进行实验时应该只改变一个外界条件。实验1、2是探究温度对化学反应速率的影响;实验1、3是探究浓度对化学反应速率的影响,故设计实验组别3的目的是作对照实验,便于比较;
(2)若反应“2Fe3++2I-=2Fe2++I2”为可逆反应,由于溶液混合时加入3 mL0.01 mol/LKI溶液和5 mL0.005 mol/LFe2(SO4)3溶液,二者发生反应:2Fe3++2I-=2Fe2++I2的物质的量的比是1:1。可知Fe3+过量,反应后溶液中含有I2及过量Fe3+。向试管i中加入AgNO3溶液时,I2与水反应产生HI、HIO,HI电离产生H+、I-,使溶液中含有少量I-,Ag+与I-反应产生AgI沉淀,故看到试管i中现象是:产生黄色沉淀;试管ii中I2与淀粉溶液反应使溶液变为蓝色,由于I2与水反应会产生I-,Ag+与I-反应产生AgI沉淀因此乙同学认为不能通过上述实验证明通过2Fe3++2I-=2Fe2++I2”为可逆反应;
②利用上述试剂要证明反应为可逆反应,可以是使溶液中KI过量,通过滴加KSCN溶液溶液变为红色,通过检验Fe3+来确定,实验操作可以是:向5 mL(过量)0.01 mol/LKI溶液中加入3 mL(少量) 0.005 mol/L Fe2(SO4)3溶液,再向其中加入KSCN溶液,溶液变红色,说明含有过量I-的溶液中存在Fe3+,即可证明反应为可逆反应。
(3)10 mL1 mol/LH3PO2与20 mL1 mol/L的NaOH溶液充分反应生成盐NaH2PO2,由于酸、碱混合物质的量的比是1:2,碱过量,若反应后生成组成为NaH2PO2的盐属于酸式盐,在碱性环境中不能存在,因此反应生成的NaH2PO2属于正盐;
(4)要证明次磷酸是弱酸,进行的实验方案可以是:通过测定NaH2PO2溶液的pH,若溶液pH>7,则证明NaH2PO2是强碱弱酸盐,水解消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),使溶液显碱性,因此可证明H3PO2是弱酸。
答案第1页,共2页
答案第1页,共2页
