3.1.3电离平衡常数 课时作业(含解析)
文档属性
| 名称 | 3.1.3电离平衡常数 课时作业(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 574.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-18 21:32:35 | ||
图片预览




文档简介
3.1.3电离平衡常数 课时作业
一、单选题
1.将HF溶液加水稀释后,下列说法中不正确的是
A.HF的电离程度增大 B.溶液的pH值增大
C.c(OH-)增大 D.HF的电离常数增大
2.易溶于水,光谱研究表明,的水溶液中存在下列平衡:
其中、、为各步的平衡常数,且 [表示的平衡压强]
下列说法正确的是
A.的焓变
B.在水中的溶解度(以物质的量浓度表示)为c,则
C.若pH=6.2时,溶液中,则pH=8.2时,溶液中
D.当的平衡压强为p时,测得,则溶液
3.已知电离常数:,氧化性:。下列有关叙述中正确的是
A.向溶液中滴加少量氯水,反应的离子方程式为:
B.向溶液中通入少量的离子方程式:
C.向溴水中加入足量氯化亚铁溶液,混合溶液变为无色
D.溶液,加水稀释,将变小
4.在相同温度下,100mL0.01mol L-1的醋酸溶液与10mL0.1mol L-1的醋酸溶液分别与足量的锌粉反应,下列说法正确的是
A.电离程度:前者>后者 B.两者的电离常数:前者>后者
C.两者产生的氢气体积:前者<后者 D.开始反应时的速率:前者>后者
5.甲胺(CH3NH2)与盐酸反应生成甲胺盐酸盐(CH3NH3Cl)。25℃时,向一定体积0.01mol·L-1CH3NH2水溶液(对应图中M点)中缓慢通入HCl气体,溶液的pH与pOH[pOH=-lgc(OH-)的关系如图所示。下列叙述不正确的是
A.图中a=2.7,b=7
B.该过程中,增大
C.Q点溶液中溶质为CH3NH3Cl和CH3NH2
D.N点溶液中:c()=c(Cl-)
6.室温下,将1.0 mol·L-1盐酸滴入20 mL 1.0 mol·L-1氨水中,溶液pH随加入盐酸体积变化的曲线如图所示。下列有关说法正确的是
A.c()+c(NH3·H2O)=c(Cl-)时,V(盐酸)=20 mL
B.V1>20 mL,此时水的电离程度最大
C.a点,pH=14
D.c点可能存在c()>c(Cl-)>c(H+)
7.下表是几种弱酸常温下的电离平衡常数:
CH3COOH H2CO3 H2S H3PO4
1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 K1=9.1×10-8 K2=1.1×10-12 K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13
则下列说法中不正确的是A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸,减小
D.向弱酸溶液中加少量溶液,电离平衡常数不变
8.已知常温下碳酸、亚硫酸、次氯酸的电离常数如表所示。
下列说法正确的是A.常温下,相同浓度的溶液和溶液的酸性,后者更强
B.向溶液中通入少量
C.向溶液中通入少量
D.向氯水中分别加入等浓度的溶液和溶液,均可提高氯水中的浓度
9.25℃时,将0.10mol·L-1HA溶液逐滴滴加到10mL等浓度的KOH溶液中,lg与溶液pH的关系如图所示。下列相关结论正确的是
A.lgKa(HA)=lg+pH
B.P点存在:c(A-)-c(K+)=(10-6-10-8)mol·L-1
C.pH=7时,加入的HA溶液的体积小于10mL
D.pH=12时,c(K+)>c(OH-)>c(HA)>c(A-)>c(H+)
10.部分弱酸的电离平衡常数如下表,下列选项不正确的是
弱酸 HCOOH HCN H2CO3
电离平衡常数(25℃)
A.
B.
C.
D.
11.向0.1mol/L的CH3COOH溶液中加水或加入少量CH3COONa晶体时,下列有关叙述不正确的是
A.都能使溶液的pH增大
B.都能使溶液中c(H+)·c(CH3COO-)增大
C.溶液中c(H+)·c(OH-)不变
D.都能使溶液中增大
12.已知某温度下有如下三个反应:NaNO2+HF=NaF+HNO2,NaCN+HF=NaF+HCN,NaCN+HNO2=NaNO2+HCN。则该温度下HCN、HF、HNO2三种弱酸的电离常数由大到小的顺序判断正确的是
A.K(HF)>K(HNO2)>K(HCN) B.K(HCN)>K(HNO2)>K(HF)
C.K(HNO2)>K(HF)>K(HCN) D.K(HF)>K(HCN)>K(HNO2)
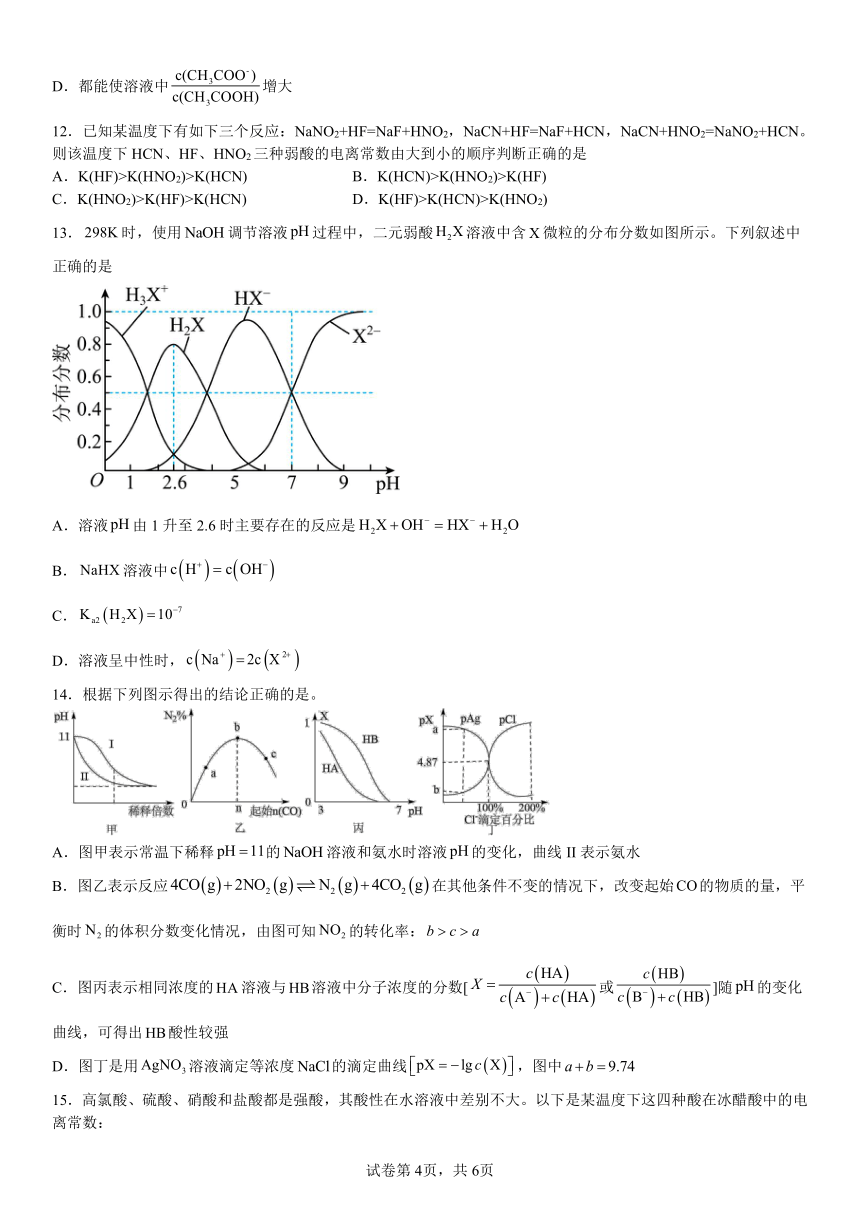
13.时,使用调节溶液过程中,二元弱酸溶液中含微粒的分布分数如图所示。下列叙述中正确的是
A.溶液由1升至2.6时主要存在的反应是
B.溶液中
C.
D.溶液呈中性时,
14.根据下列图示得出的结论正确的是。
A.图甲表示常温下稀释的溶液和氨水时溶液的变化,曲线II表示氨水
B.图乙表示反应在其他条件不变的情况下,改变起始的物质的量,平衡时的体积分数变化情况,由图可知的转化率:
C.图丙表示相同浓度的溶液与溶液中分子浓度的分数[或]随的变化曲线,可得出酸性较强
D.图丁是用溶液滴定等浓度的滴定曲线,图中
15.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 HClO4 H2SO4 HC1 HNO3
Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
从以上表格中判断以下说法中不正确的是A.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO
B.在冰醋酸中硝酸是这四种酸中最弱的酸
C.在冰醋酸中这四种酸都没有完全电离
D.电解质的电离能力与所处的溶剂相关
二、填空题
16.I.25℃时,三种酸的电离平衡常数如表:
化学式 HClO
电离平衡常数
请回答下列问题:
(1)下列反应不能发生的是_______(填序号)。
a.
b.
c.
d.
(2)用蒸馏水稀释的HClO溶液,下列各式表示的数值随水量的增加而增大的是_______(填序号)。
a. b. c.
II.研究表明常温下,溶液中微粒物质的量分数与溶液pH之间的关系如图所示:
(3)常温下,的电离平衡常数_______。
(4)若用和NaOH反应制取,溶液的pH最好控制在_______以上。
17.下列物质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4 ⑨CO2;⑩酒精溶液(均填写编号回答)
(1)是弱电解质的有_______________,是非电解质的有____________。
(2)有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为______________,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是__________________。
(3)某温度时,1 mol L-1的醋酸溶液电离平衡常数为1.0×10 -8,达平衡时,溶液中氢离子浓度是______________。
三、实验题
18.三草酸合铁酸钾晶体化学式为K3[Fe(C2O4)3]·3H2O(摩尔质量为491 g·mol-1),可用于晒制蓝图。
(1)晒制蓝图时,用三草酸合铁酸钾晶体作感光剂,光照时生成CO2和两种草酸盐,反应的化学方程式为_____________。
(2)已知25℃,H2C2O4的Ka1=10-1.2,Ka2=10-4.2。向三草酸合铁酸钾溶液中加入盐酸,当溶液中c()=c()时,溶液的pH=_________。
(3)某三草酸合铁酸钾晶体中含有少量的FeC2O4,为测定其纯度,进行如下实验:
步骤Ⅰ:称取5.000 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤Ⅱ:取25.00 mL溶液,用0.1000 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液13.50 mL。
步骤Ⅲ:另取25.00 mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤Ⅳ:用0.1000 mol·L-1酸性KMnO4溶液滴定合并后的溶液至终点,消耗KMnO4溶液15.50 mL。
已知:酸性条件下可氧化Fe2+、,被还原成Mn2+。
①步骤Ⅲ中将滤液和洗涤液合并的目的是________。
②计算该三草酸合铁酸钾晶体的纯度,写出计算过程_________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.因HF为弱酸,则将HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,故A正确;
B.HF溶液加水不断稀释,促进电离,但是体积增大程度大于氢离子和氟离子的物质的量增大程度,所以c(H+)减小,pH值增大,故B错误;
C.稀释过程中,c(H+)减小,而Kw= c(H+)×c(OH-)不变,所以c(OH-)增大,故C正确;
D.HF的电离常数只受温度影响,由于温度不变,则HF的电离常数不变,故D错误;
故选D。
2.D
【详解】A.SO2易溶于水,可知SO2(g)SO2(aq)能自发进行,该过程 S<0,可知焓变应小于零才能自发进行,A项错误;
B.SO2在水中溶解后部分生成SO2 xH2O,其溶解度为c(SO2 xH2O)与c(SO2)的和,根据,c(SO2 xH2O)=K1p(SO2),则c(SO2 xH2O)与c(SO2)的和要大于K1p(SO2),B项错误;
C.若pH=6.2时,溶液中,亚硫酸的二级电离平衡常数:,则pH=8.2时,溶液中,C项错误;
D.由盖斯定律可知反应SO2(g)+H2O2H++,可由上述三个过程加和得到,则该反应的平衡常数K=K1K2K3=,则溶液c(H+)=,D项正确。
答案选D。
3.B
【详解】A.氧化性:HClO>Cl2>Br2>Fe3+>I2,向FeI2溶液中滴加少量氯水,只有碘离子被氧化,反应的离子方程式为:2I-+Cl2=I2+2Cl-,故A错误;
B.酸性由强到弱的顺序为:H2CO3>HCN>HCO,依据强酸制弱酸的原理可知,CN-+H2O+CO2=HCN+HCO,故B正确;
C.向溴水中加入足量氯化亚铁溶液,生成Fe3+,溶液呈黄色,故C错误;
D.由越稀越电离,加水稀释可促进HCN电离,但电离程度比稀释程度较弱,所以c(CN-)减小,温度不变,离子积常数不变,则增大,故D错误;
故选:B。
4.A
【详解】A.弱酸的浓度越大电离程度越小,则电离的程度:前者大于后者,故A正确;
B.温度相同,电离常数相同,故B错误;
C.两溶液中醋酸的物质的量,(前),(后),醋酸的物质的量相等,因而两者产生的氢气体积相等,故C错误;
D.开始反应时的速率取决于氢离子的浓度;醋酸的浓度越大,溶液中的浓度越大,则氢离子浓度:前者小于后者,所以开始反应速率:前者小于后者,故D错误;
故选A。
5.B
【详解】A.M点pH=11.3,c(H+)=10-11.3mol/L,c(OH-)===10-2.7mol/L,a点pOH=-lgc(OH-)=2.7;N点pH=7,c(H+)=10-7mol/L,c(OH-)=10-7mol/L,b点pOH=-lgc(OH-)=7,选项A正确;
B.甲胺可看作一元弱碱:CH3NH2+H2O+OH-,Kb=,==,CH3NH2水溶液(对应图中M点)中缓慢通入HCl气体,c()逐渐增大,Kb只与温度有关,所以比值减小,选项B不正确;
C.CH3NH2+HCl= CH3NH3Cl,所以Q点显碱性,溶液中有CH3NH3Cl,同时还有CH3NH2剩余,选项C正确;
D.溶液中电荷守恒:c(H+)+ c()= c(OH-)+ c(Cl-),N点pH=7,c(H+)= c(OH-),故c()=c(Cl-),选项D正确;
答案选B。
6.A
【详解】A.c()+c(NH3·H2O)=c(Cl-)时,加入的氨水和盐酸等量,故V(盐酸)= V(氨水)=20 mL,选项A正确;
B.V1对应的pH为7,说明V1<20 mL,溶液中的溶质为NH4Cl和NH3·H2O,此时水的电离程度不是最大,当溶质为氯化铵时促进水的电离,水的电离程度最大,选项B错误;
C.一水合氨是弱电解质,1.00 mol·L-1氨水中存在电离平衡,所以溶液中c(OH-)<1.00 mol·L-1,则溶液的pH小于14,选项C错误;
D.c点溶液显酸性,则c(H+)>c(OH-),若存在c()>c(Cl-)>c(H+)>c(OH-),则c()+c(H+)>c(Cl-)+c(OH-),不符合电荷守恒,选项D错误;
答案选A。
7.C
【详解】A.从碳酸和氢硫酸的第一电离平衡常数分析,碳酸的酸性大于氢硫酸,A正确;
B.多元弱酸分步电离,以第一步电离为主,酸性主要取决于第一步电离,B正确;
C.在同一溶液中,微粒的物质的量浓度之比等于物质的量之比。常温下加水稀释醋酸,醋酸继续电离,醋酸根离子的物质的量增多,醋酸分子的物质的量减小,则醋酸根离子和醋酸分子的浓度的比值增大,C错误;
D.电离平衡常数取决于温度和弱电解质,温度不变,弱酸的电离常数不变,D正确;
故选C。
8.B
【详解】A.弱电解质电离常数越大,电离程度越大,的,而的,所以常温下,相同浓度的溶液的酸性强于溶液的酸性,A项错误;
B.由于的小于的,但大于其,所以向溶液中通入少量,反应的离子方程式为,当足量时,生成和,B项正确;
C.由题给信息知,所以向溶液中通入少量,反应的离子方程式为,C项错误;
D.不能与溶液反应,但是强酸,能与溶液反应,使减小,促使平衡正向移动,从而可提高的浓度;具有氧化性,具有还原性,二者能够发生氧化还原反应,所以加入溶液不能提高的浓度,D项错误;
故选B。
9.B
【详解】25°C时,将0.10mol/LHA溶液滴加到10mL等浓度的KOH溶液中,越来越大,与pH的关系也就不难理解。
A.根据电离平衡常数的表达式可以推出lgKa(HA)=-pH,选项A错误;
B.P点的电荷守恒式可以推出c(A-)-c(K+)=(10-6-10-8)mol/L,选项B正确;
C.当加入的HA溶液的体积为10mL时,溶液中溶质为KA,溶液为碱性,所以pH=7时,加入的HA溶液的体积大于10mL,选项C错误;
D.由lgKa(HA)=-pH,如果将P点值代入并由此可知Ka的数量级为10-5,由lgKa(HA)=-pH,如果将pH=12值代入据此可知,c(A-)>c(HA),选项D错误。
答案选B。
10.D
【详解】A.酸的电离平衡常数越大,酸的酸性越强,强酸能够制取弱酸,所以二者反应生成HCN和,离子方程式为CN-+H2O+CO2═HCN+,A正确;
B.K(HCOOH)>K1(H2CO3) >K2(H2CO3),所以酸性:HCOOH>H2CO3,强酸能和弱酸盐反应生成弱酸,当HCOOH足量时,则能发生离子反应,B正确;
C.K(HCOOH)>K1(H2CO3) >K2(H2CO3),所以酸性:HCOOH>H2CO3,当HCOOH 少量时,可反应:,C正确;
D.K1(H2CO3) >K(HCN)>K2(H2CO3),所以酸性: H2CO3>KHCN>,强酸能够制取弱酸,则反应为:,D错误;
故答案为:D。
11.B
【详解】A.向0.1mol·L-1的CH3COOH溶液中加水,促进CH3COOH电离,但c(H+)浓度减小,pH增大;加入少量CH3COONa晶体,抑制CH3COOH电离,使c(H+)减小,所以使溶液的pH增大,故A正确;
B.向0.1mol·L-1的CH3COOH溶液中加水,促进CH3COOH电离,但c(H+)、c(CH3COO-)浓度减小,所以c(H+)·c(CH3COO-)会减小,向0.1mol·L-1的CH3COOH溶液中加入少量CH3COONa晶体,抑制CH3COOH电离,使c(H+)减小,c(CH3COO-)增大,c(H+)·c(CH3COO-)会增大,故B错误;
C.温度不变,水的离子积不变,故c(H+)·c(OH-)不变,故C正确;
D.向0.1mol·L-1的CH3COOH溶液中加入少量CH3COONa晶体,抑制CH3COOH电离,c(CH3COO-)、c(CH3COOH)增大,但c(CH3COO-)增大的倍数大,所以溶液中比值增大;加水,促进CH3COOH电离,c(CH3COO-)、c(CH3COOH)减小,但c(CH3COO-)减小的倍数小,所以溶液中比值增大,故D正确;
答案:B。
12.A
【详解】复分解反应中遵循“强酸制弱酸”的原理,根据NaNO2+HF=NaF+HNO2,可知酸性HF>HNO2,根据NaCN+HF=NaF+HCN,可知HF>HCN,根据NaCN+HNO2=NaNO2+HCN可知酸性HNO2>HCN,综上所述酸性:HF>HNO2>HCN,酸性越强,电离平衡常数越大,所以电离常数由大到小的顺序为K(HF)>K(HNO2)>K(HCN);
故答案为A。
13.C
【详解】A.根据题图可知,当溶液由1升至2.6时,H3X+转化为H2X,其离子反应方程式为:H3X++OH- H2X+H2O,故A错误;
B.有图象可知,当HX-含量较高时,溶液显酸性,即溶液显酸性,则溶液中c(H+)>c(OH-),故B错误;
C.当溶液pH=7时,溶液中c(HX-)=c(X2-),即H2X的第二步电离平衡常数Ka2(H2X)==10-7,故C正确;
D.溶液呈中性时,根据电荷守恒有c(Na+)+ c(H+)= c(HX-)+2c(X2-)+ c(OH-),且c(H+)=c(OH-),则c(Na+)= c(HX-)+2c(X2-),故D错误;
答案选C。
14.D
【详解】A.等pH的强碱与弱碱,稀释相同倍数时,强碱的pH变化大,弱碱存在电离平衡,则图中Ⅰ表示氨水稀释的情况,选项A错误;
B.增大CO的物质的量,平衡正向移动,促进NO2的转化,则在其他条件不变的情况下结合图中起始CO的物质的量,可知NO2的转化率c> b> a,选项B错误;
C.由图丙可知,相同pH时,HB溶液中HB分子浓度较大,则HB的电离程度较小,则相同浓度的HA与HB溶液中,HB的酸性较弱,选项C错误;
D.图丁是AgCl饱和溶液中c (Ag+ )和c(Cl- )变化关系图像,当恰好反应完全时pAg= pCl= 4.87,- lg Kssp (AgCl) =[Igc(Ag+) )c(Cl-)]=[lgc(Ag+) + lgc(Cl-)] = pAg + pCl= a+b=4.87+4.87 = 9.74,选项D正确;
答案选D。
15.A
【详解】A.由硫酸在冰醋酸中的电离常数为6.3×10-9可知,硫酸在冰醋酸中部分电离,属于弱酸,电离方程式为 ,故A错误;
B.在冰醋酸中的电离常数越大,说明酸性越强,由表给电离常数可知,在冰醋酸中高氯酸是这四种酸中的电离常数最大,则最强的酸的是高氯酸,故B正确;
C.由表给电离常数可知,四种酸在冰醋酸中都部分电离,故C正确;
D.由题给四种酸在水溶液中都能完全电离,在冰醋酸中都部分电离说明电解质的电离能力与所处的溶剂相关,故D正确;
故选A。
16.(1)cd
(2)b
(3)10-6.37
(4)12
【详解】(1)酸的电离常数越大,酸性相对越强,结合酸的电离常数可知酸性强弱:>> HClO> ,依据“较强酸制较弱酸”的原理,反应、不能发生,符合题意的选项是c、d,故答案为:cd;
(2)HClO的电离平衡常数表达式为: , 只受温度影响;
a. ,加水稀释, 减小,所以减小,故a不选;
b.,加水稀释, 减小,所以增大,故b选;
c.加水稀释, 减小,所以减小,故c不选;
故答案为:b;
(3)根据可知,,由图可知,在该溶液的平衡体系中,当pH=6.37时, ,则=10-6.37,故答案为:10-6.37;
(4)观察题图,当溶液的pH=12时, 含量基本达到最大值,所以溶液的pH最好控制在12以上,故答案为:12。
17. ③⑥ ⑨ ④>⑦>⑧ a﹤b=c 1×10-4mol L-1
【分析】(1)在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不导电的化合物为非电解质,不是化合物的物质既不是电解质,也不是非电解质,据此进行解答;(2)醋酸是一元弱酸,盐酸是一元强酸,硫酸是二元强酸,pH相同时,氢离子浓度相同,醋酸不完全电离,醋酸浓度远远大于盐酸和硫酸。
【详解】(1)电解质是在水溶液或熔融状态下能够导电的化合物,满足该条件的有①NaCl;②NaOH;③NH3·H2O;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4;弱电解质是在水溶液中不能完全电离的电解质,所以其中为弱电解质是③NH3·H2O, ⑥H2O。非电解质是在水溶液和熔融状态下都不导电的化合物,满足该条件下有:⑨CO2;溶液是混合物,即不是电解质也不是非电解质, 因此,本题正确答案是:③⑥; ⑨;
(2)醋酸是一元弱酸,盐酸是一元强酸,硫酸是二元强酸,pH相同时, ④醋酸浓度大于⑦盐酸, ⑦盐酸浓度大于⑧硫酸,所以物质的量浓度由大到小的顺序为④>⑦>⑧;pH相同时,氢离子浓度相同,醋酸不完全电离,醋酸浓度远远大于盐酸和硫酸,若分别用pH相等的这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积醋酸<盐酸=硫酸, 因此,本题答案是: ④>⑦>⑧; a﹤b=c;
(4)醋酸为弱电解质,其电离方程式为: CH3COOH H++CH3COO-,其平衡常数表达式为K= c(CH3COO-).c(H+)/ c(CH3COOH),已知 1 mol L-1的醋酸溶液电离平衡常数为1.0×10 -8,所以c(H+)=1×10-4mol L-1。因此,本题正确答案是; 1×10-4mol L-1。
18. 2K3[Fe(C2O4)3]·3H2O2FeC2O4+3K2C2O4+2CO2↑+6H2O 4.2 减少Fe元素的损失 98.02%
【分析】(1)K3[Fe(C2O4)3]·3H2O光照分解,产生CO2和两种草酸盐,根据物质的元素组成,可知两种草酸盐分别是FeC2O4、K2C2O4;
(2)根据草酸的第二步电离平衡常数,结合溶液中离子浓度关系计算溶液的c(H+),然后根据pH=-lgc(H+)计算溶液pH;
(3)①根据溶液成分判断;
②先计算Fe2+、消耗的KMnO4的物质的量,再计算由Fe3+转化产生的Fe2+及溶液中含有的Fe2+、消耗的KMnO4的物质的量,利用电子转移数目相等,可计算出三草酸合铁酸钾晶体的纯度。
【详解】(1)K3[Fe(C2O4)3]·3H2O光照分解,产生CO2、FeC2O4、K2C2O4,则根据原子守恒、电子守恒,可得该反应方程式为:2K3[Fe(C2O4)3]·3H2O2FeC2O4+3K2C2O4+2CO2↑+6H2O;
(2)草酸的二级电离平衡为:+H+,则Ka2=,由于溶液中c()=c(),所以Ka2= c(H+)=10-4.2,故溶液的pH=4.2;
(3)①在滤液和洗涤液中都含有Fe2+,将二者合并然后滴定,可减少实验过程中Fe元素的损失;
②步骤II中Fe2+、消耗的KMnO4的物质的量n(KMnO4)1=c·V=0.1000 mol/L×13.50 mL×10-3 L/mL=1.350×10-3 mol;
步骤IV中Fe2+、消耗的KMnO4的物质的量n(KMnO4)2=c·V=0.1000 mol/L×15.50 mL×10-3 L/mL=1.550×10-3 mol,根据反应过程中电子转移数目相等可得关系式:5Fe3+~5Fe2+~,n(Fe3+)=5×(1.550×10-3 mol-1.350×10-3 mol)=1.000×10-3 mol,故该晶体的纯度为×100%=98.20%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.将HF溶液加水稀释后,下列说法中不正确的是
A.HF的电离程度增大 B.溶液的pH值增大
C.c(OH-)增大 D.HF的电离常数增大
2.易溶于水,光谱研究表明,的水溶液中存在下列平衡:
其中、、为各步的平衡常数,且 [表示的平衡压强]
下列说法正确的是
A.的焓变
B.在水中的溶解度(以物质的量浓度表示)为c,则
C.若pH=6.2时,溶液中,则pH=8.2时,溶液中
D.当的平衡压强为p时,测得,则溶液
3.已知电离常数:,氧化性:。下列有关叙述中正确的是
A.向溶液中滴加少量氯水,反应的离子方程式为:
B.向溶液中通入少量的离子方程式:
C.向溴水中加入足量氯化亚铁溶液,混合溶液变为无色
D.溶液,加水稀释,将变小
4.在相同温度下,100mL0.01mol L-1的醋酸溶液与10mL0.1mol L-1的醋酸溶液分别与足量的锌粉反应,下列说法正确的是
A.电离程度:前者>后者 B.两者的电离常数:前者>后者
C.两者产生的氢气体积:前者<后者 D.开始反应时的速率:前者>后者
5.甲胺(CH3NH2)与盐酸反应生成甲胺盐酸盐(CH3NH3Cl)。25℃时,向一定体积0.01mol·L-1CH3NH2水溶液(对应图中M点)中缓慢通入HCl气体,溶液的pH与pOH[pOH=-lgc(OH-)的关系如图所示。下列叙述不正确的是
A.图中a=2.7,b=7
B.该过程中,增大
C.Q点溶液中溶质为CH3NH3Cl和CH3NH2
D.N点溶液中:c()=c(Cl-)
6.室温下,将1.0 mol·L-1盐酸滴入20 mL 1.0 mol·L-1氨水中,溶液pH随加入盐酸体积变化的曲线如图所示。下列有关说法正确的是
A.c()+c(NH3·H2O)=c(Cl-)时,V(盐酸)=20 mL
B.V1>20 mL,此时水的电离程度最大
C.a点,pH=14
D.c点可能存在c()>c(Cl-)>c(H+)
7.下表是几种弱酸常温下的电离平衡常数:
CH3COOH H2CO3 H2S H3PO4
1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 K1=9.1×10-8 K2=1.1×10-12 K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13
则下列说法中不正确的是A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸,减小
D.向弱酸溶液中加少量溶液,电离平衡常数不变
8.已知常温下碳酸、亚硫酸、次氯酸的电离常数如表所示。
下列说法正确的是A.常温下,相同浓度的溶液和溶液的酸性,后者更强
B.向溶液中通入少量
C.向溶液中通入少量
D.向氯水中分别加入等浓度的溶液和溶液,均可提高氯水中的浓度
9.25℃时,将0.10mol·L-1HA溶液逐滴滴加到10mL等浓度的KOH溶液中,lg与溶液pH的关系如图所示。下列相关结论正确的是
A.lgKa(HA)=lg+pH
B.P点存在:c(A-)-c(K+)=(10-6-10-8)mol·L-1
C.pH=7时,加入的HA溶液的体积小于10mL
D.pH=12时,c(K+)>c(OH-)>c(HA)>c(A-)>c(H+)
10.部分弱酸的电离平衡常数如下表,下列选项不正确的是
弱酸 HCOOH HCN H2CO3
电离平衡常数(25℃)
A.
B.
C.
D.
11.向0.1mol/L的CH3COOH溶液中加水或加入少量CH3COONa晶体时,下列有关叙述不正确的是
A.都能使溶液的pH增大
B.都能使溶液中c(H+)·c(CH3COO-)增大
C.溶液中c(H+)·c(OH-)不变
D.都能使溶液中增大
12.已知某温度下有如下三个反应:NaNO2+HF=NaF+HNO2,NaCN+HF=NaF+HCN,NaCN+HNO2=NaNO2+HCN。则该温度下HCN、HF、HNO2三种弱酸的电离常数由大到小的顺序判断正确的是
A.K(HF)>K(HNO2)>K(HCN) B.K(HCN)>K(HNO2)>K(HF)
C.K(HNO2)>K(HF)>K(HCN) D.K(HF)>K(HCN)>K(HNO2)
13.时,使用调节溶液过程中,二元弱酸溶液中含微粒的分布分数如图所示。下列叙述中正确的是
A.溶液由1升至2.6时主要存在的反应是
B.溶液中
C.
D.溶液呈中性时,
14.根据下列图示得出的结论正确的是。
A.图甲表示常温下稀释的溶液和氨水时溶液的变化,曲线II表示氨水
B.图乙表示反应在其他条件不变的情况下,改变起始的物质的量,平衡时的体积分数变化情况,由图可知的转化率:
C.图丙表示相同浓度的溶液与溶液中分子浓度的分数[或]随的变化曲线,可得出酸性较强
D.图丁是用溶液滴定等浓度的滴定曲线,图中
15.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 HClO4 H2SO4 HC1 HNO3
Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
从以上表格中判断以下说法中不正确的是A.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO
B.在冰醋酸中硝酸是这四种酸中最弱的酸
C.在冰醋酸中这四种酸都没有完全电离
D.电解质的电离能力与所处的溶剂相关
二、填空题
16.I.25℃时,三种酸的电离平衡常数如表:
化学式 HClO
电离平衡常数
请回答下列问题:
(1)下列反应不能发生的是_______(填序号)。
a.
b.
c.
d.
(2)用蒸馏水稀释的HClO溶液,下列各式表示的数值随水量的增加而增大的是_______(填序号)。
a. b. c.
II.研究表明常温下,溶液中微粒物质的量分数与溶液pH之间的关系如图所示:
(3)常温下,的电离平衡常数_______。
(4)若用和NaOH反应制取,溶液的pH最好控制在_______以上。
17.下列物质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4 ⑨CO2;⑩酒精溶液(均填写编号回答)
(1)是弱电解质的有_______________,是非电解质的有____________。
(2)有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为______________,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是__________________。
(3)某温度时,1 mol L-1的醋酸溶液电离平衡常数为1.0×10 -8,达平衡时,溶液中氢离子浓度是______________。
三、实验题
18.三草酸合铁酸钾晶体化学式为K3[Fe(C2O4)3]·3H2O(摩尔质量为491 g·mol-1),可用于晒制蓝图。
(1)晒制蓝图时,用三草酸合铁酸钾晶体作感光剂,光照时生成CO2和两种草酸盐,反应的化学方程式为_____________。
(2)已知25℃,H2C2O4的Ka1=10-1.2,Ka2=10-4.2。向三草酸合铁酸钾溶液中加入盐酸,当溶液中c()=c()时,溶液的pH=_________。
(3)某三草酸合铁酸钾晶体中含有少量的FeC2O4,为测定其纯度,进行如下实验:
步骤Ⅰ:称取5.000 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤Ⅱ:取25.00 mL溶液,用0.1000 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液13.50 mL。
步骤Ⅲ:另取25.00 mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤Ⅳ:用0.1000 mol·L-1酸性KMnO4溶液滴定合并后的溶液至终点,消耗KMnO4溶液15.50 mL。
已知:酸性条件下可氧化Fe2+、,被还原成Mn2+。
①步骤Ⅲ中将滤液和洗涤液合并的目的是________。
②计算该三草酸合铁酸钾晶体的纯度,写出计算过程_________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.因HF为弱酸,则将HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,故A正确;
B.HF溶液加水不断稀释,促进电离,但是体积增大程度大于氢离子和氟离子的物质的量增大程度,所以c(H+)减小,pH值增大,故B错误;
C.稀释过程中,c(H+)减小,而Kw= c(H+)×c(OH-)不变,所以c(OH-)增大,故C正确;
D.HF的电离常数只受温度影响,由于温度不变,则HF的电离常数不变,故D错误;
故选D。
2.D
【详解】A.SO2易溶于水,可知SO2(g)SO2(aq)能自发进行,该过程 S<0,可知焓变应小于零才能自发进行,A项错误;
B.SO2在水中溶解后部分生成SO2 xH2O,其溶解度为c(SO2 xH2O)与c(SO2)的和,根据,c(SO2 xH2O)=K1p(SO2),则c(SO2 xH2O)与c(SO2)的和要大于K1p(SO2),B项错误;
C.若pH=6.2时,溶液中,亚硫酸的二级电离平衡常数:,则pH=8.2时,溶液中,C项错误;
D.由盖斯定律可知反应SO2(g)+H2O2H++,可由上述三个过程加和得到,则该反应的平衡常数K=K1K2K3=,则溶液c(H+)=,D项正确。
答案选D。
3.B
【详解】A.氧化性:HClO>Cl2>Br2>Fe3+>I2,向FeI2溶液中滴加少量氯水,只有碘离子被氧化,反应的离子方程式为:2I-+Cl2=I2+2Cl-,故A错误;
B.酸性由强到弱的顺序为:H2CO3>HCN>HCO,依据强酸制弱酸的原理可知,CN-+H2O+CO2=HCN+HCO,故B正确;
C.向溴水中加入足量氯化亚铁溶液,生成Fe3+,溶液呈黄色,故C错误;
D.由越稀越电离,加水稀释可促进HCN电离,但电离程度比稀释程度较弱,所以c(CN-)减小,温度不变,离子积常数不变,则增大,故D错误;
故选:B。
4.A
【详解】A.弱酸的浓度越大电离程度越小,则电离的程度:前者大于后者,故A正确;
B.温度相同,电离常数相同,故B错误;
C.两溶液中醋酸的物质的量,(前),(后),醋酸的物质的量相等,因而两者产生的氢气体积相等,故C错误;
D.开始反应时的速率取决于氢离子的浓度;醋酸的浓度越大,溶液中的浓度越大,则氢离子浓度:前者小于后者,所以开始反应速率:前者小于后者,故D错误;
故选A。
5.B
【详解】A.M点pH=11.3,c(H+)=10-11.3mol/L,c(OH-)===10-2.7mol/L,a点pOH=-lgc(OH-)=2.7;N点pH=7,c(H+)=10-7mol/L,c(OH-)=10-7mol/L,b点pOH=-lgc(OH-)=7,选项A正确;
B.甲胺可看作一元弱碱:CH3NH2+H2O+OH-,Kb=,==,CH3NH2水溶液(对应图中M点)中缓慢通入HCl气体,c()逐渐增大,Kb只与温度有关,所以比值减小,选项B不正确;
C.CH3NH2+HCl= CH3NH3Cl,所以Q点显碱性,溶液中有CH3NH3Cl,同时还有CH3NH2剩余,选项C正确;
D.溶液中电荷守恒:c(H+)+ c()= c(OH-)+ c(Cl-),N点pH=7,c(H+)= c(OH-),故c()=c(Cl-),选项D正确;
答案选B。
6.A
【详解】A.c()+c(NH3·H2O)=c(Cl-)时,加入的氨水和盐酸等量,故V(盐酸)= V(氨水)=20 mL,选项A正确;
B.V1对应的pH为7,说明V1<20 mL,溶液中的溶质为NH4Cl和NH3·H2O,此时水的电离程度不是最大,当溶质为氯化铵时促进水的电离,水的电离程度最大,选项B错误;
C.一水合氨是弱电解质,1.00 mol·L-1氨水中存在电离平衡,所以溶液中c(OH-)<1.00 mol·L-1,则溶液的pH小于14,选项C错误;
D.c点溶液显酸性,则c(H+)>c(OH-),若存在c()>c(Cl-)>c(H+)>c(OH-),则c()+c(H+)>c(Cl-)+c(OH-),不符合电荷守恒,选项D错误;
答案选A。
7.C
【详解】A.从碳酸和氢硫酸的第一电离平衡常数分析,碳酸的酸性大于氢硫酸,A正确;
B.多元弱酸分步电离,以第一步电离为主,酸性主要取决于第一步电离,B正确;
C.在同一溶液中,微粒的物质的量浓度之比等于物质的量之比。常温下加水稀释醋酸,醋酸继续电离,醋酸根离子的物质的量增多,醋酸分子的物质的量减小,则醋酸根离子和醋酸分子的浓度的比值增大,C错误;
D.电离平衡常数取决于温度和弱电解质,温度不变,弱酸的电离常数不变,D正确;
故选C。
8.B
【详解】A.弱电解质电离常数越大,电离程度越大,的,而的,所以常温下,相同浓度的溶液的酸性强于溶液的酸性,A项错误;
B.由于的小于的,但大于其,所以向溶液中通入少量,反应的离子方程式为,当足量时,生成和,B项正确;
C.由题给信息知,所以向溶液中通入少量,反应的离子方程式为,C项错误;
D.不能与溶液反应,但是强酸,能与溶液反应,使减小,促使平衡正向移动,从而可提高的浓度;具有氧化性,具有还原性,二者能够发生氧化还原反应,所以加入溶液不能提高的浓度,D项错误;
故选B。
9.B
【详解】25°C时,将0.10mol/LHA溶液滴加到10mL等浓度的KOH溶液中,越来越大,与pH的关系也就不难理解。
A.根据电离平衡常数的表达式可以推出lgKa(HA)=-pH,选项A错误;
B.P点的电荷守恒式可以推出c(A-)-c(K+)=(10-6-10-8)mol/L,选项B正确;
C.当加入的HA溶液的体积为10mL时,溶液中溶质为KA,溶液为碱性,所以pH=7时,加入的HA溶液的体积大于10mL,选项C错误;
D.由lgKa(HA)=-pH,如果将P点值代入并由此可知Ka的数量级为10-5,由lgKa(HA)=-pH,如果将pH=12值代入据此可知,c(A-)>c(HA),选项D错误。
答案选B。
10.D
【详解】A.酸的电离平衡常数越大,酸的酸性越强,强酸能够制取弱酸,所以二者反应生成HCN和,离子方程式为CN-+H2O+CO2═HCN+,A正确;
B.K(HCOOH)>K1(H2CO3) >K2(H2CO3),所以酸性:HCOOH>H2CO3,强酸能和弱酸盐反应生成弱酸,当HCOOH足量时,则能发生离子反应,B正确;
C.K(HCOOH)>K1(H2CO3) >K2(H2CO3),所以酸性:HCOOH>H2CO3,当HCOOH 少量时,可反应:,C正确;
D.K1(H2CO3) >K(HCN)>K2(H2CO3),所以酸性: H2CO3>KHCN>,强酸能够制取弱酸,则反应为:,D错误;
故答案为:D。
11.B
【详解】A.向0.1mol·L-1的CH3COOH溶液中加水,促进CH3COOH电离,但c(H+)浓度减小,pH增大;加入少量CH3COONa晶体,抑制CH3COOH电离,使c(H+)减小,所以使溶液的pH增大,故A正确;
B.向0.1mol·L-1的CH3COOH溶液中加水,促进CH3COOH电离,但c(H+)、c(CH3COO-)浓度减小,所以c(H+)·c(CH3COO-)会减小,向0.1mol·L-1的CH3COOH溶液中加入少量CH3COONa晶体,抑制CH3COOH电离,使c(H+)减小,c(CH3COO-)增大,c(H+)·c(CH3COO-)会增大,故B错误;
C.温度不变,水的离子积不变,故c(H+)·c(OH-)不变,故C正确;
D.向0.1mol·L-1的CH3COOH溶液中加入少量CH3COONa晶体,抑制CH3COOH电离,c(CH3COO-)、c(CH3COOH)增大,但c(CH3COO-)增大的倍数大,所以溶液中比值增大;加水,促进CH3COOH电离,c(CH3COO-)、c(CH3COOH)减小,但c(CH3COO-)减小的倍数小,所以溶液中比值增大,故D正确;
答案:B。
12.A
【详解】复分解反应中遵循“强酸制弱酸”的原理,根据NaNO2+HF=NaF+HNO2,可知酸性HF>HNO2,根据NaCN+HF=NaF+HCN,可知HF>HCN,根据NaCN+HNO2=NaNO2+HCN可知酸性HNO2>HCN,综上所述酸性:HF>HNO2>HCN,酸性越强,电离平衡常数越大,所以电离常数由大到小的顺序为K(HF)>K(HNO2)>K(HCN);
故答案为A。
13.C
【详解】A.根据题图可知,当溶液由1升至2.6时,H3X+转化为H2X,其离子反应方程式为:H3X++OH- H2X+H2O,故A错误;
B.有图象可知,当HX-含量较高时,溶液显酸性,即溶液显酸性,则溶液中c(H+)>c(OH-),故B错误;
C.当溶液pH=7时,溶液中c(HX-)=c(X2-),即H2X的第二步电离平衡常数Ka2(H2X)==10-7,故C正确;
D.溶液呈中性时,根据电荷守恒有c(Na+)+ c(H+)= c(HX-)+2c(X2-)+ c(OH-),且c(H+)=c(OH-),则c(Na+)= c(HX-)+2c(X2-),故D错误;
答案选C。
14.D
【详解】A.等pH的强碱与弱碱,稀释相同倍数时,强碱的pH变化大,弱碱存在电离平衡,则图中Ⅰ表示氨水稀释的情况,选项A错误;
B.增大CO的物质的量,平衡正向移动,促进NO2的转化,则在其他条件不变的情况下结合图中起始CO的物质的量,可知NO2的转化率c> b> a,选项B错误;
C.由图丙可知,相同pH时,HB溶液中HB分子浓度较大,则HB的电离程度较小,则相同浓度的HA与HB溶液中,HB的酸性较弱,选项C错误;
D.图丁是AgCl饱和溶液中c (Ag+ )和c(Cl- )变化关系图像,当恰好反应完全时pAg= pCl= 4.87,- lg Kssp (AgCl) =[Igc(Ag+) )c(Cl-)]=[lgc(Ag+) + lgc(Cl-)] = pAg + pCl= a+b=4.87+4.87 = 9.74,选项D正确;
答案选D。
15.A
【详解】A.由硫酸在冰醋酸中的电离常数为6.3×10-9可知,硫酸在冰醋酸中部分电离,属于弱酸,电离方程式为 ,故A错误;
B.在冰醋酸中的电离常数越大,说明酸性越强,由表给电离常数可知,在冰醋酸中高氯酸是这四种酸中的电离常数最大,则最强的酸的是高氯酸,故B正确;
C.由表给电离常数可知,四种酸在冰醋酸中都部分电离,故C正确;
D.由题给四种酸在水溶液中都能完全电离,在冰醋酸中都部分电离说明电解质的电离能力与所处的溶剂相关,故D正确;
故选A。
16.(1)cd
(2)b
(3)10-6.37
(4)12
【详解】(1)酸的电离常数越大,酸性相对越强,结合酸的电离常数可知酸性强弱:>> HClO> ,依据“较强酸制较弱酸”的原理,反应、不能发生,符合题意的选项是c、d,故答案为:cd;
(2)HClO的电离平衡常数表达式为: , 只受温度影响;
a. ,加水稀释, 减小,所以减小,故a不选;
b.,加水稀释, 减小,所以增大,故b选;
c.加水稀释, 减小,所以减小,故c不选;
故答案为:b;
(3)根据可知,,由图可知,在该溶液的平衡体系中,当pH=6.37时, ,则=10-6.37,故答案为:10-6.37;
(4)观察题图,当溶液的pH=12时, 含量基本达到最大值,所以溶液的pH最好控制在12以上,故答案为:12。
17. ③⑥ ⑨ ④>⑦>⑧ a﹤b=c 1×10-4mol L-1
【分析】(1)在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不导电的化合物为非电解质,不是化合物的物质既不是电解质,也不是非电解质,据此进行解答;(2)醋酸是一元弱酸,盐酸是一元强酸,硫酸是二元强酸,pH相同时,氢离子浓度相同,醋酸不完全电离,醋酸浓度远远大于盐酸和硫酸。
【详解】(1)电解质是在水溶液或熔融状态下能够导电的化合物,满足该条件的有①NaCl;②NaOH;③NH3·H2O;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4;弱电解质是在水溶液中不能完全电离的电解质,所以其中为弱电解质是③NH3·H2O, ⑥H2O。非电解质是在水溶液和熔融状态下都不导电的化合物,满足该条件下有:⑨CO2;溶液是混合物,即不是电解质也不是非电解质, 因此,本题正确答案是:③⑥; ⑨;
(2)醋酸是一元弱酸,盐酸是一元强酸,硫酸是二元强酸,pH相同时, ④醋酸浓度大于⑦盐酸, ⑦盐酸浓度大于⑧硫酸,所以物质的量浓度由大到小的顺序为④>⑦>⑧;pH相同时,氢离子浓度相同,醋酸不完全电离,醋酸浓度远远大于盐酸和硫酸,若分别用pH相等的这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积醋酸<盐酸=硫酸, 因此,本题答案是: ④>⑦>⑧; a﹤b=c;
(4)醋酸为弱电解质,其电离方程式为: CH3COOH H++CH3COO-,其平衡常数表达式为K= c(CH3COO-).c(H+)/ c(CH3COOH),已知 1 mol L-1的醋酸溶液电离平衡常数为1.0×10 -8,所以c(H+)=1×10-4mol L-1。因此,本题正确答案是; 1×10-4mol L-1。
18. 2K3[Fe(C2O4)3]·3H2O2FeC2O4+3K2C2O4+2CO2↑+6H2O 4.2 减少Fe元素的损失 98.02%
【分析】(1)K3[Fe(C2O4)3]·3H2O光照分解,产生CO2和两种草酸盐,根据物质的元素组成,可知两种草酸盐分别是FeC2O4、K2C2O4;
(2)根据草酸的第二步电离平衡常数,结合溶液中离子浓度关系计算溶液的c(H+),然后根据pH=-lgc(H+)计算溶液pH;
(3)①根据溶液成分判断;
②先计算Fe2+、消耗的KMnO4的物质的量,再计算由Fe3+转化产生的Fe2+及溶液中含有的Fe2+、消耗的KMnO4的物质的量,利用电子转移数目相等,可计算出三草酸合铁酸钾晶体的纯度。
【详解】(1)K3[Fe(C2O4)3]·3H2O光照分解,产生CO2、FeC2O4、K2C2O4,则根据原子守恒、电子守恒,可得该反应方程式为:2K3[Fe(C2O4)3]·3H2O2FeC2O4+3K2C2O4+2CO2↑+6H2O;
(2)草酸的二级电离平衡为:+H+,则Ka2=,由于溶液中c()=c(),所以Ka2= c(H+)=10-4.2,故溶液的pH=4.2;
(3)①在滤液和洗涤液中都含有Fe2+,将二者合并然后滴定,可减少实验过程中Fe元素的损失;
②步骤II中Fe2+、消耗的KMnO4的物质的量n(KMnO4)1=c·V=0.1000 mol/L×13.50 mL×10-3 L/mL=1.350×10-3 mol;
步骤IV中Fe2+、消耗的KMnO4的物质的量n(KMnO4)2=c·V=0.1000 mol/L×15.50 mL×10-3 L/mL=1.550×10-3 mol,根据反应过程中电子转移数目相等可得关系式:5Fe3+~5Fe2+~,n(Fe3+)=5×(1.550×10-3 mol-1.350×10-3 mol)=1.000×10-3 mol,故该晶体的纯度为×100%=98.20%。
答案第1页,共2页
答案第1页,共2页
