9.2溶解度 课时作业(含解析)人教版 九年级下册
文档属性
| 名称 | 9.2溶解度 课时作业(含解析)人教版 九年级下册 |  | |
| 格式 | zip | ||
| 文件大小 | 152.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-17 09:23:30 | ||
图片预览




文档简介
9.2溶解度 课时作业
一、单选题
1.下列有关溶液的说法中正确的是( )
A.均一、稳定的液体都是溶液 B.用汽油洗去衣服上的油渍是乳化作用的结果
C.饱和溶液一定比不饱和溶液浓 D.析出晶体后的溶液是饱和溶液
2.人的生存离不开氧气,下列有关氧气的说法不正确的是( )
A.用含有氧元素的物质反应才有可能产生氧气
B.夏天鱼池内开启增氧泵,是因为温度升高,氧气在水中溶解量减少
C.硫在O2里燃烧产生明亮的蓝紫色火焰
D.氧气可以支持燃烧,说明氧气具有可燃性
3.下列分析推理正确的是
A.硝酸钾的溶解度受温度影响大,其溶液只要降温就能析出晶体
B.硝酸铵溶于水时吸热,说明硝酸铵溶解时只发生吸热过程
C.CO2可溶于水,所以其水溶液中的溶质是CO2
D.酒精与水可任意比率互溶,所以不可能制得酒精的饱和溶液
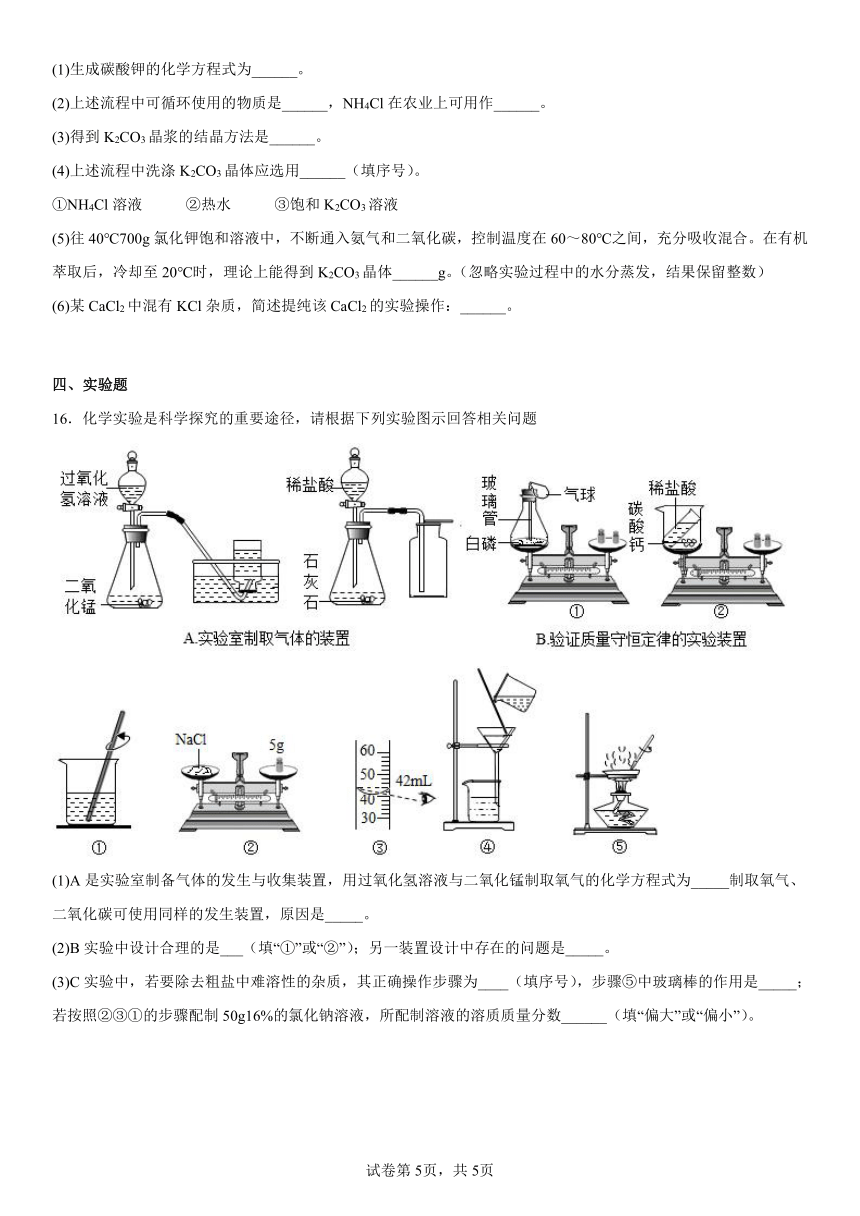
4.下列图示实验能达到目的的是
A.探究溶剂种类对物质溶解性的影响
B.测定空气中O2的含量
C.探究可燃物燃烧的条件
D.探究MnO2的催化作用
5.某温度时,甲物质的溶解度是40g,该温度时,将50g甲物质投入到100g水中,充分搅拌,所得溶液的溶质质量分数是
A.50% B.33.3% C.28.6% D.40%
6.如图是甲、乙两种固体物质的溶解度曲线。下列说法中正确的是( )
A.甲、乙两物质的溶解度相同
B.t2℃时,将25g甲与100g水混合可得到甲的饱和溶液
C.t2℃时,甲、乙饱和溶液降温至t1℃,甲析出固体的质量大于乙析出固体的质量
D.升高温度可以将甲的饱和溶液变为不饱和溶液
7.下列关于溶液的说法正确的是
A.溶液是具有均一性、稳定性的混合物
B.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C.均一、稳定的液体一定是溶液
D.溶液都是无色透明的液体
8.在一定的温度下,向不饱和的 NaNO3溶液中,逐渐加入 NaNO3晶体,下列图像中符合加入 NaNO3晶体的质量和溶液中的溶质质量变化规律的是
A. B.
C. D.
9.下图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.t1℃时,甲、乙两种物质的溶液中溶质质量分数相等
B.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为75g
C.甲物质中混有少量乙物质,可采用蒸发结晶的方法提纯甲
D.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
10.学习了化学以后,要能运用化学知识解释日常生活中的现象,分析和解决生产生活中的实际问题。下列说法中错误的是
A.搅拌能加快蔗糖在水中的溶解,其原因是增大了蔗糖的溶解度
B.天气闷热时,鱼会在接近水面处游动,原因是温度升高气压变小,氧气的溶解度减小
C.铜器上生成的绿色物质可用稀盐酸除去
D.汽油和洗衣粉都能洗去衣服上的油迹,但原理不同
11.影响固体物质在水中溶解度大小的因素是( )
A.搅拌与振荡 B.水量的多少
C.温度 D.溶质的形状
12.许多科学知识在逻辑上存在如图所示关系。其中并列关系是由于分类依据的相同而把事物截然分开并列,而交叉关系是对事物分类时,由于采用不同的分类依据,则必然出现交叉关系,下列关于溶液说法正确的是
A.饱和溶液包含浓溶液 B.饱和溶液与稀溶液属于并列关系
C.饱和溶液与不饱和溶液属于交叉关系 D.不饱和溶液与稀溶液属于交叉关系
二、填空题
13.用下列适当的化学用语填空:溶解、乳化、过滤、煮沸、结晶、吸附。
(1)海水晒盐_______;
(2)用洗洁精洗去餐具上的油污_______;
(3)用活性炭除去毒气_______;
(4)用汽油除去手上的油污_______。
14.如图表示的是甲、乙两种固体物质的溶解度曲线,请回答下列问题。
(1)甲和乙溶解度相等的温度为____________________________°C;
(2)20 °C时甲物质的溶解度是____________________________g;若将此时甲的饱和溶液降温至10 °C,则溶质的质量____________________________.(填“增大”、“减小”或“不变”);
(3)欲使接近饱和的甲溶液变成饱和溶液,可以采取的措施是____________________________。
(4)当甲中含有少量乙时,通常提纯甲的方法是____________________________。
三、推断题
15.碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域,制取碳酸钾的工艺流程示意图如图:
温度/℃ 0 10 20 30 40 60 80 100
K2CO3的溶解度/g 107.0 109.0 111.0 114.0 117.0 126.0 139.0 156.0
KCl的溶解度/g 28 31 34 37 40 45 51 56
根据如图图表信息,回答下列问题:
(1)生成碳酸钾的化学方程式为______。
(2)上述流程中可循环使用的物质是______,NH4Cl在农业上可用作______。
(3)得到K2CO3晶浆的结晶方法是______。
(4)上述流程中洗涤K2CO3晶体应选用______(填序号)。
①NH4Cl溶液 ②热水 ③饱和K2CO3溶液
(5)往40℃700g氯化钾饱和溶液中,不断通入氨气和二氧化碳,控制温度在60~80℃之间,充分吸收混合。在有机萃取后,冷却至20℃时,理论上能得到K2CO3晶体______g。(忽略实验过程中的水分蒸发,结果保留整数)
(6)某CaCl2中混有KCl杂质,简述提纯该CaCl2的实验操作:______。
四、实验题
16.化学实验是科学探究的重要途径,请根据下列实验图示回答相关问题
(1)A是实验室制备气体的发生与收集装置,用过氧化氢溶液与二氧化锰制取氧气的化学方程式为_____制取氧气、二氧化碳可使用同样的发生装置,原因是_____。
(2)B实验中设计合理的是___(填“①”或“②”);另一装置设计中存在的问题是_____。
(3)C实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为____(填序号),步骤⑤中玻璃棒的作用是_____;若按照②③①的步骤配制50g16%的氯化钠溶液,所配制溶液的溶质质量分数______(填“偏大”或“偏小”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、溶液是均一、稳定的混合物,均一、稳定的液体不一定是混合物,例如蒸馏水,故A错;
B、用汽油洗去衣服上的油渍是溶解现象,故B错;
C、在同一温度,同一溶质,饱和溶液比不饱和溶液浓;饱和溶液不一定比不饱和溶液浓,故C错;
D、析出晶体后的溶液是饱和溶液,故D正确。
故选D。
【点睛】溶液是一种均一稳定的混合物,溶质可以有多种,溶质可以是固体、气体、液体。
2.D
【详解】A、根据质量守恒定律可知反应前后元素种类不变,所以只有含有氧元素的物质反应才有可能产生氧气,故A说法正确;
B、气体的溶解度与温度成反比,即夏天温度升高,氧气的溶解度减小,水中溶解的氧气少,所以夏天鱼池内开启增氧泵,故B说法正确;
C、硫在O2里燃烧产生明亮的蓝紫色火焰,生成有刺激性气味的气体,放出热量,故C说法正确;
D、氧气具有助燃性,可以支持燃烧,但不具有可燃性,故D说法错误。
故选D。
3.D
【详解】A、硝酸钾的溶解度受温度的影响较大,但并不是说只要降温就能析出晶体,必须是达到饱和之后,继续降温才会析出晶体,故A错误;
B、硝酸铵溶于水的时候,吸热和放热是同时进行的,只是吸收的热量大于了放出的热量,从而使温度降低,故B错误;
C、二氧化碳溶于水后和水发生了化学反应生成了碳酸,所以其水溶液中的溶质为碳酸,故C错误;
D、在溶液中含有水时一般把水作为溶剂,而酒精和水能以任意比率互溶,所以不可能得到酒精的饱和溶液,故D正确。
故选D。
4.A
【详解】A、该实验中,溶剂种类不同,其它因素均相同,故可以探究溶剂种类对物质溶解性的影响,符合题意;
B、该实验中,木炭在空气中燃烧生成二氧化碳,二氧化碳是气体,化学反应前后,压强变化不大,无法测定空气中氧气含量,不符合题意;
C、该实验中,铜片上的白磷与氧气接触,温度达到了着火点,燃烧,红磷与氧气接触,温度没有达到着火点,不燃烧,说明燃烧需要温度达到可燃物的着火点,无法探究可燃物燃烧的另一条件,不符合题意;
D、该实验中,过氧化氢溶液的浓度不同,变量不唯一,无法探究二氧化锰的催化作用,不符合题意。
故选A。
5.C
【详解】因某温度时,甲物质的溶解度是40g,所以将50g甲物质投入到100g水中时,溶解的溶质为40g,所得溶液为140g,所以所得溶液中溶质的质量分数=×100%=28.6%。
综上所述:选择C。
6.D
【详解】A、通过分析溶解度曲线可知,只有在t1℃时,甲、乙两物质的溶解度相同;溶解度是否相同需要指明温度,故选项错误;
B、t2℃时,甲物质的溶解度是50g,所以将25g甲与100g水混合可得到甲的不饱和溶液,故选项错误;
C、t2℃时,甲、乙饱和溶液降温至t1℃,饱和溶液的质量不能确定,析出固体的质量也不能确定,故选项错误;
D、甲物质的溶解度随温度的升高而增大,所以升高温度可以将甲的饱和溶液变为不饱和溶液,故选项正确。故选D。
7.A
【详解】A、溶液是由溶质和溶剂混合而成的均一、稳定的混合物,故A符合题意;
B、饱和溶液不一定是浓溶液,是常温下,氢氧化钙的饱和溶液是稀溶液,不饱和溶液不一定是稀溶液,如常温下,硝酸钾的饱和溶液是浓溶液,故B不符合题意;
C、均一、稳定的液体不一定是溶液,比如水,故C不符合题意;
D、溶液是透明的,但是不一定是无色的,如硫酸铜溶液是蓝色的,故D不符合题意。
故选A。
8.C
【分析】在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液;还能继续溶解的溶液,叫做这种溶质的不饱和溶液。判断方法:加入溶质后不能溶解的是饱和溶液,还能继续溶解的是不饱和溶液。据此分析。可知在一定的温度下,向不饱和的 NaNO3 溶液中,逐渐加入 NaNO3 晶体,原有溶质质量会增多,溶质质量分数变大至饱和状态时不再溶解,故不再变化,
【详解】A、根据分析判断图中所示溶质质量分数开始时不是零,不符题意,故错误;
B、根据分析判断图中所示溶质质量分数一直不变,不符题意,故错误;
C、根据分析判断图中所示溶质质量分数开始时不是零,后逐渐增多至饱和时不再变化,符合题意,正确;
D、根据分析判断图中所示溶质质量分数一直增多,不符题意,故错误;
答案为:C
9.B
【详解】A、t1℃时,甲和乙的溶解度相等,甲、乙两种物质的饱和溶液中,溶质质量分数相等,没有确定溶液的状态,不能判定t1℃时,甲、乙两种物质的溶液中溶质质量分数相等,故A错误;
B、t2℃时,甲的溶解度是50g,将40g甲物质加入50g水中,只有25g甲物质溶解,所以充分溶解后溶液的质量为75g,故B正确;
C、甲、乙两种物质的溶解度都随温度的降低而降低,甲物质的溶解度受温度变化影响较大,乙的溶解度受温度影响较小,所以甲物质中混有少量乙物质,可采用降温结晶的方法提纯甲,故C错误;
D、没有确定溶液的质量,不能确定由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量,故D错误。故选B。
10.A
【详解】A、搅拌能加快蔗糖在水中的溶解,其原因是增大了蔗糖与水的接触面积,并不会增大溶解度,错误;
B、气体溶解度随温度的升高而降低,随压强的增大而增大,所以天气闷热时,鱼会在接近水面处游动,原因是温度升高气压变小,氧气的溶解度减小,正确;
C、铜器上生成的绿色物质,是碱式碳酸铜,,可用稀盐酸除去,正确;
D、汽油和洗衣粉都能洗去衣服上的油迹,但汽油是溶解油迹,而洗衣粉是乳化,原理不同,正确。
故选A。
11.C
【详解】溶解度是在一定温度下、100g溶剂里,达到饱和时所溶解的某固体物质的质量。所以影响固体物质在水中溶解度大小的因素是温度。故选C。
12.D
【分析】饱和溶液是指不能再继续溶剂该溶质的溶质,不饱和溶液是指还能继续溶解该溶质的溶液,溶液是否饱和与溶液的浓稀没有关系。
【详解】A、饱和溶液不一定属于浓溶液,浓溶液也不一定都是饱和溶液,它们属于交叉关系,该选项说法不正确;
B、饱和溶液可能为稀溶液,它们属于交叉关系,该选项说法不正确;
C、饱和溶液与不饱和溶液属于并列关系,该选项说法不正确;
D、不饱和溶液可能为稀溶液,它们属于交叉关系,该选项说法正确。
故选D。
13.(1)结晶
(2)乳化
(3)吸附
(4)溶解
【详解】(1)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,利用了蒸发结晶的原理。
(2)洗洁精具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,可用洗洁精洗去餐具上的油污
(3)活性炭具有吸附性,能吸附异味和色素等,可用活性炭除去毒气。
(4)汽油能溶解油污,可用汽油除去手上的油污。
14. 10 40 减小 增加溶质(或降低温度、蒸发溶剂) 冷却甲的热饱和溶液(或降温结晶)
【分析】由甲、乙两种固体物质的溶解度曲线可知,甲、乙两种固体物质的溶解度随温度的升高均增大,甲的溶解度受温度的影响较大。
【详解】(1)根据溶解度曲线可知10 °C时,甲、乙两种固体物质的溶解度曲线相交,则甲物质与乙物质的溶解度相同,故甲和乙溶解度相等的温度为10°C。
(2)由甲、乙两种固体物质的溶解度曲线可知,20 °C时,甲物质的溶解度为40g;若将20°C时甲的饱和溶液降温至10°C,甲的溶解度减小,溶液中有固体析出,导致溶质的质量减小。
(3) 甲物质的溶解度随温度的升高而增大,欲使接近饱和的甲溶液变成饱和溶液,可以采取的措施是增加溶质、降低温度或蒸发溶剂。
(4)甲物质的溶解度受温度的变化影响较大,乙的溶解度受温度的变化影响较小,当甲中含有少量乙时,提纯甲的方法是冷却甲的热饱和溶液或降温结晶。
【点睛】溶解度受温度的变化影响较大,提纯方法是降温结晶,溶解度受温度的变化影响较小,提纯方法是蒸发结晶。
15.(1)
(2) 有机萃剂 氮肥
(3)蒸发结晶
(4)③
(5)185
(6)加入足量的碳酸钾,过滤、洗涤,往滤渣中加入适量的稀盐酸,蒸发结晶的氯化钙
【解析】(1)
由流程图可知,饱和氯化钾溶液与氨气、二氧化碳反应生成碳酸钾和氯化铵,反应的化学方程式为:
(2)
由流程图可知,可循环使用的物质是有机萃剂。氯化铵含氮元素,在农业上可用作氮肥。
(3)
由表中数据可知,碳酸钾的溶解度受温度影响不大,故得到K2CO3晶浆的方法是蒸发结晶。
(4)
①NH4Cl溶液能溶解碳酸钾,不能用来洗涤碳酸钾晶体;②热水能溶解碳酸钾,不能用来洗涤碳酸钾晶体;③饱和K2CO3溶液不能继续溶解碳酸钾,可用来洗涤碳酸钾晶体,因此选③。
(5)
设40℃700g氯化钾饱和溶液中含碳酸钾质量为
设生成碳酸钾质量为
(6)
提纯该CaCl2的实验操作:加入足量的碳酸钾,过滤、洗涤,往滤渣中加入适量的稀盐酸,蒸发结晶的氯化钙。
16.(1) 反应物都是固体和液体,且不需加热
(2) ① 装置不密封,生成的二氧化碳扩散到空气中,没有称量计入反应后的总质量
(3) ①④⑤ 搅拌防止液体局部过热导致液滴飞溅 偏小
【详解】(1)过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为,制取二氧化碳的反应为碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应均在常温下发生,且反应物都是固体和液体,则制取氧气、二氧化碳可使用同样的发生装置,原因是反应物都是固体和液体,且不需加热。
(2)验证质量守恒定律,有气体逸出的装置需要密封处理,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,②没有密封,二氧化碳气体逸出,导致实验失败,则B实验中设计合理的是①;另一装置设计中存在的问题是装置不密封,生成的二氧化碳扩散到空气中,没有称量计入反应后的总质量。
(3)粗盐提纯的步骤是溶解、过滤、蒸发,故C实验中,若要除去粗盐中难溶性的杂质,正确操作步骤为是①④⑤;蒸发时用玻璃棒搅拌,是为了防止局部温度过高,使液滴飞溅,故步骤⑤中玻璃棒的作用是搅拌防止液体局部过热导致液滴飞溅;若按照②③①的步骤配制50g16%的氯化钠溶液,仰视读数量取液体时,读数偏小,实际量取的液体体积偏大,量取到的液体量偏多,溶质不变,溶剂增多,故所配制溶液的溶质质量分数偏小。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关溶液的说法中正确的是( )
A.均一、稳定的液体都是溶液 B.用汽油洗去衣服上的油渍是乳化作用的结果
C.饱和溶液一定比不饱和溶液浓 D.析出晶体后的溶液是饱和溶液
2.人的生存离不开氧气,下列有关氧气的说法不正确的是( )
A.用含有氧元素的物质反应才有可能产生氧气
B.夏天鱼池内开启增氧泵,是因为温度升高,氧气在水中溶解量减少
C.硫在O2里燃烧产生明亮的蓝紫色火焰
D.氧气可以支持燃烧,说明氧气具有可燃性
3.下列分析推理正确的是
A.硝酸钾的溶解度受温度影响大,其溶液只要降温就能析出晶体
B.硝酸铵溶于水时吸热,说明硝酸铵溶解时只发生吸热过程
C.CO2可溶于水,所以其水溶液中的溶质是CO2
D.酒精与水可任意比率互溶,所以不可能制得酒精的饱和溶液
4.下列图示实验能达到目的的是
A.探究溶剂种类对物质溶解性的影响
B.测定空气中O2的含量
C.探究可燃物燃烧的条件
D.探究MnO2的催化作用
5.某温度时,甲物质的溶解度是40g,该温度时,将50g甲物质投入到100g水中,充分搅拌,所得溶液的溶质质量分数是
A.50% B.33.3% C.28.6% D.40%
6.如图是甲、乙两种固体物质的溶解度曲线。下列说法中正确的是( )
A.甲、乙两物质的溶解度相同
B.t2℃时,将25g甲与100g水混合可得到甲的饱和溶液
C.t2℃时,甲、乙饱和溶液降温至t1℃,甲析出固体的质量大于乙析出固体的质量
D.升高温度可以将甲的饱和溶液变为不饱和溶液
7.下列关于溶液的说法正确的是
A.溶液是具有均一性、稳定性的混合物
B.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C.均一、稳定的液体一定是溶液
D.溶液都是无色透明的液体
8.在一定的温度下,向不饱和的 NaNO3溶液中,逐渐加入 NaNO3晶体,下列图像中符合加入 NaNO3晶体的质量和溶液中的溶质质量变化规律的是
A. B.
C. D.
9.下图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.t1℃时,甲、乙两种物质的溶液中溶质质量分数相等
B.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为75g
C.甲物质中混有少量乙物质,可采用蒸发结晶的方法提纯甲
D.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
10.学习了化学以后,要能运用化学知识解释日常生活中的现象,分析和解决生产生活中的实际问题。下列说法中错误的是
A.搅拌能加快蔗糖在水中的溶解,其原因是增大了蔗糖的溶解度
B.天气闷热时,鱼会在接近水面处游动,原因是温度升高气压变小,氧气的溶解度减小
C.铜器上生成的绿色物质可用稀盐酸除去
D.汽油和洗衣粉都能洗去衣服上的油迹,但原理不同
11.影响固体物质在水中溶解度大小的因素是( )
A.搅拌与振荡 B.水量的多少
C.温度 D.溶质的形状
12.许多科学知识在逻辑上存在如图所示关系。其中并列关系是由于分类依据的相同而把事物截然分开并列,而交叉关系是对事物分类时,由于采用不同的分类依据,则必然出现交叉关系,下列关于溶液说法正确的是
A.饱和溶液包含浓溶液 B.饱和溶液与稀溶液属于并列关系
C.饱和溶液与不饱和溶液属于交叉关系 D.不饱和溶液与稀溶液属于交叉关系
二、填空题
13.用下列适当的化学用语填空:溶解、乳化、过滤、煮沸、结晶、吸附。
(1)海水晒盐_______;
(2)用洗洁精洗去餐具上的油污_______;
(3)用活性炭除去毒气_______;
(4)用汽油除去手上的油污_______。
14.如图表示的是甲、乙两种固体物质的溶解度曲线,请回答下列问题。
(1)甲和乙溶解度相等的温度为____________________________°C;
(2)20 °C时甲物质的溶解度是____________________________g;若将此时甲的饱和溶液降温至10 °C,则溶质的质量____________________________.(填“增大”、“减小”或“不变”);
(3)欲使接近饱和的甲溶液变成饱和溶液,可以采取的措施是____________________________。
(4)当甲中含有少量乙时,通常提纯甲的方法是____________________________。
三、推断题
15.碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域,制取碳酸钾的工艺流程示意图如图:
温度/℃ 0 10 20 30 40 60 80 100
K2CO3的溶解度/g 107.0 109.0 111.0 114.0 117.0 126.0 139.0 156.0
KCl的溶解度/g 28 31 34 37 40 45 51 56
根据如图图表信息,回答下列问题:
(1)生成碳酸钾的化学方程式为______。
(2)上述流程中可循环使用的物质是______,NH4Cl在农业上可用作______。
(3)得到K2CO3晶浆的结晶方法是______。
(4)上述流程中洗涤K2CO3晶体应选用______(填序号)。
①NH4Cl溶液 ②热水 ③饱和K2CO3溶液
(5)往40℃700g氯化钾饱和溶液中,不断通入氨气和二氧化碳,控制温度在60~80℃之间,充分吸收混合。在有机萃取后,冷却至20℃时,理论上能得到K2CO3晶体______g。(忽略实验过程中的水分蒸发,结果保留整数)
(6)某CaCl2中混有KCl杂质,简述提纯该CaCl2的实验操作:______。
四、实验题
16.化学实验是科学探究的重要途径,请根据下列实验图示回答相关问题
(1)A是实验室制备气体的发生与收集装置,用过氧化氢溶液与二氧化锰制取氧气的化学方程式为_____制取氧气、二氧化碳可使用同样的发生装置,原因是_____。
(2)B实验中设计合理的是___(填“①”或“②”);另一装置设计中存在的问题是_____。
(3)C实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为____(填序号),步骤⑤中玻璃棒的作用是_____;若按照②③①的步骤配制50g16%的氯化钠溶液,所配制溶液的溶质质量分数______(填“偏大”或“偏小”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、溶液是均一、稳定的混合物,均一、稳定的液体不一定是混合物,例如蒸馏水,故A错;
B、用汽油洗去衣服上的油渍是溶解现象,故B错;
C、在同一温度,同一溶质,饱和溶液比不饱和溶液浓;饱和溶液不一定比不饱和溶液浓,故C错;
D、析出晶体后的溶液是饱和溶液,故D正确。
故选D。
【点睛】溶液是一种均一稳定的混合物,溶质可以有多种,溶质可以是固体、气体、液体。
2.D
【详解】A、根据质量守恒定律可知反应前后元素种类不变,所以只有含有氧元素的物质反应才有可能产生氧气,故A说法正确;
B、气体的溶解度与温度成反比,即夏天温度升高,氧气的溶解度减小,水中溶解的氧气少,所以夏天鱼池内开启增氧泵,故B说法正确;
C、硫在O2里燃烧产生明亮的蓝紫色火焰,生成有刺激性气味的气体,放出热量,故C说法正确;
D、氧气具有助燃性,可以支持燃烧,但不具有可燃性,故D说法错误。
故选D。
3.D
【详解】A、硝酸钾的溶解度受温度的影响较大,但并不是说只要降温就能析出晶体,必须是达到饱和之后,继续降温才会析出晶体,故A错误;
B、硝酸铵溶于水的时候,吸热和放热是同时进行的,只是吸收的热量大于了放出的热量,从而使温度降低,故B错误;
C、二氧化碳溶于水后和水发生了化学反应生成了碳酸,所以其水溶液中的溶质为碳酸,故C错误;
D、在溶液中含有水时一般把水作为溶剂,而酒精和水能以任意比率互溶,所以不可能得到酒精的饱和溶液,故D正确。
故选D。
4.A
【详解】A、该实验中,溶剂种类不同,其它因素均相同,故可以探究溶剂种类对物质溶解性的影响,符合题意;
B、该实验中,木炭在空气中燃烧生成二氧化碳,二氧化碳是气体,化学反应前后,压强变化不大,无法测定空气中氧气含量,不符合题意;
C、该实验中,铜片上的白磷与氧气接触,温度达到了着火点,燃烧,红磷与氧气接触,温度没有达到着火点,不燃烧,说明燃烧需要温度达到可燃物的着火点,无法探究可燃物燃烧的另一条件,不符合题意;
D、该实验中,过氧化氢溶液的浓度不同,变量不唯一,无法探究二氧化锰的催化作用,不符合题意。
故选A。
5.C
【详解】因某温度时,甲物质的溶解度是40g,所以将50g甲物质投入到100g水中时,溶解的溶质为40g,所得溶液为140g,所以所得溶液中溶质的质量分数=×100%=28.6%。
综上所述:选择C。
6.D
【详解】A、通过分析溶解度曲线可知,只有在t1℃时,甲、乙两物质的溶解度相同;溶解度是否相同需要指明温度,故选项错误;
B、t2℃时,甲物质的溶解度是50g,所以将25g甲与100g水混合可得到甲的不饱和溶液,故选项错误;
C、t2℃时,甲、乙饱和溶液降温至t1℃,饱和溶液的质量不能确定,析出固体的质量也不能确定,故选项错误;
D、甲物质的溶解度随温度的升高而增大,所以升高温度可以将甲的饱和溶液变为不饱和溶液,故选项正确。故选D。
7.A
【详解】A、溶液是由溶质和溶剂混合而成的均一、稳定的混合物,故A符合题意;
B、饱和溶液不一定是浓溶液,是常温下,氢氧化钙的饱和溶液是稀溶液,不饱和溶液不一定是稀溶液,如常温下,硝酸钾的饱和溶液是浓溶液,故B不符合题意;
C、均一、稳定的液体不一定是溶液,比如水,故C不符合题意;
D、溶液是透明的,但是不一定是无色的,如硫酸铜溶液是蓝色的,故D不符合题意。
故选A。
8.C
【分析】在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液;还能继续溶解的溶液,叫做这种溶质的不饱和溶液。判断方法:加入溶质后不能溶解的是饱和溶液,还能继续溶解的是不饱和溶液。据此分析。可知在一定的温度下,向不饱和的 NaNO3 溶液中,逐渐加入 NaNO3 晶体,原有溶质质量会增多,溶质质量分数变大至饱和状态时不再溶解,故不再变化,
【详解】A、根据分析判断图中所示溶质质量分数开始时不是零,不符题意,故错误;
B、根据分析判断图中所示溶质质量分数一直不变,不符题意,故错误;
C、根据分析判断图中所示溶质质量分数开始时不是零,后逐渐增多至饱和时不再变化,符合题意,正确;
D、根据分析判断图中所示溶质质量分数一直增多,不符题意,故错误;
答案为:C
9.B
【详解】A、t1℃时,甲和乙的溶解度相等,甲、乙两种物质的饱和溶液中,溶质质量分数相等,没有确定溶液的状态,不能判定t1℃时,甲、乙两种物质的溶液中溶质质量分数相等,故A错误;
B、t2℃时,甲的溶解度是50g,将40g甲物质加入50g水中,只有25g甲物质溶解,所以充分溶解后溶液的质量为75g,故B正确;
C、甲、乙两种物质的溶解度都随温度的降低而降低,甲物质的溶解度受温度变化影响较大,乙的溶解度受温度影响较小,所以甲物质中混有少量乙物质,可采用降温结晶的方法提纯甲,故C错误;
D、没有确定溶液的质量,不能确定由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量,故D错误。故选B。
10.A
【详解】A、搅拌能加快蔗糖在水中的溶解,其原因是增大了蔗糖与水的接触面积,并不会增大溶解度,错误;
B、气体溶解度随温度的升高而降低,随压强的增大而增大,所以天气闷热时,鱼会在接近水面处游动,原因是温度升高气压变小,氧气的溶解度减小,正确;
C、铜器上生成的绿色物质,是碱式碳酸铜,,可用稀盐酸除去,正确;
D、汽油和洗衣粉都能洗去衣服上的油迹,但汽油是溶解油迹,而洗衣粉是乳化,原理不同,正确。
故选A。
11.C
【详解】溶解度是在一定温度下、100g溶剂里,达到饱和时所溶解的某固体物质的质量。所以影响固体物质在水中溶解度大小的因素是温度。故选C。
12.D
【分析】饱和溶液是指不能再继续溶剂该溶质的溶质,不饱和溶液是指还能继续溶解该溶质的溶液,溶液是否饱和与溶液的浓稀没有关系。
【详解】A、饱和溶液不一定属于浓溶液,浓溶液也不一定都是饱和溶液,它们属于交叉关系,该选项说法不正确;
B、饱和溶液可能为稀溶液,它们属于交叉关系,该选项说法不正确;
C、饱和溶液与不饱和溶液属于并列关系,该选项说法不正确;
D、不饱和溶液可能为稀溶液,它们属于交叉关系,该选项说法正确。
故选D。
13.(1)结晶
(2)乳化
(3)吸附
(4)溶解
【详解】(1)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,利用了蒸发结晶的原理。
(2)洗洁精具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,可用洗洁精洗去餐具上的油污
(3)活性炭具有吸附性,能吸附异味和色素等,可用活性炭除去毒气。
(4)汽油能溶解油污,可用汽油除去手上的油污。
14. 10 40 减小 增加溶质(或降低温度、蒸发溶剂) 冷却甲的热饱和溶液(或降温结晶)
【分析】由甲、乙两种固体物质的溶解度曲线可知,甲、乙两种固体物质的溶解度随温度的升高均增大,甲的溶解度受温度的影响较大。
【详解】(1)根据溶解度曲线可知10 °C时,甲、乙两种固体物质的溶解度曲线相交,则甲物质与乙物质的溶解度相同,故甲和乙溶解度相等的温度为10°C。
(2)由甲、乙两种固体物质的溶解度曲线可知,20 °C时,甲物质的溶解度为40g;若将20°C时甲的饱和溶液降温至10°C,甲的溶解度减小,溶液中有固体析出,导致溶质的质量减小。
(3) 甲物质的溶解度随温度的升高而增大,欲使接近饱和的甲溶液变成饱和溶液,可以采取的措施是增加溶质、降低温度或蒸发溶剂。
(4)甲物质的溶解度受温度的变化影响较大,乙的溶解度受温度的变化影响较小,当甲中含有少量乙时,提纯甲的方法是冷却甲的热饱和溶液或降温结晶。
【点睛】溶解度受温度的变化影响较大,提纯方法是降温结晶,溶解度受温度的变化影响较小,提纯方法是蒸发结晶。
15.(1)
(2) 有机萃剂 氮肥
(3)蒸发结晶
(4)③
(5)185
(6)加入足量的碳酸钾,过滤、洗涤,往滤渣中加入适量的稀盐酸,蒸发结晶的氯化钙
【解析】(1)
由流程图可知,饱和氯化钾溶液与氨气、二氧化碳反应生成碳酸钾和氯化铵,反应的化学方程式为:
(2)
由流程图可知,可循环使用的物质是有机萃剂。氯化铵含氮元素,在农业上可用作氮肥。
(3)
由表中数据可知,碳酸钾的溶解度受温度影响不大,故得到K2CO3晶浆的方法是蒸发结晶。
(4)
①NH4Cl溶液能溶解碳酸钾,不能用来洗涤碳酸钾晶体;②热水能溶解碳酸钾,不能用来洗涤碳酸钾晶体;③饱和K2CO3溶液不能继续溶解碳酸钾,可用来洗涤碳酸钾晶体,因此选③。
(5)
设40℃700g氯化钾饱和溶液中含碳酸钾质量为
设生成碳酸钾质量为
(6)
提纯该CaCl2的实验操作:加入足量的碳酸钾,过滤、洗涤,往滤渣中加入适量的稀盐酸,蒸发结晶的氯化钙。
16.(1) 反应物都是固体和液体,且不需加热
(2) ① 装置不密封,生成的二氧化碳扩散到空气中,没有称量计入反应后的总质量
(3) ①④⑤ 搅拌防止液体局部过热导致液滴飞溅 偏小
【详解】(1)过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为,制取二氧化碳的反应为碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应均在常温下发生,且反应物都是固体和液体,则制取氧气、二氧化碳可使用同样的发生装置,原因是反应物都是固体和液体,且不需加热。
(2)验证质量守恒定律,有气体逸出的装置需要密封处理,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,②没有密封,二氧化碳气体逸出,导致实验失败,则B实验中设计合理的是①;另一装置设计中存在的问题是装置不密封,生成的二氧化碳扩散到空气中,没有称量计入反应后的总质量。
(3)粗盐提纯的步骤是溶解、过滤、蒸发,故C实验中,若要除去粗盐中难溶性的杂质,正确操作步骤为是①④⑤;蒸发时用玻璃棒搅拌,是为了防止局部温度过高,使液滴飞溅,故步骤⑤中玻璃棒的作用是搅拌防止液体局部过热导致液滴飞溅;若按照②③①的步骤配制50g16%的氯化钠溶液,仰视读数量取液体时,读数偏小,实际量取的液体体积偏大,量取到的液体量偏多,溶质不变,溶剂增多,故所配制溶液的溶质质量分数偏小。
答案第1页,共2页
答案第1页,共2页
同课章节目录
