第5章初识酸和碱检测题(含答案)-2022-2023学年九年级化学沪教版(上海)第二学期
文档属性
| 名称 | 第5章初识酸和碱检测题(含答案)-2022-2023学年九年级化学沪教版(上海)第二学期 |  | |
| 格式 | docx | ||
| 文件大小 | 84.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-17 16:10:37 | ||
图片预览


文档简介
第5章《初识酸和碱》检测题
一、单选题
1.下列物质分类正确的是
①液态空气 ②冰水混合物 ③二氧化碳 ④铁粉 ⑤氮气 ⑥高锰酸钾
A.混合物①② B.化合物②③④⑥ C.单质①④⑤ D.氧化物②③
2.下列物质中,属于酸的是
A.BaSO4 B.HCl C.Na D.C2H5OH
3.部分含硫元素的物质分类与硫元素化合价关系如图所示,下列说法错误的是
A.图中x为﹣2
B.物质a在空气中燃烧产生淡蓝色火焰
C.物质b是形成酸雨的物质之一
D.物质b与碱反应转化为d
4.向一定质量的CuSO4溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势,如图所示,下列有关说法不正确的是
A.b点时所加试剂一定是稀盐酸
B.加入试剂总体极为V1时,溶液中不存在NaOH
C.c点时溶液中的溶质都是盐
D.a点时溶液中一定不存在Cu2+
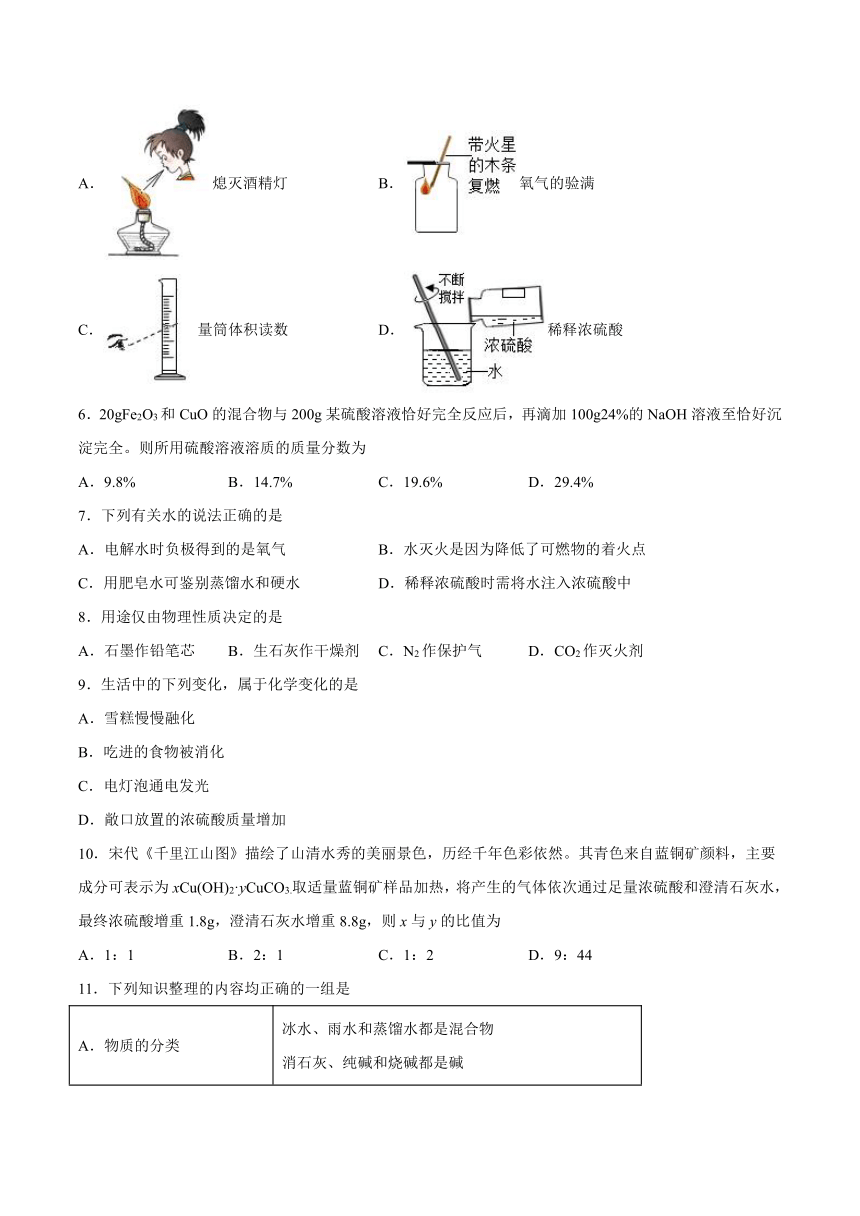
5.下列实验操作正确的是
A.熄灭酒精灯 B.氧气的验满
C. 量筒体积读数 D.稀释浓硫酸
6.20gFe2O3和CuO的混合物与200g某硫酸溶液恰好完全反应后,再滴加100g24%的NaOH溶液至恰好沉淀完全。则所用硫酸溶液溶质的质量分数为
A.9.8% B.14.7% C.19.6% D.29.4%
7.下列有关水的说法正确的是
A.电解水时负极得到的是氧气 B.水灭火是因为降低了可燃物的着火点
C.用肥皂水可鉴别蒸馏水和硬水 D.稀释浓硫酸时需将水注入浓硫酸中
8.用途仅由物理性质决定的是
A.石墨作铅笔芯 B.生石灰作干燥剂 C.N2作保护气 D.CO2作灭火剂
9.生活中的下列变化,属于化学变化的是
A.雪糕慢慢融化
B.吃进的食物被消化
C.电灯泡通电发光
D.敞口放置的浓硫酸质量增加
10.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然。其青色来自蓝铜矿颜料,主要成分可表示为xCu(OH)2·yCuCO3.取适量蓝铜矿样品加热,将产生的气体依次通过足量浓硫酸和澄清石灰水,最终浓硫酸增重1.8g,澄清石灰水增重8.8g,则x与y的比值为
A.1:1 B.2:1 C.1:2 D.9:44
11.下列知识整理的内容均正确的一组是
A.物质的分类 冰水、雨水和蒸馏水都是混合物 消石灰、纯碱和烧碱都是碱
B.物质的检验 用灼烧的方法能区别棉花和羊毛 用酚酞溶液能区分熟石灰和氢氧化钠
C.“低碳经济”的措施 减少煤、石油和天然气等化石燃料的使用 鼓励乘坐公交车出行,倡导低碳生活
D.化学与生活、生产 用甲醛溶液浸泡海产品保鲜 硫酸铵不能与草木灰(碱性物质)混合施用
A.A B.B C.C D.D
12.推理是一种重要的化学思维方法,以下推理合理的是
A.水和双氧水的组成元素相同,所以它们的化学性质相同
B.离子是带电的原子或原子团,所以带电的粒子一定是离子
C.碱溶液呈碱性,所以呈碱性的溶液都是碱溶液
D.化合物是由不同种元素组成的,所以只含一种元素的物质一定不是化合物
二、填空题
13.用符合要求的物质的序号填空
①空气 ②聚氯乙烯 ③熟石灰 ④稀盐酸 ⑤聚乙烯
(1)常用于食品包装的是________。
(2)常用于工业制取氧气的是________。
(3)常用于金属除锈的是________。
(4)常用于改良酸性土壤的是________。
14.A、B、C、D、E五种初中化学常见物质由碳、氢、氧、钙四种元素中的两种或三种组成。(提示:Ca(OH)2 +2HCl =CaCl2+2H2O)
(1)A是大理石的主要成分,其化学式为__________。
(2)B是一种氧化物,遇水会放出大量热,生成C,反应的化学方程式为__________。
(3)D被看作清洁能源,与氧气反应的微观示意图如图,请在方框内补齐相应微粒的图示_________。
(4)如图所示,打开漏斗活塞,一定量C溶液流入集气瓶中,观察到溶液变浑浊。打开弹簧夹,观察到___________,最终得到无色溶液。该溶液的成分可能是__________。
15.回答下列问题:
(1)生石灰的化学式是_____。
(2)食醋的溶质的化学式是_____。
(3)正常雨水显酸性的原因是(用化学方程式表示)_____。
(4)氢氧化钠溶液密封保存的原因(用化学方程式表示)_____。
三、简答题
16.⑴亚硝酸钠是一种工业用盐,它有毒,有咸味,外形与食盐相似。人若误食会引起中毒.亚硝酸钠的水溶液显碱性,食盐水溶液显中性.如何鉴别一瓶溶液是亚硝酸钠溶液还是食盐水____?
⑵使燃料充分燃烧,通常考虑哪些方面_____?
17.现有MgCO3和BaCO3组成的固体混合物6g,放入到100g某浓度的稀盐酸中恰好完全反应,得到不饱和溶液的质量为103.8g,则原固体混合物中Mg、Ba两种元素的质量分数总和为_____。
四、实验题
18.使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放。
(1)镁元素在自然界中是以______________(填“单质”或“化合物”)形式存在。
(2)工业制镁的一种原理是2MgO+Si+2CaO = 2Mg↑+Ca2SiO4,抽走容器中的空气对反应有促进作用,且能防止空气中的物质与Mg反应使产品混有____________(填化学式)。
(3)制镁的原料MgO可从海水中获得。小华利用镁与盐酸反应后的废液,模拟从海水中获取MgO的过程,实验如下:
步骤1:向上述废液中,边搅拌边分批加入CaO,至MgCl2完全沉淀为止,过滤得Mg(OH)2固体。共消耗8.4g CaO。
步骤2:将Mg(OH)2固体加热分解为MgO和水,所得MgO的质量为4.0g 。
①步骤2中Mg(OH)2分解的化学方程式为________________________________。
②通过所得MgO的质量计算上述废液中含MgCl2的质量m=______________g。
③分析实验数据,可知步骤Ⅰ中反生的化学反应有:
CaO+H2O=Ca(OH)2;Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓;____________________。
五、计算题
19.实验室用一氧化碳还原氧化铜制取铜。
(1)若用8g氧化铜与足量一氧化碳反应,能制得铜的质量为多少?
(2)若一氧化碳量不足,制得的铜中会含有少量未被还原的氧化铜。要除去其中的氧化铜,可向反应后所得固体混合物中加入足量 溶液,充分反应后, (填操作名称)。反应的化学方程式是 。
参考答案:
1.D 2.B 3.D 4.D 5.D 6.B 7.C 8.A 9.B 10.C 11.C 12.D
13.(1)⑤
(2)①
(3) ④
(4)③
14. CaCO3 CaO+H2O= Ca(OH)2 盐酸倒吸入集气瓶中,有气泡冒出 CaCl2或CaCl2、HCl
15. CaO CH3COOH CO2+H2O═H2CO3 CO2+2NaOH═Na2CO3+H2O
16. 操作:取两支试管分别加入少量亚硝酸钠溶液和食盐溶液,向两支试管中分别滴加无色酚酞试液。使无色酚酞变红的原溶液为亚硝酸钠溶液,不变色的原溶液为食盐水。 燃烧时有足够多的空气;燃料与空气要有足够大的接触面
17.50%
18. 化合物 MgO、Mg3N2或者C Mg(OH)2 MgO+ H2O 9.5 CaO+2HCl=CaCl2+ H2O
19.(1)设8g氧化铜与足量一氧化碳反应,能制得铜的质量为x。
答:8g氧化铜与足量一氧化碳反应,能制得铜的质量为6.4g。
(2)稀硫酸;过滤;CuO+H2SO4═CuSO4+H2O
一、单选题
1.下列物质分类正确的是
①液态空气 ②冰水混合物 ③二氧化碳 ④铁粉 ⑤氮气 ⑥高锰酸钾
A.混合物①② B.化合物②③④⑥ C.单质①④⑤ D.氧化物②③
2.下列物质中,属于酸的是
A.BaSO4 B.HCl C.Na D.C2H5OH
3.部分含硫元素的物质分类与硫元素化合价关系如图所示,下列说法错误的是
A.图中x为﹣2
B.物质a在空气中燃烧产生淡蓝色火焰
C.物质b是形成酸雨的物质之一
D.物质b与碱反应转化为d
4.向一定质量的CuSO4溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势,如图所示,下列有关说法不正确的是
A.b点时所加试剂一定是稀盐酸
B.加入试剂总体极为V1时,溶液中不存在NaOH
C.c点时溶液中的溶质都是盐
D.a点时溶液中一定不存在Cu2+
5.下列实验操作正确的是
A.熄灭酒精灯 B.氧气的验满
C. 量筒体积读数 D.稀释浓硫酸
6.20gFe2O3和CuO的混合物与200g某硫酸溶液恰好完全反应后,再滴加100g24%的NaOH溶液至恰好沉淀完全。则所用硫酸溶液溶质的质量分数为
A.9.8% B.14.7% C.19.6% D.29.4%
7.下列有关水的说法正确的是
A.电解水时负极得到的是氧气 B.水灭火是因为降低了可燃物的着火点
C.用肥皂水可鉴别蒸馏水和硬水 D.稀释浓硫酸时需将水注入浓硫酸中
8.用途仅由物理性质决定的是
A.石墨作铅笔芯 B.生石灰作干燥剂 C.N2作保护气 D.CO2作灭火剂
9.生活中的下列变化,属于化学变化的是
A.雪糕慢慢融化
B.吃进的食物被消化
C.电灯泡通电发光
D.敞口放置的浓硫酸质量增加
10.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然。其青色来自蓝铜矿颜料,主要成分可表示为xCu(OH)2·yCuCO3.取适量蓝铜矿样品加热,将产生的气体依次通过足量浓硫酸和澄清石灰水,最终浓硫酸增重1.8g,澄清石灰水增重8.8g,则x与y的比值为
A.1:1 B.2:1 C.1:2 D.9:44
11.下列知识整理的内容均正确的一组是
A.物质的分类 冰水、雨水和蒸馏水都是混合物 消石灰、纯碱和烧碱都是碱
B.物质的检验 用灼烧的方法能区别棉花和羊毛 用酚酞溶液能区分熟石灰和氢氧化钠
C.“低碳经济”的措施 减少煤、石油和天然气等化石燃料的使用 鼓励乘坐公交车出行,倡导低碳生活
D.化学与生活、生产 用甲醛溶液浸泡海产品保鲜 硫酸铵不能与草木灰(碱性物质)混合施用
A.A B.B C.C D.D
12.推理是一种重要的化学思维方法,以下推理合理的是
A.水和双氧水的组成元素相同,所以它们的化学性质相同
B.离子是带电的原子或原子团,所以带电的粒子一定是离子
C.碱溶液呈碱性,所以呈碱性的溶液都是碱溶液
D.化合物是由不同种元素组成的,所以只含一种元素的物质一定不是化合物
二、填空题
13.用符合要求的物质的序号填空
①空气 ②聚氯乙烯 ③熟石灰 ④稀盐酸 ⑤聚乙烯
(1)常用于食品包装的是________。
(2)常用于工业制取氧气的是________。
(3)常用于金属除锈的是________。
(4)常用于改良酸性土壤的是________。
14.A、B、C、D、E五种初中化学常见物质由碳、氢、氧、钙四种元素中的两种或三种组成。(提示:Ca(OH)2 +2HCl =CaCl2+2H2O)
(1)A是大理石的主要成分,其化学式为__________。
(2)B是一种氧化物,遇水会放出大量热,生成C,反应的化学方程式为__________。
(3)D被看作清洁能源,与氧气反应的微观示意图如图,请在方框内补齐相应微粒的图示_________。
(4)如图所示,打开漏斗活塞,一定量C溶液流入集气瓶中,观察到溶液变浑浊。打开弹簧夹,观察到___________,最终得到无色溶液。该溶液的成分可能是__________。
15.回答下列问题:
(1)生石灰的化学式是_____。
(2)食醋的溶质的化学式是_____。
(3)正常雨水显酸性的原因是(用化学方程式表示)_____。
(4)氢氧化钠溶液密封保存的原因(用化学方程式表示)_____。
三、简答题
16.⑴亚硝酸钠是一种工业用盐,它有毒,有咸味,外形与食盐相似。人若误食会引起中毒.亚硝酸钠的水溶液显碱性,食盐水溶液显中性.如何鉴别一瓶溶液是亚硝酸钠溶液还是食盐水____?
⑵使燃料充分燃烧,通常考虑哪些方面_____?
17.现有MgCO3和BaCO3组成的固体混合物6g,放入到100g某浓度的稀盐酸中恰好完全反应,得到不饱和溶液的质量为103.8g,则原固体混合物中Mg、Ba两种元素的质量分数总和为_____。
四、实验题
18.使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放。
(1)镁元素在自然界中是以______________(填“单质”或“化合物”)形式存在。
(2)工业制镁的一种原理是2MgO+Si+2CaO = 2Mg↑+Ca2SiO4,抽走容器中的空气对反应有促进作用,且能防止空气中的物质与Mg反应使产品混有____________(填化学式)。
(3)制镁的原料MgO可从海水中获得。小华利用镁与盐酸反应后的废液,模拟从海水中获取MgO的过程,实验如下:
步骤1:向上述废液中,边搅拌边分批加入CaO,至MgCl2完全沉淀为止,过滤得Mg(OH)2固体。共消耗8.4g CaO。
步骤2:将Mg(OH)2固体加热分解为MgO和水,所得MgO的质量为4.0g 。
①步骤2中Mg(OH)2分解的化学方程式为________________________________。
②通过所得MgO的质量计算上述废液中含MgCl2的质量m=______________g。
③分析实验数据,可知步骤Ⅰ中反生的化学反应有:
CaO+H2O=Ca(OH)2;Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓;____________________。
五、计算题
19.实验室用一氧化碳还原氧化铜制取铜。
(1)若用8g氧化铜与足量一氧化碳反应,能制得铜的质量为多少?
(2)若一氧化碳量不足,制得的铜中会含有少量未被还原的氧化铜。要除去其中的氧化铜,可向反应后所得固体混合物中加入足量 溶液,充分反应后, (填操作名称)。反应的化学方程式是 。
参考答案:
1.D 2.B 3.D 4.D 5.D 6.B 7.C 8.A 9.B 10.C 11.C 12.D
13.(1)⑤
(2)①
(3) ④
(4)③
14. CaCO3 CaO+H2O= Ca(OH)2 盐酸倒吸入集气瓶中,有气泡冒出 CaCl2或CaCl2、HCl
15. CaO CH3COOH CO2+H2O═H2CO3 CO2+2NaOH═Na2CO3+H2O
16. 操作:取两支试管分别加入少量亚硝酸钠溶液和食盐溶液,向两支试管中分别滴加无色酚酞试液。使无色酚酞变红的原溶液为亚硝酸钠溶液,不变色的原溶液为食盐水。 燃烧时有足够多的空气;燃料与空气要有足够大的接触面
17.50%
18. 化合物 MgO、Mg3N2或者C Mg(OH)2 MgO+ H2O 9.5 CaO+2HCl=CaCl2+ H2O
19.(1)设8g氧化铜与足量一氧化碳反应,能制得铜的质量为x。
答:8g氧化铜与足量一氧化碳反应,能制得铜的质量为6.4g。
(2)稀硫酸;过滤;CuO+H2SO4═CuSO4+H2O
