第11章酸与碱检测题(含答案)-2022-2023学年九年级化学京改版(2013)下册
文档属性
| 名称 | 第11章酸与碱检测题(含答案)-2022-2023学年九年级化学京改版(2013)下册 |  | |
| 格式 | docx | ||
| 文件大小 | 123.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-17 16:43:40 | ||
图片预览


文档简介
第11章《酸与碱》检测题
一、单选题
1.利用注射器进行电解水的创新实验,电极插人注射器筒内,装置示意图如下。下列说法不正确的是
A.水中加入少量氢氧化钠,作用是增强水的导电性
B.在反应一段时间后,NaOH溶液的pH减小
C.实验成功时,左边注射器收到的气体体积约是右边的2倍
D.两个注射器内的原始液面、电极长度要保持一致
2.下列有关酸的叙述正确的是
A.硫酸是重要的化工原料,可用于制化肥、农药、染料
B.盐酸敞口放置一段时间,质量会增加
C.浓硫酸沾到皮肤上应立即用大量水冲洗,然后涂上3%—5%的氢氧化钠溶液
D.某化合物化学式为H2SO3,该化合物不属于酸
3.除去下列物质中的少量杂质(括号内的为杂质),方法合理的是( )
A.CO2(CO):点燃 B.KNO3(K2SO4):溶解,加入过量的硝酸钡溶液
C.CaCl2(CaCO3):加水溶解、过滤、蒸发 D.铁粉(Fe2O3):加过量稀盐酸,过滤
4.下列说法合理的是
A.4克镁和2克氧气充分反应会生成6克氧化镁
B.水能灭火,主要是因为水蒸发吸热,降低了可燃物的着火点
C.可以用紫色石蕊试液来检验某一未知溶液的酸碱度
D.超导体电阻为零,可用做远距离输电线
5.逻辑推理是化学学习常用的思维方法,下列推理正确的是
A.水是纯净物,所以海水也是纯净物
B.分子是构成物质的微粒,因此物质都是由分子构成的
C.酸性溶液的pH都小于7,所以酸溶液pH一定小于7
D.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应
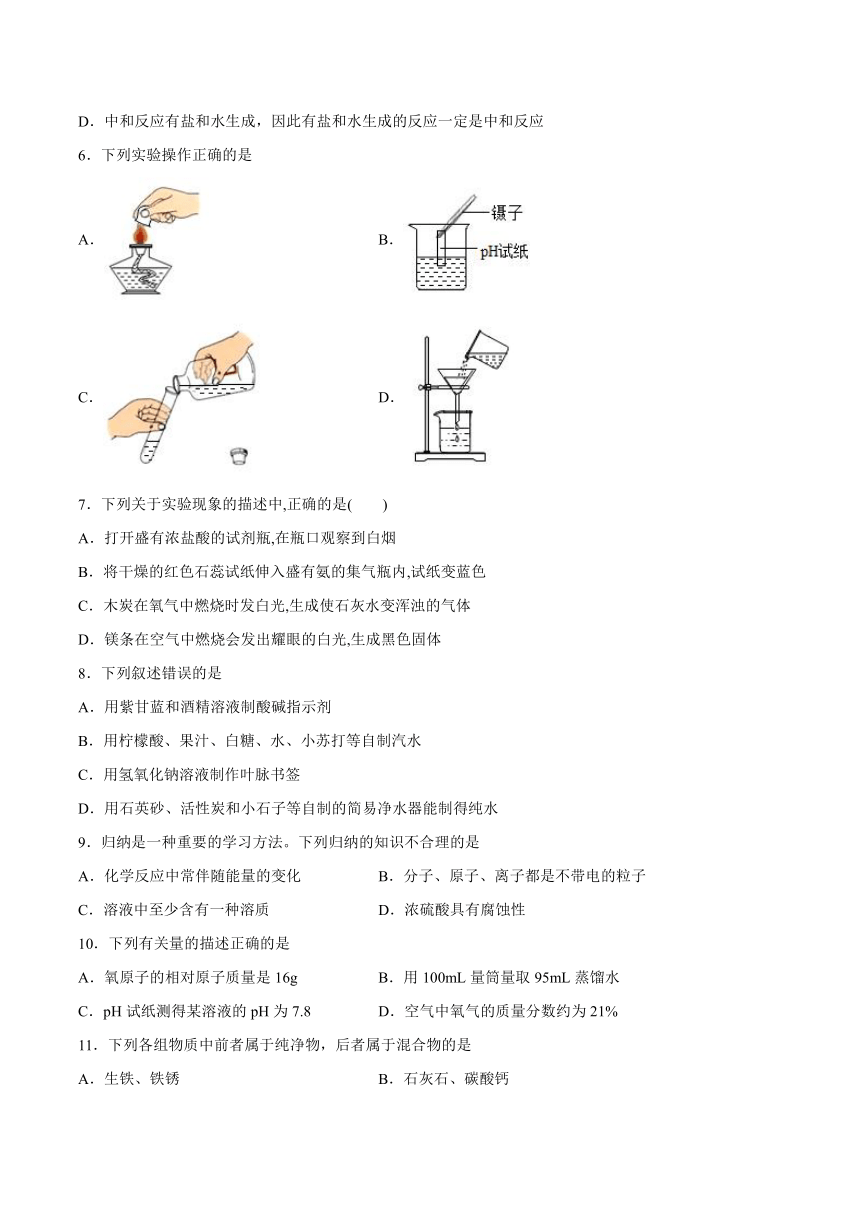
6.下列实验操作正确的是
A. B.
C. D.
7.下列关于实验现象的描述中,正确的是( )
A.打开盛有浓盐酸的试剂瓶,在瓶口观察到白烟
B.将干燥的红色石蕊试纸伸入盛有氨的集气瓶内,试纸变蓝色
C.木炭在氧气中燃烧时发白光,生成使石灰水变浑浊的气体
D.镁条在空气中燃烧会发出耀眼的白光,生成黑色固体
8.下列叙述错误的是
A.用紫甘蓝和酒精溶液制酸碱指示剂
B.用柠檬酸、果汁、白糖、水、小苏打等自制汽水
C.用氢氧化钠溶液制作叶脉书签
D.用石英砂、活性炭和小石子等自制的简易净水器能制得纯水
9.归纳是一种重要的学习方法。下列归纳的知识不合理的是
A.化学反应中常伴随能量的变化 B.分子、原子、离子都是不带电的粒子
C.溶液中至少含有一种溶质 D.浓硫酸具有腐蚀性
10.下列有关量的描述正确的是
A.氧原子的相对原子质量是16g B.用100mL量筒量取95mL蒸馏水
C.pH试纸测得某溶液的pH为7.8 D.空气中氧气的质量分数约为21%
11.下列各组物质中前者属于纯净物,后者属于混合物的是
A.生铁、铁锈 B.石灰石、碳酸钙
C.氧化铝、硬铝 D.生石灰、熟石灰
12.生活中一些物质的pH如下表所示。下列说法中错误的是
物质 橘子 西瓜 牙膏 肥皂 草木灰
pH 3~4 5~6 8~9 10 11
A.西瓜汁显酸性 B.胃酸过多的人不宜吃橘子
C.肥皂水可使紫色石蕊溶液变红 D.草木灰可改良酸性土壤
二、填空题
13.按要求写出下列反应方程式,并回答有关问题。
(1)电解水______________________________ 正极与负极气体的体积比为______
(2)氢氧化钡溶液与稀硫酸恰好完全反应___________________________ 此时液体的导电性比反应前________(填“增强”,“减弱”或“不变”)
14.化学与我们的生产、生活、能源、环境关系密切。选择下列物质的标号填空。
A.金刚石 B.氮气 C.浓硫酸 D.铜
(1)可用作干燥剂的是____________。
(2)可用于制电线的是____________。
(3)可用于裁玻璃的是____________。
(4)可用于制造低温环境的是____________。
15.维生素C又名抗坏血酸,易溶于水,易被氧化,遇热易被破坏。人体缺乏维生素C可能引发多种疾病。请预测维生素C溶液的化学性质,限选试剂有维生素C片、蒸馏水、紫色石蕊溶液、氢氧化钠溶液、碳酸钠溶液、锌片、铜片。
(1)配制维生素C溶液。将维生素C片研碎放入烧杯中,溶于蒸馏水制成溶液。如果要加速维生素C片在水中的溶解,操作方法是___________(填字母)。
A.常温下搅拌 B.边加热边搅拌
不选择另一种操作的原因是___________。
(2)请你预测维生素C溶液的化学性质,利用限选试剂设计实验验证。
预测 验证预测的实验操作与预期现象
例:维生素C溶液能与酸碱指示剂反应 取少量维生素C溶液于试管中,加入几滴紫色石蕊溶液振荡,如果发现紫色石蕊溶液变红,则预测成立。
①维生素C溶液能与_________(填物质类别,下同)反应 取少量维生素C溶液于试管中,___________,如果发现___________,则预测成立。
②维生素C溶液能与___________反应 取少量维生素C溶液于试管中,___________,如果发现___________,则预测成立。
三、简答题
16.如图所示,向烧杯A中加入白醋(酸性,易挥发),在烧杯B中加入紫色石蕊溶液(石蕊溶液遇酸变红),然后用一只大烧杯将两只小烧杯罩住。
(1)放置一段时间后,你观察到的现象是______。
(2)你对所观察到的现象的解释是______。
(3)通过实验你能得出的结论是______。
17.盐酸先生闯迷宫,前面有很多妖魔鬼怪会“吃掉”它(即与盐酸发生化学反应的物质,或物质的溶液),盐酸先生必须避开它,否则会被“吃掉”。
(1)试将盐酸走出迷宫不会被“吃掉”的路线,从入口至出口的顺序(用序号相连) HCl→ ______ →出口。
(2)写出迷宫中属于氧化物类物质的化学式: _________ (填一种,下同)盐类物质的化学式 _________ 。
(3)盐酸想走捷径,从最近距离走出,却被“吃掉”,生成一种固体时叫“干冰”的气体,用迷宫中的物质检验该气体的化学方程式为 ___________________ 。
(4)盐酸在迷宫中,不小心迷了路,走错方向, 结果被“吃掉”, 生成一种呈黄色的溶液,其化学方程式为 __ 。
四、实验题
18.如图是实验室制取气体时常用的装置,请回答下列问题。
(1)实验室用氯酸钾和二氧化锰为原料制取氧气的化学反应方程式为__________;其中二氧化锰的_____和_____在反应前后保持不变;发生装置和收集装置为_____,反应结束后,先_____,后_____,原因是_____;欲从剩余残渣中回收氯化钾,现有以下步骤:
①蒸发结晶;②过滤;③洗涤、烘干;④溶解,正确的操作顺序是_____(填序号)。
(2)如果用E装置收集到的氧气不纯,可能原因是_____(写出一种)。
(3)用盛满水的G装置收集氧气时,气体应从_____(填“a”或“b”)端通入。
(4)实验室制取并收集一瓶干燥的CO2气体,化学方程式为_____,选用的装置依次是_____(填序号)。
(5)二氧化硫气体是一种有刺激性气味的有毒气体,实验室制取SO2气体时需进行尾气处理,应选择的装置是_____(填序号),发生的化学方程式为__________。
五、计算题
19.取50.00g某质量分数浓度的NaOH溶液,向其中通入二氧化碳气体后,再向溶液中逐滴滴入18.25%的盐酸,产生CO2气体的质量(假设反应后CO2完全逸出)与所加的盐酸体积之间的关系如图所示.
计算原NaOH溶液的质量分数浓度 _______________ 。
参考答案:
1.B 2.A 3.C 4.D 5.C 6.A 7.C 8.D 9.B 10.B 11.C 12.C
13. 2H2O2H2↑+O2↑ 1:2 Ba(OH)2+H2SO4=BaSO4↓+2H2O 减弱
14.(1)C
(2)D
(3)A
(4)B
15.(1) A 维生素C遇热易被破坏
(2) 比较活泼的金属单质 加入锌粒 产生气泡 碳酸盐 加入碳酸钠溶液 产生气泡
16.(1)B烧杯内的石蕊溶液变红
(2)白醋中的醋酸能使紫色的石蕊溶液变红,分子在不断运动,A烧杯中白醋中的醋酸分子运动到了B烧杯的石蕊溶液中,使紫色的石蕊溶液变红了。
(3)分子在不断运动
17. ②→④→⑥→⑨→⑧→ SO3 KCl CO2+ Ca(OH)2===Ca2CO2↓+H2O Fe2O3+6HCl===2FeCl3+ 3H2O
18.(1) 质量 化学性质 AC或AE或AG 将导气管从水槽中撤离 熄灭酒精灯 防止水槽中的水倒流,炸裂试管 ④②①
(2)集气瓶中没有注满水或有气泡排出时立即收集
(3)b
(4) CaCO3+2HCl=CaCl2+H2O+CO2↑ BFC
(5) H
19.20.0%
一、单选题
1.利用注射器进行电解水的创新实验,电极插人注射器筒内,装置示意图如下。下列说法不正确的是
A.水中加入少量氢氧化钠,作用是增强水的导电性
B.在反应一段时间后,NaOH溶液的pH减小
C.实验成功时,左边注射器收到的气体体积约是右边的2倍
D.两个注射器内的原始液面、电极长度要保持一致
2.下列有关酸的叙述正确的是
A.硫酸是重要的化工原料,可用于制化肥、农药、染料
B.盐酸敞口放置一段时间,质量会增加
C.浓硫酸沾到皮肤上应立即用大量水冲洗,然后涂上3%—5%的氢氧化钠溶液
D.某化合物化学式为H2SO3,该化合物不属于酸
3.除去下列物质中的少量杂质(括号内的为杂质),方法合理的是( )
A.CO2(CO):点燃 B.KNO3(K2SO4):溶解,加入过量的硝酸钡溶液
C.CaCl2(CaCO3):加水溶解、过滤、蒸发 D.铁粉(Fe2O3):加过量稀盐酸,过滤
4.下列说法合理的是
A.4克镁和2克氧气充分反应会生成6克氧化镁
B.水能灭火,主要是因为水蒸发吸热,降低了可燃物的着火点
C.可以用紫色石蕊试液来检验某一未知溶液的酸碱度
D.超导体电阻为零,可用做远距离输电线
5.逻辑推理是化学学习常用的思维方法,下列推理正确的是
A.水是纯净物,所以海水也是纯净物
B.分子是构成物质的微粒,因此物质都是由分子构成的
C.酸性溶液的pH都小于7,所以酸溶液pH一定小于7
D.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应
6.下列实验操作正确的是
A. B.
C. D.
7.下列关于实验现象的描述中,正确的是( )
A.打开盛有浓盐酸的试剂瓶,在瓶口观察到白烟
B.将干燥的红色石蕊试纸伸入盛有氨的集气瓶内,试纸变蓝色
C.木炭在氧气中燃烧时发白光,生成使石灰水变浑浊的气体
D.镁条在空气中燃烧会发出耀眼的白光,生成黑色固体
8.下列叙述错误的是
A.用紫甘蓝和酒精溶液制酸碱指示剂
B.用柠檬酸、果汁、白糖、水、小苏打等自制汽水
C.用氢氧化钠溶液制作叶脉书签
D.用石英砂、活性炭和小石子等自制的简易净水器能制得纯水
9.归纳是一种重要的学习方法。下列归纳的知识不合理的是
A.化学反应中常伴随能量的变化 B.分子、原子、离子都是不带电的粒子
C.溶液中至少含有一种溶质 D.浓硫酸具有腐蚀性
10.下列有关量的描述正确的是
A.氧原子的相对原子质量是16g B.用100mL量筒量取95mL蒸馏水
C.pH试纸测得某溶液的pH为7.8 D.空气中氧气的质量分数约为21%
11.下列各组物质中前者属于纯净物,后者属于混合物的是
A.生铁、铁锈 B.石灰石、碳酸钙
C.氧化铝、硬铝 D.生石灰、熟石灰
12.生活中一些物质的pH如下表所示。下列说法中错误的是
物质 橘子 西瓜 牙膏 肥皂 草木灰
pH 3~4 5~6 8~9 10 11
A.西瓜汁显酸性 B.胃酸过多的人不宜吃橘子
C.肥皂水可使紫色石蕊溶液变红 D.草木灰可改良酸性土壤
二、填空题
13.按要求写出下列反应方程式,并回答有关问题。
(1)电解水______________________________ 正极与负极气体的体积比为______
(2)氢氧化钡溶液与稀硫酸恰好完全反应___________________________ 此时液体的导电性比反应前________(填“增强”,“减弱”或“不变”)
14.化学与我们的生产、生活、能源、环境关系密切。选择下列物质的标号填空。
A.金刚石 B.氮气 C.浓硫酸 D.铜
(1)可用作干燥剂的是____________。
(2)可用于制电线的是____________。
(3)可用于裁玻璃的是____________。
(4)可用于制造低温环境的是____________。
15.维生素C又名抗坏血酸,易溶于水,易被氧化,遇热易被破坏。人体缺乏维生素C可能引发多种疾病。请预测维生素C溶液的化学性质,限选试剂有维生素C片、蒸馏水、紫色石蕊溶液、氢氧化钠溶液、碳酸钠溶液、锌片、铜片。
(1)配制维生素C溶液。将维生素C片研碎放入烧杯中,溶于蒸馏水制成溶液。如果要加速维生素C片在水中的溶解,操作方法是___________(填字母)。
A.常温下搅拌 B.边加热边搅拌
不选择另一种操作的原因是___________。
(2)请你预测维生素C溶液的化学性质,利用限选试剂设计实验验证。
预测 验证预测的实验操作与预期现象
例:维生素C溶液能与酸碱指示剂反应 取少量维生素C溶液于试管中,加入几滴紫色石蕊溶液振荡,如果发现紫色石蕊溶液变红,则预测成立。
①维生素C溶液能与_________(填物质类别,下同)反应 取少量维生素C溶液于试管中,___________,如果发现___________,则预测成立。
②维生素C溶液能与___________反应 取少量维生素C溶液于试管中,___________,如果发现___________,则预测成立。
三、简答题
16.如图所示,向烧杯A中加入白醋(酸性,易挥发),在烧杯B中加入紫色石蕊溶液(石蕊溶液遇酸变红),然后用一只大烧杯将两只小烧杯罩住。
(1)放置一段时间后,你观察到的现象是______。
(2)你对所观察到的现象的解释是______。
(3)通过实验你能得出的结论是______。
17.盐酸先生闯迷宫,前面有很多妖魔鬼怪会“吃掉”它(即与盐酸发生化学反应的物质,或物质的溶液),盐酸先生必须避开它,否则会被“吃掉”。
(1)试将盐酸走出迷宫不会被“吃掉”的路线,从入口至出口的顺序(用序号相连) HCl→ ______ →出口。
(2)写出迷宫中属于氧化物类物质的化学式: _________ (填一种,下同)盐类物质的化学式 _________ 。
(3)盐酸想走捷径,从最近距离走出,却被“吃掉”,生成一种固体时叫“干冰”的气体,用迷宫中的物质检验该气体的化学方程式为 ___________________ 。
(4)盐酸在迷宫中,不小心迷了路,走错方向, 结果被“吃掉”, 生成一种呈黄色的溶液,其化学方程式为 __ 。
四、实验题
18.如图是实验室制取气体时常用的装置,请回答下列问题。
(1)实验室用氯酸钾和二氧化锰为原料制取氧气的化学反应方程式为__________;其中二氧化锰的_____和_____在反应前后保持不变;发生装置和收集装置为_____,反应结束后,先_____,后_____,原因是_____;欲从剩余残渣中回收氯化钾,现有以下步骤:
①蒸发结晶;②过滤;③洗涤、烘干;④溶解,正确的操作顺序是_____(填序号)。
(2)如果用E装置收集到的氧气不纯,可能原因是_____(写出一种)。
(3)用盛满水的G装置收集氧气时,气体应从_____(填“a”或“b”)端通入。
(4)实验室制取并收集一瓶干燥的CO2气体,化学方程式为_____,选用的装置依次是_____(填序号)。
(5)二氧化硫气体是一种有刺激性气味的有毒气体,实验室制取SO2气体时需进行尾气处理,应选择的装置是_____(填序号),发生的化学方程式为__________。
五、计算题
19.取50.00g某质量分数浓度的NaOH溶液,向其中通入二氧化碳气体后,再向溶液中逐滴滴入18.25%的盐酸,产生CO2气体的质量(假设反应后CO2完全逸出)与所加的盐酸体积之间的关系如图所示.
计算原NaOH溶液的质量分数浓度 _______________ 。
参考答案:
1.B 2.A 3.C 4.D 5.C 6.A 7.C 8.D 9.B 10.B 11.C 12.C
13. 2H2O2H2↑+O2↑ 1:2 Ba(OH)2+H2SO4=BaSO4↓+2H2O 减弱
14.(1)C
(2)D
(3)A
(4)B
15.(1) A 维生素C遇热易被破坏
(2) 比较活泼的金属单质 加入锌粒 产生气泡 碳酸盐 加入碳酸钠溶液 产生气泡
16.(1)B烧杯内的石蕊溶液变红
(2)白醋中的醋酸能使紫色的石蕊溶液变红,分子在不断运动,A烧杯中白醋中的醋酸分子运动到了B烧杯的石蕊溶液中,使紫色的石蕊溶液变红了。
(3)分子在不断运动
17. ②→④→⑥→⑨→⑧→ SO3 KCl CO2+ Ca(OH)2===Ca2CO2↓+H2O Fe2O3+6HCl===2FeCl3+ 3H2O
18.(1) 质量 化学性质 AC或AE或AG 将导气管从水槽中撤离 熄灭酒精灯 防止水槽中的水倒流,炸裂试管 ④②①
(2)集气瓶中没有注满水或有气泡排出时立即收集
(3)b
(4) CaCO3+2HCl=CaCl2+H2O+CO2↑ BFC
(5) H
19.20.0%
