2.2.2炔烃(教学课件)(共20张PPT)—2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 2.2.2炔烃(教学课件)(共20张PPT)—2022-2023学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | ppt | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-19 07:53:46 | ||
图片预览







文档简介
(共20张PPT)
第二章 烃
第二节 烯烃 炔烃
第2课时 炔烃
1、了解炔烃的结构特点及炔烃的物理性质;
2、能以典型代表物乙炔为例理解炔烃的化学性质;
3、掌握乙炔的实验室制法及操作步骤。
课程目标
教学重点
理解炔烃的化学性质。
教学难点
掌握乙炔的实验室制法。
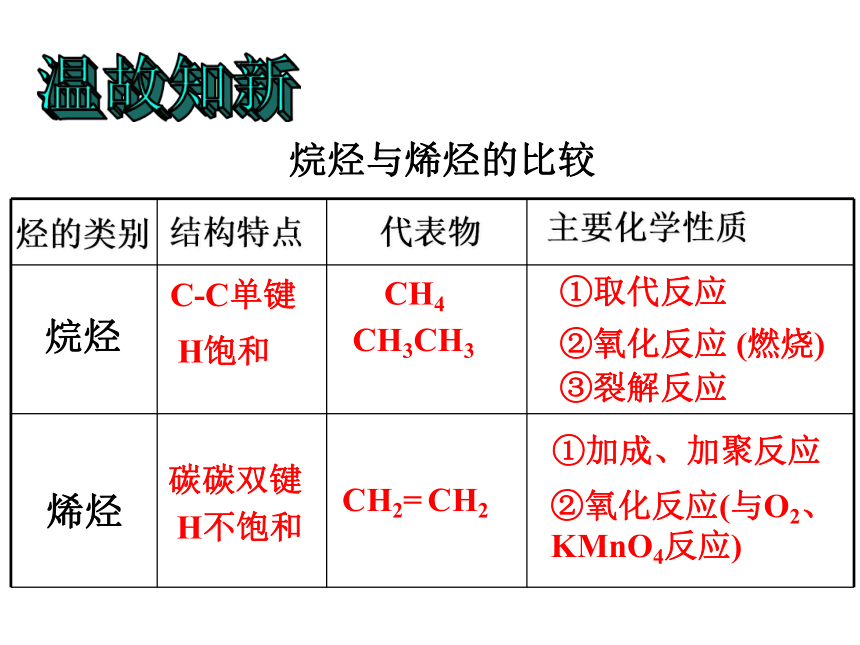
C-C单键
CH3CH3
③裂解反应
主要化学性质
代表物
结构特点
烃的类别
烷烃
烯烃
①取代反应
②氧化反应 (燃烧)
H饱和
CH4
碳碳双键
CH2= CH2
②氧化反应(与O2、KMnO4反应)
H不饱和
①加成、加聚反应
烷烃与烯烃的比较
炔烃
炔烃
一、炔烃
(1)定义:分子里含有 的一类脂肪烃。
(2)官能团:名称为 ,结构简式为 。
(3)通式:炔烃只有一个碳碳三键时,其通式为 。
(4)物理性质:随碳原子数的增加炔烃的物理性质呈现规律性的变化,熔、沸点随碳原子数的增加而 ,C2~C4的炔烃在常温常压下呈气态,最简单的炔烃是 。同其他烃一样,炔烃不易溶于水而易溶于有机溶剂。
碳碳三键
碳碳三键
—C≡C—
CnH2n-2(n≥2)
递增
乙炔
乙炔
1、乙炔的组成和结构
电子式:
H—C≡C—H
结构简式:
CH≡CH
结构式:
直线型,
空间结构:
分子式:
C2H2
或 HC≡CH
键角1800
球棍模型
空间填充模型
含有叁键结构的相邻四原子在同一直线上
乙炔
乙炔
2、乙炔的物理性质
乙炔是 色 味的气体,密度比相同条件下的空气 , 溶于水,易溶于有机溶剂。
无
无
稍小
微
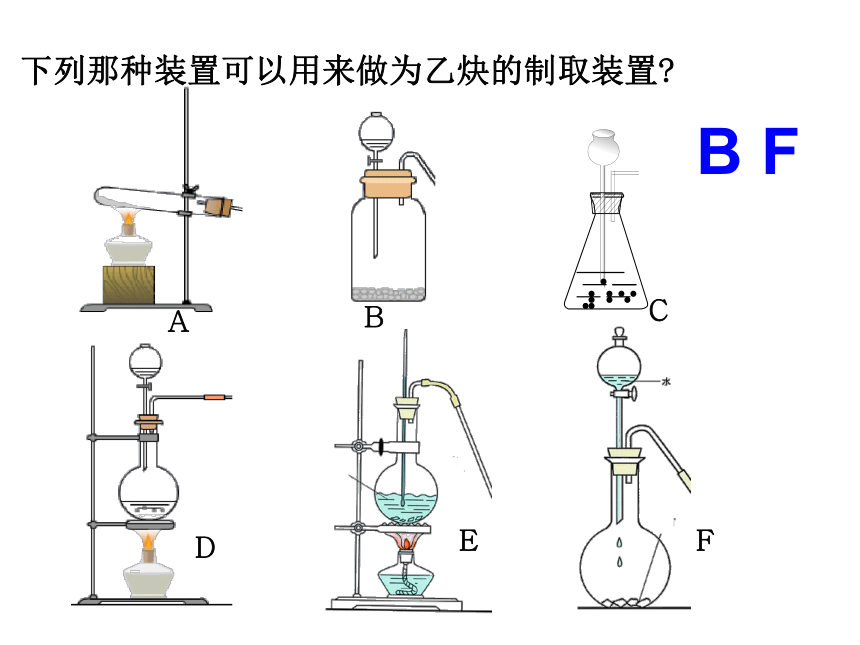
下列那种装置可以用来做为乙炔的制取装置
A
B
C
D
E
F
B F
乙炔
3、乙炔的实验室制法及有关性质验证
(1)实验装置
乙炔
(2)反应原理:
装置①:CaC2+2H2O―→Ca(OH)2+C2H2↑。
(3)性质验证
装置②:CuSO4+H2S===CuS↓+H2SO4,除去杂质。
装置③: (现象)。
装置④: (现象),
反应为:CH≡CH+2Br2―→CHBr2CHBr2。
装置⑤: (现象)。
酸性KMnO4溶液褪色
溴的四氯化碳溶液褪色
有明亮的火焰并有浓烟产生
(4)注意事项
①实验装置在使用前,要先检验 。
②盛电石的试剂瓶要及时密封并放于干燥处,严防电石吸水而失效。取电石时要用镊子夹取,切忌用手拿。
③制取乙炔时,由于CaC2和水反应剧烈,并产生泡沫,为防止产生的泡沫进入导管,应在导气管口附近塞入少量棉花。
④电石与水反应很剧烈。为得到平稳的乙炔气流,可用
代替水,并用分液漏斗控制水流的速度,
让水逐滴慢慢地滴入。
乙炔
气密性
饱和食盐水
(4)注意事项
⑤制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因是:
;
;
。
⑥由电石制得的乙炔中往往含有H2S、PH3等杂质,使混合气体通过盛有 或 的洗气瓶可将杂质除去。
乙炔
碳化钙吸水性强,与水反应剧烈,不能随用、随停
反应过程中放出大量的热,易使启普发生器炸裂
生成的Ca(OH)2呈糊状易堵塞球形漏斗
NaOH溶液
CuSO4溶液
乙炔
甲烷、乙烯、乙炔的燃烧
C2H4
CH4
C2H2
4、乙炔的化学性质
①纯净的乙炔在空气中燃烧
; 反应。
②乙炔与溴的四氯化碳溶液作用
HCCH+Br2→ ;加成反应
CHBr===CHBr+Br2―→ ;加成反应。
③乙炔与H2(催化剂,加热)
CH≡CH+H2 加成反应
CH≡CH+2H2 加成反应
炔烃
2C2H2+5O2 4CO2+2H2O
氧化
CHBr===CHBr(1,2 二溴乙烯)
CHBr2—CHBr2
CH2=CH2
CH3CH3
④乙炔与氯化氢(催化剂、加热)
CH≡CH+HCl 加成反应。
⑤乙炔与水(催化剂、加热)
CH≡CH+H2O 加成反应。
⑥加聚反应——制聚乙炔(制备导电高分子材料)
反应方程式为 。
炔烃
H2C==CHCl
CH3CHO
5、炔烃的化学性质
炔烃的化学性质与乙炔相似,容易发生
反应和
反应等,能使
及
溶液褪色。
乙炔
加成
氧化
溴的四氯化碳
酸性高锰酸钾
烷烃、烯烃、炔烃的结构和化学性质的比较
烷烃 烯烃 炔烃
通式 CnH2n+2(n≥1) CnH2n(n≥2) CnH2n-2(n≥2)
代表物 CH4 CH2==CH2 CH≡CH
结构特点 全部单键;饱和链烃 含碳碳双键;不饱和链烃 含碳碳三键;不饱和链烃
烷烃 烯烃 炔烃
化学性质 取代反应 光照卤代 - -
加成反应 - 能与H2、X2、HX、H2O、HCN等
发生加成反应
氧化反应 燃烧火焰较明亮 燃烧火焰明亮,
伴有黑烟 燃烧火焰很明亮,伴有浓烈的黑烟
不与酸性KMnO4
溶液反应 能使酸性KMnO4溶液褪色
加聚反应 - 能发生
鉴别 溴水和酸性KMnO4溶液均不褪色 溴水和酸性KMnO4溶液均褪色
烷烃、烯烃、炔烃的结构和化学性质的比较
教学课件
感谢观看
第二章 烃
第二节 烯烃 炔烃
第2课时 炔烃
1、了解炔烃的结构特点及炔烃的物理性质;
2、能以典型代表物乙炔为例理解炔烃的化学性质;
3、掌握乙炔的实验室制法及操作步骤。
课程目标
教学重点
理解炔烃的化学性质。
教学难点
掌握乙炔的实验室制法。
C-C单键
CH3CH3
③裂解反应
主要化学性质
代表物
结构特点
烃的类别
烷烃
烯烃
①取代反应
②氧化反应 (燃烧)
H饱和
CH4
碳碳双键
CH2= CH2
②氧化反应(与O2、KMnO4反应)
H不饱和
①加成、加聚反应
烷烃与烯烃的比较
炔烃
炔烃
一、炔烃
(1)定义:分子里含有 的一类脂肪烃。
(2)官能团:名称为 ,结构简式为 。
(3)通式:炔烃只有一个碳碳三键时,其通式为 。
(4)物理性质:随碳原子数的增加炔烃的物理性质呈现规律性的变化,熔、沸点随碳原子数的增加而 ,C2~C4的炔烃在常温常压下呈气态,最简单的炔烃是 。同其他烃一样,炔烃不易溶于水而易溶于有机溶剂。
碳碳三键
碳碳三键
—C≡C—
CnH2n-2(n≥2)
递增
乙炔
乙炔
1、乙炔的组成和结构
电子式:
H—C≡C—H
结构简式:
CH≡CH
结构式:
直线型,
空间结构:
分子式:
C2H2
或 HC≡CH
键角1800
球棍模型
空间填充模型
含有叁键结构的相邻四原子在同一直线上
乙炔
乙炔
2、乙炔的物理性质
乙炔是 色 味的气体,密度比相同条件下的空气 , 溶于水,易溶于有机溶剂。
无
无
稍小
微
下列那种装置可以用来做为乙炔的制取装置
A
B
C
D
E
F
B F
乙炔
3、乙炔的实验室制法及有关性质验证
(1)实验装置
乙炔
(2)反应原理:
装置①:CaC2+2H2O―→Ca(OH)2+C2H2↑。
(3)性质验证
装置②:CuSO4+H2S===CuS↓+H2SO4,除去杂质。
装置③: (现象)。
装置④: (现象),
反应为:CH≡CH+2Br2―→CHBr2CHBr2。
装置⑤: (现象)。
酸性KMnO4溶液褪色
溴的四氯化碳溶液褪色
有明亮的火焰并有浓烟产生
(4)注意事项
①实验装置在使用前,要先检验 。
②盛电石的试剂瓶要及时密封并放于干燥处,严防电石吸水而失效。取电石时要用镊子夹取,切忌用手拿。
③制取乙炔时,由于CaC2和水反应剧烈,并产生泡沫,为防止产生的泡沫进入导管,应在导气管口附近塞入少量棉花。
④电石与水反应很剧烈。为得到平稳的乙炔气流,可用
代替水,并用分液漏斗控制水流的速度,
让水逐滴慢慢地滴入。
乙炔
气密性
饱和食盐水
(4)注意事项
⑤制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因是:
;
;
。
⑥由电石制得的乙炔中往往含有H2S、PH3等杂质,使混合气体通过盛有 或 的洗气瓶可将杂质除去。
乙炔
碳化钙吸水性强,与水反应剧烈,不能随用、随停
反应过程中放出大量的热,易使启普发生器炸裂
生成的Ca(OH)2呈糊状易堵塞球形漏斗
NaOH溶液
CuSO4溶液
乙炔
甲烷、乙烯、乙炔的燃烧
C2H4
CH4
C2H2
4、乙炔的化学性质
①纯净的乙炔在空气中燃烧
; 反应。
②乙炔与溴的四氯化碳溶液作用
HCCH+Br2→ ;加成反应
CHBr===CHBr+Br2―→ ;加成反应。
③乙炔与H2(催化剂,加热)
CH≡CH+H2 加成反应
CH≡CH+2H2 加成反应
炔烃
2C2H2+5O2 4CO2+2H2O
氧化
CHBr===CHBr(1,2 二溴乙烯)
CHBr2—CHBr2
CH2=CH2
CH3CH3
④乙炔与氯化氢(催化剂、加热)
CH≡CH+HCl 加成反应。
⑤乙炔与水(催化剂、加热)
CH≡CH+H2O 加成反应。
⑥加聚反应——制聚乙炔(制备导电高分子材料)
反应方程式为 。
炔烃
H2C==CHCl
CH3CHO
5、炔烃的化学性质
炔烃的化学性质与乙炔相似,容易发生
反应和
反应等,能使
及
溶液褪色。
乙炔
加成
氧化
溴的四氯化碳
酸性高锰酸钾
烷烃、烯烃、炔烃的结构和化学性质的比较
烷烃 烯烃 炔烃
通式 CnH2n+2(n≥1) CnH2n(n≥2) CnH2n-2(n≥2)
代表物 CH4 CH2==CH2 CH≡CH
结构特点 全部单键;饱和链烃 含碳碳双键;不饱和链烃 含碳碳三键;不饱和链烃
烷烃 烯烃 炔烃
化学性质 取代反应 光照卤代 - -
加成反应 - 能与H2、X2、HX、H2O、HCN等
发生加成反应
氧化反应 燃烧火焰较明亮 燃烧火焰明亮,
伴有黑烟 燃烧火焰很明亮,伴有浓烈的黑烟
不与酸性KMnO4
溶液反应 能使酸性KMnO4溶液褪色
加聚反应 - 能发生
鉴别 溴水和酸性KMnO4溶液均不褪色 溴水和酸性KMnO4溶液均褪色
烷烃、烯烃、炔烃的结构和化学性质的比较
教学课件
感谢观看
