专题2 化学反应速率与化学平衡 检测题 (含答案) 2022-2023学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题2 化学反应速率与化学平衡 检测题 (含答案) 2022-2023学年高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 899.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-19 09:40:03 | ||
图片预览




文档简介
专题2《化学反应速率与化学平衡》检测题
一、单选题
1.可逆反应中反应物B的体积分数(B%)、生成物C的体积分数(C%)与压强(P)、温度(T)的关系如图所示,关于该反应的判断正确的是
A.该反应不能自发进行
B.ΔH>0,ΔS>0
C.a+b>c
D.T1、T2温度下的平衡常数:K(T1)<K(T2)
2.NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳气体:2NO+2CO=N2+2CO2,对此反应,下列叙述正确的是
A.使用催化剂能加快反应速率
B.压强增大不影响化学反应速率
C.冬天气温低,反应速率降低,对人类危害减小
D.无论外界条件怎样改变,均对此化学反应的速率无影响
3.某温度时,的平衡常数,则此温度下,的平衡常数为
A. B. C. D.
4.在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系密度不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A.③④⑤⑥ B.①③④⑥ C.②③④⑥ D.①③④⑤
5.可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0,达到平衡后,下列选项中采用的三种方法都能使氢气的转化率增大的是
A.升高温度、降低压强、增加氮气
B.降低温度、增大压强、加入催化剂
C.升高温度、增大压强、增加氮气
D.降低温度、增大压强、分离出部分氨气
6.有关合成氨反应的说法,正确的是
A.根据计算,常温下合成氨反应的ΔH-TΔS<0,所以常温下的反应速率很快
B.升高温度,既可以加快合成氨的速率,又可以提高平衡转化率
C.工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行
D.工业合成氨的反应是熵减小的放热反应,在常温时可自发进行
7.一定温度下,某密闭容器中发生反应:2HI(g) H2(g)+I2(g) △H<0。若0~15s内c(HI)由0.1mol/L降到0.07mol/L,则下列说法正确的是
A.0~15s内用HI表示的平均反应速率v(HI)=0.002mol/(L·s)
B.c(HI)由0.07mol/L降到0.04mol/L所用时间小于15s
C.升高温度,正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快,平衡正向移动
8.在一定条件下,在容积不变的密闭容器中,1molN2和3molH2发生反应N2(g)+3H2(g)2NH3(g)。下列说法正确的是
A.N2、H2和NH3的物质的量比为1:3:2时,该反应达到平衡
B.该反应达到平衡时,vNH3(正)=2vN2(逆)
C.达到平衡时,混合气体密度不随时间变化
D.提高该反应的温度,可以实现H2的完全转化
9.一定条件能发生反应:2N2Og)2N2(g)+O2(g)。为探究不同条件对该反应的影响,在四个恒容密闭容器中按下表相应量充入气体,测得容器①、②、③、④中氧气的物质的量随时间的变化如图所示:
容器 温度/℃ 容积/L 起始物质的量/mol
N2O N2 O2
① 450 V① 0.1 0 0
② 450 1.0 0.1 0 0
③ 400 0.8 0.1 0 0
④ T④ 1.0 0.2 0 0
下列说法正确的是A.相同温度下反应,t1时间内,该反应的平均反应速率v①=v③
B.第②个容器中一定加入催化剂
C.若T④>450℃,说明温度越高,反应速率越快
D.若①②③④四个容器都未加催化剂,比较①③两个容器的数据,说明温度越高,反应速率越快
10.下列说法正确的是
A.相同规格的Fe和Mg分别与0.1mol L-1的盐酸反应,反应速率相同
B.0.1mol L-1的盐酸与0.1mol L-1CH3COOH分别与大小、形状相同的大理石反应,反应速率相同
C.催化剂能降低分子活化时所需能量,使活化分子百分数大大增加
D.100mL2mol L-1的盐酸与锌片反应,加入适量的NaCl固体,反应速率增大
11.下列有关说法正确的是
A.CaCO3(s) == CaO(s) + CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2 (g)+ 3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应
12.氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列有关说法不正确的是
A.该反应一定能自发进行
B.该反应的正反应的活化能小于逆反应的活化能
C.断裂1mol N—H键的同时断裂1molO—H键,说明该反应达到平衡状态
D.达到平衡时,增大容器的体积,v(正)增加、v(逆)减小
13.将某些化学知识用数轴表示直观形象、简明易记。下列用数轴表示正确的是
A.平衡常数与转化率关系:
B.分散系的分类:
C.AlCl3和NaOH反应后铝元素的存在形式:
D.Na与O2反应的产物:
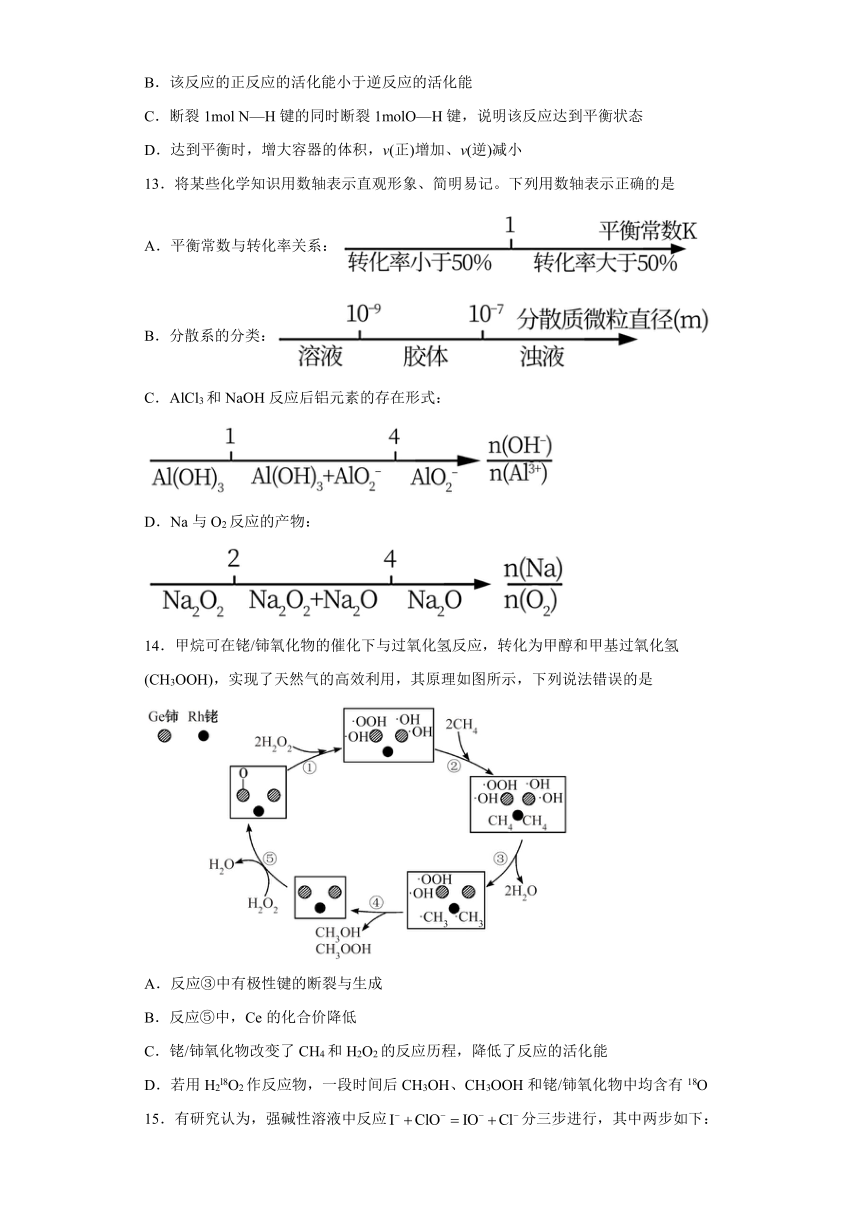
14.甲烷可在铑/铈氧化物的催化下与过氧化氢反应,转化为甲醇和甲基过氧化氢(CH3OOH),实现了天然气的高效利用,其原理如图所示,下列说法错误的是
A.反应③中有极性键的断裂与生成
B.反应⑤中,Ce的化合价降低
C.铑/铈氧化物改变了CH4和H2O2的反应历程,降低了反应的活化能
D.若用H2l8O2作反应物,一段时间后CH3OH、CH3OOH和铑/铈氧化物中均含有18O
15.有研究认为,强碱性溶液中反应分三步进行,其中两步如下:
第一步
第三步
下列说法不正确的是
A.是该化学反应的中间产物,不是催化剂 B.第一步反应为氧化还原反应
C.由K值无法判断第一步与第三步反应的快慢 D.反应的第二步为
二、填空题
16.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:;据此回答以下问题:
(1)根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值_______。(填“越大”、“越小”或“不变”)
(2)某温度下,若把与置于体积为的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的,则平衡时氢气的转化率=_______(用百分数表示。能说明该反应达到化学平衡状态的是_______填字母。
a.容器内的密度保持不变b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g) 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,△H______0
17.目前城市空气质量恶化的原因之一是机动车尾气和燃煤产生的烟气。NO和CO均为汽车尾气的成分这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-a kJ/mol,在一定温度下,将,气体通入固定容积为2L的密闭容器中,发应过程中部分物质的浓度变化如图1所示计算结果保留三位有效数字。
(1)的平均速率______,CO的转化率为______。
(2)15 min后反应达到平衡,若将此时得到的气体用含有的溶液吸收,则电解质溶液中各种离子的物质的量浓度由大到小的顺序是______。
(3)20 min时,若改变某一反应条件,导致CO浓度增大,则改变的条件可能是______ 填序号。
缩小容器体积 扩大容器体积 增加 NO的量
降低温度 增加CO的量 使用催化剂
(4)若保持反应体系的温度不变,20min时再向容器中充入CO、各,化学平衡将______填“向左”、“向右”或“不”移动,重新达到平衡后,该反应的化学平衡常数为______。
(5)对于反应,在温度为,时,平衡体系中的体积分数随压强变化曲线如图所2示。则下列说法正确的是______。
、C两点的反应速率:
、C两点气体的颜色:A深、C浅
、C两点的气体的平均相对分子质量:
由状态B到状态A,可以用加热的方法
三、计算题
18.在2 L恒容密闭容器中,发生反应 2NO(g)+O2(g)2NO2(g)。
⑴某温度时,按物质的量比2∶1充入NO和O2开始反应,n(NO)随时间变化如表:
时间(s) 0 1 2 3 4 5
n(NO)(mol) 0.020 0.010 0.007 0.006 0.006 0.006
0~4s内以O2浓度变化表示的反应速率__________1~5s内以NO浓度变化表示的反应速率(选填“小于”、“大于”、“等于”)。
⑵该反应的平衡常数表达式为K=______。能说明该反应已达到平衡状态的是_____。
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ逆(NO)=2υ正(O2) D.气体密度保持不变
⑶已知:K300℃>K400℃。下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是________。
A.升高温度 B.充入Ar使压强增大 C.充入O2使压强增大 D.选择高效催化剂
⑷将amolNO和bmolO2发生反应,要使反应物和生成物物质的量之比为1∶2,则a/b的取值范围是_________。
19.恒温、恒压下,在一个容积可变的容器中发生如下反应:N2(g)+3H2(g)2NH3(g)
(1)若开始时放入1 mol N2和3 mol H2,达到平衡后,生成a mol NH3,这时N2的物质的量为________mol
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入H2的物质的量为________mol(平衡时NH3的质量分数与(1)中相同)。
(3)若开始时放入x mol N2、6 mol H2和2 mol NH3达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则y=________。平衡时H2的物质的量________(选填一个编号)。
A.大于6 mol B.等于6 mol C.小于6 mol D.可能大于、小于或等于6 mol
(4)若在(3)的平衡混合物中,再加入6 mol NH3,再次达到平衡后,NH3的质量分数为________。
四、实验题
20.铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产.
I.CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。
(1)写出装置A中,发生反应的化学反应方程式:_______________________________,装置C的作用是_______________________________
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→_________________________。(每种仪器限使用一次)
(3)上述D装置的作用是____________________
(4)实验完毕,取试管中的固体用盐酸溶解后,欲提纯氯化铜(原粗铜含杂质铁)可加入_________,并过滤。
A.Cu B.CuCO3 C.CuO D.NaOH
ⅡCuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:_______________________________ 。
方法二 铜粉还原CuSO4溶液
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+ 2Cl- [CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是_______________,当观察到_________________________________________________________________________________现象,即表明反应已经完全。
(2)②中,加入大量水的作用是______________。(从平衡角度解释)
(3)溶液中氯离子浓度达到一定量时,生成CuCl会部分溶解生成CuCl2-在一定温度下建立两个平衡: Cu Cl(s)Cu+(aq) + Cl-(aq) Ksp=1.4x10-6 Cu Cl(s) + Cl一(aq)CuCl2-(aq) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2-]的函数关系曲线(要求至少标出曲线上一个坐标点)
_______________
21.实验小组探究溶液与KI溶液的反应及其速率,实验操作和现象如下。
已知:ⅰ.具有强氧化性,能完全电离,易被还原为;
ⅱ.淀粉检测的灵敏度很高,遇低浓度的即可快速变蓝;
ⅲ.可与发生反应:。
编号 1-1 1-2
实验操作 2滴淀粉溶液 2mL KI溶液 2mL 溶液和2滴淀粉溶液 2mL KI溶液
现象 无明显现象 溶液立即变蓝
(1)实验1-1的目的是_______。
(2)与KI反应的离子方程式为_______。
为了研究与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如下表。
编号 KI溶液/mL 溶液/mL 蒸馏水/mL 淀粉溶液/滴 溶液/mL 变色时间/s
2-1 2 0 2.8 2 0.2 立即
2-2 2 0.8 0.2 2 2 30
(3)加入溶液后溶液变蓝的时间明显增长,甲同学对此提出猜想:
猜想1:先与反应,使降低;
猜想2:先与KI反应,_______。
①甲同学提出猜想1的依据:由信息ⅲ推测,的还原性_______(填“强于”或“弱于”)KI的。
②乙同学根据现有数据证明猜想1不成立,理由是_______。
③补全猜想2:_______。
(4)查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率_______(写出计算式即可)。
(5)实验2-2中,30s内未检测到与反应,可能的原因是_______。
试卷第2页,共9页
参考答案:
1.C
【分析】根据“先拐先平数值大”知,温度:T2>T1.压强P1>P2,其它条件不变时升高温度C含量减小,则平衡逆向移动,△H<0;增大压强B含量减小,平衡正向移动,则a+b>c,故该反应的正反应为气体分子数减小且放热的反应。
【详解】A.该反应的正反应为气体分子数减小且放热的反应,则ΔH<0,ΔS<0,根据ΔG=ΔH-TΔS<0,则该反应在低温可自发进行,故A错误;
B.该反应的正反应为气体分子数减小且放热的反应,则ΔH<0,ΔS<0,故B错误;
C.由以上分析可知,a+b>c,故C正确;
D.该反应为放热反应,升高温度,平衡逆向移动,温度越高,平衡常数越小,则K(T1)>K(T2),故D错误。
故答案为:C
2.A
【详解】A.催化剂可以改变化学反应速率,我们通常所说的催化剂一般都指正催化剂,能加快反应速率,故A正确;
B.增大压强,可以使气体物质的体积变小,其浓度变大,所以反应速率加快,反之,减小压强,可使气体的体积变大,浓度变小,反应速率变慢,由于该反应是气体物之间的反应,改变压强,对反应速率有影响,故B错误;
C.升高温度,可以加快反应速率,降低温度可减慢反应速率。由于NO和CO对人的危害远大于N2和CO2,所以当NO与CO反应生成N2和CO2的速率降低时,对人危害更大,故C错误;
D.2NO+2CO=N2+2CO2是一个气体物质间的化学反应,改变反应物的浓度、压强、温度均能改变该反应的速率,故D错误;
故选A。
3.A
【详解】某温度度下,反应的平衡常数为=a;反应的平衡常数表达式为,相同温度时=,由=a,可得,故选A。
4.B
【详解】①体系的温度不再改变,正、逆反应速率相等,能据此判断该反应达到平衡状态,①正确;
②反应混合物都是气体,反应在恒容密闭容器内进行,容器的容积不变,因此无论反应是否达到平衡,混合气体的密度一直不变,不能据此判断反应是否处于平衡状态,②错误;
③各组分的物质的量浓度不再改变,该反应达到平衡状态,③正确;
④当该反应达到平衡状态,各组分的质量分数不再改变,④正确;
⑤当反应速率vA:vB:vC:vD=m:n:p:q,由于未指明是正反应速率还是逆反应速率,所以不能据此判断该反应是否达到平衡状态,⑤错误;
⑥单位时间内m mol A断键反应等效于pmol C形成,同时pmol C也断键反应,说明任何物质的浓度不变,反应处于平衡状态,⑥正确;
综上所述可知,说法正确的是①③④⑥,故合理选项是B。
5.D
【分析】为了使H2的转化率增大,一般使可逆反应3H2(g)+N2(g) 2NH3(g)△H<0向正反应方向移动,增大氢气的浓度,平衡向正反应方向移动,但会导致H2的转化率减小;该反应为气体体积减小的放热反应,所以可以降低温度,增大压强都能向正反应方向移动,H2的转化率增大,催化剂不改变平衡移动,分离出部分氨也能使平衡向正反应方向移动,H2的转化率增大;
【详解】A.升高温度、降低压强,平衡逆向移动,氢气转化率降低,A错误;
B.催化剂改变反应速率,不影响平衡移动,B错误;
C.升高温度,平衡逆向移动,氢气转化率降低,C错误;
D.降低温度、增大压强、分离出部分氨气,平衡向正反应方向移动,H2的转化率增大,D正确;
故选D。
6.D
【详解】A.常温下合成氨反应的ΔH-TΔS<0,只能说明合成氮反应在常温下能自发进行,而不能说明反应的快慢,故A错;
B.合成氨反应放热,升高温度,合成氨反应逆向移动,平衡转化率降低,故B错误;
C.由于合成氨反应的ΔS<0,ΔH<0,根据ΔH-TΔS,可知高温不自发,故C错误;
D.由于合成氨反应的ΔS<0,ΔH<0,根据ΔH-TΔS,可知在常温时可自发进行,D正确;
选D。
7.A
【详解】A.0~15s内c(HI)由0.1mol/L降到0.07mol/L,HI变化的物质的量浓度为0.03mol·L-1,根据化学反应速率的数学表达式,v(HI)==0.002mol/(L·s),故A正确;
B.浓度降低,化学反应速率减缓,c(HI)由0.07mol·L-1降到0.04mol·L-1,HI表示的化学反应速率小于0.002mol/(L·s),因此所用时间大于15s,故B错误;
C.升高温度,正逆反应速率都增大,故C错误;
D.该反应是气体物质的量不变的反应,减小反应体系的体积,压强增大,化学反应速率加快,当反应平衡不移动,故D错误;
答案为A。
8.B
【详解】A.反应达到平衡时,各组分的含量不变,而不是与系数成比例,A错误;
B.v正=v逆时,反应达到平衡,根据反应速率之比等于化学计量数之比,,故反应达到平衡时,vNH3(正)=2vN2(逆),B正确;
C.根据ρ=,该反应中的物质均为气体,根据质量守恒定律,反应前后m不变,该容器为容积不变的密闭容器,V不变,因此ρ不是变量,变量不变时反应才达到平衡,C错误;
D.可逆反应不能完全进行,D错误;
故选B。
9.D
【分析】采用控制变量方法研究外界条件对反应速率的影响。①②是研究浓度对速率的影响;①③是研究温度对速率的影响,则V=0.8 L,结合图示数据分析判断。
【详解】A.由图可知,t1时间内,①比③生成氧气多,则反应的平均反应速率v①>v③,A错误;
B.①②比较,温度相同、起始物质的量相同,平衡状态不同,由于催化剂只能改变反应速率,不能使化学平衡发生移动,所以②中不可能加催化剂,B错误;
C.若T④>450℃,由表中数据可知温度、浓度均影响反应速率;由②④温度、浓度均不同,因此不能说明是温度对反应速率的影响,C错误;
D.若①②③④四个容器都未加催化剂,①③是研究温度对速率的影响,比较①③两个容器的数据,t1时间内,①比③生成氧气多,二者只有温度不同,可说明温度越高,反应速率越快,D正确;
故合理选项是D。
10.C
【详解】A.Mg比Fe活泼,相同规格下,Mg与盐酸反应速率更快,A错误;
B.浓度相同的盐酸和醋酸,盐酸酸性强,与大理石反应更快,B错误;
C.催化剂降低活化能,活化分子数增加,总分子数不变,所以活化分子百分数增加,C正确;
D.盐酸与锌反应的本质是H+与Zn反应,加入NaCl固体,对反应速率无影响,D错误;
故答案选C。
11.B
【详解】A.碳酸钙分解的反应,是熵增的反应,但反应不能在室温下自发进行,说明该反应的△H>0,错误;
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈,是因为铁比铜活泼,形成原电池时,铁做负极,被腐蚀,正确;
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2 )加快,而平衡逆向移动,氢气的转化率降低,错误;
D.水的离子积常数Kw随着温度的升高而增大,说明升高温度,平衡正向移动,则水的电离是放吸热反应,错误;
答案选B。
12.D
【详解】A.由热化学方程式可知,该反应是一个熵增的放热反应,反应ΔH<0、ΔS>0、ΔH—TΔS恒小于0,该反应一定能自发进行,故A正确;
B.由热化学方程式可知,该反应是放热反应,则反应的正反应的活化能小于逆反应的活化能,故B正确;
C.断裂1mol N—H键的同时断裂1molO—H键说明正反应速率等于逆反应速率,反应已达到化学平衡状态,故C正确;
D.达到平衡时,增大容器的体积,气体压强减小,正反应速率v(正)减小、逆反应速率v(逆)减小,故D错误;
故选D。
13.B
【详解】A.平衡常数和转化率是衡量反应进行程度的物理量,平衡常数越大反应进行程度越大;反应物的转化率越大,反应进行程度越大,平衡常数等于1时,反应物的转化率并不一定等于50%,A错误;
B.1nm=10-7m,分散质微粒直径小于1nm形成的分散系为溶液,大于100nm形成的为浊液,分散质微粒直径在1nm~100nm时形成的分散系为胶体,B正确;
C.OH-与Al3+的物质的量之比为3:1时,铝元素都以Al(OH)3的形式存在,即OH-与Al3+的物质的量之比为≤3时铝元素都以Al(OH)3的形式存在,C错误;
D.钠与氧气的反应不仅与物质的量有关,而且与外界条件有关,点燃条件下生成过氧化钠,D错误。
答案选B。
14.B
【详解】A.反应③中CH4中断裂1条C-H键形成 CH3, OH与H形成H2O中有O-H键生成,则有极性键的断裂与生成,A正确;
B.反应⑤中,H2O2→H2O中O元素从-1降低至-2价,则Ce的化合价升高,B错误;
C.铑/铈氧化物是催化剂,可改变了CH4和H2O2的反应历程,降低了反应的活化能,C正确;
D.由反应⑤可知O连接在Ce上,甲烷可在铑/铈氧化物的催化下与过氧化氢反应,转化为甲醇和甲基过氧化氢(CH3OOH),则若用H2l8O2作反应物,一段时间后CH3OH、CH3OOH和铑/铈氧化物中均含有18O,D正确;
故选:B。
15.B
【详解】A.第一步水解产生了OH-,第三步又消耗了OH-,所以OH-是整个反应的中间产物,不是催化剂,A正确;
B. 第一步反应是水解反应,不是氧化还原反应,B 错误;
C.平衡常数的数值大小可以判断反应进行的程度,不能判断反应速率大小,C正确;
D.总反应减去第一步反应和第三步反应可得第二步为HOCl+I-→HOI + Cl-,D正确;
故选B。
16.(1)越小
(2) 20% bd
(3)<
【详解】(1)合成氨为放热反应,升高温度,平衡逆移,平衡常数减小,故温度越高,其化学平衡常数的值越小。
(2)把与置于体积为的密闭容器内,设反应达平衡时N2转化的物质的量为x,
根据理想气体状态方程,可知恒温恒容条件下,反应前后的压强之比等于气体的总物质的量之比,则
,解x=2,平衡时氢气的转化率=;
反应体系中全部为气体,气体的总质量为定值,恒容条件下,气体的密度不变,不能作为达平衡的标志,a项错误;
该反应为气体分子数减小的反应,恒容装置中,随着反应的进行,体系的压强减小,容器内压强不变说明反应已经达到平衡状态,b项正确;
根据反应的方程式为,可知达平衡时2v正(N2)= v逆(NH3),c项错误;
c(NH3)会随着反应的进行而变化,混合气体中c(NH3)不变,说明反应已经达到平衡状态,d项正确;
故选bd。
(3)结合图象可知,Q点之前反应未达到平衡,随着反应正向进行,混合体系中X的体积分数逐渐减小,Q点之后反应已经达到平衡状态,升高温度,混合体系中X的体积分数增大,说明升温平衡逆移,则正反应为放热反应,故。
17. 0.0267 mol/(L·min) 33.3% c(K+)>c()>c(OH-)>c(H+)>c() ae 向左 0.139 ④
【详解】(1)由图可知,的浓度变化量为,速率之比等于化学计量数之比,则,参加反应的CO为,故CO的转化率为,故答案为:;;
(2)到达平衡,固定容积为2L的密闭容器中,,与KOH物质的量之比为1:1,,则反应生成,溶液中碳酸氢根离子水解溶液呈碱性,溶液中氢氧根离子源于水的电离与碳酸氢根离子水解,故溶液中,故答案为:;
(3)缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大,平衡时CO浓度增大,故a正确;
扩大容器体积,压强减小,平衡向逆反应方向移动,平衡时CO浓度减小,故b错误;
增加NO的量,平衡正向移动,CO浓度减小,故c错误;
降低温度,平衡向正反应方向移动,CO浓度减小,故d错误;
增加CO的量,CO的浓度增大,故e正确;
使用催化剂平衡不移动,CO浓度不变,故f错误,
故答案为:ae;
(4)平衡时氮气浓度变化量为,NO的起始浓度为、CO的起始浓度为,则:
故平衡常数,
20min时再向容器中充入CO、各,此时浓度商,故反应向逆反应进行,即向左移动,
温度不变,平衡常数不变,即重新达到平衡后,该反应的化学平衡常数为,故答案为:向左;;
(5)①、C两点温度相等,则平衡常数相同,故①错误;
②、C两点都在等温线上,C的压强大,与A相比C点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时浓度比A的浓度高,为红棕色气体,则A、C两点气体的颜色:A浅,C深,故②错误;
③、C两点相同物质的含量相同,即二氧化氮与四氧化二氮的物质的量之比相等,则平均相对分子质量相等,故③错误;
④升高温度,化学平衡正向移动,的体积分数增大,由图象可知,A点的体积分数大,则,由状态B到状态A,可以用加热的方法,故④正确;
故答案为:④。
18. 大于 A B C C 1<<3
【详解】试题分析:⑴随时间的延长,反应速率减慢;⑵根据该平衡常数的定义书写表达式;A.气体颜色保持不变,说明NO2的浓度不变,一定平衡; B.根据 ,气体平均相对分子质量为变量,气体平均相对分子质量不变,一定平衡;C.υ逆(NO)=2υ正(O2) ,一定平衡; D.根据 ,气体密度为恒量,密度保持不变,不一定平衡;⑶根据影响平衡移动的因素分析;⑷利用极值法分析a/b的取值范围;
解析:⑴随时间的延长,反应速率减慢,所以0~4s的反应速率大于1~5s内的反应速率;⑵根据该平衡常数的定义,2NO(g)+O2(g)2NO2(g) 平衡常数表达式为;根据V(正)=V(逆)、浓度不变、变量不变分析是否平衡;⑶A.K300℃>K400℃,说明焓变<0,升高温度平衡逆向移动; B.充入Ar使压强增大,平衡不移动; C.充入O2使压强增大,平衡正向移动; D.选择高效催化剂,平衡不移动;⑷利用极值法,假设NO完全反应,则生成NO2 amol,剩余氧气b-0.5a, ,a/b=1;假设O2完全反应,则生成NO2 2bmol,剩余NO a-2b, ,a/b=3,所以a/b的取值范围1<<3;
点睛:缩小容器的体积,增大压强,平衡向气体体积小的方向移动,若恒容通入无关气体增大压强,由于浓度不变,所以平衡不移动。
19. 1-0.5a 9 3-1.5a D 0.5a
【详解】(1)设生成amolmolNH3转化的N2的物质的量为y,则:
N2(g)+3H2(g)2NH3(g),
1 2
y amol
=,y=mol,则平衡时氮气的物质的量为1mol-mol=(1-0.5a)mol;
(2)若在恒温恒压条件1molN2与3molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,若只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,且平衡时NH3 的质量分数与前者相同,根据等效平衡及极限转化后起始的量与原起始量成正比,故H2的物质的量为3mol×3=9mol;
(3)若开始时通入xmolN2﹑6molH2和2molNH3,将2molNH3极限转化为反应物,则相当于开始加入(x+1)molN2﹑(6+3)molH2,达平衡后,NH3的物质的量3amol,则(x+1)mol:(6+3)mol=1:3,解得x=2mol,由恒温恒压条件,两种情况中起始的反应物的物质的量成正比,则平衡时各物质的含量成正比,则1molN2与3molH2的混合气体通入发生反应时平衡时氮气的物质的量为(1- )mol,故开始时通入2molN2﹑6molH2和2molNH3的混合气体通入发生反应时平衡时氮气的物质的量为(1- )mol×3=(3-1.5a)mol,由x=2得开始时通入2 molN2﹑6molH2和2molNH3,平衡时NH3的物质的量3a,则无法判断氨气开始的2mol与平衡时的3amol谁大,故不知道平衡到底向什么方向移动,所以应选D;
(4)若在(3)的平衡混合物中,再加入6molNH3,相当于成比例增大反应物,恒温、恒压下等效,故再次达到平衡后NH3的质量分数与原平衡相同,即NH3的质量分数=×100%=50a%=0.5a。
20. 2KMnO4+16HCl=5Cl2↑+2KCl+8H2O+2MnCl2 除去氯气中混有的HCl d e j h (b c) g f 吸收氯气防止尾气污染;防止空气中的水蒸气进入装置,使CuCl2水解 BC 2Cu2++2Cl-+SO2+2H2O2CuCl↓+4H++SO42- 温度不能过低,防止反应速率慢;不能过高,过高HCl挥发 溶液由蓝色变为无色 稀释促进平衡Cu Cl(白色)+2Cl- [ CuCl3] 2-(无色溶液)逆向移动,生成CuCl;
【详解】I. (1)写出装置A中,发生反应的化学反应方程式为:2KMnO4+16HCl=5Cl2↑+2KCl+8H2O+2MnCl2,装置C装有饱和食盐水,其作用是除去氯气中混有的HCl;(2)从a出来的气体含有氯化氢和水蒸气,依次通过d e j h 除去氯化氢和水蒸气,然后与铜反应,最后尾气处理用氢氧化钠,则依次再通过b c g f,所以按照气流方向各仪器接口的连接顺序为a→d→e→j→h→b→c →g→f;(3)D装置中装有碱石灰,其作用是吸收氯气防止尾气污染;防止空气中的水蒸气进入装置,使CuCl2水解;(4)实验完毕,取试管中的固体用盐酸溶解后,欲提纯氯化铜(原粗铜含杂质铁)可加入CuO或CuCO3、Cu2(OH)2 CO3、.Cu(OH)2以消耗氢离子但不引入新的杂质,并过滤。答案选BC;
Ⅱ、向制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,同时生成硫酸,反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O2CuCl↓+4H++SO42-;(1)温度不能过低,防止反应速率慢;不能过高,过高HCl挥发,故①中“加热”温度不宜过高和过低;当观察到溶液由蓝色变为无色,即表明反应已经完全;(2)②中,加入大量水的作用是稀释促进平衡Cu Cl(白色)+2Cl- [ CuCl3] 2-(无色溶液)逆向移动,生成CuCl;(3)根据①Cu Cl(s)Cu+(aq) + Cl-(aq) Ksp=1.4x10-6;②Cu Cl(s) + Cl一(aq)CuCl2-(aq) K=0.35,①+②得2Cu Cl(s) Cu+(a q)+ [CuCl2]- (a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)= 0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图象为:。
21.(1)做对照,排除O2氧化I-的干扰
(2)+2I-=2+I2
(3) 强于 根据信息i和信息iii可以推测与发生氧化还原反应:+2=2+,实验2-2中,起始n()=0.410-3mol,n()=0.00810-3mol,该反应后n()=0.39610-3mol,仍高于2-1中起始n()(0.0410-3mol),即实验2-2中与反应后,溶液中的浓度仍大于实验2-1中的起始浓度,则实验2-2的溶液应立即变蓝,与实际不符,故猜想1不成立 生成的I2与Na2S2O3迅速反应,待Na2S2O3消耗完,继续生成I2时,淀粉才变蓝
(4)
(5)NH4)2S2O8与Na2S2O3反应的活化能大于与KI反应的活化能(或浓度相同时,(NH4)2S2O8与Na2S2O3反应的速率较(NH4)2S2O8与KI的小),也可能是因为c(Na2S2O3)小于c(KI)
【分析】(NH4)2S2O8具有强氧化性,可以氧化KI生成和I2;为了研究(NH4)2S2O8与KI反应的速率,设计了实验,实验现象表明,用淀粉作指示剂的情况下,实验2-1中(NH4)2S2O8与KI的反应很快,溶液立即变色,而实验2-2中,加入了(NH4)2S2O8与KI,还加入了少量的Na2S2O3溶液,溶液变色时间明显增长,可以依据实验2-2,可表示出(NH4)2S2O8的反应速率。
【详解】(1)实验1-2中,(NH4)2S2O8氧化KI生成I2,淀粉遇I2变蓝,实验1-1中没有加入氧化剂,而在实验1-1和实验1-2中,空气中的O2会将I-氧化为I2,故实验1-1的目的是做对照,排除O2氧化I-的干扰。
(2)根据题干信息可知,(NH4)2S2O8与KI反应生成(NH4)2SO4、K2SO4和I2,该反应的的离子方程式为+2I-=2+I2。
(3)①还原剂还原性大于还原产物;信息iii:2+I2=+2I-,做还原剂,I-为还原产物,故Na2S2O3的还原性强于KI的;
②根据信息i和信息iii可以推测与发生氧化还原反应:+2=2+,实验2-2中,起始n()=0.410-3mol,n()=0.00810-3mol,该反应后n()=0.39610-3mol,仍高于2-1中起始n()(0.0410-3mol),即实验2-2中与反应后,溶液中的浓度仍大于实验2-1中的起始浓度,则实验2-2的溶液应立即变蓝,与实际不符,故猜想1不成立;
③实验2-2中,加入Na2S2O3溶液后溶液变蓝的时间明显增长,还可能是因为(NH4)2S2O8先与KI反应,生成的I2与Na2S2O3迅速反应,待Na2S2O3消耗完,继续生成I2时,淀粉才变蓝。
(4)由反应+2I-=2+I2和反应2+I2=+2I-可得:~2,30s内,Δn()=0.00810-3mol,则Δn()=0.00810-3mol,故30s内的平均反应速率v()==mol·L-1·s-1。
(5)实验2-2中,30s内未检测到(NH4)2S2O8与Na2S2O3反应,可能的原因是(NH4)2S2O8与Na2S2O3反应的活化能大于与KI反应的活化能(或浓度相同时,(NH4)2S2O8与Na2S2O3反应的速率较(NH4)2S2O8与KI的小),也可能是因为c(Na2S2O3)小于c(KI)
一、单选题
1.可逆反应中反应物B的体积分数(B%)、生成物C的体积分数(C%)与压强(P)、温度(T)的关系如图所示,关于该反应的判断正确的是
A.该反应不能自发进行
B.ΔH>0,ΔS>0
C.a+b>c
D.T1、T2温度下的平衡常数:K(T1)<K(T2)
2.NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳气体:2NO+2CO=N2+2CO2,对此反应,下列叙述正确的是
A.使用催化剂能加快反应速率
B.压强增大不影响化学反应速率
C.冬天气温低,反应速率降低,对人类危害减小
D.无论外界条件怎样改变,均对此化学反应的速率无影响
3.某温度时,的平衡常数,则此温度下,的平衡常数为
A. B. C. D.
4.在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系密度不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A.③④⑤⑥ B.①③④⑥ C.②③④⑥ D.①③④⑤
5.可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0,达到平衡后,下列选项中采用的三种方法都能使氢气的转化率增大的是
A.升高温度、降低压强、增加氮气
B.降低温度、增大压强、加入催化剂
C.升高温度、增大压强、增加氮气
D.降低温度、增大压强、分离出部分氨气
6.有关合成氨反应的说法,正确的是
A.根据计算,常温下合成氨反应的ΔH-TΔS<0,所以常温下的反应速率很快
B.升高温度,既可以加快合成氨的速率,又可以提高平衡转化率
C.工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行
D.工业合成氨的反应是熵减小的放热反应,在常温时可自发进行
7.一定温度下,某密闭容器中发生反应:2HI(g) H2(g)+I2(g) △H<0。若0~15s内c(HI)由0.1mol/L降到0.07mol/L,则下列说法正确的是
A.0~15s内用HI表示的平均反应速率v(HI)=0.002mol/(L·s)
B.c(HI)由0.07mol/L降到0.04mol/L所用时间小于15s
C.升高温度,正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快,平衡正向移动
8.在一定条件下,在容积不变的密闭容器中,1molN2和3molH2发生反应N2(g)+3H2(g)2NH3(g)。下列说法正确的是
A.N2、H2和NH3的物质的量比为1:3:2时,该反应达到平衡
B.该反应达到平衡时,vNH3(正)=2vN2(逆)
C.达到平衡时,混合气体密度不随时间变化
D.提高该反应的温度,可以实现H2的完全转化
9.一定条件能发生反应:2N2Og)2N2(g)+O2(g)。为探究不同条件对该反应的影响,在四个恒容密闭容器中按下表相应量充入气体,测得容器①、②、③、④中氧气的物质的量随时间的变化如图所示:
容器 温度/℃ 容积/L 起始物质的量/mol
N2O N2 O2
① 450 V① 0.1 0 0
② 450 1.0 0.1 0 0
③ 400 0.8 0.1 0 0
④ T④ 1.0 0.2 0 0
下列说法正确的是A.相同温度下反应,t1时间内,该反应的平均反应速率v①=v③
B.第②个容器中一定加入催化剂
C.若T④>450℃,说明温度越高,反应速率越快
D.若①②③④四个容器都未加催化剂,比较①③两个容器的数据,说明温度越高,反应速率越快
10.下列说法正确的是
A.相同规格的Fe和Mg分别与0.1mol L-1的盐酸反应,反应速率相同
B.0.1mol L-1的盐酸与0.1mol L-1CH3COOH分别与大小、形状相同的大理石反应,反应速率相同
C.催化剂能降低分子活化时所需能量,使活化分子百分数大大增加
D.100mL2mol L-1的盐酸与锌片反应,加入适量的NaCl固体,反应速率增大
11.下列有关说法正确的是
A.CaCO3(s) == CaO(s) + CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2 (g)+ 3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应
12.氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列有关说法不正确的是
A.该反应一定能自发进行
B.该反应的正反应的活化能小于逆反应的活化能
C.断裂1mol N—H键的同时断裂1molO—H键,说明该反应达到平衡状态
D.达到平衡时,增大容器的体积,v(正)增加、v(逆)减小
13.将某些化学知识用数轴表示直观形象、简明易记。下列用数轴表示正确的是
A.平衡常数与转化率关系:
B.分散系的分类:
C.AlCl3和NaOH反应后铝元素的存在形式:
D.Na与O2反应的产物:
14.甲烷可在铑/铈氧化物的催化下与过氧化氢反应,转化为甲醇和甲基过氧化氢(CH3OOH),实现了天然气的高效利用,其原理如图所示,下列说法错误的是
A.反应③中有极性键的断裂与生成
B.反应⑤中,Ce的化合价降低
C.铑/铈氧化物改变了CH4和H2O2的反应历程,降低了反应的活化能
D.若用H2l8O2作反应物,一段时间后CH3OH、CH3OOH和铑/铈氧化物中均含有18O
15.有研究认为,强碱性溶液中反应分三步进行,其中两步如下:
第一步
第三步
下列说法不正确的是
A.是该化学反应的中间产物,不是催化剂 B.第一步反应为氧化还原反应
C.由K值无法判断第一步与第三步反应的快慢 D.反应的第二步为
二、填空题
16.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:;据此回答以下问题:
(1)根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值_______。(填“越大”、“越小”或“不变”)
(2)某温度下,若把与置于体积为的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的,则平衡时氢气的转化率=_______(用百分数表示。能说明该反应达到化学平衡状态的是_______填字母。
a.容器内的密度保持不变b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g) 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,△H______0
17.目前城市空气质量恶化的原因之一是机动车尾气和燃煤产生的烟气。NO和CO均为汽车尾气的成分这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-a kJ/mol,在一定温度下,将,气体通入固定容积为2L的密闭容器中,发应过程中部分物质的浓度变化如图1所示计算结果保留三位有效数字。
(1)的平均速率______,CO的转化率为______。
(2)15 min后反应达到平衡,若将此时得到的气体用含有的溶液吸收,则电解质溶液中各种离子的物质的量浓度由大到小的顺序是______。
(3)20 min时,若改变某一反应条件,导致CO浓度增大,则改变的条件可能是______ 填序号。
缩小容器体积 扩大容器体积 增加 NO的量
降低温度 增加CO的量 使用催化剂
(4)若保持反应体系的温度不变,20min时再向容器中充入CO、各,化学平衡将______填“向左”、“向右”或“不”移动,重新达到平衡后,该反应的化学平衡常数为______。
(5)对于反应,在温度为,时,平衡体系中的体积分数随压强变化曲线如图所2示。则下列说法正确的是______。
、C两点的反应速率:
、C两点气体的颜色:A深、C浅
、C两点的气体的平均相对分子质量:
由状态B到状态A,可以用加热的方法
三、计算题
18.在2 L恒容密闭容器中,发生反应 2NO(g)+O2(g)2NO2(g)。
⑴某温度时,按物质的量比2∶1充入NO和O2开始反应,n(NO)随时间变化如表:
时间(s) 0 1 2 3 4 5
n(NO)(mol) 0.020 0.010 0.007 0.006 0.006 0.006
0~4s内以O2浓度变化表示的反应速率__________1~5s内以NO浓度变化表示的反应速率(选填“小于”、“大于”、“等于”)。
⑵该反应的平衡常数表达式为K=______。能说明该反应已达到平衡状态的是_____。
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ逆(NO)=2υ正(O2) D.气体密度保持不变
⑶已知:K300℃>K400℃。下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是________。
A.升高温度 B.充入Ar使压强增大 C.充入O2使压强增大 D.选择高效催化剂
⑷将amolNO和bmolO2发生反应,要使反应物和生成物物质的量之比为1∶2,则a/b的取值范围是_________。
19.恒温、恒压下,在一个容积可变的容器中发生如下反应:N2(g)+3H2(g)2NH3(g)
(1)若开始时放入1 mol N2和3 mol H2,达到平衡后,生成a mol NH3,这时N2的物质的量为________mol
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入H2的物质的量为________mol(平衡时NH3的质量分数与(1)中相同)。
(3)若开始时放入x mol N2、6 mol H2和2 mol NH3达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则y=________。平衡时H2的物质的量________(选填一个编号)。
A.大于6 mol B.等于6 mol C.小于6 mol D.可能大于、小于或等于6 mol
(4)若在(3)的平衡混合物中,再加入6 mol NH3,再次达到平衡后,NH3的质量分数为________。
四、实验题
20.铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产.
I.CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。
(1)写出装置A中,发生反应的化学反应方程式:_______________________________,装置C的作用是_______________________________
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→_________________________。(每种仪器限使用一次)
(3)上述D装置的作用是____________________
(4)实验完毕,取试管中的固体用盐酸溶解后,欲提纯氯化铜(原粗铜含杂质铁)可加入_________,并过滤。
A.Cu B.CuCO3 C.CuO D.NaOH
ⅡCuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:_______________________________ 。
方法二 铜粉还原CuSO4溶液
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+ 2Cl- [CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是_______________,当观察到_________________________________________________________________________________现象,即表明反应已经完全。
(2)②中,加入大量水的作用是______________。(从平衡角度解释)
(3)溶液中氯离子浓度达到一定量时,生成CuCl会部分溶解生成CuCl2-在一定温度下建立两个平衡: Cu Cl(s)Cu+(aq) + Cl-(aq) Ksp=1.4x10-6 Cu Cl(s) + Cl一(aq)CuCl2-(aq) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2-]的函数关系曲线(要求至少标出曲线上一个坐标点)
_______________
21.实验小组探究溶液与KI溶液的反应及其速率,实验操作和现象如下。
已知:ⅰ.具有强氧化性,能完全电离,易被还原为;
ⅱ.淀粉检测的灵敏度很高,遇低浓度的即可快速变蓝;
ⅲ.可与发生反应:。
编号 1-1 1-2
实验操作 2滴淀粉溶液 2mL KI溶液 2mL 溶液和2滴淀粉溶液 2mL KI溶液
现象 无明显现象 溶液立即变蓝
(1)实验1-1的目的是_______。
(2)与KI反应的离子方程式为_______。
为了研究与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如下表。
编号 KI溶液/mL 溶液/mL 蒸馏水/mL 淀粉溶液/滴 溶液/mL 变色时间/s
2-1 2 0 2.8 2 0.2 立即
2-2 2 0.8 0.2 2 2 30
(3)加入溶液后溶液变蓝的时间明显增长,甲同学对此提出猜想:
猜想1:先与反应,使降低;
猜想2:先与KI反应,_______。
①甲同学提出猜想1的依据:由信息ⅲ推测,的还原性_______(填“强于”或“弱于”)KI的。
②乙同学根据现有数据证明猜想1不成立,理由是_______。
③补全猜想2:_______。
(4)查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率_______(写出计算式即可)。
(5)实验2-2中,30s内未检测到与反应,可能的原因是_______。
试卷第2页,共9页
参考答案:
1.C
【分析】根据“先拐先平数值大”知,温度:T2>T1.压强P1>P2,其它条件不变时升高温度C含量减小,则平衡逆向移动,△H<0;增大压强B含量减小,平衡正向移动,则a+b>c,故该反应的正反应为气体分子数减小且放热的反应。
【详解】A.该反应的正反应为气体分子数减小且放热的反应,则ΔH<0,ΔS<0,根据ΔG=ΔH-TΔS<0,则该反应在低温可自发进行,故A错误;
B.该反应的正反应为气体分子数减小且放热的反应,则ΔH<0,ΔS<0,故B错误;
C.由以上分析可知,a+b>c,故C正确;
D.该反应为放热反应,升高温度,平衡逆向移动,温度越高,平衡常数越小,则K(T1)>K(T2),故D错误。
故答案为:C
2.A
【详解】A.催化剂可以改变化学反应速率,我们通常所说的催化剂一般都指正催化剂,能加快反应速率,故A正确;
B.增大压强,可以使气体物质的体积变小,其浓度变大,所以反应速率加快,反之,减小压强,可使气体的体积变大,浓度变小,反应速率变慢,由于该反应是气体物之间的反应,改变压强,对反应速率有影响,故B错误;
C.升高温度,可以加快反应速率,降低温度可减慢反应速率。由于NO和CO对人的危害远大于N2和CO2,所以当NO与CO反应生成N2和CO2的速率降低时,对人危害更大,故C错误;
D.2NO+2CO=N2+2CO2是一个气体物质间的化学反应,改变反应物的浓度、压强、温度均能改变该反应的速率,故D错误;
故选A。
3.A
【详解】某温度度下,反应的平衡常数为=a;反应的平衡常数表达式为,相同温度时=,由=a,可得,故选A。
4.B
【详解】①体系的温度不再改变,正、逆反应速率相等,能据此判断该反应达到平衡状态,①正确;
②反应混合物都是气体,反应在恒容密闭容器内进行,容器的容积不变,因此无论反应是否达到平衡,混合气体的密度一直不变,不能据此判断反应是否处于平衡状态,②错误;
③各组分的物质的量浓度不再改变,该反应达到平衡状态,③正确;
④当该反应达到平衡状态,各组分的质量分数不再改变,④正确;
⑤当反应速率vA:vB:vC:vD=m:n:p:q,由于未指明是正反应速率还是逆反应速率,所以不能据此判断该反应是否达到平衡状态,⑤错误;
⑥单位时间内m mol A断键反应等效于pmol C形成,同时pmol C也断键反应,说明任何物质的浓度不变,反应处于平衡状态,⑥正确;
综上所述可知,说法正确的是①③④⑥,故合理选项是B。
5.D
【分析】为了使H2的转化率增大,一般使可逆反应3H2(g)+N2(g) 2NH3(g)△H<0向正反应方向移动,增大氢气的浓度,平衡向正反应方向移动,但会导致H2的转化率减小;该反应为气体体积减小的放热反应,所以可以降低温度,增大压强都能向正反应方向移动,H2的转化率增大,催化剂不改变平衡移动,分离出部分氨也能使平衡向正反应方向移动,H2的转化率增大;
【详解】A.升高温度、降低压强,平衡逆向移动,氢气转化率降低,A错误;
B.催化剂改变反应速率,不影响平衡移动,B错误;
C.升高温度,平衡逆向移动,氢气转化率降低,C错误;
D.降低温度、增大压强、分离出部分氨气,平衡向正反应方向移动,H2的转化率增大,D正确;
故选D。
6.D
【详解】A.常温下合成氨反应的ΔH-TΔS<0,只能说明合成氮反应在常温下能自发进行,而不能说明反应的快慢,故A错;
B.合成氨反应放热,升高温度,合成氨反应逆向移动,平衡转化率降低,故B错误;
C.由于合成氨反应的ΔS<0,ΔH<0,根据ΔH-TΔS,可知高温不自发,故C错误;
D.由于合成氨反应的ΔS<0,ΔH<0,根据ΔH-TΔS,可知在常温时可自发进行,D正确;
选D。
7.A
【详解】A.0~15s内c(HI)由0.1mol/L降到0.07mol/L,HI变化的物质的量浓度为0.03mol·L-1,根据化学反应速率的数学表达式,v(HI)==0.002mol/(L·s),故A正确;
B.浓度降低,化学反应速率减缓,c(HI)由0.07mol·L-1降到0.04mol·L-1,HI表示的化学反应速率小于0.002mol/(L·s),因此所用时间大于15s,故B错误;
C.升高温度,正逆反应速率都增大,故C错误;
D.该反应是气体物质的量不变的反应,减小反应体系的体积,压强增大,化学反应速率加快,当反应平衡不移动,故D错误;
答案为A。
8.B
【详解】A.反应达到平衡时,各组分的含量不变,而不是与系数成比例,A错误;
B.v正=v逆时,反应达到平衡,根据反应速率之比等于化学计量数之比,,故反应达到平衡时,vNH3(正)=2vN2(逆),B正确;
C.根据ρ=,该反应中的物质均为气体,根据质量守恒定律,反应前后m不变,该容器为容积不变的密闭容器,V不变,因此ρ不是变量,变量不变时反应才达到平衡,C错误;
D.可逆反应不能完全进行,D错误;
故选B。
9.D
【分析】采用控制变量方法研究外界条件对反应速率的影响。①②是研究浓度对速率的影响;①③是研究温度对速率的影响,则V=0.8 L,结合图示数据分析判断。
【详解】A.由图可知,t1时间内,①比③生成氧气多,则反应的平均反应速率v①>v③,A错误;
B.①②比较,温度相同、起始物质的量相同,平衡状态不同,由于催化剂只能改变反应速率,不能使化学平衡发生移动,所以②中不可能加催化剂,B错误;
C.若T④>450℃,由表中数据可知温度、浓度均影响反应速率;由②④温度、浓度均不同,因此不能说明是温度对反应速率的影响,C错误;
D.若①②③④四个容器都未加催化剂,①③是研究温度对速率的影响,比较①③两个容器的数据,t1时间内,①比③生成氧气多,二者只有温度不同,可说明温度越高,反应速率越快,D正确;
故合理选项是D。
10.C
【详解】A.Mg比Fe活泼,相同规格下,Mg与盐酸反应速率更快,A错误;
B.浓度相同的盐酸和醋酸,盐酸酸性强,与大理石反应更快,B错误;
C.催化剂降低活化能,活化分子数增加,总分子数不变,所以活化分子百分数增加,C正确;
D.盐酸与锌反应的本质是H+与Zn反应,加入NaCl固体,对反应速率无影响,D错误;
故答案选C。
11.B
【详解】A.碳酸钙分解的反应,是熵增的反应,但反应不能在室温下自发进行,说明该反应的△H>0,错误;
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈,是因为铁比铜活泼,形成原电池时,铁做负极,被腐蚀,正确;
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2 )加快,而平衡逆向移动,氢气的转化率降低,错误;
D.水的离子积常数Kw随着温度的升高而增大,说明升高温度,平衡正向移动,则水的电离是放吸热反应,错误;
答案选B。
12.D
【详解】A.由热化学方程式可知,该反应是一个熵增的放热反应,反应ΔH<0、ΔS>0、ΔH—TΔS恒小于0,该反应一定能自发进行,故A正确;
B.由热化学方程式可知,该反应是放热反应,则反应的正反应的活化能小于逆反应的活化能,故B正确;
C.断裂1mol N—H键的同时断裂1molO—H键说明正反应速率等于逆反应速率,反应已达到化学平衡状态,故C正确;
D.达到平衡时,增大容器的体积,气体压强减小,正反应速率v(正)减小、逆反应速率v(逆)减小,故D错误;
故选D。
13.B
【详解】A.平衡常数和转化率是衡量反应进行程度的物理量,平衡常数越大反应进行程度越大;反应物的转化率越大,反应进行程度越大,平衡常数等于1时,反应物的转化率并不一定等于50%,A错误;
B.1nm=10-7m,分散质微粒直径小于1nm形成的分散系为溶液,大于100nm形成的为浊液,分散质微粒直径在1nm~100nm时形成的分散系为胶体,B正确;
C.OH-与Al3+的物质的量之比为3:1时,铝元素都以Al(OH)3的形式存在,即OH-与Al3+的物质的量之比为≤3时铝元素都以Al(OH)3的形式存在,C错误;
D.钠与氧气的反应不仅与物质的量有关,而且与外界条件有关,点燃条件下生成过氧化钠,D错误。
答案选B。
14.B
【详解】A.反应③中CH4中断裂1条C-H键形成 CH3, OH与H形成H2O中有O-H键生成,则有极性键的断裂与生成,A正确;
B.反应⑤中,H2O2→H2O中O元素从-1降低至-2价,则Ce的化合价升高,B错误;
C.铑/铈氧化物是催化剂,可改变了CH4和H2O2的反应历程,降低了反应的活化能,C正确;
D.由反应⑤可知O连接在Ce上,甲烷可在铑/铈氧化物的催化下与过氧化氢反应,转化为甲醇和甲基过氧化氢(CH3OOH),则若用H2l8O2作反应物,一段时间后CH3OH、CH3OOH和铑/铈氧化物中均含有18O,D正确;
故选:B。
15.B
【详解】A.第一步水解产生了OH-,第三步又消耗了OH-,所以OH-是整个反应的中间产物,不是催化剂,A正确;
B. 第一步反应是水解反应,不是氧化还原反应,B 错误;
C.平衡常数的数值大小可以判断反应进行的程度,不能判断反应速率大小,C正确;
D.总反应减去第一步反应和第三步反应可得第二步为HOCl+I-→HOI + Cl-,D正确;
故选B。
16.(1)越小
(2) 20% bd
(3)<
【详解】(1)合成氨为放热反应,升高温度,平衡逆移,平衡常数减小,故温度越高,其化学平衡常数的值越小。
(2)把与置于体积为的密闭容器内,设反应达平衡时N2转化的物质的量为x,
根据理想气体状态方程,可知恒温恒容条件下,反应前后的压强之比等于气体的总物质的量之比,则
,解x=2,平衡时氢气的转化率=;
反应体系中全部为气体,气体的总质量为定值,恒容条件下,气体的密度不变,不能作为达平衡的标志,a项错误;
该反应为气体分子数减小的反应,恒容装置中,随着反应的进行,体系的压强减小,容器内压强不变说明反应已经达到平衡状态,b项正确;
根据反应的方程式为,可知达平衡时2v正(N2)= v逆(NH3),c项错误;
c(NH3)会随着反应的进行而变化,混合气体中c(NH3)不变,说明反应已经达到平衡状态,d项正确;
故选bd。
(3)结合图象可知,Q点之前反应未达到平衡,随着反应正向进行,混合体系中X的体积分数逐渐减小,Q点之后反应已经达到平衡状态,升高温度,混合体系中X的体积分数增大,说明升温平衡逆移,则正反应为放热反应,故。
17. 0.0267 mol/(L·min) 33.3% c(K+)>c()>c(OH-)>c(H+)>c() ae 向左 0.139 ④
【详解】(1)由图可知,的浓度变化量为,速率之比等于化学计量数之比,则,参加反应的CO为,故CO的转化率为,故答案为:;;
(2)到达平衡,固定容积为2L的密闭容器中,,与KOH物质的量之比为1:1,,则反应生成,溶液中碳酸氢根离子水解溶液呈碱性,溶液中氢氧根离子源于水的电离与碳酸氢根离子水解,故溶液中,故答案为:;
(3)缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大,平衡时CO浓度增大,故a正确;
扩大容器体积,压强减小,平衡向逆反应方向移动,平衡时CO浓度减小,故b错误;
增加NO的量,平衡正向移动,CO浓度减小,故c错误;
降低温度,平衡向正反应方向移动,CO浓度减小,故d错误;
增加CO的量,CO的浓度增大,故e正确;
使用催化剂平衡不移动,CO浓度不变,故f错误,
故答案为:ae;
(4)平衡时氮气浓度变化量为,NO的起始浓度为、CO的起始浓度为,则:
故平衡常数,
20min时再向容器中充入CO、各,此时浓度商,故反应向逆反应进行,即向左移动,
温度不变,平衡常数不变,即重新达到平衡后,该反应的化学平衡常数为,故答案为:向左;;
(5)①、C两点温度相等,则平衡常数相同,故①错误;
②、C两点都在等温线上,C的压强大,与A相比C点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时浓度比A的浓度高,为红棕色气体,则A、C两点气体的颜色:A浅,C深,故②错误;
③、C两点相同物质的含量相同,即二氧化氮与四氧化二氮的物质的量之比相等,则平均相对分子质量相等,故③错误;
④升高温度,化学平衡正向移动,的体积分数增大,由图象可知,A点的体积分数大,则,由状态B到状态A,可以用加热的方法,故④正确;
故答案为:④。
18. 大于 A B C C 1<<3
【详解】试题分析:⑴随时间的延长,反应速率减慢;⑵根据该平衡常数的定义书写表达式;A.气体颜色保持不变,说明NO2的浓度不变,一定平衡; B.根据 ,气体平均相对分子质量为变量,气体平均相对分子质量不变,一定平衡;C.υ逆(NO)=2υ正(O2) ,一定平衡; D.根据 ,气体密度为恒量,密度保持不变,不一定平衡;⑶根据影响平衡移动的因素分析;⑷利用极值法分析a/b的取值范围;
解析:⑴随时间的延长,反应速率减慢,所以0~4s的反应速率大于1~5s内的反应速率;⑵根据该平衡常数的定义,2NO(g)+O2(g)2NO2(g) 平衡常数表达式为;根据V(正)=V(逆)、浓度不变、变量不变分析是否平衡;⑶A.K300℃>K400℃,说明焓变<0,升高温度平衡逆向移动; B.充入Ar使压强增大,平衡不移动; C.充入O2使压强增大,平衡正向移动; D.选择高效催化剂,平衡不移动;⑷利用极值法,假设NO完全反应,则生成NO2 amol,剩余氧气b-0.5a, ,a/b=1;假设O2完全反应,则生成NO2 2bmol,剩余NO a-2b, ,a/b=3,所以a/b的取值范围1<<3;
点睛:缩小容器的体积,增大压强,平衡向气体体积小的方向移动,若恒容通入无关气体增大压强,由于浓度不变,所以平衡不移动。
19. 1-0.5a 9 3-1.5a D 0.5a
【详解】(1)设生成amolmolNH3转化的N2的物质的量为y,则:
N2(g)+3H2(g)2NH3(g),
1 2
y amol
=,y=mol,则平衡时氮气的物质的量为1mol-mol=(1-0.5a)mol;
(2)若在恒温恒压条件1molN2与3molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,若只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,且平衡时NH3 的质量分数与前者相同,根据等效平衡及极限转化后起始的量与原起始量成正比,故H2的物质的量为3mol×3=9mol;
(3)若开始时通入xmolN2﹑6molH2和2molNH3,将2molNH3极限转化为反应物,则相当于开始加入(x+1)molN2﹑(6+3)molH2,达平衡后,NH3的物质的量3amol,则(x+1)mol:(6+3)mol=1:3,解得x=2mol,由恒温恒压条件,两种情况中起始的反应物的物质的量成正比,则平衡时各物质的含量成正比,则1molN2与3molH2的混合气体通入发生反应时平衡时氮气的物质的量为(1- )mol,故开始时通入2molN2﹑6molH2和2molNH3的混合气体通入发生反应时平衡时氮气的物质的量为(1- )mol×3=(3-1.5a)mol,由x=2得开始时通入2 molN2﹑6molH2和2molNH3,平衡时NH3的物质的量3a,则无法判断氨气开始的2mol与平衡时的3amol谁大,故不知道平衡到底向什么方向移动,所以应选D;
(4)若在(3)的平衡混合物中,再加入6molNH3,相当于成比例增大反应物,恒温、恒压下等效,故再次达到平衡后NH3的质量分数与原平衡相同,即NH3的质量分数=×100%=50a%=0.5a。
20. 2KMnO4+16HCl=5Cl2↑+2KCl+8H2O+2MnCl2 除去氯气中混有的HCl d e j h (b c) g f 吸收氯气防止尾气污染;防止空气中的水蒸气进入装置,使CuCl2水解 BC 2Cu2++2Cl-+SO2+2H2O2CuCl↓+4H++SO42- 温度不能过低,防止反应速率慢;不能过高,过高HCl挥发 溶液由蓝色变为无色 稀释促进平衡Cu Cl(白色)+2Cl- [ CuCl3] 2-(无色溶液)逆向移动,生成CuCl;
【详解】I. (1)写出装置A中,发生反应的化学反应方程式为:2KMnO4+16HCl=5Cl2↑+2KCl+8H2O+2MnCl2,装置C装有饱和食盐水,其作用是除去氯气中混有的HCl;(2)从a出来的气体含有氯化氢和水蒸气,依次通过d e j h 除去氯化氢和水蒸气,然后与铜反应,最后尾气处理用氢氧化钠,则依次再通过b c g f,所以按照气流方向各仪器接口的连接顺序为a→d→e→j→h→b→c →g→f;(3)D装置中装有碱石灰,其作用是吸收氯气防止尾气污染;防止空气中的水蒸气进入装置,使CuCl2水解;(4)实验完毕,取试管中的固体用盐酸溶解后,欲提纯氯化铜(原粗铜含杂质铁)可加入CuO或CuCO3、Cu2(OH)2 CO3、.Cu(OH)2以消耗氢离子但不引入新的杂质,并过滤。答案选BC;
Ⅱ、向制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,同时生成硫酸,反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O2CuCl↓+4H++SO42-;(1)温度不能过低,防止反应速率慢;不能过高,过高HCl挥发,故①中“加热”温度不宜过高和过低;当观察到溶液由蓝色变为无色,即表明反应已经完全;(2)②中,加入大量水的作用是稀释促进平衡Cu Cl(白色)+2Cl- [ CuCl3] 2-(无色溶液)逆向移动,生成CuCl;(3)根据①Cu Cl(s)Cu+(aq) + Cl-(aq) Ksp=1.4x10-6;②Cu Cl(s) + Cl一(aq)CuCl2-(aq) K=0.35,①+②得2Cu Cl(s) Cu+(a q)+ [CuCl2]- (a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)= 0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图象为:。
21.(1)做对照,排除O2氧化I-的干扰
(2)+2I-=2+I2
(3) 强于 根据信息i和信息iii可以推测与发生氧化还原反应:+2=2+,实验2-2中,起始n()=0.410-3mol,n()=0.00810-3mol,该反应后n()=0.39610-3mol,仍高于2-1中起始n()(0.0410-3mol),即实验2-2中与反应后,溶液中的浓度仍大于实验2-1中的起始浓度,则实验2-2的溶液应立即变蓝,与实际不符,故猜想1不成立 生成的I2与Na2S2O3迅速反应,待Na2S2O3消耗完,继续生成I2时,淀粉才变蓝
(4)
(5)NH4)2S2O8与Na2S2O3反应的活化能大于与KI反应的活化能(或浓度相同时,(NH4)2S2O8与Na2S2O3反应的速率较(NH4)2S2O8与KI的小),也可能是因为c(Na2S2O3)小于c(KI)
【分析】(NH4)2S2O8具有强氧化性,可以氧化KI生成和I2;为了研究(NH4)2S2O8与KI反应的速率,设计了实验,实验现象表明,用淀粉作指示剂的情况下,实验2-1中(NH4)2S2O8与KI的反应很快,溶液立即变色,而实验2-2中,加入了(NH4)2S2O8与KI,还加入了少量的Na2S2O3溶液,溶液变色时间明显增长,可以依据实验2-2,可表示出(NH4)2S2O8的反应速率。
【详解】(1)实验1-2中,(NH4)2S2O8氧化KI生成I2,淀粉遇I2变蓝,实验1-1中没有加入氧化剂,而在实验1-1和实验1-2中,空气中的O2会将I-氧化为I2,故实验1-1的目的是做对照,排除O2氧化I-的干扰。
(2)根据题干信息可知,(NH4)2S2O8与KI反应生成(NH4)2SO4、K2SO4和I2,该反应的的离子方程式为+2I-=2+I2。
(3)①还原剂还原性大于还原产物;信息iii:2+I2=+2I-,做还原剂,I-为还原产物,故Na2S2O3的还原性强于KI的;
②根据信息i和信息iii可以推测与发生氧化还原反应:+2=2+,实验2-2中,起始n()=0.410-3mol,n()=0.00810-3mol,该反应后n()=0.39610-3mol,仍高于2-1中起始n()(0.0410-3mol),即实验2-2中与反应后,溶液中的浓度仍大于实验2-1中的起始浓度,则实验2-2的溶液应立即变蓝,与实际不符,故猜想1不成立;
③实验2-2中,加入Na2S2O3溶液后溶液变蓝的时间明显增长,还可能是因为(NH4)2S2O8先与KI反应,生成的I2与Na2S2O3迅速反应,待Na2S2O3消耗完,继续生成I2时,淀粉才变蓝。
(4)由反应+2I-=2+I2和反应2+I2=+2I-可得:~2,30s内,Δn()=0.00810-3mol,则Δn()=0.00810-3mol,故30s内的平均反应速率v()==mol·L-1·s-1。
(5)实验2-2中,30s内未检测到(NH4)2S2O8与Na2S2O3反应,可能的原因是(NH4)2S2O8与Na2S2O3反应的活化能大于与KI反应的活化能(或浓度相同时,(NH4)2S2O8与Na2S2O3反应的速率较(NH4)2S2O8与KI的小),也可能是因为c(Na2S2O3)小于c(KI)
