2.2.3 化学平衡常数 课件 (共14张PPT) 2022-2023学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.3 化学平衡常数 课件 (共14张PPT) 2022-2023学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 156.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-19 09:55:18 | ||
图片预览






文档简介
(共14张PPT)
第二章 化学反应速率和化学平衡
第二节 化学平衡
第3课时 化学平衡常数
学习目标(1min)
1.理解化学平衡常数的概念。
2.学会正确书写化学平衡常数的表达式
3.掌握一定温度下的平衡常数的计算。
问题导学(10min)
阅读课本P31-32的实验数据表格,思考下列问题:
①各组实验在什么温度完成的?
②一共完成了几次实验?
③每次实验都有七个数据,请把第一组实验和第四组实验的七个数据的意思具体说出来。想想这两次实验的化学反应方向有何不同
④哪几组实验是从正反应方向开始的,哪几组实验是从逆反应方向开始的?
⑤通过分析实验数据能够得出哪些结论?
通过分析实验数据得出:
(2)该常数与反应的起始浓度大小无关;
(3)该常数与正向还是逆向建立平衡无关即与平衡建立的途径无关。
那么该常数大小与什么有关呢?
(1)某温度下, 为一常数;
2
C (HI)
C(H2) · C(I2)
点拨精讲(17min)
一、化学平衡常数
1.定义:
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应在该温度下的化学平衡常数(简称平衡常数),用符号“K”表示。
2.表达式:
mA(g)+nB(g) pC(g)+qD(g)
K=
Cp(C)· Cq(D)
Cm(A)· Cn(B)
代入公式的浓度是指平衡时各物质的浓度
(1)固体和纯液体不记入平衡常数表达式中:
Cr2O72-+H2O 2CrO42-+2H+
C2(CrO42-)·C2(H+)
C(Cr2O72-)
K=
②平衡常数大小与反应物或生成物的浓度和压强无关,仅与温度有关 。
①若计算时代入的浓度必须是平衡浓度。
③平衡常数没有固定单位,一般不写。
K=C(CO2)
CaCO3(s) CaO(s)+CO2(g)
3.平衡常数表达式的书写注意事项:
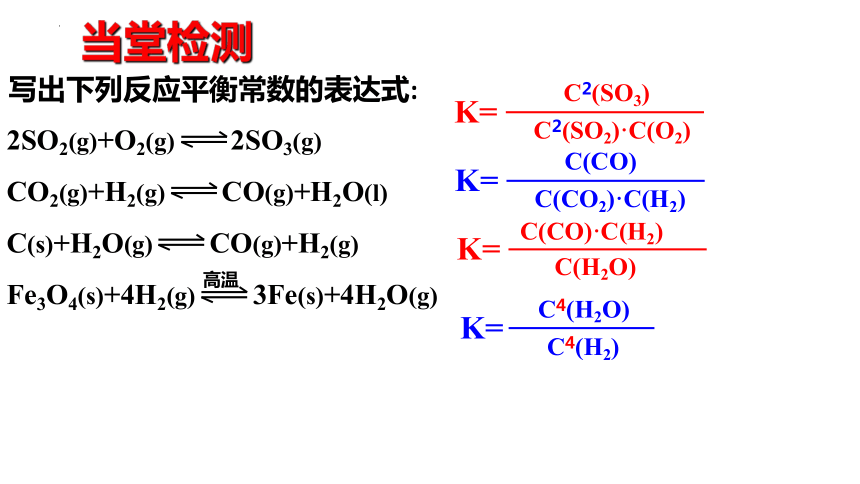
当堂检测
写出下列反应平衡常数的表达式:
2SO2(g)+O2(g) 2SO3(g)
CO2(g)+H2(g) CO(g)+H2O(l)
C(s)+H2O(g) CO(g)+H2(g)
Fe3O4(s)+4H2(g) 3Fe(s)+4H2O(g)
高温
C2(SO3)
C2(SO2)·C(O2)
K=
C(CO)
C(CO2)·C(H2)
K=
C(CO)·C(H2)
C(H2O)
K=
C4(H2O)
C4(H2)
K=
N2+3H2 2NH3
2NH3 N2+3H2
1/2N2+3/2H2 NH3
(2)平衡常数的表达式与方程式的书写方式有关:
K1 = 1/K2 = K32
C2(NH3)
C(N2)·C3 (H2)
K1=
C(N2)·C3 (H2)
C2(NH3)
K2=
C(NH3)
C1/2 (N2)·C3/2 (H2)
K3=
平衡常数是指某一具体反应的平衡常数,若反应方向改变或化学计量数等倍扩大或缩小,平衡常数也会改变。
(3)多重平衡规则:
若方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商):
分别写出下列平衡数的表达式,找出关系。
2NO(g)+O2(g) 2NO2 K1
2NO2(g) N2O4 K2
2NO(g) +O2(g) N2O4(g) K
C(s)+CO2(g) 2CO(g) K
C(s)+H2O(g) CO(g)+H2(g) K1
CO(g)+H2O(g) CO2(g)+H2(g) K2
= K1 K2
= K1 /K2
(4)对于离子反应,应根据离子方程式来书写化学平衡常数的表达式:
Cl2+H2O HCl+HClO
C(H+)·C(Cl-)·C(HClO)
C(Cl2)
K=
C(HCl)·C(HClO)
C(Cl2)
K=
×
4.平衡常数的影响因素:
(1)决定因素:反应本身;
(2)影响因素:温度。
课堂小结(2min)
一、化学平衡常数
1.定义:
2.表达式:
3.注意事项:
(1)固体和纯液体不记入平衡常数表达式中:
(2)平衡常数的表达式与方程式的书写方式有关:
(4)对于离子反应,应根据离子方程式来书写化学平衡常数的表达式:
(3)多重平衡规则:
若方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商):
(1)决定因素:反应本身;
(2)影响因素:温度。
4.影响因素:
当堂检测(15min)
1.反应H2(g)+I2(g) 2HI(g)在450℃时,其化学平衡常数为49,则反应HI(g) H2(g)+ I2(g)在450℃时的化学平衡常数为( )
A.49 B.1/49 C.24.5 D.1/7
2.下列关于平衡常数K的说法中,正确的是( )
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④改变压强会改变平衡常数K
A.①② B.②③ C.③④ D.①③
1
2
1
2
D
D
当堂检测(15min)
3.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物 质 X Y Z
初始浓度/mol·L-1 0.1 0.2 0
平衡浓度/mol·L-1 0.05 0.05 0.1
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z ,其平衡常数为1600
C.增大压强使平衡向生成Z方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
C
4.将固体NH4I(碘化铵)置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g)
②2HI(g) H2(g)+I2(g)
达到平衡时,C(H2)=0.5mol/L,C(HI)=4mol/L,
则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
C
当堂检测(15min)
第二章 化学反应速率和化学平衡
第二节 化学平衡
第3课时 化学平衡常数
学习目标(1min)
1.理解化学平衡常数的概念。
2.学会正确书写化学平衡常数的表达式
3.掌握一定温度下的平衡常数的计算。
问题导学(10min)
阅读课本P31-32的实验数据表格,思考下列问题:
①各组实验在什么温度完成的?
②一共完成了几次实验?
③每次实验都有七个数据,请把第一组实验和第四组实验的七个数据的意思具体说出来。想想这两次实验的化学反应方向有何不同
④哪几组实验是从正反应方向开始的,哪几组实验是从逆反应方向开始的?
⑤通过分析实验数据能够得出哪些结论?
通过分析实验数据得出:
(2)该常数与反应的起始浓度大小无关;
(3)该常数与正向还是逆向建立平衡无关即与平衡建立的途径无关。
那么该常数大小与什么有关呢?
(1)某温度下, 为一常数;
2
C (HI)
C(H2) · C(I2)
点拨精讲(17min)
一、化学平衡常数
1.定义:
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应在该温度下的化学平衡常数(简称平衡常数),用符号“K”表示。
2.表达式:
mA(g)+nB(g) pC(g)+qD(g)
K=
Cp(C)· Cq(D)
Cm(A)· Cn(B)
代入公式的浓度是指平衡时各物质的浓度
(1)固体和纯液体不记入平衡常数表达式中:
Cr2O72-+H2O 2CrO42-+2H+
C2(CrO42-)·C2(H+)
C(Cr2O72-)
K=
②平衡常数大小与反应物或生成物的浓度和压强无关,仅与温度有关 。
①若计算时代入的浓度必须是平衡浓度。
③平衡常数没有固定单位,一般不写。
K=C(CO2)
CaCO3(s) CaO(s)+CO2(g)
3.平衡常数表达式的书写注意事项:
当堂检测
写出下列反应平衡常数的表达式:
2SO2(g)+O2(g) 2SO3(g)
CO2(g)+H2(g) CO(g)+H2O(l)
C(s)+H2O(g) CO(g)+H2(g)
Fe3O4(s)+4H2(g) 3Fe(s)+4H2O(g)
高温
C2(SO3)
C2(SO2)·C(O2)
K=
C(CO)
C(CO2)·C(H2)
K=
C(CO)·C(H2)
C(H2O)
K=
C4(H2O)
C4(H2)
K=
N2+3H2 2NH3
2NH3 N2+3H2
1/2N2+3/2H2 NH3
(2)平衡常数的表达式与方程式的书写方式有关:
K1 = 1/K2 = K32
C2(NH3)
C(N2)·C3 (H2)
K1=
C(N2)·C3 (H2)
C2(NH3)
K2=
C(NH3)
C1/2 (N2)·C3/2 (H2)
K3=
平衡常数是指某一具体反应的平衡常数,若反应方向改变或化学计量数等倍扩大或缩小,平衡常数也会改变。
(3)多重平衡规则:
若方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商):
分别写出下列平衡数的表达式,找出关系。
2NO(g)+O2(g) 2NO2 K1
2NO2(g) N2O4 K2
2NO(g) +O2(g) N2O4(g) K
C(s)+CO2(g) 2CO(g) K
C(s)+H2O(g) CO(g)+H2(g) K1
CO(g)+H2O(g) CO2(g)+H2(g) K2
= K1 K2
= K1 /K2
(4)对于离子反应,应根据离子方程式来书写化学平衡常数的表达式:
Cl2+H2O HCl+HClO
C(H+)·C(Cl-)·C(HClO)
C(Cl2)
K=
C(HCl)·C(HClO)
C(Cl2)
K=
×
4.平衡常数的影响因素:
(1)决定因素:反应本身;
(2)影响因素:温度。
课堂小结(2min)
一、化学平衡常数
1.定义:
2.表达式:
3.注意事项:
(1)固体和纯液体不记入平衡常数表达式中:
(2)平衡常数的表达式与方程式的书写方式有关:
(4)对于离子反应,应根据离子方程式来书写化学平衡常数的表达式:
(3)多重平衡规则:
若方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商):
(1)决定因素:反应本身;
(2)影响因素:温度。
4.影响因素:
当堂检测(15min)
1.反应H2(g)+I2(g) 2HI(g)在450℃时,其化学平衡常数为49,则反应HI(g) H2(g)+ I2(g)在450℃时的化学平衡常数为( )
A.49 B.1/49 C.24.5 D.1/7
2.下列关于平衡常数K的说法中,正确的是( )
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④改变压强会改变平衡常数K
A.①② B.②③ C.③④ D.①③
1
2
1
2
D
D
当堂检测(15min)
3.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物 质 X Y Z
初始浓度/mol·L-1 0.1 0.2 0
平衡浓度/mol·L-1 0.05 0.05 0.1
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z ,其平衡常数为1600
C.增大压强使平衡向生成Z方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
C
4.将固体NH4I(碘化铵)置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g)
②2HI(g) H2(g)+I2(g)
达到平衡时,C(H2)=0.5mol/L,C(HI)=4mol/L,
则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
C
当堂检测(15min)
