第1章 原子结构 元素周期律 检测题 (含答案) 2022-2023学年高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章 原子结构 元素周期律 检测题 (含答案) 2022-2023学年高一下学期化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 231.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-19 09:32:32 | ||
图片预览



文档简介
第1章《原子结构 元素周期律》检测题
一、单选题(共13题)
1.太空飞船的太阳能电池板有“飞船血液”之称,我国在砷化镓太阳能电池研究方面处于国际领先水平,下列有关说法正确的是
A.砷元素符号为As,位于元素周期表中第四周期ⅤA族
B.酸性:砷酸>磷酸
C.镓元素符号为Ga,单质不能与水反应
D.碱性:Ga(OH)3<Al(OH)3
2.由物理变化引起的颜色改变是
A.光照使Cl2和CH4的混合气体变浅 B.浓硫酸使蔗糖变黑
C.溴水中加苯振荡使水层褪色 D.通电使CuCl2溶液变浅
3.已知短周期元素的离子:aAm+、bBn+、cCm-、dDn-(m>n)都具有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>C>D B.原子序数:d>c>b>a
C.离子半径:C>D>B>A D.单质的还原性:A>B>D>C
4.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法正确的是( )
X Y
Z W
A.X、Y的最高价氧化物对应水化物的酸性:
B.W、X两种元素的氧化物均能与NaOH溶液反应
C.常温下,Z和W的单质均能溶于浓硫酸
D.原子半径由大到小的顺序:
5.下列化合物中,阳离子半径与阴离子半径比值最小的是
A.NaF B.NaCl C.MgI2 D.KBr
6.下列关于硅的说法正确的是
①硅在自然界中以游离态和化合态两种形式存在
②水泥是硅酸盐材料
③单质硅是良好的半导体
④氮化硅陶瓷是新型的无机非金属材料
⑤光导纤维属于硅酸盐产品
A.①② B.③④⑤ C.①②⑤ D.②③④
7.已知四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,正确的是
A.原子半径: B.原子序数:
C.原子最外层电子数: D.金属性:,还原性:
8.短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法错误的是
W X
Y Z
A.最高价氧化物对应水化物的酸性:Z>Y
B.W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
C.在元素周期表中,53号元素与Z元素位于同一主族
D.工业上常用YX2漂白纸浆、毛、丝等
9.在核反应中用α粒子(即氦核He)轰击金属原子X,得到核素Y,开创了人造放射性核素的先河:X+He→Y+n。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
A.X的相对原子质量为26
B.α粒子轰击金属原子X发生了化学反应
C.X的原子半径小于Y的原子半径
D.X、Y均可形成三氯化物
10.下列各组性质比较中,选项中均正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:NaOH>Mg(OH)2>Al(OH)3 ③离子半径:O2-Cl2>Br2 ⑤气态氢化物稳定性:HF>HCl>H2S
A.①②③ B.②③④ C.①②④⑤ D.①②③④
11.据报道,科学家已成功合成了少量,有关的说法正确的是
A.和的化学性质完全相同 B.的摩尔质量是
C.和是氢元素的两种核素 D.是氢元素的一种同位素
12.三氧化二铬(Cr2O3) 是一种深绿色的固体,熔点很高,难溶于水,其化学性质类似于Al2O3,水溶液中Cr(+3)具有还原性。下列关于Cr2O3的说法错误的是
A.与稀硫酸反应: Cr2O3+ 3H2SO4 = Cr2(SO4)3+ 3H2O
B.与NaOH溶液反应: Cr2O3+ 4OH- = 2+2H2O
C.碱性条件下被H2O2氧化为Cr(+6): Cr2O3+ 3H2O2+ 4OH- =2+ 5H2O
D.由于金属性铝强于铬,且铬的熔点较高,故可用铝热法还原Cr2O3制取金属铬
13.在元素周期表中,铂元素如图所示,下列有关说法正确的是
A.铂是非金属元素,在常温下呈固态
B.Pt和Pt的核外电子数相同,互为同位素
C.“195.1”是铂的质量数
D.由78可以推出Pt为第5周期元素
二、非选择题(共10题)
14.短周期主族元素X、Y、Z、W、R原子序数依次增大,X原子最外层电子数是其内层电子数的2倍,Y、R同主族,且两者核外电子数之和是x核外电子数的4倍,Z是迄今发现的非金属性最强的元素,在周期表中W位于ⅠA族。
请按要求回答:
(1)元素X在周期表中所处位置为________。
(2)元素Y、R的简单氢化物稳定性由强到弱的顺序为________(写氢化物的化学式)。
(3)元素Z、W的简单离子半径由大到小的顺序依次为________(填离子符号)。
(4)W、R两种元素最高价氧化物对应的水化物在水溶液中相互反应的离子方程式为____________。
(5)已知:在加热条件下,R单质能与W的氢氧化物水溶液反应,产物中R元素的分别为+4和-2。试写出该反应的化学方程式:_______________。
15.黑火药爆炸时发生的反应:S+2KNO3+3CK2S+3CO2↑+N2↑
(1)上述反应涉及的元素中,非金属性最强的是___________,S在周期表中的位置是___________。
(2)氮元素对应的气态氢化物是___________,其水溶液显___________性,写出一水合氨的电离方程式___________。
(3)硫元素在自然界主要以硫酸盐的形式存在。写出检验SO的方法:___________
(4)氧、硫的非金属性强弱可通过比较这两种元素___________(选填编号)
a.原子的得电子的能力b.含氧酸的酸性c.气态氢化物的酸性d.单质的熔沸点
16.根据所学知识填空:
(1)16 g物质A中含有的分子数为3.01×1023,则A的摩尔质量为_______。
(2)1.7 g NH3与标准状况下_______ L H2S含有相同数目的氢原子。
(3)0.17 g OH-中质子的物质的量为_______,电子的微粒数为_______个。
(4)某气体在标准状况下的密度为1.25 g/L,则14 g该气体所含有的分子数为_______。
17.钾玻璃中含有18.4%的K2O,11.0%的CaO,70.6%的SiO2。
(1)计算三种氧化物的物质的量之比_________。
(2)若需制造5.1 t 钾玻璃,需用碳酸钾、石灰石、石英各_________吨?
(3)生产过程中释放出_________吨温室气体二氧化碳?
18.硅元素有28Si、29Si、30Si三种同位素,硅的近似相对原子质量为28.1,自然界中28Si的原子百分数为92%,则29Si和30Si的原子个数比为____________。
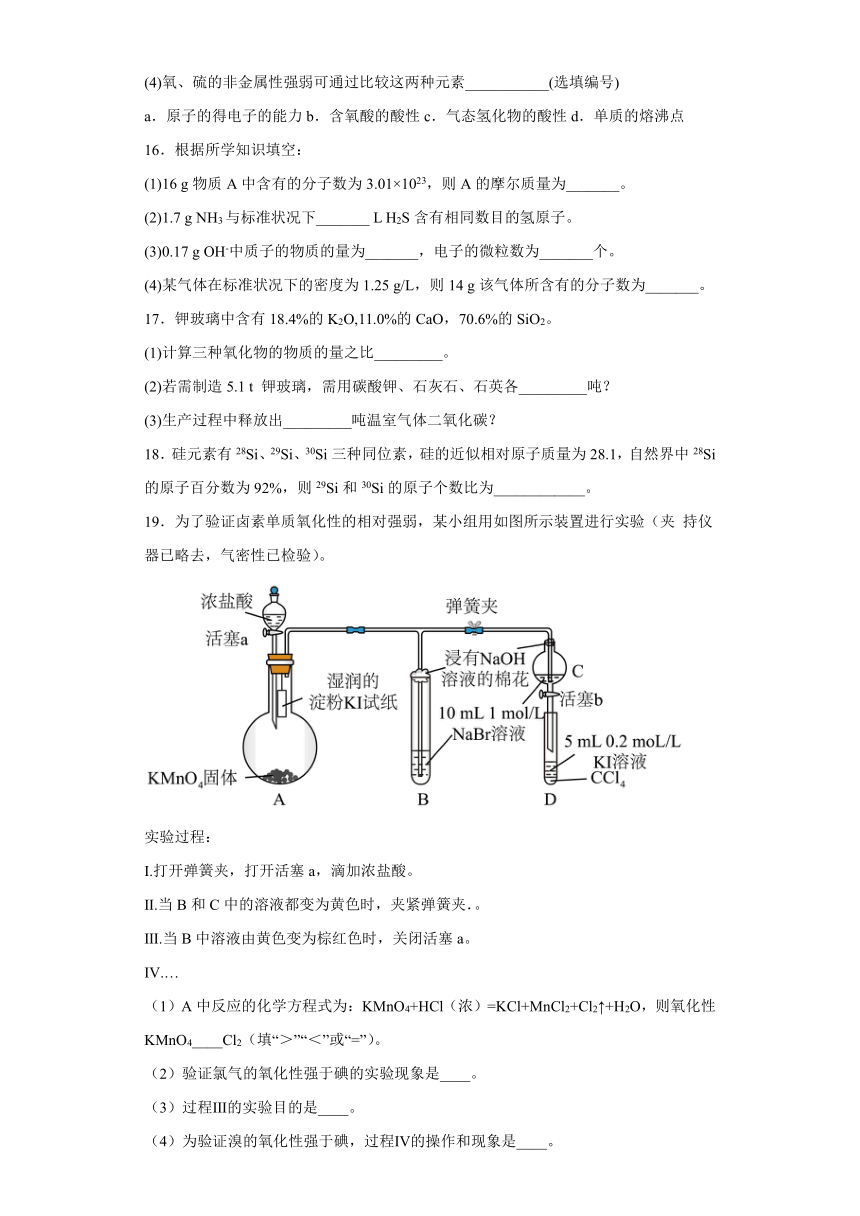
19.为了验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹 持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.…
(1)A中反应的化学方程式为:KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O,则氧化性KMnO4____Cl2(填“>”“<”或“=”)。
(2)验证氯气的氧化性强于碘的实验现象是____。
(3)过程Ⅲ的实验目的是____。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____。
(5)浸有NaOH溶液的棉花团的作用是____。此处发生的化学方 程式是____。
(6)氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们单质氧化性强弱为:Cl2>Br2>(CN)2>(SCN)2>I2。试写出:在NaBr和KSCN的混合溶液中加入(CN)2的化学方程式:____。
20.A、B、C、D、E 五种短周期元素,它们的原子序数依次增大。A可与其他四种元素分别形成二元化合物,其中只在与D形成的化合物中呈-1价;对应的水化物与反应生成一种盐X;D的原子半径在短周期中最大(0族元素除外);E元素原子的最外层电子数是其次外层电子数的3/4倍。请回答下列问题:
(1)X中含有的化学键类型为_______,化合物DA的电子式为_______,A与B形成的18电子的化合物的结构式为_______。
(2)元素的非金属性C_______E(填“>”“<”或“=”)下列各项中,能说明该结论的事实有_______(填序号);
①氢化物的酸性比强
②氢化物的热稳定性比强
③氢化物的水溶液放置在空气中会变浑浊
④单质与氢气化合C比E容易
(3)B、C、D形成的简单离子的半径由大到小的顺序是:_______(用离子符号表示)。用电子式表示D与E形成的化合物的形成过程:_______。
(4)B、C的气态氢化物稳定性为_______>_______,请从原子结构的角度解释其原因:_______。
21.A、B、C、D、E 是核电荷数依次增大的五种短周期主族元素,A 元素的原子核内只有 1 个质子;B 元素的原子半径是其所在主族中最小的,B 的最高价氧化物对应水化物的化学式为HBO3; C 元素原子的最外层电子数比次外层多 4;C 的阴离子与 D 的阳离子具有相同的电子排布,两元素可形成化合物 D2C;C、E 同主族。
(1)E 元素形成的最高价氧化物对应的水化物的化学式为 ___________。
(2)元素 C、D、E 形成的简单离子半径大小关系是 ___________(用离子符号表示)。
(3)用电子式表示化合物A2C的形成过程:___________。C、D 还可形成化合物 D2C2, D2C2中含有的化学键类型是___________。
(4)由 A、B、C 三种元素形成的离子化合物的化学式为 ___________,它与强碱溶液共热,发生反应的离子方程式是___________。
22.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 B ① ② Ne
3 ③ ④ ⑤ Si ⑥ ⑦
(1) ①的元素符号是__________
(2) ②和⑥两种元素的原子半径大小关系:_________(填“>”或“<”);
(3) ③和⑤两种元素的金属性强弱关系:________(填“>”或“<”);
(4)③和⑦形成的化合物属于_________(填“离子化合物”或“共价化合物”);写出该化合物的电子式为:______________________;
(5)写出元素②在周期表中的位置_______________________;
(6)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:_____________。
23.X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 相关信息
X X的某种氢化物能使湿润的红色石蕊试纸变蓝
Y Y的一种核素质量数为24.中子数为12
Z Z的单质是良好的半导体材料,广泛应用于光电信息领域
W W的最高价氧化物对应水化物是一种不溶于水的蓝色固体
回答下列问题:
(1)Y在元素周期表中的位置是________;X、Z的简单气态氢化物稳定性较弱的是____(填化学式)。
(2)X的一种氢化物X2H4的分子中极性键和非极性键数目比为_______;Y的氯化物电子式为________。
(3)W的氧化物(W2O)跟X的最高价氧化物对应的水化物反应生成XO的离子方程式为_______。
参考答案:
1.A 2.C 3.C 4.D 5.C 6.D 7.B 8.B 9.D 10.C 11.B 12.B 13.B
14.(1)第二周期ⅣA族
(2)H2O、H2S或H2O>H2S
(3)F-、Na+或F->Na+
(4)H++OH-=H2O
(5)3S + 6NaOH2Na2S + Na2SO3 + 3H2O
15. O 第三周期第ⅥA族 NH3 碱 NH3·H2O NH+OH- 取样,先加入稀盐酸无明显现象,再加入BaCl2溶液,有白色沉淀产生,证明有硫酸根 a
16.(1)32 g·mol-1
(2)3.36
(3) 0.09 mol 6.02×1022
(4)3.01×1023
17. 1∶1∶6 1.38 t、1.00 t、3.6 t 0.88 t
18.3:1
19. > 淀粉KI试纸变蓝 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫(或紫红)色 吸收氯气,防止污染空气 Cl2+2NaOH=NaCl+ NaClO+H2O 2SCN-+(CN)2=(SCN)2+2CN-
20.(1) 离子键和共价键
(2) > ②③④
(3)
(4) 因为O原子的核电荷数多,原子半径小,最外层电子数多,原子核对最外层电子的吸引能力强
21. H2SO4 S2->O2->Na+ 离子键、非极性共价键(或离子键、共价键) NH4NO3 NH4++OH-NH3↑+H2O
22. N < > 离子化合物 第二周期VIA族 Mg+2H+=Mg2++H2↑
23. 第三周期、第IIA族 SiH4 4:1 3Cu2O + 2NO3- +14H+=6Cu2++ 2NO↑+ 7H2O
一、单选题(共13题)
1.太空飞船的太阳能电池板有“飞船血液”之称,我国在砷化镓太阳能电池研究方面处于国际领先水平,下列有关说法正确的是
A.砷元素符号为As,位于元素周期表中第四周期ⅤA族
B.酸性:砷酸>磷酸
C.镓元素符号为Ga,单质不能与水反应
D.碱性:Ga(OH)3<Al(OH)3
2.由物理变化引起的颜色改变是
A.光照使Cl2和CH4的混合气体变浅 B.浓硫酸使蔗糖变黑
C.溴水中加苯振荡使水层褪色 D.通电使CuCl2溶液变浅
3.已知短周期元素的离子:aAm+、bBn+、cCm-、dDn-(m>n)都具有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>C>D B.原子序数:d>c>b>a
C.离子半径:C>D>B>A D.单质的还原性:A>B>D>C
4.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法正确的是( )
X Y
Z W
A.X、Y的最高价氧化物对应水化物的酸性:
B.W、X两种元素的氧化物均能与NaOH溶液反应
C.常温下,Z和W的单质均能溶于浓硫酸
D.原子半径由大到小的顺序:
5.下列化合物中,阳离子半径与阴离子半径比值最小的是
A.NaF B.NaCl C.MgI2 D.KBr
6.下列关于硅的说法正确的是
①硅在自然界中以游离态和化合态两种形式存在
②水泥是硅酸盐材料
③单质硅是良好的半导体
④氮化硅陶瓷是新型的无机非金属材料
⑤光导纤维属于硅酸盐产品
A.①② B.③④⑤ C.①②⑤ D.②③④
7.已知四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,正确的是
A.原子半径: B.原子序数:
C.原子最外层电子数: D.金属性:,还原性:
8.短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法错误的是
W X
Y Z
A.最高价氧化物对应水化物的酸性:Z>Y
B.W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
C.在元素周期表中,53号元素与Z元素位于同一主族
D.工业上常用YX2漂白纸浆、毛、丝等
9.在核反应中用α粒子(即氦核He)轰击金属原子X,得到核素Y,开创了人造放射性核素的先河:X+He→Y+n。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
A.X的相对原子质量为26
B.α粒子轰击金属原子X发生了化学反应
C.X的原子半径小于Y的原子半径
D.X、Y均可形成三氯化物
10.下列各组性质比较中,选项中均正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:NaOH>Mg(OH)2>Al(OH)3 ③离子半径:O2-
A.①②③ B.②③④ C.①②④⑤ D.①②③④
11.据报道,科学家已成功合成了少量,有关的说法正确的是
A.和的化学性质完全相同 B.的摩尔质量是
C.和是氢元素的两种核素 D.是氢元素的一种同位素
12.三氧化二铬(Cr2O3) 是一种深绿色的固体,熔点很高,难溶于水,其化学性质类似于Al2O3,水溶液中Cr(+3)具有还原性。下列关于Cr2O3的说法错误的是
A.与稀硫酸反应: Cr2O3+ 3H2SO4 = Cr2(SO4)3+ 3H2O
B.与NaOH溶液反应: Cr2O3+ 4OH- = 2+2H2O
C.碱性条件下被H2O2氧化为Cr(+6): Cr2O3+ 3H2O2+ 4OH- =2+ 5H2O
D.由于金属性铝强于铬,且铬的熔点较高,故可用铝热法还原Cr2O3制取金属铬
13.在元素周期表中,铂元素如图所示,下列有关说法正确的是
A.铂是非金属元素,在常温下呈固态
B.Pt和Pt的核外电子数相同,互为同位素
C.“195.1”是铂的质量数
D.由78可以推出Pt为第5周期元素
二、非选择题(共10题)
14.短周期主族元素X、Y、Z、W、R原子序数依次增大,X原子最外层电子数是其内层电子数的2倍,Y、R同主族,且两者核外电子数之和是x核外电子数的4倍,Z是迄今发现的非金属性最强的元素,在周期表中W位于ⅠA族。
请按要求回答:
(1)元素X在周期表中所处位置为________。
(2)元素Y、R的简单氢化物稳定性由强到弱的顺序为________(写氢化物的化学式)。
(3)元素Z、W的简单离子半径由大到小的顺序依次为________(填离子符号)。
(4)W、R两种元素最高价氧化物对应的水化物在水溶液中相互反应的离子方程式为____________。
(5)已知:在加热条件下,R单质能与W的氢氧化物水溶液反应,产物中R元素的分别为+4和-2。试写出该反应的化学方程式:_______________。
15.黑火药爆炸时发生的反应:S+2KNO3+3CK2S+3CO2↑+N2↑
(1)上述反应涉及的元素中,非金属性最强的是___________,S在周期表中的位置是___________。
(2)氮元素对应的气态氢化物是___________,其水溶液显___________性,写出一水合氨的电离方程式___________。
(3)硫元素在自然界主要以硫酸盐的形式存在。写出检验SO的方法:___________
(4)氧、硫的非金属性强弱可通过比较这两种元素___________(选填编号)
a.原子的得电子的能力b.含氧酸的酸性c.气态氢化物的酸性d.单质的熔沸点
16.根据所学知识填空:
(1)16 g物质A中含有的分子数为3.01×1023,则A的摩尔质量为_______。
(2)1.7 g NH3与标准状况下_______ L H2S含有相同数目的氢原子。
(3)0.17 g OH-中质子的物质的量为_______,电子的微粒数为_______个。
(4)某气体在标准状况下的密度为1.25 g/L,则14 g该气体所含有的分子数为_______。
17.钾玻璃中含有18.4%的K2O,11.0%的CaO,70.6%的SiO2。
(1)计算三种氧化物的物质的量之比_________。
(2)若需制造5.1 t 钾玻璃,需用碳酸钾、石灰石、石英各_________吨?
(3)生产过程中释放出_________吨温室气体二氧化碳?
18.硅元素有28Si、29Si、30Si三种同位素,硅的近似相对原子质量为28.1,自然界中28Si的原子百分数为92%,则29Si和30Si的原子个数比为____________。
19.为了验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹 持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.…
(1)A中反应的化学方程式为:KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O,则氧化性KMnO4____Cl2(填“>”“<”或“=”)。
(2)验证氯气的氧化性强于碘的实验现象是____。
(3)过程Ⅲ的实验目的是____。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____。
(5)浸有NaOH溶液的棉花团的作用是____。此处发生的化学方 程式是____。
(6)氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们单质氧化性强弱为:Cl2>Br2>(CN)2>(SCN)2>I2。试写出:在NaBr和KSCN的混合溶液中加入(CN)2的化学方程式:____。
20.A、B、C、D、E 五种短周期元素,它们的原子序数依次增大。A可与其他四种元素分别形成二元化合物,其中只在与D形成的化合物中呈-1价;对应的水化物与反应生成一种盐X;D的原子半径在短周期中最大(0族元素除外);E元素原子的最外层电子数是其次外层电子数的3/4倍。请回答下列问题:
(1)X中含有的化学键类型为_______,化合物DA的电子式为_______,A与B形成的18电子的化合物的结构式为_______。
(2)元素的非金属性C_______E(填“>”“<”或“=”)下列各项中,能说明该结论的事实有_______(填序号);
①氢化物的酸性比强
②氢化物的热稳定性比强
③氢化物的水溶液放置在空气中会变浑浊
④单质与氢气化合C比E容易
(3)B、C、D形成的简单离子的半径由大到小的顺序是:_______(用离子符号表示)。用电子式表示D与E形成的化合物的形成过程:_______。
(4)B、C的气态氢化物稳定性为_______>_______,请从原子结构的角度解释其原因:_______。
21.A、B、C、D、E 是核电荷数依次增大的五种短周期主族元素,A 元素的原子核内只有 1 个质子;B 元素的原子半径是其所在主族中最小的,B 的最高价氧化物对应水化物的化学式为HBO3; C 元素原子的最外层电子数比次外层多 4;C 的阴离子与 D 的阳离子具有相同的电子排布,两元素可形成化合物 D2C;C、E 同主族。
(1)E 元素形成的最高价氧化物对应的水化物的化学式为 ___________。
(2)元素 C、D、E 形成的简单离子半径大小关系是 ___________(用离子符号表示)。
(3)用电子式表示化合物A2C的形成过程:___________。C、D 还可形成化合物 D2C2, D2C2中含有的化学键类型是___________。
(4)由 A、B、C 三种元素形成的离子化合物的化学式为 ___________,它与强碱溶液共热,发生反应的离子方程式是___________。
22.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 B ① ② Ne
3 ③ ④ ⑤ Si ⑥ ⑦
(1) ①的元素符号是__________
(2) ②和⑥两种元素的原子半径大小关系:_________(填“>”或“<”);
(3) ③和⑤两种元素的金属性强弱关系:________(填“>”或“<”);
(4)③和⑦形成的化合物属于_________(填“离子化合物”或“共价化合物”);写出该化合物的电子式为:______________________;
(5)写出元素②在周期表中的位置_______________________;
(6)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:_____________。
23.X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 相关信息
X X的某种氢化物能使湿润的红色石蕊试纸变蓝
Y Y的一种核素质量数为24.中子数为12
Z Z的单质是良好的半导体材料,广泛应用于光电信息领域
W W的最高价氧化物对应水化物是一种不溶于水的蓝色固体
回答下列问题:
(1)Y在元素周期表中的位置是________;X、Z的简单气态氢化物稳定性较弱的是____(填化学式)。
(2)X的一种氢化物X2H4的分子中极性键和非极性键数目比为_______;Y的氯化物电子式为________。
(3)W的氧化物(W2O)跟X的最高价氧化物对应的水化物反应生成XO的离子方程式为_______。
参考答案:
1.A 2.C 3.C 4.D 5.C 6.D 7.B 8.B 9.D 10.C 11.B 12.B 13.B
14.(1)第二周期ⅣA族
(2)H2O、H2S或H2O>H2S
(3)F-、Na+或F->Na+
(4)H++OH-=H2O
(5)3S + 6NaOH2Na2S + Na2SO3 + 3H2O
15. O 第三周期第ⅥA族 NH3 碱 NH3·H2O NH+OH- 取样,先加入稀盐酸无明显现象,再加入BaCl2溶液,有白色沉淀产生,证明有硫酸根 a
16.(1)32 g·mol-1
(2)3.36
(3) 0.09 mol 6.02×1022
(4)3.01×1023
17. 1∶1∶6 1.38 t、1.00 t、3.6 t 0.88 t
18.3:1
19. > 淀粉KI试纸变蓝 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫(或紫红)色 吸收氯气,防止污染空气 Cl2+2NaOH=NaCl+ NaClO+H2O 2SCN-+(CN)2=(SCN)2+2CN-
20.(1) 离子键和共价键
(2) > ②③④
(3)
(4) 因为O原子的核电荷数多,原子半径小,最外层电子数多,原子核对最外层电子的吸引能力强
21. H2SO4 S2->O2->Na+ 离子键、非极性共价键(或离子键、共价键) NH4NO3 NH4++OH-NH3↑+H2O
22. N < > 离子化合物 第二周期VIA族 Mg+2H+=Mg2++H2↑
23. 第三周期、第IIA族 SiH4 4:1 3Cu2O + 2NO3- +14H+=6Cu2++ 2NO↑+ 7H2O
