2023届高三化学二轮复习基于“价类二维”的情境导研式元素化合物复习策略课件(共36张PPT)
文档属性
| 名称 | 2023届高三化学二轮复习基于“价类二维”的情境导研式元素化合物复习策略课件(共36张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-19 11:09:25 | ||
图片预览


文档简介
(共36张PPT)
基于“价类二维”的情境导研式元素化合物复习策略
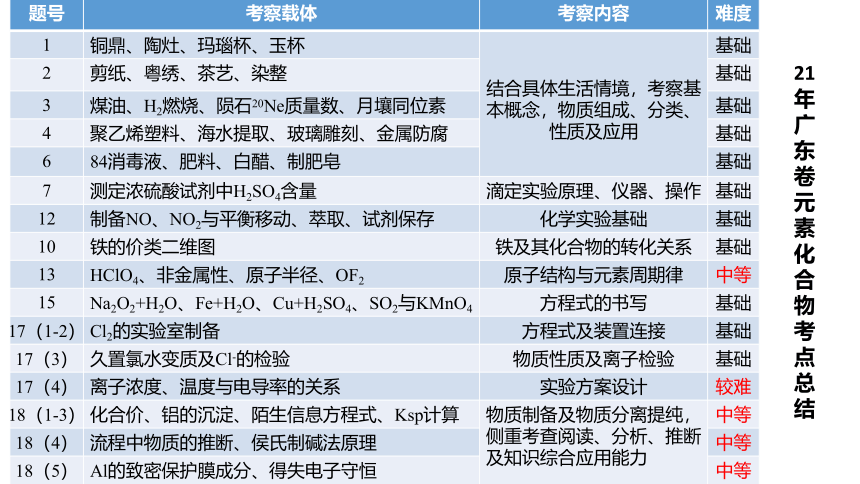
题号 考察载体 考察内容 难度
1 铜鼎、陶灶、玛瑙杯、玉杯 结合具体生活情境,考察基本概念,物质组成、分类、性质及应用 基础
2 剪纸、粤绣、茶艺、染整 基础
3 煤油、H2燃烧、陨石20Ne质量数、月壤同位素 基础
4 聚乙烯塑料、海水提取、玻璃雕刻、金属防腐 基础
6 84消毒液、肥料、白醋、制肥皂 基础
7 测定浓硫酸试剂中H2SO4含量 滴定实验原理、仪器、操作 基础
12 制备NO、NO2与平衡移动、萃取、试剂保存 化学实验基础 基础
10 铁的价类二维图 铁及其化合物的转化关系 基础
13 HClO4、非金属性、原子半径、OF2 原子结构与元素周期律 中等
15 Na2O2+H2O、Fe+H2O、Cu+H2SO4、SO2与KMnO4 方程式的书写 基础
17(1-2) Cl2的实验室制备 方程式及装置连接 基础
17(3) 久置氯水变质及Cl-的检验 物质性质及离子检验 基础
17(4) 离子浓度、温度与电导率的关系 实验方案设计 较难
18(1-3) 化合价、铝的沉淀、陌生信息方程式、Ksp计算 物质制备及物质分离提纯,侧重考查阅读、分析、推断及知识综合应用能力 中等
18(4) 流程中物质的推断、侯氏制碱法原理 中等
18(5) Al的致密保护膜成分、得失电子守恒 中等
21年广东卷元素化合物考点总结
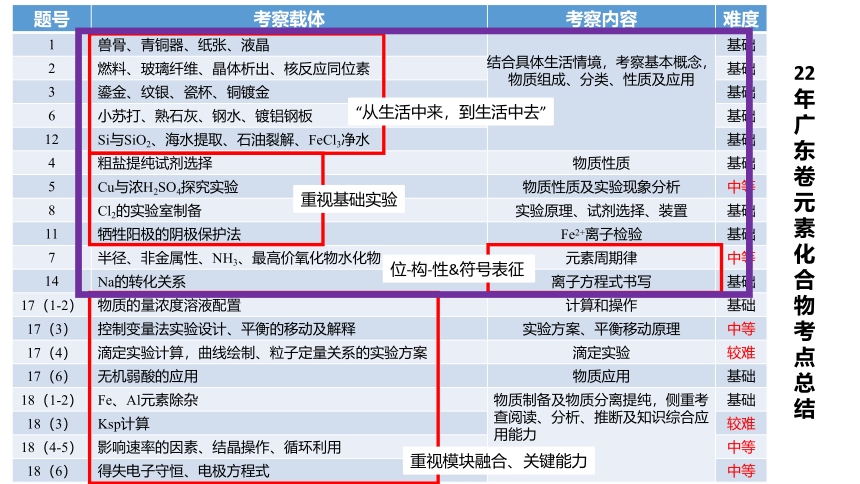
题号 考察载体 考察内容 难度
1 兽骨、青铜器、纸张、液晶 结合具体生活情境,考察基本概念,物质组成、分类、性质及应用 基础
2 燃料、玻璃纤维、晶体析出、核反应同位素 基础
3 鎏金、纹银、瓷杯、铜镀金 基础
6 小苏打、熟石灰、钢水、镀铝钢板 基础
12 Si与SiO2、海水提取、石油裂解、FeCl3净水 基础
4 粗盐提纯试剂选择 物质性质 基础
5 Cu与浓H2SO4探究实验 物质性质及实验现象分析 中等
8 Cl2的实验室制备 实验原理、试剂选择、装置 基础
11 牺牲阳极的阴极保护法 Fe2+离子检验 基础
7 半径、非金属性、NH3、最高价氧化物水化物 元素周期律 中等
14 Na的转化关系 离子方程式书写 基础
17(1-2) 物质的量浓度溶液配置 计算和操作 基础
17(3) 控制变量法实验设计、平衡的移动及解释 实验方案、平衡移动原理 中等
17(4) 滴定实验计算,曲线绘制、粒子定量关系的实验方案 滴定实验 较难
17(6) 无机弱酸的应用 物质应用 基础
18(1-2) Fe、Al元素除杂 物质制备及物质分离提纯,侧重考查阅读、分析、推断及知识综合应用能力 基础
18(3) Ksp计算 较难
18(4-5) 影响速率的因素、结晶操作、循环利用 中等
18(6) 得失电子守恒、电极方程式 中等
22年广东卷元素化合物考点总结
“从生活中来,到生活中去”
重视基础实验
位-构-性&符号表征
重视模块融合、关键能力
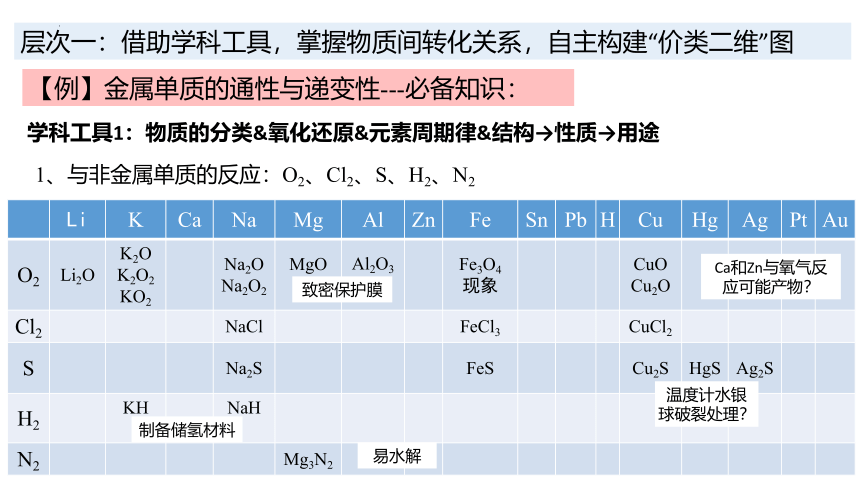
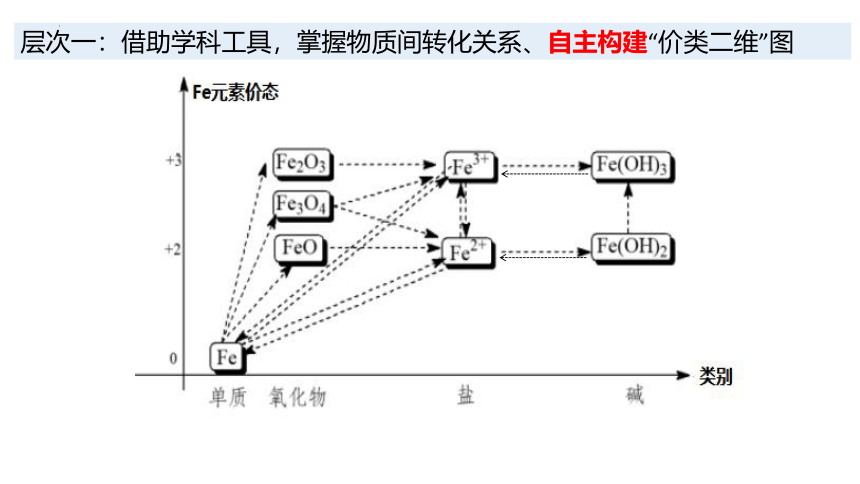
层次一:借助学科工具,掌握物质间转化关系,自主构建“价类二维”图
学科工具1:物质的分类&氧化还原&元素周期律&结构→性质→用途
【例】金属单质的通性与递变性---必备知识:
1、与非金属单质的反应:O2、Cl2、S、H2、N2
Li K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
O2 Li2O K2O K2O2 KO2 Na2O Na2O2 MgO Al2O3 Fe3O4 现象 CuO Cu2O
Cl2 NaCl FeCl3 CuCl2
S Na2S FeS Cu2S HgS Ag2S
H2 KH NaH
N2 Mg3N2
致密保护膜
温度计水银球破裂处理?
制备储氢材料
易水解
Ca和Zn与氧气反应可能产物?
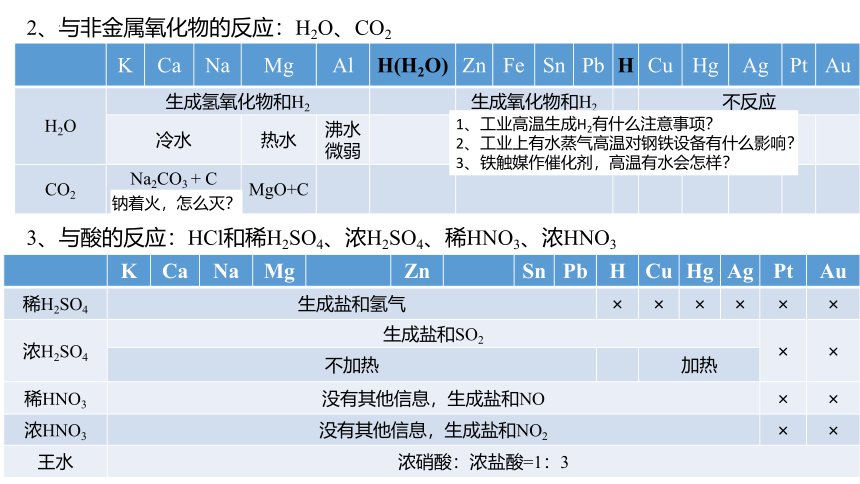
K Ca Na Mg Al H(H2O) Zn Fe Sn Pb H Cu Hg Ag Pt Au
H2O 生成氢氧化物和H2 生成氧化物和H2 不反应
冷水 热水 沸水 微弱 水蒸气、高温
CO2 Na2CO3 + C MgO+C
2、与非金属氧化物的反应:H2O、CO2
K Ca Na Mg Zn Sn Pb H Cu Hg Ag Pt Au
稀H2SO4 生成盐和氢气 × × × × × ×
浓H2SO4 生成盐和SO2 × ×
不加热 加热
稀HNO3 没有其他信息,生成盐和NO × ×
浓HNO3 没有其他信息,生成盐和NO2 × ×
王水 浓硝酸:浓盐酸=1:3
3、与酸的反应:HCl和稀H2SO4、浓H2SO4、稀HNO3、浓HNO3
钠着火,怎么灭?
1、工业高温生成H2有什么注意事项?
2、工业上有水蒸气高温对钢铁设备有什么影响?
3、铁触媒作催化剂,高温有水会怎样?
学科工具2:反应体系的一般规律&量的关系
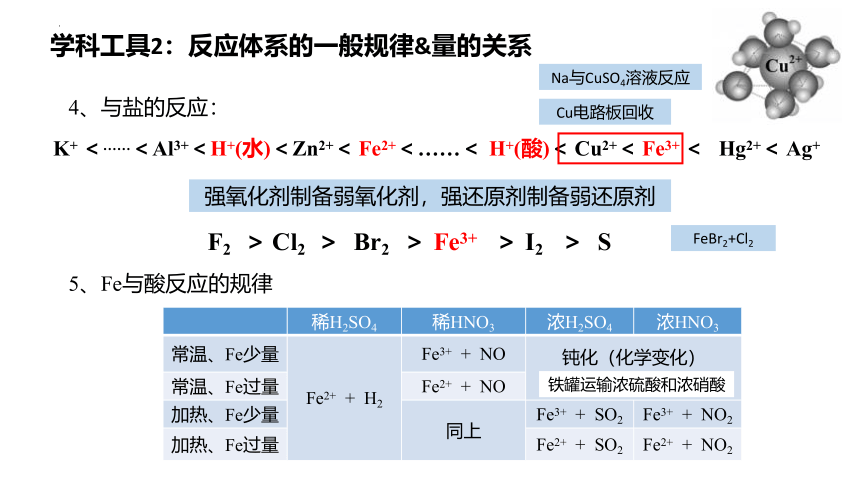
4、与盐的反应:
K+ <……<Al3+<H+(水)<Zn2+< Fe2+<……< H+(酸)< Cu2+< Fe3+ < Hg2+< Ag+
强氧化剂制备弱氧化剂,强还原剂制备弱还原剂
5、Fe与酸反应的规律
稀H2SO4 稀HNO3 浓H2SO4 浓HNO3
常温、Fe少量 Fe2+ + H2 Fe3+ + NO 钝化(化学变化)
常温、Fe过量 Fe2+ + NO
加热、Fe少量 同上 Fe3+ + SO2 Fe3+ + NO2
加热、Fe过量 Fe2+ + SO2 Fe2+ + NO2
F2 > Cl2 > Br2 > Fe3+ > I2 > S
Cu电路板回收
铁罐运输浓硫酸和浓硝酸
Na与CuSO4溶液反应
FeBr2+Cl2
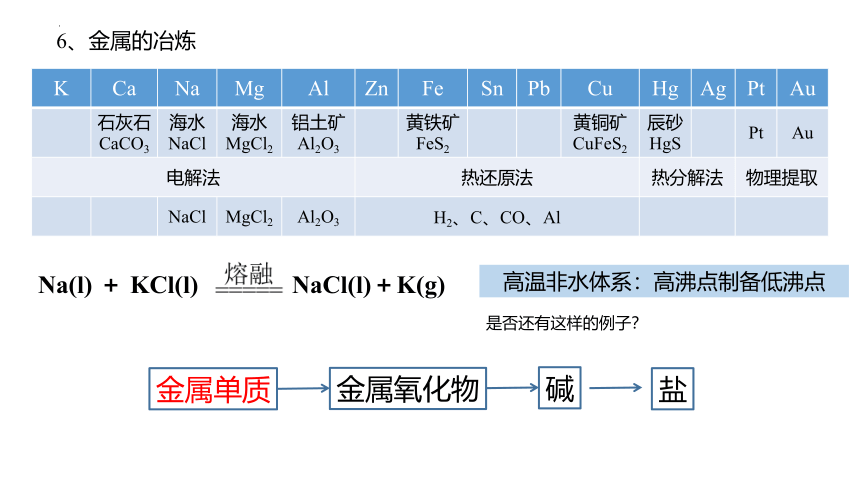
6、金属的冶炼
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
石灰石 CaCO3 海水 NaCl 海水 MgCl2 铝土矿 Al2O3 黄铁矿 FeS2 黄铜矿 CuFeS2 辰砂 HgS Pt Au
电解法 热还原法 热分解法 物理提取
NaCl MgCl2 Al2O3 H2、C、CO、Al
高温非水体系:高沸点制备低沸点
Na(l) + KCl(l) NaCl(l)+K(g)
金属单质
金属氧化物
碱
盐
是否还有这样的例子?
层次一:借助学科工具,掌握物质间转化关系、自主构建“价类二维”图
题号 考察载体 考察内容 难度
1 兽骨、青铜器、纸张、液晶 结合具体生活情境,考察基本概念,物质组成、分类、性质及应用 基础
2 燃料、玻璃纤维、晶体析出、核反应同位素 基础
3 鎏金、纹银、瓷杯、铜镀金 基础
6 小苏打、熟石灰、钢水、镀铝钢板 基础
12 Si与SiO2、海水提取、石油裂解、FeCl3净水 基础
4 粗盐提纯试剂选择 物质性质 基础
5 Cu与浓H2SO4探究实验 物质性质及实验现象分析 中等
8 Cl2的实验室制备 实验原理、试剂选择、装置 基础
11 牺牲阳极的阴极保护法 Fe2+离子检验 基础
7 半径、非金属性、NH3、最高价氧化物水化物 元素周期律 中等
14 Na的转化关系 离子方程式书写 基础
17(1-2) 物质的量浓度溶液配置 计算和操作 基础
17(3) 控制变量法实验设计、平衡的移动及解释 实验方案、平衡移动原理 中等
17(4) 滴定实验计算,曲线绘制、粒子定量关系的实验方案 滴定实验 较难
17(6) 无机弱酸的应用 物质应用 基础
18(1-2) Fe、Al元素除杂 物质制备及物质分离提纯,侧重考查阅读、分析、推断及知识综合应用能力 基础
18(3) Ksp计算 较难
18(4-5) 影响速率的因素、结晶操作、循环利用 中等
18(6) 得失电子守恒、电极方程式 中等
22年广东卷元素化合物考点总结
“从生活中来,到生活中去”
重视基础实验
位-构-性&符号表征
重视模块融合、关键能力
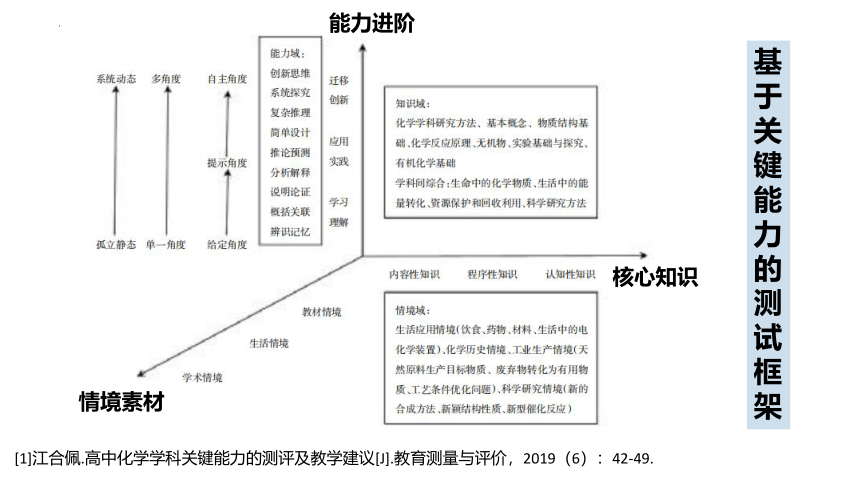
基于关键能力的测试框架
情境素材
核心知识
能力进阶
[1]江合佩.高中化学学科关键能力的测评及教学建议[J].教育测量与评价,2019(6):42-49.
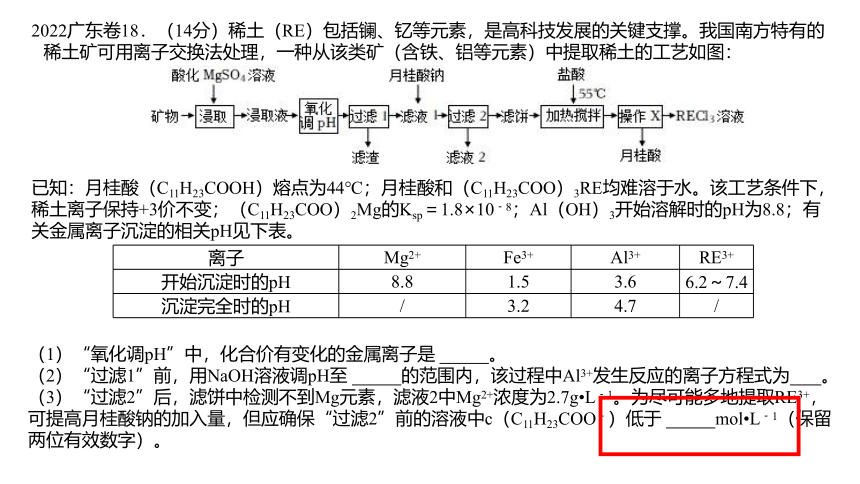
2022广东卷18.(14分)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如图:
已知:月桂酸(C11H23COOH)熔点为44℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10﹣8;Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是 。
(2)“过滤1”前,用NaOH溶液调pH至 的范围内,该过程中Al3+发生反应的离子方程式为 。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7g L﹣1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO﹣)低于 mol L﹣1(保留两位有效数字)。
Fe2+ + S2- = FeS↓ Cu2+ + S2- = CuS↓
已知 : FeS Ksp=6.3×10-18 CuS Ksp=1.3×10-36
H2S K1 = 9.1×10-8 K2=1.0×10-15
问题1:请分别书写FeSO4和CuSO4溶液中滴加Na2S溶液的离子方程式
问题2:FeSO4 溶液中通入H2S没有沉淀,CuSO4溶液中通入H2S有黑色沉淀生成 ,请通过计算解释原因 。
Fe2+ + H2S = FeS↓ + 2H+ 该反应K= = =1.4×10-5
c2(H+)
c(Fe2+)·c(H2S)
K1·K2
Ksp(FeS)
Cu2+ + H2S = CuS↓ + 2H+ 该反应K= 7.0×1013
问题3:请书写实验室制备H2S气体的离子方程式。
问题4:向Na2S溶液中滴加少量Fe2(SO4)3溶液的离子方程式。
FeS + 2H+ = Fe2+ + H2S ↑
3S2- + 2Fe3+ = S↓ + 2FeS↓
问题情境1
S2- + 2Fe3+ = S↓ + 2Fe2+
×
H2SO4
FeS
S2-
H2S
S2-过量
问题1:请书写FeCl3溶液中存在过程的化学方程式。
问题2:向沸水中滴入几滴饱和FeCl3溶液,煮沸至红褐色,请书写该过程涉及的化学方程式。
问题3:将FeCl3溶液蒸干,请书写该过程涉及反应的化学方程式。
问题4:持续灼烧(3)获得的物质
FeCl3+ 3H2O Fe(OH)3 + 3HCl
FeCl3+ 3H2O === Fe(OH)3 (胶体) + 3HCl
△
FeCl3+ 3H2O === Fe(OH)3 ↓ + 3HCl↑
△
问题情境2
2Fe(OH)3 === Fe2O3 + 3H2O
△
<1nm
1-100nm
>100nm
Fe(OH)3溶液
Fe(OH)3胶体
Fe(OH)3沉淀
层次二:结合问题情境,促进多模块知识融合,应用并完善“价类二维”图
问题情境 设计意图
1 Fe与H2O反应产物的检验 Fe3O4+HI Fe3O4+HNO3 Fe2+ 与Fe3+的检验
多重反应体系
2 除掉Mg2+中的Fe3+ 除掉Mg2+中的Fe2+ Ksp与pH的计算
除杂原理
3 Fe(OH)3胶体的制备 水解平衡的移动
4 Fe(OH)2沉淀制备 补铁剂与维C同时服用 价类二维应用
5 FeCl3溶液的制备和保存 价态变化及水解
6 由FeSO4溶液制备FeSO4·7H2O 价态及结晶实验操作
7 暖宝宝的工作原理 电化学
8 解释为什么 Fe2++S2- Fe2+ + H2S Cu2+ + H2S 如果换成Fe3+ + S2- Ksp的计算
多重反应体系
【净水剂---FeSO4·7H2O】
将硫铁矿烧渣处理后得到FeSO4溶液,经 、过滤、洗涤、干燥,得到的绿矾(FeSO4·7H2O)晶体曾用于生活净水,请书写绿矾净水的化学方程式 。
环节①--- 制备铁系净水剂
阶段三:走进真实情境,提升全面分析解决能力,优化“价类二维”路径
真实情境:工业硫铁矿烧渣制备铁系化工产品
资料: 铁系净水剂在供水和排水处理方面综合性能优良,日益受到广泛关注。现有一种利用硫铁矿烧渣(主要成分为Fe2O3和的SiO2)制备铁系净水剂的方法。
加热浓缩得到60℃饱和溶液,降温至0℃析出晶体
4FeSO4·7H2O + O2 = 4Fe(OH)3(胶体)+ 4H2SO4 + 18H2O
FeSO4
FeSO4·7H2O
Fe(OH)3胶体
直接使用绿矾净水,有聚合速度慢、形成的絮状物小等缺点。
【净水剂---聚合硫酸铁】
聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种无机高分子絮凝剂,具有絮体密实性大且沉淀速度快等优点,现广泛应用于各类水的净化处理。
聚合硫酸铁可由硫酸亚铁溶液经KClO3、H2SO4混合溶液氧化、硫酸铁水解、聚合共三步反应生成。其中聚合反应的化学方程式为
mFe2(OH)n(SO4)3-n/2 ═ [Fe2(OH)n(SO4)3-n/2]m
★分别写出第一步和第二步反应的化学方程式:
。
6FeSO4+ KClO3 + 3H2SO4 = 3Fe2(SO4)3 + KCl + 3H2O
2Fe2(SO4)3 + 2n H2O = 2Fe2(OH)n(SO4)3-n/2 + n H2SO4
Fe(OH)3溶液
Fe(OH)3胶体
Fe(OH)3沉淀
[Fe2(OH)n(SO4)3-n/2]m
★盐基度是用来衡量聚合硫酸铁中OH-含量n的指标,盐基度越大,n值越大。请根据表格中的数据说明随着硫酸与硫酸亚铁摩尔比减小,盐基度增大的原因是
。
【净水剂----K2FeO4】
硫铁矿烧渣经处理制得Fe(NO3)3,进一步制取高铁酸钾的流程如下:
请写出该过程涉及到的离子方程式:
。
普通净水方法还需通入Cl2以达到消毒效果,K2FeO4作为净水剂,能够同时起到净化和消毒作用。
3ClO-+2Fe3++10OH- = 2FeO42- + 3Cl- + 5H2O
FeO42- + 2K+ ═ K2FeO4 ↓
FeSO4
[Fe2(OH)n(SO4)3-n/2]m
Na2FeO4
K2FeO4
FeSO4·7H2O
Fe3+水解
制胶体
模块融合
问题情境
真实情境
关键能力
模型认知
信息提取
认知冲突
证据推理
2021广东18.(13分)对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如图:
已知:25℃时,H2CO3的Ka1=4.5×10﹣7,Ka2=4.7×10﹣11;Ksp(BaMoO4)=3.5×10﹣8;Ksp(BaCO3)=2.6×10﹣9;该工艺中,pH>6.0时,溶液中Mo元素以MoO42﹣的形态存在。
(1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为 。
(2)“沉铝”中,生成的沉淀X为 。
(3)“沉钼”中,pH为7.0。
①生成BaMoO4的离子方程式为 。
②若条件控制不当,BaCO3也会沉淀。为避免BaMoO4中混入BaCO3沉淀,溶液中c(HCO3﹣):c(MoO42﹣)= (列出算式)时,应停止加入BaCl2溶液。
(4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为 。
②往滤液Ⅲ中添加适量NaCl固体后,通入足量 (填化学式)气体,再通入足量CO2,可析出Y。
资料: 氧化铁颜料因无毒、不渗色、以及价格低廉等,而成为涂料工业用的二大无机颜料。现有一种利用硫铁矿烧渣(主要成分为Fe2O3和的SiO2)制备Fe2O3颜料的方法。该工艺条件容易控制,原材料来源方便,成本低,周期短,具有较好的社会、经济及环境效益。
环节②--- 制备Fe2O3铁红颜料
真实情境:工业硫铁矿烧渣制备铁系化工产品
FeCO3
★试剂选择:Na2CO3
NaHCO3
NH4HCO3
★“合成”方程式的书写
FeSO4
Fe2O3
SiO2
H2SO4
Fe2+→FeCO3
NH4HCO3
×
多体系----结合模块融合----突破“价类二维”转化关系固化
水钴矿
浸出液
①加Na2CO3
调pH至5.2
滤液1
滤液
萃后余液
CoCl2·6H2O
盐酸
Na2SO3
NaClO3
沉淀
NaF
萃取剂
萃取液
操作1
浸出
②过滤
除铁、铝
除锰
除钙、镁
利用题目情境,建立工业上各种金属离子的除杂的思维模型
Co2+
11:12:34
Mg(OH)2:
Ksp=5.61×10-12
Ca(OH)2:
Ksp=5.5×10 -6
CaF2:
Ksp=2.7×10-11
MgF2:
Ksp=7.42×10-11
磷酸酯萃取金属离子的机理
水溶性
脂溶性
2013-2020年全国卷和广东卷无机化工流程题对比分析表
本表由天河外国语学校赵雪平和广州市第三中学 郎丽老师发言整理
2021-2022年广东卷无机化工流程题对比分析表
年份 2021 2022
题号 18 18
分值 13 14
空数 8 9
工业合成背景 废催化剂回收利用金属 矿石提取稀土金属
主要考查元素 Al、Mo、Ni RE、Fe、Al、Mg
【2022·广东·18】稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如图:
已知:月桂酸(C11H23COOH)熔点为44℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10﹣8;Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
除铁、铝
除镁
做题经验不能解决一切问题
必备知识+关键能力
转化
1、通过对以往试题的研究,把简单的知识体系化,把复杂的问题进行切割实现结构化。
2、分层教学不意味着暂时能力差的学生达不到高层次水平,学生的思维能力是螺旋式上升的,将难题中的知识点进行拆分,层层逐级铺垫,就有机会把不可能变成可能。
3、多关注学生的反馈,通过学生的表现,诊断学生的能力程度,找寻最近发展区,在部分学生做好知识准备的时候,提出一些略有挑战性的任务,更有助于学生体验学习的成就感。学生关键能力提升了,反过来就更有助于对核心知识的理解和掌握。
关于元素化合物复习的一点感悟
目录
01
02
层次三:
走进真实情境,提升全面分析解决能力,优化“价类二维”路径
03
层次一:
借助学科工具,掌握物质间转化关系,自主构建“价类二维“图
层次二:
结合问题情境,促进多模块知识融合,应用并完善“价类二维”图
感谢聆听 请批评指正
基于“价类二维”的情境导研式元素化合物复习策略
题号 考察载体 考察内容 难度
1 铜鼎、陶灶、玛瑙杯、玉杯 结合具体生活情境,考察基本概念,物质组成、分类、性质及应用 基础
2 剪纸、粤绣、茶艺、染整 基础
3 煤油、H2燃烧、陨石20Ne质量数、月壤同位素 基础
4 聚乙烯塑料、海水提取、玻璃雕刻、金属防腐 基础
6 84消毒液、肥料、白醋、制肥皂 基础
7 测定浓硫酸试剂中H2SO4含量 滴定实验原理、仪器、操作 基础
12 制备NO、NO2与平衡移动、萃取、试剂保存 化学实验基础 基础
10 铁的价类二维图 铁及其化合物的转化关系 基础
13 HClO4、非金属性、原子半径、OF2 原子结构与元素周期律 中等
15 Na2O2+H2O、Fe+H2O、Cu+H2SO4、SO2与KMnO4 方程式的书写 基础
17(1-2) Cl2的实验室制备 方程式及装置连接 基础
17(3) 久置氯水变质及Cl-的检验 物质性质及离子检验 基础
17(4) 离子浓度、温度与电导率的关系 实验方案设计 较难
18(1-3) 化合价、铝的沉淀、陌生信息方程式、Ksp计算 物质制备及物质分离提纯,侧重考查阅读、分析、推断及知识综合应用能力 中等
18(4) 流程中物质的推断、侯氏制碱法原理 中等
18(5) Al的致密保护膜成分、得失电子守恒 中等
21年广东卷元素化合物考点总结
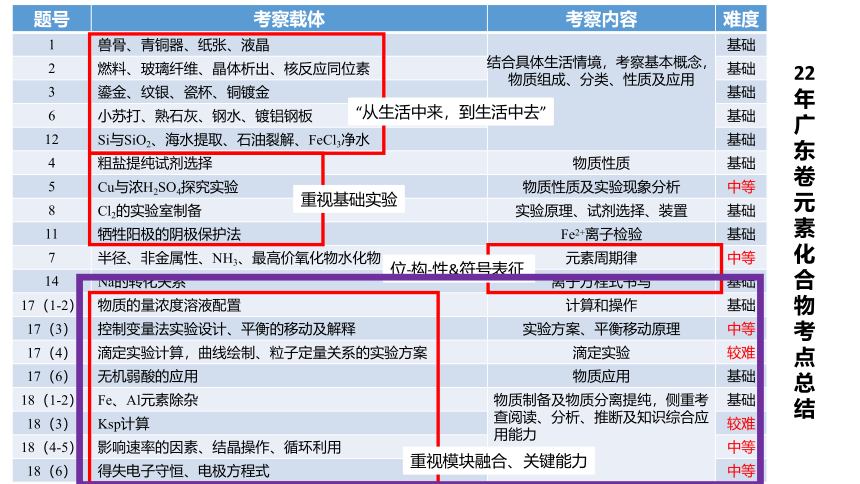
题号 考察载体 考察内容 难度
1 兽骨、青铜器、纸张、液晶 结合具体生活情境,考察基本概念,物质组成、分类、性质及应用 基础
2 燃料、玻璃纤维、晶体析出、核反应同位素 基础
3 鎏金、纹银、瓷杯、铜镀金 基础
6 小苏打、熟石灰、钢水、镀铝钢板 基础
12 Si与SiO2、海水提取、石油裂解、FeCl3净水 基础
4 粗盐提纯试剂选择 物质性质 基础
5 Cu与浓H2SO4探究实验 物质性质及实验现象分析 中等
8 Cl2的实验室制备 实验原理、试剂选择、装置 基础
11 牺牲阳极的阴极保护法 Fe2+离子检验 基础
7 半径、非金属性、NH3、最高价氧化物水化物 元素周期律 中等
14 Na的转化关系 离子方程式书写 基础
17(1-2) 物质的量浓度溶液配置 计算和操作 基础
17(3) 控制变量法实验设计、平衡的移动及解释 实验方案、平衡移动原理 中等
17(4) 滴定实验计算,曲线绘制、粒子定量关系的实验方案 滴定实验 较难
17(6) 无机弱酸的应用 物质应用 基础
18(1-2) Fe、Al元素除杂 物质制备及物质分离提纯,侧重考查阅读、分析、推断及知识综合应用能力 基础
18(3) Ksp计算 较难
18(4-5) 影响速率的因素、结晶操作、循环利用 中等
18(6) 得失电子守恒、电极方程式 中等
22年广东卷元素化合物考点总结
“从生活中来,到生活中去”
重视基础实验
位-构-性&符号表征
重视模块融合、关键能力
层次一:借助学科工具,掌握物质间转化关系,自主构建“价类二维”图
学科工具1:物质的分类&氧化还原&元素周期律&结构→性质→用途
【例】金属单质的通性与递变性---必备知识:
1、与非金属单质的反应:O2、Cl2、S、H2、N2
Li K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
O2 Li2O K2O K2O2 KO2 Na2O Na2O2 MgO Al2O3 Fe3O4 现象 CuO Cu2O
Cl2 NaCl FeCl3 CuCl2
S Na2S FeS Cu2S HgS Ag2S
H2 KH NaH
N2 Mg3N2
致密保护膜
温度计水银球破裂处理?
制备储氢材料
易水解
Ca和Zn与氧气反应可能产物?
K Ca Na Mg Al H(H2O) Zn Fe Sn Pb H Cu Hg Ag Pt Au
H2O 生成氢氧化物和H2 生成氧化物和H2 不反应
冷水 热水 沸水 微弱 水蒸气、高温
CO2 Na2CO3 + C MgO+C
2、与非金属氧化物的反应:H2O、CO2
K Ca Na Mg Zn Sn Pb H Cu Hg Ag Pt Au
稀H2SO4 生成盐和氢气 × × × × × ×
浓H2SO4 生成盐和SO2 × ×
不加热 加热
稀HNO3 没有其他信息,生成盐和NO × ×
浓HNO3 没有其他信息,生成盐和NO2 × ×
王水 浓硝酸:浓盐酸=1:3
3、与酸的反应:HCl和稀H2SO4、浓H2SO4、稀HNO3、浓HNO3
钠着火,怎么灭?
1、工业高温生成H2有什么注意事项?
2、工业上有水蒸气高温对钢铁设备有什么影响?
3、铁触媒作催化剂,高温有水会怎样?
学科工具2:反应体系的一般规律&量的关系
4、与盐的反应:
K+ <……<Al3+<H+(水)<Zn2+< Fe2+<……< H+(酸)< Cu2+< Fe3+ < Hg2+< Ag+
强氧化剂制备弱氧化剂,强还原剂制备弱还原剂
5、Fe与酸反应的规律
稀H2SO4 稀HNO3 浓H2SO4 浓HNO3
常温、Fe少量 Fe2+ + H2 Fe3+ + NO 钝化(化学变化)
常温、Fe过量 Fe2+ + NO
加热、Fe少量 同上 Fe3+ + SO2 Fe3+ + NO2
加热、Fe过量 Fe2+ + SO2 Fe2+ + NO2
F2 > Cl2 > Br2 > Fe3+ > I2 > S
Cu电路板回收
铁罐运输浓硫酸和浓硝酸
Na与CuSO4溶液反应
FeBr2+Cl2
6、金属的冶炼
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
石灰石 CaCO3 海水 NaCl 海水 MgCl2 铝土矿 Al2O3 黄铁矿 FeS2 黄铜矿 CuFeS2 辰砂 HgS Pt Au
电解法 热还原法 热分解法 物理提取
NaCl MgCl2 Al2O3 H2、C、CO、Al
高温非水体系:高沸点制备低沸点
Na(l) + KCl(l) NaCl(l)+K(g)
金属单质
金属氧化物
碱
盐
是否还有这样的例子?
层次一:借助学科工具,掌握物质间转化关系、自主构建“价类二维”图
题号 考察载体 考察内容 难度
1 兽骨、青铜器、纸张、液晶 结合具体生活情境,考察基本概念,物质组成、分类、性质及应用 基础
2 燃料、玻璃纤维、晶体析出、核反应同位素 基础
3 鎏金、纹银、瓷杯、铜镀金 基础
6 小苏打、熟石灰、钢水、镀铝钢板 基础
12 Si与SiO2、海水提取、石油裂解、FeCl3净水 基础
4 粗盐提纯试剂选择 物质性质 基础
5 Cu与浓H2SO4探究实验 物质性质及实验现象分析 中等
8 Cl2的实验室制备 实验原理、试剂选择、装置 基础
11 牺牲阳极的阴极保护法 Fe2+离子检验 基础
7 半径、非金属性、NH3、最高价氧化物水化物 元素周期律 中等
14 Na的转化关系 离子方程式书写 基础
17(1-2) 物质的量浓度溶液配置 计算和操作 基础
17(3) 控制变量法实验设计、平衡的移动及解释 实验方案、平衡移动原理 中等
17(4) 滴定实验计算,曲线绘制、粒子定量关系的实验方案 滴定实验 较难
17(6) 无机弱酸的应用 物质应用 基础
18(1-2) Fe、Al元素除杂 物质制备及物质分离提纯,侧重考查阅读、分析、推断及知识综合应用能力 基础
18(3) Ksp计算 较难
18(4-5) 影响速率的因素、结晶操作、循环利用 中等
18(6) 得失电子守恒、电极方程式 中等
22年广东卷元素化合物考点总结
“从生活中来,到生活中去”
重视基础实验
位-构-性&符号表征
重视模块融合、关键能力
基于关键能力的测试框架
情境素材
核心知识
能力进阶
[1]江合佩.高中化学学科关键能力的测评及教学建议[J].教育测量与评价,2019(6):42-49.
2022广东卷18.(14分)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如图:
已知:月桂酸(C11H23COOH)熔点为44℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10﹣8;Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是 。
(2)“过滤1”前,用NaOH溶液调pH至 的范围内,该过程中Al3+发生反应的离子方程式为 。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7g L﹣1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO﹣)低于 mol L﹣1(保留两位有效数字)。
Fe2+ + S2- = FeS↓ Cu2+ + S2- = CuS↓
已知 : FeS Ksp=6.3×10-18 CuS Ksp=1.3×10-36
H2S K1 = 9.1×10-8 K2=1.0×10-15
问题1:请分别书写FeSO4和CuSO4溶液中滴加Na2S溶液的离子方程式
问题2:FeSO4 溶液中通入H2S没有沉淀,CuSO4溶液中通入H2S有黑色沉淀生成 ,请通过计算解释原因 。
Fe2+ + H2S = FeS↓ + 2H+ 该反应K= = =1.4×10-5
c2(H+)
c(Fe2+)·c(H2S)
K1·K2
Ksp(FeS)
Cu2+ + H2S = CuS↓ + 2H+ 该反应K= 7.0×1013
问题3:请书写实验室制备H2S气体的离子方程式。
问题4:向Na2S溶液中滴加少量Fe2(SO4)3溶液的离子方程式。
FeS + 2H+ = Fe2+ + H2S ↑
3S2- + 2Fe3+ = S↓ + 2FeS↓
问题情境1
S2- + 2Fe3+ = S↓ + 2Fe2+
×
H2SO4
FeS
S2-
H2S
S2-过量
问题1:请书写FeCl3溶液中存在过程的化学方程式。
问题2:向沸水中滴入几滴饱和FeCl3溶液,煮沸至红褐色,请书写该过程涉及的化学方程式。
问题3:将FeCl3溶液蒸干,请书写该过程涉及反应的化学方程式。
问题4:持续灼烧(3)获得的物质
FeCl3+ 3H2O Fe(OH)3 + 3HCl
FeCl3+ 3H2O === Fe(OH)3 (胶体) + 3HCl
△
FeCl3+ 3H2O === Fe(OH)3 ↓ + 3HCl↑
△
问题情境2
2Fe(OH)3 === Fe2O3 + 3H2O
△
<1nm
1-100nm
>100nm
Fe(OH)3溶液
Fe(OH)3胶体
Fe(OH)3沉淀
层次二:结合问题情境,促进多模块知识融合,应用并完善“价类二维”图
问题情境 设计意图
1 Fe与H2O反应产物的检验 Fe3O4+HI Fe3O4+HNO3 Fe2+ 与Fe3+的检验
多重反应体系
2 除掉Mg2+中的Fe3+ 除掉Mg2+中的Fe2+ Ksp与pH的计算
除杂原理
3 Fe(OH)3胶体的制备 水解平衡的移动
4 Fe(OH)2沉淀制备 补铁剂与维C同时服用 价类二维应用
5 FeCl3溶液的制备和保存 价态变化及水解
6 由FeSO4溶液制备FeSO4·7H2O 价态及结晶实验操作
7 暖宝宝的工作原理 电化学
8 解释为什么 Fe2++S2- Fe2+ + H2S Cu2+ + H2S 如果换成Fe3+ + S2- Ksp的计算
多重反应体系
【净水剂---FeSO4·7H2O】
将硫铁矿烧渣处理后得到FeSO4溶液,经 、过滤、洗涤、干燥,得到的绿矾(FeSO4·7H2O)晶体曾用于生活净水,请书写绿矾净水的化学方程式 。
环节①--- 制备铁系净水剂
阶段三:走进真实情境,提升全面分析解决能力,优化“价类二维”路径
真实情境:工业硫铁矿烧渣制备铁系化工产品
资料: 铁系净水剂在供水和排水处理方面综合性能优良,日益受到广泛关注。现有一种利用硫铁矿烧渣(主要成分为Fe2O3和的SiO2)制备铁系净水剂的方法。
加热浓缩得到60℃饱和溶液,降温至0℃析出晶体
4FeSO4·7H2O + O2 = 4Fe(OH)3(胶体)+ 4H2SO4 + 18H2O
FeSO4
FeSO4·7H2O
Fe(OH)3胶体
直接使用绿矾净水,有聚合速度慢、形成的絮状物小等缺点。
【净水剂---聚合硫酸铁】
聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种无机高分子絮凝剂,具有絮体密实性大且沉淀速度快等优点,现广泛应用于各类水的净化处理。
聚合硫酸铁可由硫酸亚铁溶液经KClO3、H2SO4混合溶液氧化、硫酸铁水解、聚合共三步反应生成。其中聚合反应的化学方程式为
mFe2(OH)n(SO4)3-n/2 ═ [Fe2(OH)n(SO4)3-n/2]m
★分别写出第一步和第二步反应的化学方程式:
。
6FeSO4+ KClO3 + 3H2SO4 = 3Fe2(SO4)3 + KCl + 3H2O
2Fe2(SO4)3 + 2n H2O = 2Fe2(OH)n(SO4)3-n/2 + n H2SO4
Fe(OH)3溶液
Fe(OH)3胶体
Fe(OH)3沉淀
[Fe2(OH)n(SO4)3-n/2]m
★盐基度是用来衡量聚合硫酸铁中OH-含量n的指标,盐基度越大,n值越大。请根据表格中的数据说明随着硫酸与硫酸亚铁摩尔比减小,盐基度增大的原因是
。
【净水剂----K2FeO4】
硫铁矿烧渣经处理制得Fe(NO3)3,进一步制取高铁酸钾的流程如下:
请写出该过程涉及到的离子方程式:
。
普通净水方法还需通入Cl2以达到消毒效果,K2FeO4作为净水剂,能够同时起到净化和消毒作用。
3ClO-+2Fe3++10OH- = 2FeO42- + 3Cl- + 5H2O
FeO42- + 2K+ ═ K2FeO4 ↓
FeSO4
[Fe2(OH)n(SO4)3-n/2]m
Na2FeO4
K2FeO4
FeSO4·7H2O
Fe3+水解
制胶体
模块融合
问题情境
真实情境
关键能力
模型认知
信息提取
认知冲突
证据推理
2021广东18.(13分)对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如图:
已知:25℃时,H2CO3的Ka1=4.5×10﹣7,Ka2=4.7×10﹣11;Ksp(BaMoO4)=3.5×10﹣8;Ksp(BaCO3)=2.6×10﹣9;该工艺中,pH>6.0时,溶液中Mo元素以MoO42﹣的形态存在。
(1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为 。
(2)“沉铝”中,生成的沉淀X为 。
(3)“沉钼”中,pH为7.0。
①生成BaMoO4的离子方程式为 。
②若条件控制不当,BaCO3也会沉淀。为避免BaMoO4中混入BaCO3沉淀,溶液中c(HCO3﹣):c(MoO42﹣)= (列出算式)时,应停止加入BaCl2溶液。
(4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为 。
②往滤液Ⅲ中添加适量NaCl固体后,通入足量 (填化学式)气体,再通入足量CO2,可析出Y。
资料: 氧化铁颜料因无毒、不渗色、以及价格低廉等,而成为涂料工业用的二大无机颜料。现有一种利用硫铁矿烧渣(主要成分为Fe2O3和的SiO2)制备Fe2O3颜料的方法。该工艺条件容易控制,原材料来源方便,成本低,周期短,具有较好的社会、经济及环境效益。
环节②--- 制备Fe2O3铁红颜料
真实情境:工业硫铁矿烧渣制备铁系化工产品
FeCO3
★试剂选择:Na2CO3
NaHCO3
NH4HCO3
★“合成”方程式的书写
FeSO4
Fe2O3
SiO2
H2SO4
Fe2+→FeCO3
NH4HCO3
×
多体系----结合模块融合----突破“价类二维”转化关系固化
水钴矿
浸出液
①加Na2CO3
调pH至5.2
滤液1
滤液
萃后余液
CoCl2·6H2O
盐酸
Na2SO3
NaClO3
沉淀
NaF
萃取剂
萃取液
操作1
浸出
②过滤
除铁、铝
除锰
除钙、镁
利用题目情境,建立工业上各种金属离子的除杂的思维模型
Co2+
11:12:34
Mg(OH)2:
Ksp=5.61×10-12
Ca(OH)2:
Ksp=5.5×10 -6
CaF2:
Ksp=2.7×10-11
MgF2:
Ksp=7.42×10-11
磷酸酯萃取金属离子的机理
水溶性
脂溶性
2013-2020年全国卷和广东卷无机化工流程题对比分析表
本表由天河外国语学校赵雪平和广州市第三中学 郎丽老师发言整理
2021-2022年广东卷无机化工流程题对比分析表
年份 2021 2022
题号 18 18
分值 13 14
空数 8 9
工业合成背景 废催化剂回收利用金属 矿石提取稀土金属
主要考查元素 Al、Mo、Ni RE、Fe、Al、Mg
【2022·广东·18】稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如图:
已知:月桂酸(C11H23COOH)熔点为44℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10﹣8;Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
除铁、铝
除镁
做题经验不能解决一切问题
必备知识+关键能力
转化
1、通过对以往试题的研究,把简单的知识体系化,把复杂的问题进行切割实现结构化。
2、分层教学不意味着暂时能力差的学生达不到高层次水平,学生的思维能力是螺旋式上升的,将难题中的知识点进行拆分,层层逐级铺垫,就有机会把不可能变成可能。
3、多关注学生的反馈,通过学生的表现,诊断学生的能力程度,找寻最近发展区,在部分学生做好知识准备的时候,提出一些略有挑战性的任务,更有助于学生体验学习的成就感。学生关键能力提升了,反过来就更有助于对核心知识的理解和掌握。
关于元素化合物复习的一点感悟
目录
01
02
层次三:
走进真实情境,提升全面分析解决能力,优化“价类二维”路径
03
层次一:
借助学科工具,掌握物质间转化关系,自主构建“价类二维“图
层次二:
结合问题情境,促进多模块知识融合,应用并完善“价类二维”图
感谢聆听 请批评指正
同课章节目录
