1.2.1有机化合物的分离和提纯(教学课件)(共22张PPT)2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2.1有机化合物的分离和提纯(教学课件)(共22张PPT)2022-2023学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-19 16:06:35 | ||
图片预览








文档简介
(共22张PPT)
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第1课时 有机化合物的分离和提纯
1、了解怎样研究有机化合物应采取的步骤和方法。
2、掌握有机化合物分离提纯的常用方法。
3、掌握蒸馏、重结晶和萃取实验的基本技能。
课程目标
教学重点
有机化合物分离提纯的常用方法和分离原理。
教学难点
有机化合物分离提纯的常用方法和分离原理。
01
研究
有机物的基本步骤
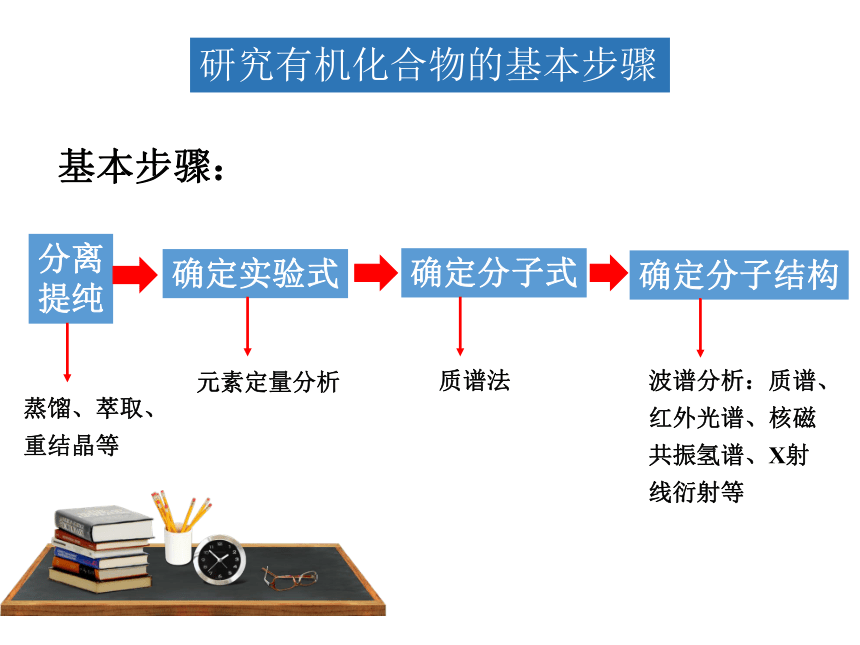
基本步骤:
分离
提纯
确定实验式
确定分子式
确定分子结构
蒸馏、萃取、重结晶等
元素定量分析
质谱法
波谱分析:质谱、红外光谱、核磁共振氢谱、X射线衍射等
研究有机化合物的基本步骤
02
物质的分离
物质的分离
1、分离原则
把混合物中的各种物质 ,得到各纯净物。分离过程中要尽量减少各物质的损失,各组分要尽量纯净。
2、分离方法
(1) 方法:过滤、重结晶、升华、蒸发、蒸馏、分馏、液化、渗析、盐析等。
(2) 方法:加热分解、氧化还原转化、生成沉淀等。
逐一分开
物理
化学
03
物质的提纯
物质的提纯
1、概念:
提纯是采用物理或化学方法将物质中的杂质 的过程。它和分离的主要区别在于 。
2、提纯原则
(1) :在提纯过程中不增加新的杂质;
(2) :在提纯过程中不减少被提纯的物质;
(3) :被提纯物质与杂质易分离;
(4) :被提纯物质易复原。
除掉
除掉的杂质可以不进行恢复
不增
不减
易分离
易复原
04
常用的
分离和提纯方法
常用的分离和提纯方法
1、蒸馏——分离和提纯 有机化合物的常用方法
(1)适用范围
分离、提纯的有机物 ,其沸点与杂质的沸点相差较大。
(2)实验装置(填仪器名称)
液态
热稳定性较高
蒸馏烧瓶
温度计
冷凝管
常用的分离和提纯方法
①温度计水银球位于 。
②碎瓷片的作用:
。
③冷凝管中水流的方向是 口进入, 口流出。
注意事项:
蒸馏烧瓶支管口处
使液体平稳沸腾,防止暴沸
下
上
常用的分离和提纯方法
2、萃取——分为 萃取和 萃取。
(1)萃取的原理
①液 液萃取是利用待分离组分在两种互不相溶的溶剂中的 不同,将其从一种溶剂转移到另一种溶剂的过程。
②固 液萃取是利用 从 中溶解出待分离组分的过程。
液 液
固 液
溶解性
溶剂
固体物质
常用的分离和提纯方法
(2)萃取剂的条件及常用试剂
待分离组分在萃取剂中的溶解度较 ,常用的萃取剂有 、 、二氯甲烷等。
(3)分液:将萃取后的两层液体分开的操作。
(4)主要玻璃仪器为 、烧杯。
注意:
①分液时,上层液体从上口倒出。
②萃取剂与原溶剂不能互溶,且不与溶质反应。
大
乙醚
乙酸乙酯
分液漏斗
常用的分离和提纯方法
3、重结晶——提纯 有机化合物常用的方法
(1)原理:利用被提纯物质与杂质在同一溶剂中的 不同而将杂质除去。
(2)溶剂的选择
①杂质在所选溶剂中的溶解度 ,易于除去。
②被提纯的有机化合物在所选溶剂中的溶解度受温度的影响较大,能够进行 。
固体
溶解度
很大或溶解度很小
冷却结晶
重结晶法提纯苯甲酸
【问题】
某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过哪些步骤?
【资料】
苯甲酸可用作食品添加剂。纯净的苯甲酸为无色结晶。其结构可表示为 ,熔点122℃,沸点249 ℃。苯甲酸微溶于水,易溶于
乙醇等有机溶剂。苯甲酸在水中的溶解度如下:
探究
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
【实验】
(1)观察粗苯甲酸样品的状态。
(2)将1.0g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液禁止,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
探究
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
实验原理:苯甲酸在水中的溶解度随温度变化较大,通过重结晶可以使它与杂质分离。
主要操作步骤:①加热溶解;②趁热过滤;③冷却结晶;④过滤、洗涤;⑤干燥;⑥称重。
加热可促进苯甲酸的溶解。
趁热过滤可避免苯甲酸提前结晶析出。
讨论
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
(4)如何检验提纯后的苯甲酸中氯化钠已被除净?
玻璃棒的作用:①溶解时搅拌,加快溶解速度;②过滤、洗涤时引流;③干燥时用于转移晶体。
用适量蒸馏水洗涤过滤器中的苯甲酸晶体,取一烧杯收集n次洗涤后的滤液,滴加几滴硝酸银溶液,观察是否有沉淀产生。若无,则氯化钠被除尽。
讨论
萃取与分液有什么区别
练一练
提示:
(1)分液和萃取是两个不同的操作方法,分液可以单独进行,但萃取之后一般要进行分液。
(2)分液是将两种互不相溶的液体混合物进行分离的操作。
归纳总结
混合物 试剂 分离、提纯的方法 主要仪器
苯(苯甲酸) NaOH溶液 分液 分液漏斗、烧杯
苯(苯酚) NaOH溶液
乙酸乙酯(乙酸) 饱和Na2CO3溶液
溴苯(溴) NaOH溶液
苯(乙苯) KMnO4酸性溶液、NaOH溶液
苯酚(苯甲酸) NaHCO3溶液
常见有机物分离、提纯的方法
归纳总结
混合物 试剂 分离、提纯的方法 主要仪器
乙醇(水) CaO 蒸馏 蒸馏烧瓶、冷凝管
乙醛(乙酸) NaOH溶液
肥皂(甘油) NaCl 盐析 漏斗、烧杯
淀粉(纯碱) H2O 渗析 半透膜、烧杯
乙烷(乙烯) 溴水 洗气 洗气瓶
教学课件
感谢观看
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第1课时 有机化合物的分离和提纯
1、了解怎样研究有机化合物应采取的步骤和方法。
2、掌握有机化合物分离提纯的常用方法。
3、掌握蒸馏、重结晶和萃取实验的基本技能。
课程目标
教学重点
有机化合物分离提纯的常用方法和分离原理。
教学难点
有机化合物分离提纯的常用方法和分离原理。
01
研究
有机物的基本步骤
基本步骤:
分离
提纯
确定实验式
确定分子式
确定分子结构
蒸馏、萃取、重结晶等
元素定量分析
质谱法
波谱分析:质谱、红外光谱、核磁共振氢谱、X射线衍射等
研究有机化合物的基本步骤
02
物质的分离
物质的分离
1、分离原则
把混合物中的各种物质 ,得到各纯净物。分离过程中要尽量减少各物质的损失,各组分要尽量纯净。
2、分离方法
(1) 方法:过滤、重结晶、升华、蒸发、蒸馏、分馏、液化、渗析、盐析等。
(2) 方法:加热分解、氧化还原转化、生成沉淀等。
逐一分开
物理
化学
03
物质的提纯
物质的提纯
1、概念:
提纯是采用物理或化学方法将物质中的杂质 的过程。它和分离的主要区别在于 。
2、提纯原则
(1) :在提纯过程中不增加新的杂质;
(2) :在提纯过程中不减少被提纯的物质;
(3) :被提纯物质与杂质易分离;
(4) :被提纯物质易复原。
除掉
除掉的杂质可以不进行恢复
不增
不减
易分离
易复原
04
常用的
分离和提纯方法
常用的分离和提纯方法
1、蒸馏——分离和提纯 有机化合物的常用方法
(1)适用范围
分离、提纯的有机物 ,其沸点与杂质的沸点相差较大。
(2)实验装置(填仪器名称)
液态
热稳定性较高
蒸馏烧瓶
温度计
冷凝管
常用的分离和提纯方法
①温度计水银球位于 。
②碎瓷片的作用:
。
③冷凝管中水流的方向是 口进入, 口流出。
注意事项:
蒸馏烧瓶支管口处
使液体平稳沸腾,防止暴沸
下
上
常用的分离和提纯方法
2、萃取——分为 萃取和 萃取。
(1)萃取的原理
①液 液萃取是利用待分离组分在两种互不相溶的溶剂中的 不同,将其从一种溶剂转移到另一种溶剂的过程。
②固 液萃取是利用 从 中溶解出待分离组分的过程。
液 液
固 液
溶解性
溶剂
固体物质
常用的分离和提纯方法
(2)萃取剂的条件及常用试剂
待分离组分在萃取剂中的溶解度较 ,常用的萃取剂有 、 、二氯甲烷等。
(3)分液:将萃取后的两层液体分开的操作。
(4)主要玻璃仪器为 、烧杯。
注意:
①分液时,上层液体从上口倒出。
②萃取剂与原溶剂不能互溶,且不与溶质反应。
大
乙醚
乙酸乙酯
分液漏斗
常用的分离和提纯方法
3、重结晶——提纯 有机化合物常用的方法
(1)原理:利用被提纯物质与杂质在同一溶剂中的 不同而将杂质除去。
(2)溶剂的选择
①杂质在所选溶剂中的溶解度 ,易于除去。
②被提纯的有机化合物在所选溶剂中的溶解度受温度的影响较大,能够进行 。
固体
溶解度
很大或溶解度很小
冷却结晶
重结晶法提纯苯甲酸
【问题】
某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过哪些步骤?
【资料】
苯甲酸可用作食品添加剂。纯净的苯甲酸为无色结晶。其结构可表示为 ,熔点122℃,沸点249 ℃。苯甲酸微溶于水,易溶于
乙醇等有机溶剂。苯甲酸在水中的溶解度如下:
探究
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
【实验】
(1)观察粗苯甲酸样品的状态。
(2)将1.0g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液禁止,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
探究
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
实验原理:苯甲酸在水中的溶解度随温度变化较大,通过重结晶可以使它与杂质分离。
主要操作步骤:①加热溶解;②趁热过滤;③冷却结晶;④过滤、洗涤;⑤干燥;⑥称重。
加热可促进苯甲酸的溶解。
趁热过滤可避免苯甲酸提前结晶析出。
讨论
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
(4)如何检验提纯后的苯甲酸中氯化钠已被除净?
玻璃棒的作用:①溶解时搅拌,加快溶解速度;②过滤、洗涤时引流;③干燥时用于转移晶体。
用适量蒸馏水洗涤过滤器中的苯甲酸晶体,取一烧杯收集n次洗涤后的滤液,滴加几滴硝酸银溶液,观察是否有沉淀产生。若无,则氯化钠被除尽。
讨论
萃取与分液有什么区别
练一练
提示:
(1)分液和萃取是两个不同的操作方法,分液可以单独进行,但萃取之后一般要进行分液。
(2)分液是将两种互不相溶的液体混合物进行分离的操作。
归纳总结
混合物 试剂 分离、提纯的方法 主要仪器
苯(苯甲酸) NaOH溶液 分液 分液漏斗、烧杯
苯(苯酚) NaOH溶液
乙酸乙酯(乙酸) 饱和Na2CO3溶液
溴苯(溴) NaOH溶液
苯(乙苯) KMnO4酸性溶液、NaOH溶液
苯酚(苯甲酸) NaHCO3溶液
常见有机物分离、提纯的方法
归纳总结
混合物 试剂 分离、提纯的方法 主要仪器
乙醇(水) CaO 蒸馏 蒸馏烧瓶、冷凝管
乙醛(乙酸) NaOH溶液
肥皂(甘油) NaCl 盐析 漏斗、烧杯
淀粉(纯碱) H2O 渗析 半透膜、烧杯
乙烷(乙烯) 溴水 洗气 洗气瓶
教学课件
感谢观看
