1.2.2实验式、分子式、分子结构的确定(学案,含答案)-2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2.2实验式、分子式、分子结构的确定(学案,含答案)-2022-2023学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | doc | ||
| 文件大小 | 545.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-19 21:12:08 | ||
图片预览



文档简介
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第2课时
【学法指导】
1.解测定有机化合物元素含量、相对分子质量的般方法,能确定有机化合物分子式。(证据推理)
2.知道通过化学实验和某些物理方法可以确定有机化合物的分子结构。(科学探究)
3.初步了解质谱、红外光谱、核磁共振氢谱的原理及用途。(宏观辨识)
【基础梳理】
要点一、确定实验式
1.元素定性分析——确定有机物的元素组成
一般是将一定量的有机物燃烧,转化为简单的无机物。
2.元素定量分析——确定有机物的实验式(最简式)
(1)原理:通过无机物的质量推算出该有机物所含各元素的质量分数,然后计算出该有机物分子内各元素原子的 ,确定其 (也称 )。
(2)测定步骤(李比希法)
例如:某含C、H、O三元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.2%,氢的质量分数为13.1%。则:
①氧的质量分数为 ;
②C、H、O的原子个数比:N(C):N(H):N(O)= ;
③该未知物的实验式为 。
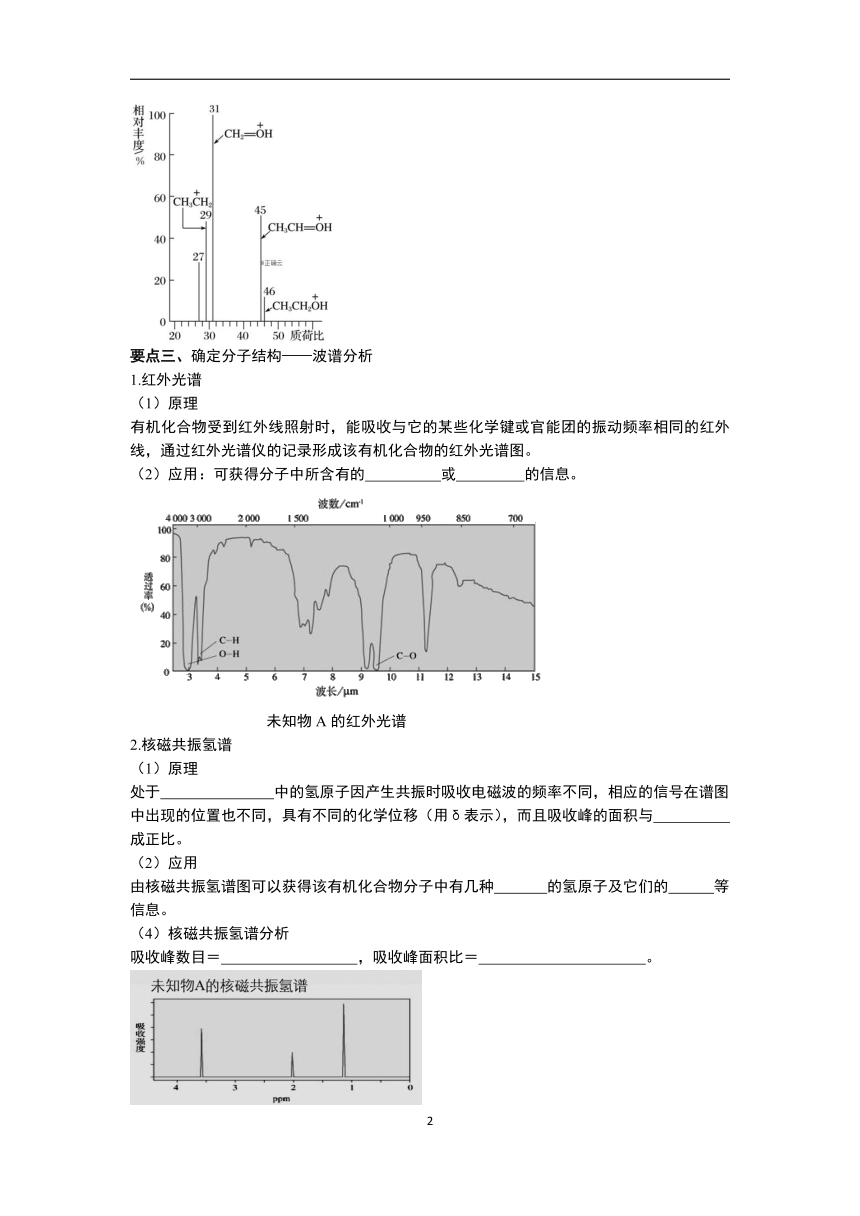
要点二、确定分子式——质谱法
1.原理
2.质荷比
是指分子离子、碎片离子的 与 的比值,即质荷比。
以质荷比为横坐标,以各类离子的相对丰度为纵坐标记录测试结果,就得到有机化合物的质谱图。质谱图中,质荷比的 就表示了样品分子的相对分子质量。
由图可知,样品分子的相对分子质量为 。
要点三、确定分子结构——波谱分析
1.红外光谱
(1)原理
有机化合物受到红外线照射时,能吸收与它的某些化学键或官能团的振动频率相同的红外线,通过红外光谱仪的记录形成该有机化合物的红外光谱图。
(2)应用:可获得分子中所含有的 或 的信息。
未知物A的红外光谱
2.核磁共振氢谱
(1)原理
处于 中的氢原子因产生共振时吸收电磁波的频率不同,相应的信号在谱图中出现的位置也不同,具有不同的化学位移(用δ表示),而且吸收峰的面积与 成正比。
(2)应用
由核磁共振氢谱图可以获得该有机化合物分子中有几种 的氢原子及它们的 等信息。
(4)核磁共振氢谱分析
吸收峰数目= ,吸收峰面积比= 。
3.X射线衍射谱
(1)原理
X射线是一种波长很短(约10m)的电磁波,它和晶体中的原子相互作用可以产生衍射谱图。
(2)应用
经过计算可以从中获得分子结构的有关数据,包括 、 等分子结构信息。将X射线衍射技术用于有机化合物(特别是复杂的生物大分子)晶体结构的测定,可以获得更为直接而详尽的结构信息。
基础达标训练
典例1正误判断
(1)燃烧后只产生CO2和H2O的物质不一定只含有碳、氢两种元素。( )
(2)根据红外光谱可以确定有机物中化学键种类。( )
(3)核磁共振氢谱中,有几个吸收峰就说明有几个氢原子。( )
(4)根据核磁共振氢谱可推知分子中有几种不同类型的氢原子及它们的相对数目。( )
强化训练
1.下列关于物质研究方法的说法中错误的是( )
A.用官能团的特征反应可推测有机物可能的结构
B.核磁共振氢谱能反映出未知有机物中不同化学环境氢原子的种类和个数
C.根据红外光谱图的分析可以初步判断有机物中具有哪些基团
D.质谱法可测定有机物的相对分子质量
2.下列说法中正确的是( )
A.在其核磁共振氢谱图中有5组吸收峰
B.红外光谱图只能确定有机物中所含官能团的种类和数目
C.质谱法不能用于相对分子质量的测定
D.红外光谱、核磁共振氢谱和质谱都可用于分析有机物结构
3.在核磁共振氢谱中出现3组峰,且氢原子个数比为3:1:4的化合物是( )
A. B. C. D.
4.二甲醚和乙醇是同分异构体,其鉴別可采用化学方法或物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A.利用金属钠或者金属钾 B.利用质谱法
C.利用红外光谱法 D.利用核磁共振氢谱
5.某有机物A用质谱仪测定如图① ,核磁共振氢谱示意图如图② ,则A的结构简式可能为( )
A.HCOOH B. C. D.
6.某有机化合物在氧气中充分燃烧,生成等物质的量的二氧化碳和水。则该有机化合物的组成必须满足的条件是( )
A.分子中C、H、O原子的个数比为1:2:3 B.分子中C、H原子的个数比为1:2
C.该有机化合物的相对分子质量为14 D.该分子中肯定不含氧元素
7.下列化合物的核磁共振氢谱中出现三组峰的是( )
A.2,2,3,3-四甲基丁烷 B.2,3,4-三甲基戊烷
C.3,4-二甲基己烷 D.2,5-二甲基己烷
8.将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g和8.8 g ,消耗氧气6.72 L(标准状况下),则该物质的最简式为________,若要确定其分子式,_____________(填“是”或“否”)需有其他条件。已知有机物A的核磁共振氢谱、质谱如图所示,则A的结构简式为________。
若质谱图显示B的相对分子质量为74,红外光谱如图所示,则B的结构简式为________,其官能团的名称为_______。
【课后练习】
1.验证某有机化合物属于烃,应完成的实验内容是( )
A.测定它的C、H原子个数比
B.证明它完全燃烧后的产物只有水和
C.测定其燃烧产物中水和的物质的量之比
D.测定该有机化合物的质量及其完全燃烧后生成和水的质量
2.有机化合物Y的分子式为,其红外光谱图如图所示,则该有机化合物可能的结构简式为( )
A. B.
C. D.
3.A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%,那么A的实验式是( )
A. B.
C. D.
4.在有机化合物的研究过程中,能测出有机化合物相对分子质量的仪器是( )
A.红外光谱仪 B.元素分析仪 C.质谱仪 D.核磁共振仪
5.某有机化合物只含碳、氢、氧三种元素中的两种或三种,相对分子质量为74,完全燃烧时产生等物质的量的CO2和H2O。它的分子式可能为( )
A.C4H10O B.C4H4O2 C.C3H6O2 D.C4H8O2
6.某气态烃对空气的相对密度为2,在氧气中充分燃烧1.16g 这种烃,并将所得产物依次通过装有无水氯化钙的干燥管和装有碱石灰的干燥管,称量这两个干燥管的质量,它们依次增重1.8g和3.52g。这种烃的分子式是( )
A.C2H6 B.C4H10 C.C5H10 D.C5H12
7.测定某有机化合物A的结构,进行如下实验。
[分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下)。则该物质中各元素的原子个数比是______。
(2)质谱仪测定有机化合物A的相对分子质量为46,则该物质的分子式是_______。
(3)根据价键理论,预测A的可能结构并写出结构简式:__________。
[结构式的确定]
(4)经测定,有机物A的核磁共振氢谱如图所示,则A的结构简式为__________。
【性质实验】
(5)A在Cu作用下可被氧化生成B,其化学方程式为_______________。
(6)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式: _______________。
答案及解析
1.答案:D
解析:烃只含C、H两种元素。只测定它的C、H原子个数比,不能确定是否含有O原子,不能验证该有机化合物属于烃,故A错误;烃和烃的含氧衍生物的燃烧产物都是,则只证明该有机化合物完全燃烧后产物只有,不能验证该有机化合物属于烃,故B错误;只测定其燃烧产物中的物质的量之比,只能测出它的C、H原子个数比,不能确定是否含有O原子,不能验证该有机化合物属于烃,故C错误;测定该有机化合物的质量及其完全燃烧后生成的质量,若有机化合物的质量与中C、H元素的质量之和相等,则能验证该有杋化合物属于烃,故D正确。
2.答案:A
解析:由红外光谱图可看出该分子中有不对称的,因此该分子中有2个,由图还可以看出有机化合物Y含有、COC结构,则Y的结构简式为或,A正确。
3.答案:A
解析:由于A中碳的质量分数为44.1%,氢的质量分数为8.82%,故A中氧的质量分数为1-44.1%-8.82%=47.08%。由此可算出5:12:4,故该有机化合物的实验式为,A正确。
4.答案:C
解析:红外光谱仪可用于判断有机化合物中的化学键、官能团情况,元素分析仪可确定有机化合物中所含元素,质谱仪可测出有机化合物的相对分子质量,核磁共振仪可确定有机化合物分子中有几种不同类型的氢原子或碳原子等,故C正确。
5.答案:C
解析:C4H10O的相对分子质量为74,完全燃烧生成的CO2和H2O的物质的量之比为4:5,A错误;C4H4O2的相对分子质量为84,B错误;C3H6O2的相对分子质量为74,完全燃烧生成的CO2和H2O的物质的量之比为1:1,C正确;C4H8O2的相对分子质量为88,D错误。
6.答案:B
解析:气态烃对空气(空气的平均相对分子质量为29)的相对密度为2,则该烃的相对分子质量为29×2=58,则该烃的物质的量为,装有无水氯化钙的干燥管增重的1.8g为生成水的质量,其物质的量为,装有碱石灰的干燥管增重的3.52g为生成二氧化碳的质量,其物质的量为,根据原子守恒可知烃分子中,则该烃分子式为,故B正确。
7.答案:(1)2:6:1(2)C2H6O(3)CH3CH2OH、CH3OCH3(4)CH3CH2OH
(5)2CH3CH2OH+O22CH3CHO+2H2O
(6)CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O
解析:(1)根据题意有n(H2O)=0.3mol,n(CO2)=0.2mol,则有n(H)=0.6mol,n(C)=0.2mol。根据氧原子守恒有n(O)=n(H2O)+2n(CO2)-2n(O2)=0.3mol+2×0.2mol-2×=0.1mol,则该物质中各元素原子个数比N(C):N(H):N(O)=n(C):n(H):n(O)=2:6:1。
(2)据(1)可知该有机物的实验式为C2H6O,假设该存机物的分子式为(C2H6O)m,其相对分子质量为46,则46m=46,即m=1,故其分子式为C2H6O。
(3)由A的分子式C2H6O可知A为饱和化合物,可推测其结构可能为CH3CH2OH或CH3OCH3。
(4)根据A的核磁并振氢谱图可知A中含有三种化学环境的H原子,故其结构简式为CH3CH2OH。
(5)乙醇在Cu作用下可被氧化成乙醛,其化学方程式为2CH3CH2OH+O22CH3CHO+2H2O。
(6)由粮食制得的乙醇在密闭储存时部分会被氧化成CH3COOH,乙醇与乙酸发生酯化反应生成了具有香味的乙酸乙酯,其化学方程式一定温度CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O。
2
第二节 研究有机化合物的一般方法
第2课时
【学法指导】
1.解测定有机化合物元素含量、相对分子质量的般方法,能确定有机化合物分子式。(证据推理)
2.知道通过化学实验和某些物理方法可以确定有机化合物的分子结构。(科学探究)
3.初步了解质谱、红外光谱、核磁共振氢谱的原理及用途。(宏观辨识)
【基础梳理】
要点一、确定实验式
1.元素定性分析——确定有机物的元素组成
一般是将一定量的有机物燃烧,转化为简单的无机物。
2.元素定量分析——确定有机物的实验式(最简式)
(1)原理:通过无机物的质量推算出该有机物所含各元素的质量分数,然后计算出该有机物分子内各元素原子的 ,确定其 (也称 )。
(2)测定步骤(李比希法)
例如:某含C、H、O三元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.2%,氢的质量分数为13.1%。则:
①氧的质量分数为 ;
②C、H、O的原子个数比:N(C):N(H):N(O)= ;
③该未知物的实验式为 。
要点二、确定分子式——质谱法
1.原理
2.质荷比
是指分子离子、碎片离子的 与 的比值,即质荷比。
以质荷比为横坐标,以各类离子的相对丰度为纵坐标记录测试结果,就得到有机化合物的质谱图。质谱图中,质荷比的 就表示了样品分子的相对分子质量。
由图可知,样品分子的相对分子质量为 。
要点三、确定分子结构——波谱分析
1.红外光谱
(1)原理
有机化合物受到红外线照射时,能吸收与它的某些化学键或官能团的振动频率相同的红外线,通过红外光谱仪的记录形成该有机化合物的红外光谱图。
(2)应用:可获得分子中所含有的 或 的信息。
未知物A的红外光谱
2.核磁共振氢谱
(1)原理
处于 中的氢原子因产生共振时吸收电磁波的频率不同,相应的信号在谱图中出现的位置也不同,具有不同的化学位移(用δ表示),而且吸收峰的面积与 成正比。
(2)应用
由核磁共振氢谱图可以获得该有机化合物分子中有几种 的氢原子及它们的 等信息。
(4)核磁共振氢谱分析
吸收峰数目= ,吸收峰面积比= 。
3.X射线衍射谱
(1)原理
X射线是一种波长很短(约10m)的电磁波,它和晶体中的原子相互作用可以产生衍射谱图。
(2)应用
经过计算可以从中获得分子结构的有关数据,包括 、 等分子结构信息。将X射线衍射技术用于有机化合物(特别是复杂的生物大分子)晶体结构的测定,可以获得更为直接而详尽的结构信息。
基础达标训练
典例1正误判断
(1)燃烧后只产生CO2和H2O的物质不一定只含有碳、氢两种元素。( )
(2)根据红外光谱可以确定有机物中化学键种类。( )
(3)核磁共振氢谱中,有几个吸收峰就说明有几个氢原子。( )
(4)根据核磁共振氢谱可推知分子中有几种不同类型的氢原子及它们的相对数目。( )
强化训练
1.下列关于物质研究方法的说法中错误的是( )
A.用官能团的特征反应可推测有机物可能的结构
B.核磁共振氢谱能反映出未知有机物中不同化学环境氢原子的种类和个数
C.根据红外光谱图的分析可以初步判断有机物中具有哪些基团
D.质谱法可测定有机物的相对分子质量
2.下列说法中正确的是( )
A.在其核磁共振氢谱图中有5组吸收峰
B.红外光谱图只能确定有机物中所含官能团的种类和数目
C.质谱法不能用于相对分子质量的测定
D.红外光谱、核磁共振氢谱和质谱都可用于分析有机物结构
3.在核磁共振氢谱中出现3组峰,且氢原子个数比为3:1:4的化合物是( )
A. B. C. D.
4.二甲醚和乙醇是同分异构体,其鉴別可采用化学方法或物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A.利用金属钠或者金属钾 B.利用质谱法
C.利用红外光谱法 D.利用核磁共振氢谱
5.某有机物A用质谱仪测定如图① ,核磁共振氢谱示意图如图② ,则A的结构简式可能为( )
A.HCOOH B. C. D.
6.某有机化合物在氧气中充分燃烧,生成等物质的量的二氧化碳和水。则该有机化合物的组成必须满足的条件是( )
A.分子中C、H、O原子的个数比为1:2:3 B.分子中C、H原子的个数比为1:2
C.该有机化合物的相对分子质量为14 D.该分子中肯定不含氧元素
7.下列化合物的核磁共振氢谱中出现三组峰的是( )
A.2,2,3,3-四甲基丁烷 B.2,3,4-三甲基戊烷
C.3,4-二甲基己烷 D.2,5-二甲基己烷
8.将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g和8.8 g ,消耗氧气6.72 L(标准状况下),则该物质的最简式为________,若要确定其分子式,_____________(填“是”或“否”)需有其他条件。已知有机物A的核磁共振氢谱、质谱如图所示,则A的结构简式为________。
若质谱图显示B的相对分子质量为74,红外光谱如图所示,则B的结构简式为________,其官能团的名称为_______。
【课后练习】
1.验证某有机化合物属于烃,应完成的实验内容是( )
A.测定它的C、H原子个数比
B.证明它完全燃烧后的产物只有水和
C.测定其燃烧产物中水和的物质的量之比
D.测定该有机化合物的质量及其完全燃烧后生成和水的质量
2.有机化合物Y的分子式为,其红外光谱图如图所示,则该有机化合物可能的结构简式为( )
A. B.
C. D.
3.A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%,那么A的实验式是( )
A. B.
C. D.
4.在有机化合物的研究过程中,能测出有机化合物相对分子质量的仪器是( )
A.红外光谱仪 B.元素分析仪 C.质谱仪 D.核磁共振仪
5.某有机化合物只含碳、氢、氧三种元素中的两种或三种,相对分子质量为74,完全燃烧时产生等物质的量的CO2和H2O。它的分子式可能为( )
A.C4H10O B.C4H4O2 C.C3H6O2 D.C4H8O2
6.某气态烃对空气的相对密度为2,在氧气中充分燃烧1.16g 这种烃,并将所得产物依次通过装有无水氯化钙的干燥管和装有碱石灰的干燥管,称量这两个干燥管的质量,它们依次增重1.8g和3.52g。这种烃的分子式是( )
A.C2H6 B.C4H10 C.C5H10 D.C5H12
7.测定某有机化合物A的结构,进行如下实验。
[分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下)。则该物质中各元素的原子个数比是______。
(2)质谱仪测定有机化合物A的相对分子质量为46,则该物质的分子式是_______。
(3)根据价键理论,预测A的可能结构并写出结构简式:__________。
[结构式的确定]
(4)经测定,有机物A的核磁共振氢谱如图所示,则A的结构简式为__________。
【性质实验】
(5)A在Cu作用下可被氧化生成B,其化学方程式为_______________。
(6)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式: _______________。
答案及解析
1.答案:D
解析:烃只含C、H两种元素。只测定它的C、H原子个数比,不能确定是否含有O原子,不能验证该有机化合物属于烃,故A错误;烃和烃的含氧衍生物的燃烧产物都是,则只证明该有机化合物完全燃烧后产物只有,不能验证该有机化合物属于烃,故B错误;只测定其燃烧产物中的物质的量之比,只能测出它的C、H原子个数比,不能确定是否含有O原子,不能验证该有机化合物属于烃,故C错误;测定该有机化合物的质量及其完全燃烧后生成的质量,若有机化合物的质量与中C、H元素的质量之和相等,则能验证该有杋化合物属于烃,故D正确。
2.答案:A
解析:由红外光谱图可看出该分子中有不对称的,因此该分子中有2个,由图还可以看出有机化合物Y含有、COC结构,则Y的结构简式为或,A正确。
3.答案:A
解析:由于A中碳的质量分数为44.1%,氢的质量分数为8.82%,故A中氧的质量分数为1-44.1%-8.82%=47.08%。由此可算出5:12:4,故该有机化合物的实验式为,A正确。
4.答案:C
解析:红外光谱仪可用于判断有机化合物中的化学键、官能团情况,元素分析仪可确定有机化合物中所含元素,质谱仪可测出有机化合物的相对分子质量,核磁共振仪可确定有机化合物分子中有几种不同类型的氢原子或碳原子等,故C正确。
5.答案:C
解析:C4H10O的相对分子质量为74,完全燃烧生成的CO2和H2O的物质的量之比为4:5,A错误;C4H4O2的相对分子质量为84,B错误;C3H6O2的相对分子质量为74,完全燃烧生成的CO2和H2O的物质的量之比为1:1,C正确;C4H8O2的相对分子质量为88,D错误。
6.答案:B
解析:气态烃对空气(空气的平均相对分子质量为29)的相对密度为2,则该烃的相对分子质量为29×2=58,则该烃的物质的量为,装有无水氯化钙的干燥管增重的1.8g为生成水的质量,其物质的量为,装有碱石灰的干燥管增重的3.52g为生成二氧化碳的质量,其物质的量为,根据原子守恒可知烃分子中,则该烃分子式为,故B正确。
7.答案:(1)2:6:1(2)C2H6O(3)CH3CH2OH、CH3OCH3(4)CH3CH2OH
(5)2CH3CH2OH+O22CH3CHO+2H2O
(6)CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O
解析:(1)根据题意有n(H2O)=0.3mol,n(CO2)=0.2mol,则有n(H)=0.6mol,n(C)=0.2mol。根据氧原子守恒有n(O)=n(H2O)+2n(CO2)-2n(O2)=0.3mol+2×0.2mol-2×=0.1mol,则该物质中各元素原子个数比N(C):N(H):N(O)=n(C):n(H):n(O)=2:6:1。
(2)据(1)可知该有机物的实验式为C2H6O,假设该存机物的分子式为(C2H6O)m,其相对分子质量为46,则46m=46,即m=1,故其分子式为C2H6O。
(3)由A的分子式C2H6O可知A为饱和化合物,可推测其结构可能为CH3CH2OH或CH3OCH3。
(4)根据A的核磁并振氢谱图可知A中含有三种化学环境的H原子,故其结构简式为CH3CH2OH。
(5)乙醇在Cu作用下可被氧化成乙醛,其化学方程式为2CH3CH2OH+O22CH3CHO+2H2O。
(6)由粮食制得的乙醇在密闭储存时部分会被氧化成CH3COOH,乙醇与乙酸发生酯化反应生成了具有香味的乙酸乙酯,其化学方程式一定温度CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O。
2
