第9章溶液检测题(含答案)--2022-2023学年九年级化学京改版(2013)下册
文档属性
| 名称 | 第9章溶液检测题(含答案)--2022-2023学年九年级化学京改版(2013)下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 117.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
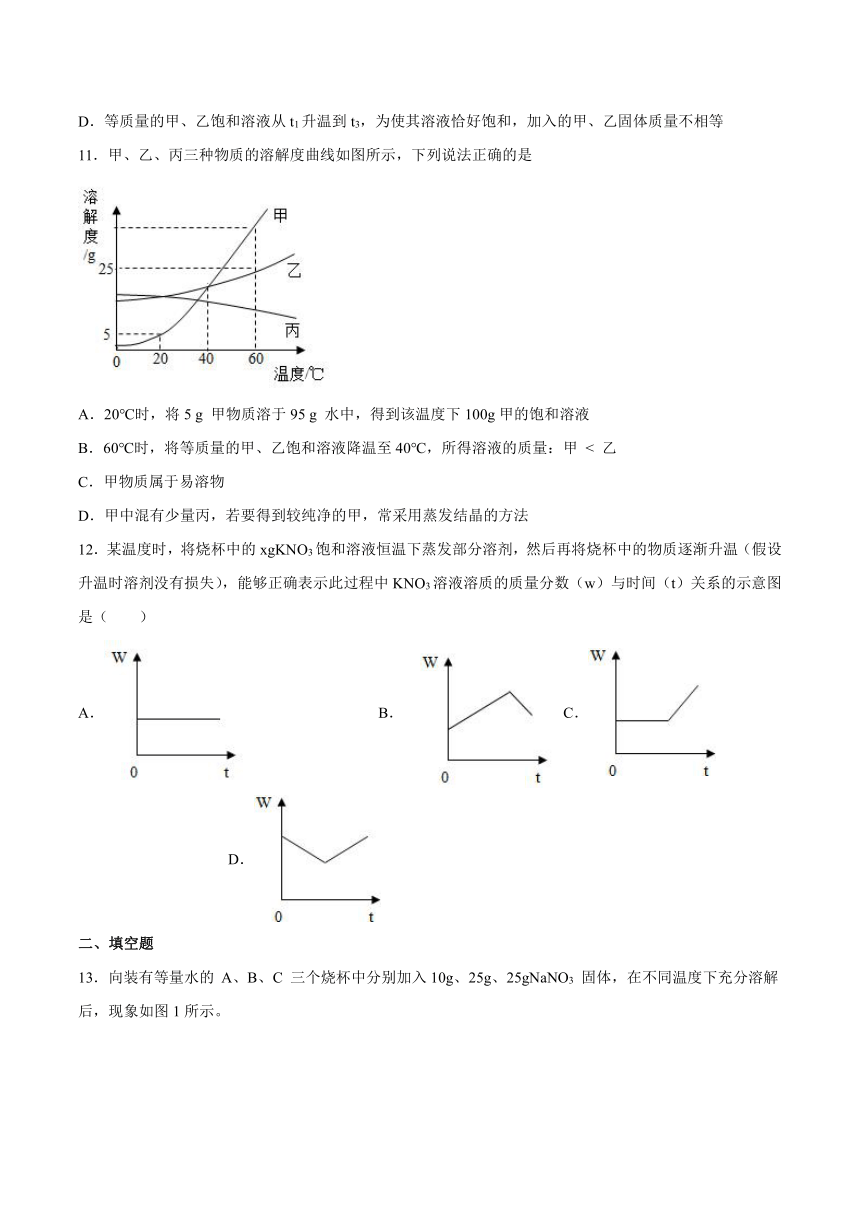
| 科目 | 化学 | ||
| 更新时间 | 2023-04-18 21:07:57 | ||
图片预览

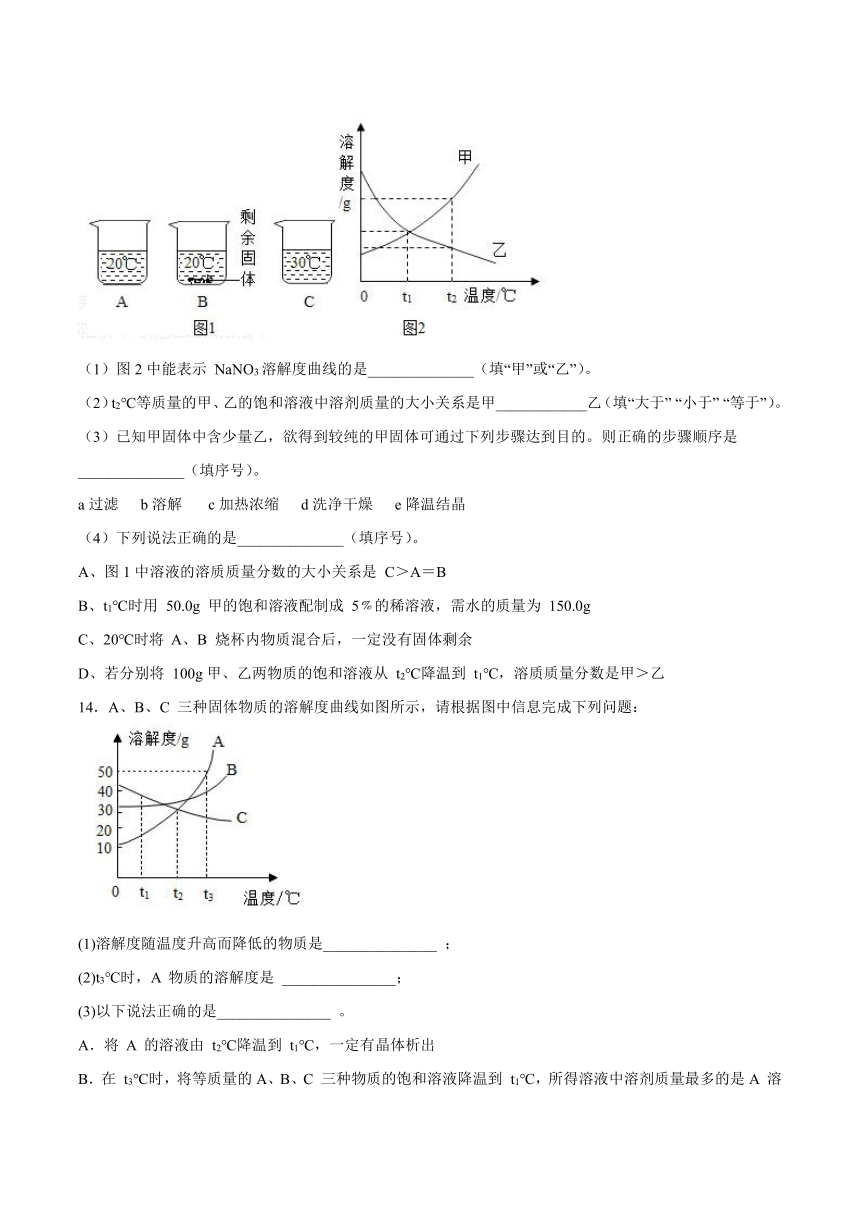
文档简介
第9章《溶液》检测题
一、单选题
1.关于溶解度的说法错误的是
A.溶剂的量可以影响固体物质的溶解度
B.某温度下,某固体物质的饱和溶液可能是稀溶液
C.溶解度可以定量地表示某种物质在某种溶剂中的溶解性
D.在一定温度下,压强越大气体溶解度越大
2.下列说法正确的是
A.凡是均一的、稳定的液体一定是溶液
B.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
C.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
D.将硝酸铵固体溶于水,溶液的温度升高
3.如图是甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法中正确的是
A.t2℃时,80g甲溶于200g水中,得到的是甲的饱和溶液
B.t2℃时,将甲、乙两种物质的饱和溶液分别降温至t1℃,析出晶体的质量甲一定大于乙
C.t1℃时,甲的饱和溶液恒温蒸发10g水析出1g晶体
D.t1℃时分别将甲、乙的饱和溶液升温到t2℃,所得溶液的溶质质量分数相等
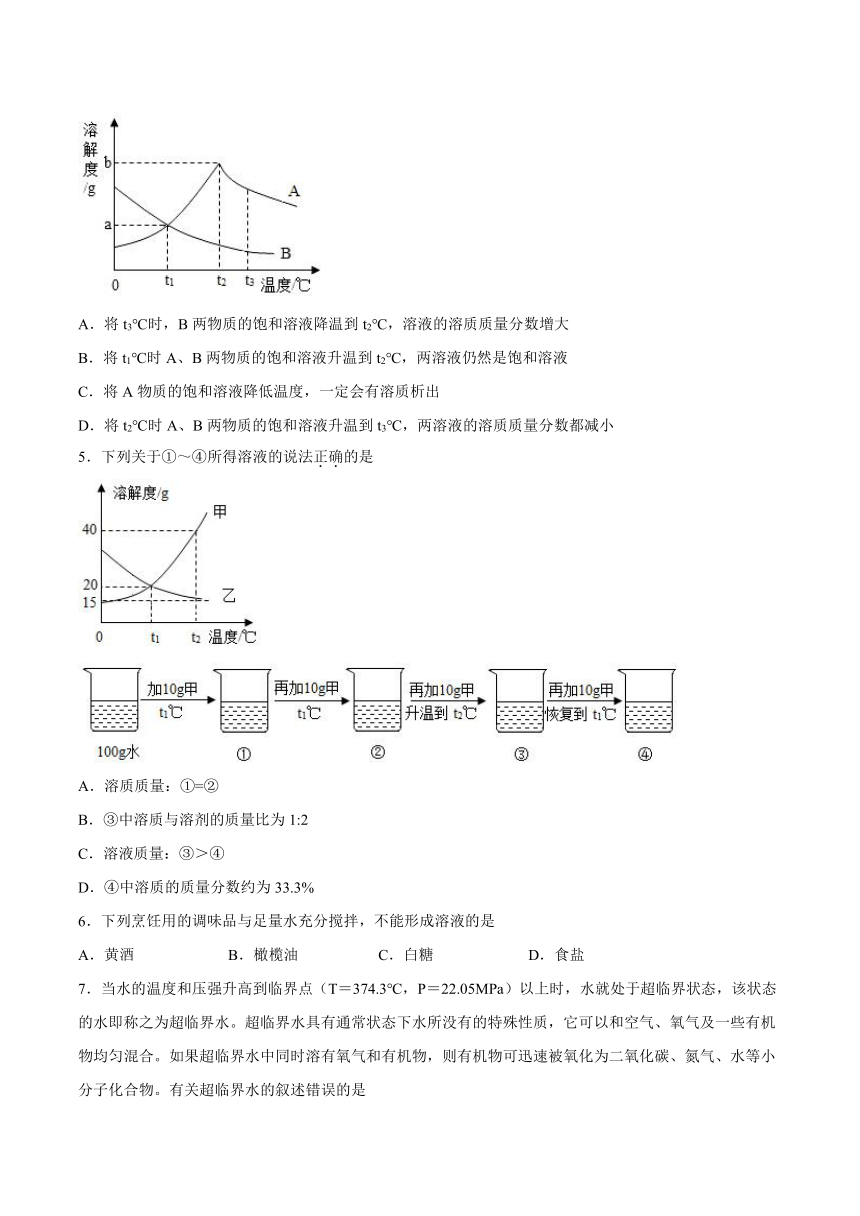
4.如图是A、B两物质的溶解度曲线图,下列说法正确的是
A.将t3℃时,B两物质的饱和溶液降温到t2℃,溶液的溶质质量分数增大
B.将t1℃时A、B两物质的饱和溶液升温到t2℃,两溶液仍然是饱和溶液
C.将A物质的饱和溶液降低温度,一定会有溶质析出
D.将t2℃时A、B两物质的饱和溶液升温到t3℃,两溶液的溶质质量分数都减小
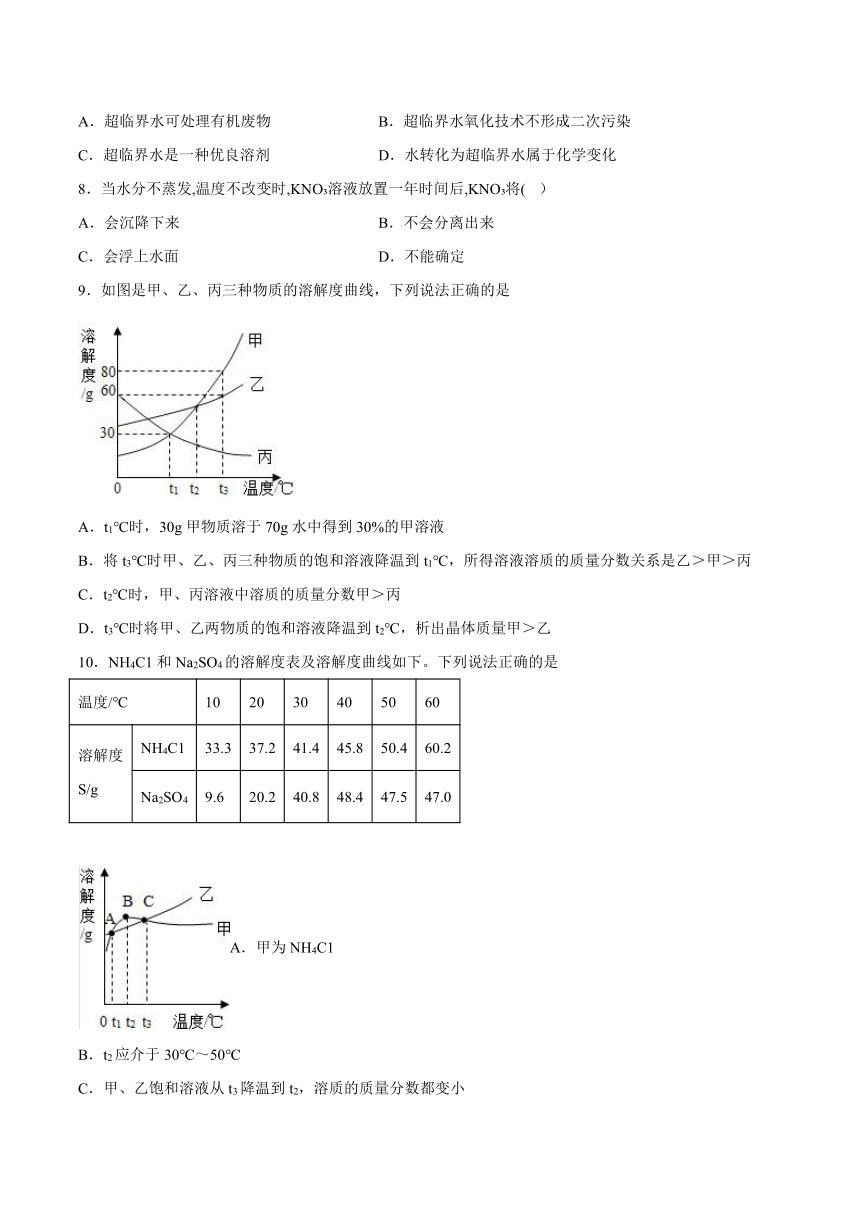
5.下列关于①~④所得溶液的说法正确的是
A.溶质质量:①=②
B.③中溶质与溶剂的质量比为1:2
C.溶液质量:③>④
D.④中溶质的质量分数约为33.3%
6.下列烹饪用的调味品与足量水充分搅拌,不能形成溶液的是
A.黄酒 B.橄榄油 C.白糖 D.食盐
7.当水的温度和压强升高到临界点(T=374.3℃,P=22.05MPa)以上时,水就处于超临界状态,该状态的水即称之为超临界水。超临界水具有通常状态下水所没有的特殊性质,它可以和空气、氧气及一些有机物均匀混合。如果超临界水中同时溶有氧气和有机物,则有机物可迅速被氧化为二氧化碳、氮气、水等小分子化合物。有关超临界水的叙述错误的是
A.超临界水可处理有机废物 B.超临界水氧化技术不形成二次污染
C.超临界水是一种优良溶剂 D.水转化为超临界水属于化学变化
8.当水分不蒸发,温度不改变时,KNO 溶液放置一年时间后,KNO 将( )
A.会沉降下来 B.不会分离出来
C.会浮上水面 D.不能确定
9.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是
A.t1℃时,30g甲物质溶于70g水中得到30%的甲溶液
B.将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液溶质的质量分数关系是乙>甲>丙
C.t2℃时,甲、丙溶液中溶质的质量分数甲>丙
D.t3℃时将甲、乙两物质的饱和溶液降温到t2℃,析出晶体质量甲>乙
10.NH4C1和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是
温度/℃ 10 20 30 40 50 60
溶解度 S/g NH4C1 33.3 37.2 41.4 45.8 50.4 60.2
Na2SO4 9.6 20.2 40.8 48.4 47.5 47.0
A.甲为NH4C1
B.t2应介于30℃~50℃
C.甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小
D.等质量的甲、乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,加入的甲、乙固体质量不相等
11.甲、乙、丙三种物质的溶解度曲线如图所示,下列说法正确的是
A.20℃时,将5 g 甲物质溶于95 g 水中,得到该温度下100g甲的饱和溶液
B.60℃时,将等质量的甲、乙饱和溶液降温至40℃,所得溶液的质量:甲 < 乙
C.甲物质属于易溶物
D.甲中混有少量丙,若要得到较纯净的甲,常采用蒸发结晶的方法
12.某温度时,将烧杯中的xgKNO3饱和溶液恒温下蒸发部分溶剂,然后再将烧杯中的物质逐渐升温(假设升温时溶剂没有损失),能够正确表示此过程中KNO3溶液溶质的质量分数(w)与时间(t)关系的示意图是( )
A. B. C. D.
二、填空题
13.向装有等量水的 A、B、C 三个烧杯中分别加入10g、25g、25gNaNO3 固体,在不同温度下充分溶解后,现象如图1所示。
(1)图2中能表示 NaNO3溶解度曲线的是______________(填“甲”或“乙”)。
(2)t2℃等质量的甲、乙的饱和溶液中溶剂质量的大小关系是甲____________乙(填“大于” “小于” “等于”)。
(3)已知甲固体中含少量乙,欲得到较纯的甲固体可通过下列步骤达到目的。则正确的步骤顺序是______________(填序号)。
a过滤 b溶解 c加热浓缩 d洗净干燥 e降温结晶
(4)下列说法正确的是______________(填序号)。
A、图1中溶液的溶质质量分数的大小关系是 C>A=B
B、t1℃时用 50.0g 甲的饱和溶液配制成 5﹪的稀溶液,需水的质量为 150.0g
C、20℃时将 A、B 烧杯内物质混合后,一定没有固体剩余
D、若分别将 100g甲、乙两物质的饱和溶液从 t2℃降温到 t1℃,溶质质量分数是甲>乙
14.A、B、C 三种固体物质的溶解度曲线如图所示,请根据图中信息完成下列问题:
(1)溶解度随温度升高而降低的物质是_______________ ;
(2)t3℃时,A 物质的溶解度是 _______________;
(3)以下说法正确的是_______________ 。
A.将 A 的溶液由 t2℃降温到 t1℃,一定有晶体析出
B.在 t3℃时,将等质量的A、B、C 三种物质的饱和溶液降温到 t1℃,所得溶液中溶剂质量最多的是A 溶液
C.t1℃时将A、B、C 三种物质各 5g 分别加入 20g 水中充分溶解,所得溶液质量的大小关系为C=B>A
D.将 A、B、C 三种物质的饱和溶液分别由 t2℃升温到 t3℃,所得溶液中溶质的质量分数最大的物质是B
15.溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是_______(填字母序号)。
A.植物油 B.冰块 C.高锰酸钾 D.面粉
(2)下列有关溶液的说法中,正确的是_______(填字母序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①t1℃时,甲、乙两种物质的溶解度_______(填“相等”或“不相等”)。
②t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为_______(填最简比) 。
③现有t1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,所得溶液中溶质质量分数大小关系是_______(填字母序号)。
A.甲>乙>丙 B.甲=乙丙 C.甲=乙>丙
(4)下图是利用海水提取粗盐的过程。
根据海水晒盐的原理,下列说法正确的是_______(填字母序号)。
A.进入贮水池中的海水,氯化钠的质量逐渐减少
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.析出晶体后,母液中的氯化钠溶液达到饱和
(5)某同学配制50g溶质质量分数为10%的氯化钠溶液。
①需要固体氯化钠的质量为_______g。
②配制过程有以下步骤:a.称量及量取 b.计算 c.溶解 d.装瓶贴标签,正确顺序是_______(填字母序号)。
A.bcad B.bacd
③将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水的质量为____g。
(6)喝了汽水以后,常常会打嗝。这说明随温度升高气体的溶解度_____(填“增大”或“减小”)。
三、简答题
16.如图1是A、B、C三种物质的溶解度曲线图.请回答:
①t1℃时,溶解度相等的两种物质是________.
②B的饱和溶液中混有少量的物质A,要除去A得到较纯的B物质,可采用的结晶方法是________.
③如图2所示,在大烧杯中加入一定量的硝酸铵固体后,甲试管内出现的现象是________,乙试管内的溶液为________溶液(填“饱和”或“不饱和”).
17.水和水溶液是初中化学的重要知识。
(1)水的净化过程中,利用活性炭的_____性,可除去水中的色素和异味。
(2)下表是硝酸钾和氯化钠在不同温度下的溶解度。
温度/℃ 20 40 60 80 100
硝酸钾溶解度/g 31.6 63.9 110 169 246
氯化钠溶解度/g 36.0 36.6 37.3 38.4 39.8
①若硝酸钾中混有少量的氯化钠,提纯硝酸钾可以采取的方法是_____。
②60℃时,将硝酸钾和氯化钠两种固体各50g分别加入盛有100g水的烧杯中,充分溶解后能得到饱和溶液的是_____(填“硝酸钾”或“氯化钠”),该饱和溶液的溶质质量分数为_____(列计算式即可)。
(3)①将一定量的氢氧化钠固体完全溶于适量的水中恰好形成饱和溶液,放置一会儿,观察到有无色晶体从溶液中析出,经检验,该无色晶体为氢氧化钠。请简述导致氢氧化钠晶体从溶液中析出的主要原因:_____
②用54g溶质质量分数为1%的氢氧化钠溶液进行水的电解实验,当氢氧化钠溶液中的溶质质量分数变为3%时停止电解,电解过程中氢氧化钠质量始终不变,则被电解的水的质量为_____g。
四、实验题
18.小红同学加热KClO3和MnO2的混合物制取氧气,对充分反应后的固体进行了如下研究。
[实验一]分离混合物中的KCl和MnO2。
(1)根据KCl和MnO2溶解性不同,设计了以下三步实验:____、过滤、蒸发。
(2)过滤时,应选用如图所示仪器中的____________(填编号)。把过滤后的固体,再通过洗涤、干燥,得到的物质是_________。
(3)蒸发滤液过程中,要用玻璃棒不断搅拌,其目的是___________,丽丽对蒸发过程中刚有晶体析出时蒸发皿中的溶液M,与继续加热一段时间后蒸发皿中的溶液N进行了以下两方面的比较(假设温度不变)。
①溶液中溶质的质量:溶液M ___溶液N (选填“>”、“<”或“=”,下同);
②溶液中溶质的质量分数:溶液M_______溶液N。
[实验二]利用回收的KCl,配置溶质质量分数为5%的KCl植物营养液。若回收得到的KCl为10g,全部配成5%的营养液,需要水的质量为________。
五、计算题
19.山西老陈醋居中国名醋之首,驰名中外。其主要成分是醋酸,化学式为CH3COOH。测定老陈醋醋酸含量的原理是:。化学课外活动小组中和10g老陈醋,用去NaOH的质量为4g。请你计算:
(1)醋酸中碳、氢、氧元素的质量比: (最简整数比)。
(2)老陈醋中醋酸的质量分数。
参考答案:
1.A 2.B 3.D 4.D 5.C 6.B 7.D 8.B 9.B 10.B 11.B 12.C
13. 甲 小于 bcead BD
14.(1)C
(2)50g
(3)CD
15.(1)C
(2)B
(3) 相等 1:2 C
(4)C
(5) 5 B 50
(6)减小
16. A、C 蒸发结晶 有晶体析出 不饱和
17. 吸附 冷却热饱和溶液(或其他合理答案) 氯化钠 氢氧化钠固体溶于水放热,配成热饱和溶液,放置后溶液温度降低,氢氧化钠的溶解度变小,故晶体析出 36
18. 溶解 ①⑤⑥⑦ MnO2 防止局部温度过高,造成液滴飞溅 > = 190g
19.(1)6:1:8
(2)解:老陈醋中醋酸的质量分数为x
答:老陈醋中醋酸的质量分数为6%
一、单选题
1.关于溶解度的说法错误的是
A.溶剂的量可以影响固体物质的溶解度
B.某温度下,某固体物质的饱和溶液可能是稀溶液
C.溶解度可以定量地表示某种物质在某种溶剂中的溶解性
D.在一定温度下,压强越大气体溶解度越大
2.下列说法正确的是
A.凡是均一的、稳定的液体一定是溶液
B.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
C.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
D.将硝酸铵固体溶于水,溶液的温度升高
3.如图是甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法中正确的是
A.t2℃时,80g甲溶于200g水中,得到的是甲的饱和溶液
B.t2℃时,将甲、乙两种物质的饱和溶液分别降温至t1℃,析出晶体的质量甲一定大于乙
C.t1℃时,甲的饱和溶液恒温蒸发10g水析出1g晶体
D.t1℃时分别将甲、乙的饱和溶液升温到t2℃,所得溶液的溶质质量分数相等
4.如图是A、B两物质的溶解度曲线图,下列说法正确的是
A.将t3℃时,B两物质的饱和溶液降温到t2℃,溶液的溶质质量分数增大
B.将t1℃时A、B两物质的饱和溶液升温到t2℃,两溶液仍然是饱和溶液
C.将A物质的饱和溶液降低温度,一定会有溶质析出
D.将t2℃时A、B两物质的饱和溶液升温到t3℃,两溶液的溶质质量分数都减小
5.下列关于①~④所得溶液的说法正确的是
A.溶质质量:①=②
B.③中溶质与溶剂的质量比为1:2
C.溶液质量:③>④
D.④中溶质的质量分数约为33.3%
6.下列烹饪用的调味品与足量水充分搅拌,不能形成溶液的是
A.黄酒 B.橄榄油 C.白糖 D.食盐
7.当水的温度和压强升高到临界点(T=374.3℃,P=22.05MPa)以上时,水就处于超临界状态,该状态的水即称之为超临界水。超临界水具有通常状态下水所没有的特殊性质,它可以和空气、氧气及一些有机物均匀混合。如果超临界水中同时溶有氧气和有机物,则有机物可迅速被氧化为二氧化碳、氮气、水等小分子化合物。有关超临界水的叙述错误的是
A.超临界水可处理有机废物 B.超临界水氧化技术不形成二次污染
C.超临界水是一种优良溶剂 D.水转化为超临界水属于化学变化
8.当水分不蒸发,温度不改变时,KNO 溶液放置一年时间后,KNO 将( )
A.会沉降下来 B.不会分离出来
C.会浮上水面 D.不能确定
9.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是
A.t1℃时,30g甲物质溶于70g水中得到30%的甲溶液
B.将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液溶质的质量分数关系是乙>甲>丙
C.t2℃时,甲、丙溶液中溶质的质量分数甲>丙
D.t3℃时将甲、乙两物质的饱和溶液降温到t2℃,析出晶体质量甲>乙
10.NH4C1和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是
温度/℃ 10 20 30 40 50 60
溶解度 S/g NH4C1 33.3 37.2 41.4 45.8 50.4 60.2
Na2SO4 9.6 20.2 40.8 48.4 47.5 47.0
A.甲为NH4C1
B.t2应介于30℃~50℃
C.甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小
D.等质量的甲、乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,加入的甲、乙固体质量不相等
11.甲、乙、丙三种物质的溶解度曲线如图所示,下列说法正确的是
A.20℃时,将5 g 甲物质溶于95 g 水中,得到该温度下100g甲的饱和溶液
B.60℃时,将等质量的甲、乙饱和溶液降温至40℃,所得溶液的质量:甲 < 乙
C.甲物质属于易溶物
D.甲中混有少量丙,若要得到较纯净的甲,常采用蒸发结晶的方法
12.某温度时,将烧杯中的xgKNO3饱和溶液恒温下蒸发部分溶剂,然后再将烧杯中的物质逐渐升温(假设升温时溶剂没有损失),能够正确表示此过程中KNO3溶液溶质的质量分数(w)与时间(t)关系的示意图是( )
A. B. C. D.
二、填空题
13.向装有等量水的 A、B、C 三个烧杯中分别加入10g、25g、25gNaNO3 固体,在不同温度下充分溶解后,现象如图1所示。
(1)图2中能表示 NaNO3溶解度曲线的是______________(填“甲”或“乙”)。
(2)t2℃等质量的甲、乙的饱和溶液中溶剂质量的大小关系是甲____________乙(填“大于” “小于” “等于”)。
(3)已知甲固体中含少量乙,欲得到较纯的甲固体可通过下列步骤达到目的。则正确的步骤顺序是______________(填序号)。
a过滤 b溶解 c加热浓缩 d洗净干燥 e降温结晶
(4)下列说法正确的是______________(填序号)。
A、图1中溶液的溶质质量分数的大小关系是 C>A=B
B、t1℃时用 50.0g 甲的饱和溶液配制成 5﹪的稀溶液,需水的质量为 150.0g
C、20℃时将 A、B 烧杯内物质混合后,一定没有固体剩余
D、若分别将 100g甲、乙两物质的饱和溶液从 t2℃降温到 t1℃,溶质质量分数是甲>乙
14.A、B、C 三种固体物质的溶解度曲线如图所示,请根据图中信息完成下列问题:
(1)溶解度随温度升高而降低的物质是_______________ ;
(2)t3℃时,A 物质的溶解度是 _______________;
(3)以下说法正确的是_______________ 。
A.将 A 的溶液由 t2℃降温到 t1℃,一定有晶体析出
B.在 t3℃时,将等质量的A、B、C 三种物质的饱和溶液降温到 t1℃,所得溶液中溶剂质量最多的是A 溶液
C.t1℃时将A、B、C 三种物质各 5g 分别加入 20g 水中充分溶解,所得溶液质量的大小关系为C=B>A
D.将 A、B、C 三种物质的饱和溶液分别由 t2℃升温到 t3℃,所得溶液中溶质的质量分数最大的物质是B
15.溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是_______(填字母序号)。
A.植物油 B.冰块 C.高锰酸钾 D.面粉
(2)下列有关溶液的说法中,正确的是_______(填字母序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①t1℃时,甲、乙两种物质的溶解度_______(填“相等”或“不相等”)。
②t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为_______(填最简比) 。
③现有t1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,所得溶液中溶质质量分数大小关系是_______(填字母序号)。
A.甲>乙>丙 B.甲=乙丙 C.甲=乙>丙
(4)下图是利用海水提取粗盐的过程。
根据海水晒盐的原理,下列说法正确的是_______(填字母序号)。
A.进入贮水池中的海水,氯化钠的质量逐渐减少
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.析出晶体后,母液中的氯化钠溶液达到饱和
(5)某同学配制50g溶质质量分数为10%的氯化钠溶液。
①需要固体氯化钠的质量为_______g。
②配制过程有以下步骤:a.称量及量取 b.计算 c.溶解 d.装瓶贴标签,正确顺序是_______(填字母序号)。
A.bcad B.bacd
③将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水的质量为____g。
(6)喝了汽水以后,常常会打嗝。这说明随温度升高气体的溶解度_____(填“增大”或“减小”)。
三、简答题
16.如图1是A、B、C三种物质的溶解度曲线图.请回答:
①t1℃时,溶解度相等的两种物质是________.
②B的饱和溶液中混有少量的物质A,要除去A得到较纯的B物质,可采用的结晶方法是________.
③如图2所示,在大烧杯中加入一定量的硝酸铵固体后,甲试管内出现的现象是________,乙试管内的溶液为________溶液(填“饱和”或“不饱和”).
17.水和水溶液是初中化学的重要知识。
(1)水的净化过程中,利用活性炭的_____性,可除去水中的色素和异味。
(2)下表是硝酸钾和氯化钠在不同温度下的溶解度。
温度/℃ 20 40 60 80 100
硝酸钾溶解度/g 31.6 63.9 110 169 246
氯化钠溶解度/g 36.0 36.6 37.3 38.4 39.8
①若硝酸钾中混有少量的氯化钠,提纯硝酸钾可以采取的方法是_____。
②60℃时,将硝酸钾和氯化钠两种固体各50g分别加入盛有100g水的烧杯中,充分溶解后能得到饱和溶液的是_____(填“硝酸钾”或“氯化钠”),该饱和溶液的溶质质量分数为_____(列计算式即可)。
(3)①将一定量的氢氧化钠固体完全溶于适量的水中恰好形成饱和溶液,放置一会儿,观察到有无色晶体从溶液中析出,经检验,该无色晶体为氢氧化钠。请简述导致氢氧化钠晶体从溶液中析出的主要原因:_____
②用54g溶质质量分数为1%的氢氧化钠溶液进行水的电解实验,当氢氧化钠溶液中的溶质质量分数变为3%时停止电解,电解过程中氢氧化钠质量始终不变,则被电解的水的质量为_____g。
四、实验题
18.小红同学加热KClO3和MnO2的混合物制取氧气,对充分反应后的固体进行了如下研究。
[实验一]分离混合物中的KCl和MnO2。
(1)根据KCl和MnO2溶解性不同,设计了以下三步实验:____、过滤、蒸发。
(2)过滤时,应选用如图所示仪器中的____________(填编号)。把过滤后的固体,再通过洗涤、干燥,得到的物质是_________。
(3)蒸发滤液过程中,要用玻璃棒不断搅拌,其目的是___________,丽丽对蒸发过程中刚有晶体析出时蒸发皿中的溶液M,与继续加热一段时间后蒸发皿中的溶液N进行了以下两方面的比较(假设温度不变)。
①溶液中溶质的质量:溶液M ___溶液N (选填“>”、“<”或“=”,下同);
②溶液中溶质的质量分数:溶液M_______溶液N。
[实验二]利用回收的KCl,配置溶质质量分数为5%的KCl植物营养液。若回收得到的KCl为10g,全部配成5%的营养液,需要水的质量为________。
五、计算题
19.山西老陈醋居中国名醋之首,驰名中外。其主要成分是醋酸,化学式为CH3COOH。测定老陈醋醋酸含量的原理是:。化学课外活动小组中和10g老陈醋,用去NaOH的质量为4g。请你计算:
(1)醋酸中碳、氢、氧元素的质量比: (最简整数比)。
(2)老陈醋中醋酸的质量分数。
参考答案:
1.A 2.B 3.D 4.D 5.C 6.B 7.D 8.B 9.B 10.B 11.B 12.C
13. 甲 小于 bcead BD
14.(1)C
(2)50g
(3)CD
15.(1)C
(2)B
(3) 相等 1:2 C
(4)C
(5) 5 B 50
(6)减小
16. A、C 蒸发结晶 有晶体析出 不饱和
17. 吸附 冷却热饱和溶液(或其他合理答案) 氯化钠 氢氧化钠固体溶于水放热,配成热饱和溶液,放置后溶液温度降低,氢氧化钠的溶解度变小,故晶体析出 36
18. 溶解 ①⑤⑥⑦ MnO2 防止局部温度过高,造成液滴飞溅 > = 190g
19.(1)6:1:8
(2)解:老陈醋中醋酸的质量分数为x
答:老陈醋中醋酸的质量分数为6%
