江西省部分学校2022-2023学年高二下学期4月联考化学试题(含答案)
文档属性
| 名称 | 江西省部分学校2022-2023学年高二下学期4月联考化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 444.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-20 08:45:49 | ||
图片预览


文档简介
江西省部分学校2022-2023学年高二下学期4月联考化学试卷
考生注意:
1.本试卷分选择题和非选择题两部分,共100分。考试时间75分钟。
2.请将各题答案填写在答题卡上。
3.本试卷主要考试内容:人教版选择性必修2、选择性必修3第一章至第二章第二节。
4.可能用到的相对原子质量:H1 C12 N14 O16 Na23 Mg24 Cl35.5 Cu64 Zn65
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“雨过天晴润如玉,花留水彩凝成珠。品绿评红幻万象,颖是画圣神笔图”是毛病陶瓷的诗句。我国定窑陶瓷质高形美,闻名世界。下列说法正确的是( )
A.烧制陶瓷时使用的木炭属于有机物
B.部分瓷器的青色来自瓷器中的氧化铁
C.传统陶瓷是典型的绝缘材料
D.瓷器中含有的属于分子晶体
2.下列化学用语表达正确的是( )
A.中子数为10的O原子:
B.乙醚的结构简式:
C.铵银离子的结构式:
D.环己烷的键线式:
3.下列物质的晶体熔化时,破坏的微粒间的作用力与HF完全相同的是( )
A.Ca B. C.NaCl D.
4.豆腐脑味道鲜美,营养丰富。豆腐脑中含有的大豆异黄酮是天然的癌症化学预防剂,其结构如图所示,下列有关大豆异黄酮的说法错误的是( )
A.分子式为
B.分子中所有的原子可能共平面
C.可以发生加成反应和氧化反应
D.所含的酮羰基的键角为
5.下列有关说法正确的是( )
A.H原子与O原子以构成,说明共价键具有饱和性
B.同一基态原子中高能级电子的能量一定比低能级电子的能量高
C.键的电子云重叠程度低,易断裂,所以分子中含键越多越不稳定
D.分子晶体的熔、沸点一定比共价晶体、离子晶体、金属晶体的低
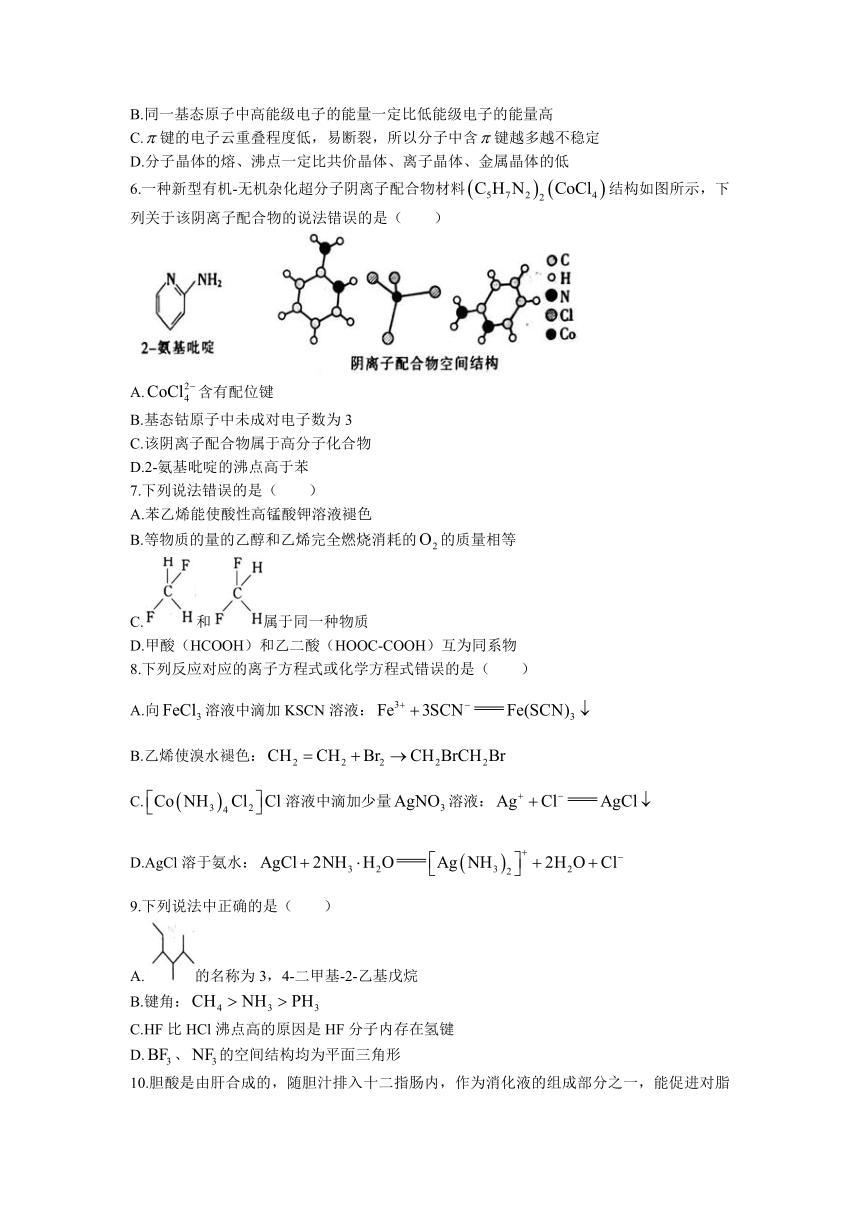
6.一种新型有机-无机杂化超分子阴离子配合物材料结构如图所示,下列关于该阴离子配合物的说法错误的是( )
A.含有配位键
B.基态钴原子中未成对电子数为3
C.该阴离子配合物属于高分子化合物
D.2-氨基吡啶的沸点高于苯
7.下列说法错误的是( )
A.苯乙烯能使酸性高锰酸钾溶液褪色
B.等物质的量的乙醇和乙烯完全燃烧消耗的的质量相等
C.和属于同一种物质
D.甲酸(HCOOH)和乙二酸(HOOC-COOH)互为同系物
8.下列反应对应的离子方程式或化学方程式错误的是( )
A.向溶液中滴加KSCN溶液:
B.乙烯使溴水褪色:
C.溶液中滴加少量溶液:
D.AgCl溶于氨水:
9.下列说法中正确的是( )
A.的名称为3,4-二甲基-2-乙基戊烷
B.键角:
C.HF比HCl沸点高的原因是HF分子内存在氢键
D.、的空间结构均为平面三角形
10.胆酸是由肝合成的,随胆汁排入十二指肠内,作为消化液的组成部分之一,能促进对脂类物质的消化和吸收。当幽门功能不全时,胆酸会反流到胃内,同胃酸一起造成对胃黏膜的损伤,并引起胃痛等不适症状,因此,胆酸是引起胃黏膜损伤的化学因子之一。胆酸的结构如图所示,其分子中手性C原子数为( )
A.9 B.10 C.11 D.12
11.光触媒是一种以纳米级为代表的具有光催化功能的光半导体材料的总称。光触媒在紫外线及可见光的照射下,会产生类似光合作用的光催化反应,产生羟基自由基和活性氧,能杀灭细菌和除去环境中的有机污染物。光触媒除去甲醛的示意图如图,下列说法错误的是( )
A.和活性氧具有强氧化性
B.HCHO的电子式为
C.除甲醛步骤的反应为
D.中键与键数目之比为
12.NaH是一种无机盐。有机合成中,氢化钠主要用作强碱,能夺取很多化合物中的质子而生成相应的钠化合物,如与水反应生成NaOH与,设为阿伏加德罗常数的值,下列说法错误的是( )
A.NaH形成的晶体是离子晶体
B.NaH可以与乙醇反应产生
C.1mol氢化钠与水完全反应转移的电子数为
D.24gNaH所含电子数与24gMg原子所含电子数相同
13.聚乙炔经溴或碘掺杂之后导电性会提高到金属水平,可广泛应用于太阳能电池、半导体材料和电活性聚合物的制备,下列说法错误的是( )
A.聚乙炔分子中所有碳原子在同一直线上
B.聚乙炔能使酸性高锰酸钾溶液褪色
C.聚乙炔没有固定的熔沸点
D.聚乙炔的结构简式为
14.“点击化学”是一种简单、高效、可控和快捷的合成方法。已知“点击化学”中的一个经典反应如图所示,该反应具有快速、条件温和、对水分不敏感的特性,使其在固体推进剂中具有广阔的应用前景。下列说法中错误的是( )
A.该反应为加成反应
B.属于极性分子
C.上述反应所涉及的物质均为纯净物
D.上述反应所涉及的物质中,C原子的杂化类型为sp、、
15.由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体(晶胞为图乙)可视为Ge晶体(晶胞为图甲)中部分Ge原子被Hg和Sb取代后形成。下列说法正确的是( )
A.2号原子的坐标为
B.X晶体的化学式为
C.设Ge晶体晶胞边长为,则Ge原子之间的最短距离为
D.X晶体中与Hg最近且等距离的Sb的数目为8
二、非选择题:本题共4小题,共55分。
16.(13分)学好有机化学,从认识有机物的组成和结构开始。请用所学知识回答下列问题:
(1)某有机物R的结构简式为,该物质的名称为________(用系统命名法命名)。
(2)有机物中官能团的名称为________。
(3)和的关系为________(填“同种物质”、“同系物”或“同分异构体”)。
(4)属于________(填“烃”、“芳香烃”或“卤代烃”)。
(5)分子中最多有________个C原子共平面,最多有________个原子在同一直线上;1mol该物质与反应,最多消耗________。
17.(14分)X、Y、Z、W、R为原子序数依次增大的前四周期元素,其中X元素原子价层电子排布式为,X、Y同周期且相邻;Z、R为金属元素,其原子序数之和为41。Z、W位于同一周期,Z元素的最高价和W元素的最低价的代数和为0,R元素基态原子核外无未成对电子,且p轨道电子总数与d轨道电子总数的比值为。请回答下列问题:
(1)W元素基态原子的价层电子轨道表示式为________,R元素在周期表中的位置为________。
(2)X、Y、W最简单氢化物的熔点从大到小的顺序为________(用化学式表示),原因为________。
(3)X、W可形成一种实验室常见的非极性分子,该分子的化学式为________,写出该物质的一种用途:________。
(4)Y、Z、R三种元素的最高价氧化物对应的水化物两两之间均能反应生成盐和水,写出R的最高价氧化物对应的水化物分别与Z、Y元素的最高价氧化物对应的水化物反应的离子方程式:________、________。
18.(14分)某同学为测定有机物M(仅可能含C、H、O三种元素)的分子式,设计了如图所示的实验装置。(加热仪器略)
已知:装置C中样品M的质量为2.25g,实验结束后测得装置D增重1.35g,装置E增重5.94g(反应产物全部被吸收)。
(1)仪器a的名称是________,盛装的试剂名称为________。
(2)装置B的作用是________;装置F的作用是________。
(3)M中________(填“含”或“不含”)O元素。
(4)M的实验式为________。
(5)若想知道M的分子式,则还需要知道M的________。
19.(14分)氯化亚铜的分子式为CuCl,外观为白色或灰白色粉末,是重要的铜盐产品。某学习小组用氨性铜蚀刻液制取氯化亚铜的流程如图所示,回答下列问题。
已知:①的氨性铜蚀刻液的部分成分如表所示。
成分
1.615 0.355 4.370 8.999 2.326
②CuCl难溶于水和乙醇,易溶于浓度较大的体系()。
(1)基态铜原子的核外电子排布式为________,基态铜原子中最外层电子占据的原子轨道的电子云轮廓图为________。
(2)“还原”时加入和HCl,此时发生反应的离子方程式为________,需要严格控制HCl的量,原因是________。
(3)氯化亚铜的晶胞结构如图所示。
①距离最近且等距的数目为________,距离最近的构成了________(填空间结构名称)。
②设为阿伏加德罗常数的值,晶胞边长为,则该晶体的密度________。
高二化学试卷参考答案
1.C 2.C 3.D 4.D 5.A 6.C 7.D 8.A 9.B 10.C 11.B 12.C 13.A 14.C 15.C
16.(1)3-甲基-1,4-戊二烯(2分)
(2)碳氯键、酯基(2分)
(3)同分异构体(2分)
(4)卤代烃(1分)
(5)17(2分);6(2分);9(2分)
17.(1)(2分);第四周期第ⅡB族(2分)
(2)(2分);、HCl、均为分子晶体,可以形成分子间氢键,其熔、沸点最高,HCl的相对分子质量大于,故范德华力比甲烷大,导致HCl的熔、沸点高于(2分)
(3)(1分);灭火剂(或其他合理答案,1分)
(4)(2分);[或,2分]
18.(1)分液漏斗(2分);双氧水(2分)
(2)除去中的水蒸气(2分);防止空气中的和进入装置E(2分)
(3)含(2分)
(4)(2分)
(5)相对分子质量(2分)
19.(1)或(2分);球形(2分)
(2)(2分);防止生成,使CuCl产率下降(2分)
(3)①12(2分);正四面体(2分)
②(2分)
考生注意:
1.本试卷分选择题和非选择题两部分,共100分。考试时间75分钟。
2.请将各题答案填写在答题卡上。
3.本试卷主要考试内容:人教版选择性必修2、选择性必修3第一章至第二章第二节。
4.可能用到的相对原子质量:H1 C12 N14 O16 Na23 Mg24 Cl35.5 Cu64 Zn65
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“雨过天晴润如玉,花留水彩凝成珠。品绿评红幻万象,颖是画圣神笔图”是毛病陶瓷的诗句。我国定窑陶瓷质高形美,闻名世界。下列说法正确的是( )
A.烧制陶瓷时使用的木炭属于有机物
B.部分瓷器的青色来自瓷器中的氧化铁
C.传统陶瓷是典型的绝缘材料
D.瓷器中含有的属于分子晶体
2.下列化学用语表达正确的是( )
A.中子数为10的O原子:
B.乙醚的结构简式:
C.铵银离子的结构式:
D.环己烷的键线式:
3.下列物质的晶体熔化时,破坏的微粒间的作用力与HF完全相同的是( )
A.Ca B. C.NaCl D.
4.豆腐脑味道鲜美,营养丰富。豆腐脑中含有的大豆异黄酮是天然的癌症化学预防剂,其结构如图所示,下列有关大豆异黄酮的说法错误的是( )
A.分子式为
B.分子中所有的原子可能共平面
C.可以发生加成反应和氧化反应
D.所含的酮羰基的键角为
5.下列有关说法正确的是( )
A.H原子与O原子以构成,说明共价键具有饱和性
B.同一基态原子中高能级电子的能量一定比低能级电子的能量高
C.键的电子云重叠程度低,易断裂,所以分子中含键越多越不稳定
D.分子晶体的熔、沸点一定比共价晶体、离子晶体、金属晶体的低
6.一种新型有机-无机杂化超分子阴离子配合物材料结构如图所示,下列关于该阴离子配合物的说法错误的是( )
A.含有配位键
B.基态钴原子中未成对电子数为3
C.该阴离子配合物属于高分子化合物
D.2-氨基吡啶的沸点高于苯
7.下列说法错误的是( )
A.苯乙烯能使酸性高锰酸钾溶液褪色
B.等物质的量的乙醇和乙烯完全燃烧消耗的的质量相等
C.和属于同一种物质
D.甲酸(HCOOH)和乙二酸(HOOC-COOH)互为同系物
8.下列反应对应的离子方程式或化学方程式错误的是( )
A.向溶液中滴加KSCN溶液:
B.乙烯使溴水褪色:
C.溶液中滴加少量溶液:
D.AgCl溶于氨水:
9.下列说法中正确的是( )
A.的名称为3,4-二甲基-2-乙基戊烷
B.键角:
C.HF比HCl沸点高的原因是HF分子内存在氢键
D.、的空间结构均为平面三角形
10.胆酸是由肝合成的,随胆汁排入十二指肠内,作为消化液的组成部分之一,能促进对脂类物质的消化和吸收。当幽门功能不全时,胆酸会反流到胃内,同胃酸一起造成对胃黏膜的损伤,并引起胃痛等不适症状,因此,胆酸是引起胃黏膜损伤的化学因子之一。胆酸的结构如图所示,其分子中手性C原子数为( )
A.9 B.10 C.11 D.12
11.光触媒是一种以纳米级为代表的具有光催化功能的光半导体材料的总称。光触媒在紫外线及可见光的照射下,会产生类似光合作用的光催化反应,产生羟基自由基和活性氧,能杀灭细菌和除去环境中的有机污染物。光触媒除去甲醛的示意图如图,下列说法错误的是( )
A.和活性氧具有强氧化性
B.HCHO的电子式为
C.除甲醛步骤的反应为
D.中键与键数目之比为
12.NaH是一种无机盐。有机合成中,氢化钠主要用作强碱,能夺取很多化合物中的质子而生成相应的钠化合物,如与水反应生成NaOH与,设为阿伏加德罗常数的值,下列说法错误的是( )
A.NaH形成的晶体是离子晶体
B.NaH可以与乙醇反应产生
C.1mol氢化钠与水完全反应转移的电子数为
D.24gNaH所含电子数与24gMg原子所含电子数相同
13.聚乙炔经溴或碘掺杂之后导电性会提高到金属水平,可广泛应用于太阳能电池、半导体材料和电活性聚合物的制备,下列说法错误的是( )
A.聚乙炔分子中所有碳原子在同一直线上
B.聚乙炔能使酸性高锰酸钾溶液褪色
C.聚乙炔没有固定的熔沸点
D.聚乙炔的结构简式为
14.“点击化学”是一种简单、高效、可控和快捷的合成方法。已知“点击化学”中的一个经典反应如图所示,该反应具有快速、条件温和、对水分不敏感的特性,使其在固体推进剂中具有广阔的应用前景。下列说法中错误的是( )
A.该反应为加成反应
B.属于极性分子
C.上述反应所涉及的物质均为纯净物
D.上述反应所涉及的物质中,C原子的杂化类型为sp、、
15.由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体(晶胞为图乙)可视为Ge晶体(晶胞为图甲)中部分Ge原子被Hg和Sb取代后形成。下列说法正确的是( )
A.2号原子的坐标为
B.X晶体的化学式为
C.设Ge晶体晶胞边长为,则Ge原子之间的最短距离为
D.X晶体中与Hg最近且等距离的Sb的数目为8
二、非选择题:本题共4小题,共55分。
16.(13分)学好有机化学,从认识有机物的组成和结构开始。请用所学知识回答下列问题:
(1)某有机物R的结构简式为,该物质的名称为________(用系统命名法命名)。
(2)有机物中官能团的名称为________。
(3)和的关系为________(填“同种物质”、“同系物”或“同分异构体”)。
(4)属于________(填“烃”、“芳香烃”或“卤代烃”)。
(5)分子中最多有________个C原子共平面,最多有________个原子在同一直线上;1mol该物质与反应,最多消耗________。
17.(14分)X、Y、Z、W、R为原子序数依次增大的前四周期元素,其中X元素原子价层电子排布式为,X、Y同周期且相邻;Z、R为金属元素,其原子序数之和为41。Z、W位于同一周期,Z元素的最高价和W元素的最低价的代数和为0,R元素基态原子核外无未成对电子,且p轨道电子总数与d轨道电子总数的比值为。请回答下列问题:
(1)W元素基态原子的价层电子轨道表示式为________,R元素在周期表中的位置为________。
(2)X、Y、W最简单氢化物的熔点从大到小的顺序为________(用化学式表示),原因为________。
(3)X、W可形成一种实验室常见的非极性分子,该分子的化学式为________,写出该物质的一种用途:________。
(4)Y、Z、R三种元素的最高价氧化物对应的水化物两两之间均能反应生成盐和水,写出R的最高价氧化物对应的水化物分别与Z、Y元素的最高价氧化物对应的水化物反应的离子方程式:________、________。
18.(14分)某同学为测定有机物M(仅可能含C、H、O三种元素)的分子式,设计了如图所示的实验装置。(加热仪器略)
已知:装置C中样品M的质量为2.25g,实验结束后测得装置D增重1.35g,装置E增重5.94g(反应产物全部被吸收)。
(1)仪器a的名称是________,盛装的试剂名称为________。
(2)装置B的作用是________;装置F的作用是________。
(3)M中________(填“含”或“不含”)O元素。
(4)M的实验式为________。
(5)若想知道M的分子式,则还需要知道M的________。
19.(14分)氯化亚铜的分子式为CuCl,外观为白色或灰白色粉末,是重要的铜盐产品。某学习小组用氨性铜蚀刻液制取氯化亚铜的流程如图所示,回答下列问题。
已知:①的氨性铜蚀刻液的部分成分如表所示。
成分
1.615 0.355 4.370 8.999 2.326
②CuCl难溶于水和乙醇,易溶于浓度较大的体系()。
(1)基态铜原子的核外电子排布式为________,基态铜原子中最外层电子占据的原子轨道的电子云轮廓图为________。
(2)“还原”时加入和HCl,此时发生反应的离子方程式为________,需要严格控制HCl的量,原因是________。
(3)氯化亚铜的晶胞结构如图所示。
①距离最近且等距的数目为________,距离最近的构成了________(填空间结构名称)。
②设为阿伏加德罗常数的值,晶胞边长为,则该晶体的密度________。
高二化学试卷参考答案
1.C 2.C 3.D 4.D 5.A 6.C 7.D 8.A 9.B 10.C 11.B 12.C 13.A 14.C 15.C
16.(1)3-甲基-1,4-戊二烯(2分)
(2)碳氯键、酯基(2分)
(3)同分异构体(2分)
(4)卤代烃(1分)
(5)17(2分);6(2分);9(2分)
17.(1)(2分);第四周期第ⅡB族(2分)
(2)(2分);、HCl、均为分子晶体,可以形成分子间氢键,其熔、沸点最高,HCl的相对分子质量大于,故范德华力比甲烷大,导致HCl的熔、沸点高于(2分)
(3)(1分);灭火剂(或其他合理答案,1分)
(4)(2分);[或,2分]
18.(1)分液漏斗(2分);双氧水(2分)
(2)除去中的水蒸气(2分);防止空气中的和进入装置E(2分)
(3)含(2分)
(4)(2分)
(5)相对分子质量(2分)
19.(1)或(2分);球形(2分)
(2)(2分);防止生成,使CuCl产率下降(2分)
(3)①12(2分);正四面体(2分)
②(2分)
同课章节目录
