第一章第三节元素周期表的应用同步练习(含解析)2022——2023学年鲁科版(2019)高一化学必修第二册
文档属性
| 名称 | 第一章第三节元素周期表的应用同步练习(含解析)2022——2023学年鲁科版(2019)高一化学必修第二册 |  | |
| 格式 | zip | ||
| 文件大小 | 526.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-20 09:07:17 | ||
图片预览




文档简介
第一章第三节元素周期表的应用同步练习
2022——2023学年鲁科版(2019)高一化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列物质不与二氧化硅反应的是
A.烧碱 B.氢氟酸 C.硝酸 D.生石灰
2.短周期主族元素A、B、C、D、E、F的原子序数依次增大,A的某种核素没有中子,B、C、D、E在周期表中的相对位置如图,且四种元素原子序数之和为37。下列说法不正确的是
B C D
E
A.B的某种核素可用来判定文物的年代
B.A、C、D三种元素可组成可溶于水的盐
C.原子半径由大到小顺序:E>F>C>A
D.最简单气态氢化物的稳定性:D3.A、B均是短周期元素,它们的离子A-和B2+具有相同的核外电子层结构,下列说法正确的是
A.原子序数A>B B.离子半径A->B2+
C.原子半径A>B D.电子数A>B
4.氮族元素随原子核外电子层数的增加,下列变化规律的叙述有错误的是
A.非金属性逐渐减弱,金属性逐渐增强
B.单质的密度依次增大
C.氮、磷、砷单质的熔、沸点依次升高
D.单质与氢化合能力依次增强
5.向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL1mol·L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是
A.b曲线表示的离子方程式为:AlO+H++H2O=Al(OH)3↓
B.d和c曲线表示的离子反应是相同的
C.M点时Al(OH)3的质量等于3.9g
D.原混合溶液中的与AlO的物质的量之比为1︰2
6.砹(At)是放射性元素,它的化学性质符合卤素性质的变化规律,下列说法正确的是
A.HAt很稳定 B.AgAt易溶于水
C.砹易溶于有机溶剂 D.砹(At2)是白色固体
7.如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
下列关于元素在周期表中的位置的叙述正确的是
A.K位于元素周期表中第四周期第IIB族,属于ds区元素
B.J位于元素周期表中第四周期第IVB族,属于d区元素
C.F位于元素周期表中第三周期第IIA族,属于s区元素
D.I位于元素周期表中第三周期第VIIA族,属于ds区元素
8.下列微粒半径的比值大于1的是
A. B. C. D.
9.X、Y分别代表两种非金属元素,下列不能说明非金属性X比Y强的是
A.X的氧化物对应水化物的酸性比Y的氧化物对应水化物的酸性强
B.的还原性强于
C.X的单质能将Y的阴离子Y氧化为
D.X、Y的单质分别与化合,产物中前者的稳定性比后者强
10.下列实验或事实能证明相应结论的是
A.实验Ⅰ可验证金属性:
B.实验Ⅱ可验证金属性:
C.实验Ⅲ可验证非金属性:
D.实验W可验证非金属性:
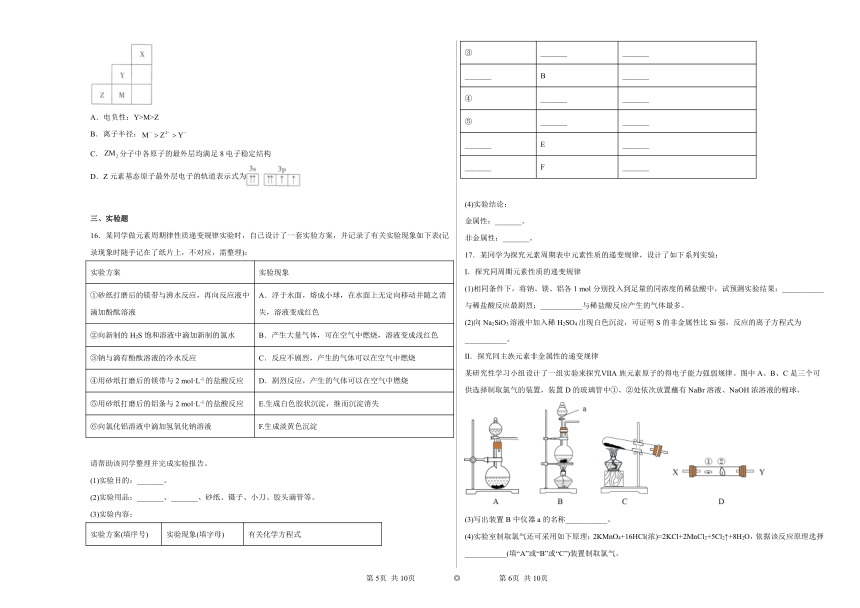
11.已知短周期元素Y、Z、M、Q和R在周期表中的相对位置如图所示,其中Y的最高化合价为+3价。下列说法错误的是
A.原子半径:Y>Z>M
B.Y与R形成的化合物属于非电解质
C.Z的氢化物常温下可能为固体
D.M最高价氧化物对应水化物能与其简单氢化物反应
12.德国制药商赫希斯特公司于1987年首次合成了罗红霉素,它一般用于治疗呼吸道、尿道和软组织感染,其化学式为。X、Y、Z、M属于四种短周期元素,原子序数依次增大,X的核外电子数是X元素主族序数的2倍;Y、Z、M为同周期相邻元素,Y元素的最高正价与最低负价的绝对值均等于主族序数,Z原子的最外层电子数是次外层电子数的2.5倍。下列说法不正确的是
A.原子半径:YB.最高价氧化物对应水化物的酸性:YC.X与M组成的化合物X2M2能用作消毒剂
D.Z、M简单离子半径:Z>M
13.已知短周期主族元素A、B、C、D、E的相对原子质量依次增大,其中D、E为金属元素,A和E的原子序数之和与B和C的原子序数之和相等,E是地壳中含量最多的金属元素。它们的原子半径和最外层电子数的大小关系如图所示。下列说法正确的是
A.B与C的简单氢化物的稳定性:
B.C、D、E的简单离子的半径大小关系:
C.A、D均能和C形成两种化合物
D.B与E的最高价氧化物对应的水化物能发生化学反应
二、多选题
14.X、Y、Z、M是四种短周期主族元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比X原子的少1。M是同周期主族元素中半径最大的。下列说法错误的是
A.X、Y、Z的最简单氢化物中,X的最简单氢化物沸点最高
B.四种元素简单离子的半径大小为Y>X>Z>M
C.Y的最高价氧化物对应水化物的化学式可表示为HYO3
D.X、Y、M可以组成多种化合物
15.如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是
A.电负性:Y>M>Z
B.离子半径:
C.分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子的轨道表示式为
三、实验题
16.某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在了纸片上,不对应,需整理):
实验方案 实验现象
①砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞溶液 A.浮于水面,熔成小球,在水面上无定向移动并随之消失,溶液变成红色
②向新制的H2S饱和溶液中滴加新制的氯水 B.产生大量气体,可在空气中燃烧,溶液变成浅红色
③钠与滴有酚酞溶液的冷水反应 C.反应不剧烈,产生的气体可以在空气中燃烧
④用砂纸打磨后的镁带与2 mol·L-1的盐酸反应 D.剧烈反应,产生的气体可以在空气中燃烧
⑤用砂纸打磨后的铝条与2 mol·L-1的盐酸反应 E.生成白色胶状沉淀,继而沉淀消失
⑥向氯化铝溶液中滴加氢氧化钠溶液 F.生成淡黄色沉淀
请帮助该同学整理并完成实验报告。
(1)实验目的:_______。
(2)实验用品:_______、_______、砂纸、镊子、小刀、胶头滴管等。
(3)实验内容:
实验方案(填序号) 实验现象(填字母) 有关化学方程式
③ _______ _______
_______ B _______
④ _______ _______
⑤ _______ _______
_______ E _______
_______ F _______
(4)实验结论:
金属性:_______。
非金属性:_______。
17.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
Ⅰ.探究同周期元素性质的递变规律
(1)相同条件下,将钠、镁、铝各1 mol分别投入到足量的同浓度的稀盐酸中,试预测实验结果:___________与稀盐酸反应最剧烈;___________与稀盐酸反应产生的气体最多。
(2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀,可证明S的非金属性比Si强,反应的离子方程式为___________。
Ⅱ.探究同主族元素非金属性的递变规律
某研究性学习小组设计了一组实验来探究ⅦA族元素原子的得电子能力强弱规律。图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①、②处依次放置蘸有NaBr溶液、NaOH浓溶液的棉球。
(3)写出装置B中仪器a的名称___________。
(4)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,依据该反应原理选择___________(填“A”或“B”或“C”)装置制取氯气。
(5)反应装置的导气管连接装置D的X导管,①处发生反应的离子方程式为:___________。②处发生反应的离子方程式为:___________。
18.某研究性学习小组设计了几组实验验证元素周期律。
Ⅰ.探究碱金属元素性质的递变规律
(1)实验用品:玻璃管(直径6~10mm,长100mm)、试管夹、小刀、镊子、滤纸、钾粒、钠粒、玻璃棒、酒精灯、火柴、洗耳球等。
(2)实验时,加热玻璃管至其中的钠粒(钾粒)熔化后,立即用洗耳球向玻璃管内鼓入空气,可以观察到玻璃管内的钠(钾)粒燃烧,且________比________燃烧更剧烈。
(3)从该实验中获得的结论是________________________。
Ⅱ.探究同周期主族元素金属性的强弱规律
(4)甲同学想验证同周期主族元素金属性强弱规律,最好选用第________周期的________(填元素符号)三种元素。请设计最简单的实验进行验证,并说明分别观察到的现象:
①________________________________________________________________;
②________________________________________________________________;
其理论解释是______________________________________________________。
这三种元素最高价氧化物的水化物的碱性强弱顺序为________________(填化学式)。
Ⅲ.探究同一主族元素性质的递变规律
(5)实验内容(在表中横线处填写相关内容):
序号 实验方案 实验现象
① 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再加入少量四氯化碳,振荡后静置 液体分为两层,下层呈________色
② 向盛有少量碘化钠溶液的试管中滴加少量新制的溴水振荡,再加入少量四氯化碳,振荡后静置 液体分为两层,下层呈________色
(6)实验结论:________________________________________。
(7)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为________________、________________。
②请用本单元所学内容简单说明得出上述结论的原因:_________________________________。
四、工业流程题
19.光纤通讯是光导纤维传送信号的一种通讯手段,氮化硅是一种优良的高温结构陶瓷,可用于火箭发动机和高温电极材料。合成光导纤维及氮化硅的工艺流程如下:
回答下列问题:
(1)反应Ⅰ的化学方程式为___________,氧化剂为___________(填化学式)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 SiCl4 SiHCl3 SiH2Cl2 HCl BCl3 PCl3
质量分数 0.545 0.405 0.046 2 0.000 3 0.001 93 0.001 57
沸点/℃ 57.6 31.8 8.2 -85 12.5 75.5
图中“操作X”的名称为___________。
(3)反应Ⅲ和Ⅳ中尾气的用途为___________;反应Ⅳ的化学方程式为___________。
20.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的通常有两种工艺。因向铝土矿中加入NaOH时形成的赤泥(残渣)中常含有铝硅酸钠,故流程乙常处理SiO2含量小于8%的铝土矿,若SiO2含量较高则可采用流程甲来处理。
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_______。
(2)流程乙加入烧碱后生成SiO的离子方程式为_______。
(3)流程甲滤液D中通入过量CO2的化学方程式为_______。
(4)“通入过量CO2”能否改用盐酸_______,原因是_______。
(5)滤液E、K中溶质的主要成分是_______(填化学式),写出该溶质的一种用途_______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.SiO2和烧碱反应生成硅酸钠和氢气,故A不选;
B.SiO2和氢氟酸反应生成SiF4和水,故B不选;
C.硝酸不与SiO2反应,故C不选;
D.SiO2和生石灰反应生成硅酸钙,故D不选;
故选C。
2.D
【分析】A的某种核素没有中子,故A为H元素;全部为短周期元素,根据图示位置关系,B 、C、 D第二周期,E、F为第三周期,且D、E同族。B、 C、 D、 E四种元素原子序数之和为37,则设D的原子序数为x,则x-2+x-1+x+x+8=37,则x=8,故B为C元素,C为N元素,D为O元素,E为S元素,都为主族元素,所以F为Cl元素;
【详解】A.B元素为碳,含碳的化合物在自然界中种类最多,A正确;
B.A、C、D三元素可组成化合物硝酸铵,可溶于水,B正确;
C.E、F第三周期,C为第二周期,A为第一周期,周期数越大,电子层数越多,半径越大,故,E、F半径大于C,C半径大于A;E、F同周期且F原子序数大于E,从左至右,原子半径依次减小,因此E半径大于F;所以原子半径由大到小顺序:E>F>C>A,C正确;
D.非金属性:D>E,非金属越强,气态氢化物的稳定性越强,因此氢化物的稳定性:D>E,D错误;
故选D。
3.B
【分析】A和B是短周期的元素,它们的离子A-和B2+有相同的电子层结构,则其核外电子数相同,所以原子序数是A<B,且B位于A的下一周期;
【详解】A.B的原子序数=离子核外电子数+2、A的原子序数=离子核外电子数-1,两种离子核外电子数相等,所以原子序数AB.电子层结构相同的离子,离子半径随着原子序数增大而减小,则两种离子半径:A->B2+,故B正确;
C.B位于A下一周期,B原子核外电子层数大于A,原子半径:AD.A原子电子数=离子核外电子数-1、B原子核外电子数=离子核外电子数+2,两种离子核外电子数相等,所以原子核外电子数:A故选B。
4.D
【详解】A.同主族元素从上到下,非金属性逐渐减弱,金属性逐渐增强,故A正确;
B.单质的密度依次增大,故B正确;
C.氮、磷、砷都是非金属元素,单质由分子构成,相对分子质量逐渐增大,熔沸点逐渐升高,故C正确;
D.同主族元素从上到下,非金属性逐渐减弱,单质与氢化合能力依次减弱,故D错误;
选D。
5.C
【分析】Na2CO3、NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO+H++H2O═Al(OH)3↓,a线表示AlO减少;第二阶段,AlO反应完毕,发生反应CO+H+═HCO,b线表示CO减少,c线表示HCO的增加;第三阶段,CO反应完毕,发生反应HCO+H+═CO2↑+H2O,d线表示HCO减少,此阶段Al(OH)3不参与反应。
【详解】A.由分析可知,b曲线表示的离子方程式为:CO+H+═HCO,A错误;
B.由分析可知,d和c曲线表示的离子反应是不相同的,B错误;
C.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)=0.05mol,m[Al(OH)3]=0.05mol×78g/mol=3.9g,C正确;
D.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO+H+═HCO3-,可知CO与AlO的物质的量之比为1:1,D错误;
故选C。
6.C
【分析】砹(At)为第六周期第ⅦA族元素;
【详解】A.卤族元素随着原子半径增大,卤化氢的稳定性减弱,Hat不稳定,A错误;
B.氟化银到碘化银溶解性减小,则AgAt难溶于水,B错误;
C.同主族由上而下,溴、碘易溶于有机溶剂,则砹易溶于有机溶剂,C正确;
D.同主族由上而下,卤素单质颜色变深,砹(At2)不是白色固体,D错误;
故选C。
7.C
【分析】根据图中元素周期表可知,A为Li,B为Be,C为C,D为N,E为Na,F为Mg,G为Al,H为S,I为Cl,J为Cr,K为Cu,M为Br,L为Ba。
【详解】A.K位于元素周期表中第四周期第ⅠB族,属于ds区元素,A错误;
B.J位于元素周期表中第四周期第ⅥB族,属于d区元素,B错误;
C.F位于元素周期表中第三周期第ⅡA族,属于s区元素,C正确;
D.I位于元素周期表中第三周期第ⅦA族,属于p区元素,D错误;
故答案选C。
8.B
【详解】A.和的核外均有一个电子层,但的核电荷数大,故半径更小,A错误;
B.和Cl的核外均有3个电子层,且核内均有17个质子,但的核外电子数多于Cl,故半径更大,B正确;
C.和的核外均有2个电子层,但的核电荷数更大,故半径更小,C错误;
D.的核外有2个电子层,而的核外有3个电子层,故的半径更大,D错误;
答案选B。
9.A
【详解】A.元素非金属性强弱可由最高价氧化物对应水化物的酸性强弱来判断,选项中没有指明是否是最高价氧化物,无法判断非金属性强弱,A正确;
B.元素非金属性越弱,其离子的还原性越强,B错误;
C.单质能与发生置换反应生成,说明非金属性:,C错误:
D.单质与化合,根据产物的稳定性可知非金属性:,D错误;
故答案选A。
10.D
【详解】A.验证元素的金属性的强弱,可由金属单质与酸反应置换出氢气的难易程度来判断,而不是与溶液反应,故A不符合题意;
B.的金属性强于,故B不符合题意;
C.与溶液反应生成溴,使左侧棉球变为橙色,未反应的继续与溶液反应置换出,使右侧棉球变为蓝色,能证明非金属性:,但不能证明非金属性:,故C不符合题意;
D.实验Ⅳ可证明酸性,这三种酸为的最高价氧化物对应的水化物,故能验证非金属性:,故D符合题意;
故答案选D。
11.B
【分析】由题图可知Z、M为第二周期元素,其他为第三周期元素。由Y的最高化合价为价,可知Y为Al元素,结合元素在周期表中的位置可确定Z为C、M为N、Q为S、R为Cl元素。
【详解】A.同周期从左到右原子半径减小,同主族从上到下原子半径增大,结合三种元素在周期表中的位置可确定原子半径:Al>C>N,A正确;
B.AlCl3在溶液中能导电,属于电解质,B错误;
C.碳元素的氢化物可能是气体、液体或固体,C正确;
D.HNO3能与NH3反应生成NH4NO3,D正确;
故选:B。
12.A
【分析】根据X的核外电子数是X元素主族序数的2倍,可推知X为H元素;由Z原子的最外层电子数是次外层电子数的2.5倍,可推知Z为N元素;由Y、Z、M为同周期相邻元素,Y元素的最高正价与最低负价的绝对值均等于主族序数,可推知Y为C元素、M为O元素。
【详解】A.同周期主族元素从左到右原子半径依次减小,则原子半径:,A错误;
B.非金属性:,则最高价氧化物对应水化物的酸性:,B正确;
C.具有强氧化性,可用于杀菌、消毒,C正确;
D.核外电子排布相同的离子,核电荷数小的半径大,故离子半径:,D正确;
故选A。
13.C
【分析】判断原子半径、最外层电子数时,要从正五边形到顶点的距离大小来判断,从原子半径图可以看出,原子半径:,结合最外层电子数:,可知A为H元素,D为Na元素,A和E的原子序数之和与B和C的原子序数之和相等,E是地壳中含量最多的金属元素,可知E为Al元素,结合最外层电子数可知B为C元素,C为O元素,据此解答。
【详解】A.非金属性:,非金属性越强,简单氢化物越稳定,简单氢化物的稳定性:,A项错误;
B.C、D、E的简单离子分别为,三种离子的核外电子排布相同,核电荷数大的半径小,所以半径:,B项错误
C.A与C可形成和两种化合物,D与C可形成和两种化合物,C项正确;
D.B和E的最高价氧化物的水化物分别为,不能与发生反应,D项错误;
答案选C。
14.BC
【分析】X、Y、Z、M是4种短周期元素,X原子最外层电子数是其电子层数的3倍,X原子有2个电子层,最外层电子数为6,则X为O元素,X、Y位于同一主族,则Y为S元素;Z原子的核外电子数比X原子少1,又X与Z位于同一周期,则Z为N元素;M是同周期中半径最大的元素,应处于IA族元素,由Y与M同一周期,则M为Na元素。
【详解】根据上述分析可知,X、Y、Z、M分别是O、S、N和Na,则
A.X为O元素,H2O常温下为液体,而氨气、硫化氢为气态,故水的沸点最高,A正确;
B.离子的核外电子层数越多半径越大,S2-半径最大,Na+、O2-、N3-核外电子排布相同,其核电核数越大,离子半径越小,则四种元素简单离子的半径由大到小依次为Y(S2-)>Z(N3-)>X(O2-)>M(Na+),B错误;
C.S的最高价氧化物对应水化物的化学式为H2SO4,C错误;
D.O、S、Na可以组成Na2SO4、Na2SO3等化合物,D正确。
答案选BC。
15.AC
【分析】题图为元素周期表中短周期的一部分,由X、Y、Z、M在周期表中的位置关系可知,X为He元素,Y为F元素,M为Cl元素,Z为S元素。
【详解】A.同周期元素自左而右非金属性增强,同主族元素自上而下非金属性减弱,非金属性,故电负性,A正确;
B.电子层数相同,核电荷数越大离子半径越小,电子层数不同时,电子层越多离子半径越大,离子半径:,B错误;
C.为,分子中S元素化合价为价,,S原子最外层满足8电子稳定结构,Cl元素化合价为价,,Cl原子最外层满足8电子稳定结构,C正确;
D.Z为S元素,最外层有6个电子,其基态原子的最外层电子的轨道表示式为,D错误;
故答案选AC。
16. 验证Na、Mg、Al元素从左到右金属性递减,S、Cl元素从左到右非金属性递增的规律 试管 酒精灯 A ① D C ⑥ 、 ② Na>Mg>Al S【详解】(1)①③实验对比可得金属性:Na>Mg;②Cl2能从H2S中置换出硫,可得非金属性:Cl>S;④⑤实验对比可得金属性:Mg>Al,因此实验目的为验证Na、Mg、Al元素从左到右金属性递减,S、Cl元素从左到右非金属性递增的规律;
(2)分析实验可知,需要用到的仪器有试管、酒精灯、砂纸、镊子、小刀、胶头滴管等;
(3)实验内容:
③钠与水反应生成氢氧化钠与氢气,与滴有酚酞溶液的冷水反应现象为钠浮于水面,熔成小球,在水面上无定向移动并随之消失,溶液变成红色,选A;反应的化学方程式为;
B.现象为产生大量气体,可在空气中燃烧,溶液变成浅红色,应是镁条与滴有酚酞的热水反应生成氢氧化镁和氢气的现象,答案选①;反应的化学方程式为;
④用砂纸打磨后的镁带与2 mol·L-1的盐酸反应生成氯化镁和氢气,反应现象比镁与热水反应剧烈,现象为剧烈反应,产生的气体可以在空气中燃烧,选D;反应的化学方程式为;
⑤用砂纸打磨后的铝条与2 mol·L-1的盐酸反应生成氯化铝和氢气,铝没有镁活泼,没有④剧烈,现象为反应不剧烈,产生的气体可以在空气中燃烧,选C;反应的化学方程式为;
E.现象为生成白色胶状沉淀,继而沉淀消失,是可溶性铝盐中滴加强碱生成氢氧化铝、继而氢氧化铝溶于氢氧化钠的现象,选⑥;反应的化学方程式为、;
F.生成淡黄色沉淀,该淡黄色沉淀应为硫单质,因此该现象为置换出硫单质的反应的现象,选②;反应的化学方程式为;
(4)同周期从左往右金属性减弱,非金属性增强,因此有:
金属性:Na>Mg>Al;
非金属性:S17. 钠 铝 +2H+=H2SiO3↓ 分液漏斗 A C12+2Br﹣=2Cl﹣+Br2 Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
【分析】I.(1)金属性Na>Mg>Al,金属越活泼,与酸反应越剧烈,均1mol时Al失去电子最多; (2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀生成硅酸,利用强酸制弱酸;
Ⅱ.实验室制备氯气可用二氧化锰和浓盐酸在加热条件下反应,也可用高锰酸钾与浓盐酸反应制备,反应较为剧烈,无需加热即可进行,氯气具有强氧化性,能与NaBr溶液发生置换反应生成单质Br2,氯气有毒,用碱吸收,在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
【详解】I.(1)金属活泼性顺序为:钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钠;生成1mol氢气需要得到2mol电子,1mol钠失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,故答案为:钠;铝;
(2) 利用强酸制弱酸,向Na2SiO3溶液中加入稀H2SO4出现白色沉淀生成硅酸,离子方程式为:+2H+=H2SiO3↓;故答案为:+2H+=H2SiO3↓;
Ⅱ.(3)装置B中仪器a的名称为分液漏斗,故答案为:分液漏斗;
(4)高锰酸钾与浓盐酸反应较为剧烈,无需加热即可进行,是固体和液体不加热制备气体装置,选择A,故答案为:A;
(5)①氯气与NaBr溶液反应生成Br2,反应的离子方程式为Cl2+2Br-=2Cl-+Br2,故答案为:C12+2Br-=2Cl-+Br2;
②氯气在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。
18. 钾粒 钠粒 K的金属性强于Na 三 Na、Mg、Al 取大小相同的三小粒金属分别投入蒸馏水中,Na剧烈反应,而Mg、Al无明显现象 取大小相同的镁块和铝块分别投入相同浓度的稀盐酸中,Mg反应较剧烈,产生大量气泡; Al反应比Mg缓慢,有较多的气泡产生同周期主族元素从左到右,原子半径逐渐减小,核电荷数逐渐增多,原子核对最外层电子的吸引力逐渐增大,原子失电子能力逐渐减弱,故金属性逐渐减弱 橙红 紫红 同一主族元素从上到下元素原子的得电子能力逐渐减弱 同一主族元素,各元素原子的最外层电子数相同,从上到下,电子层数依次增多,原子半径依次增大,原子得电子能力逐渐减弱
【详解】Ⅰ.(2)根据实验目的,将处理好的Na、K放在玻璃管内加热并用洗耳球向玻璃管内鼓入空气,观察现象来判断反应的剧烈程度,从而得出Na、K金属性的相对强弱。由于Na、K同主族,K的原子半径大于Na,K在反应中更易失电子,金属性更强,燃烧更为剧烈,故答案为:钾粒;钠粒;
(3)K反应更剧烈,说明K的金属性强于Na,故答案为:K的金属性强于Na;
Ⅱ.(4)由于第周期元素的代表性强且Na、Mg、Al等单质是实验室中的常见药品、实验易操作、现象明显,所以选择第三周期的Na、Mg、Al与水或盐酸反应来探究同周期主族元素的性质递变规律;Na、Mg、Al同周期,随着原子序数的递增,原子半径逐渐减小,原子失电子能力逐渐减弱,其单质与水或盐酸反应的能力也逐渐减弱,从而证明它们的金属性逐渐减弱,故答案为:三;Na、Mg、Al;取大小相同的三小粒金属分别投入蒸馏水中,Na剧烈反应,而Mg、Al无明显现象;取大小相同的镁块和铝块分别投入相同浓度的稀盐酸中,Mg反应较剧烈,产生大量气泡;Al反应比Mg缓慢,有较多的气泡产生同周期主族元素从左到右,原子半径逐渐减小,核电荷数逐渐增多,原子核对最外层电子的吸引力逐渐增大,原子失电子能力逐渐减弱,故金属性逐渐减弱;
Ⅲ.(5)向NaBr溶液中加入新制的氯水,发生反应,证明氧化性;再加入后振荡静置,液体分层,上层接近无色,下层呈橙红色。向NaI溶液中加入新制的溴水,发生反应,证明氧化性;再加入后,振荡静置,液体分层,上层接近无色,下层呈紫红色。两个实验说明:同一主族元素从上到下元素原子的得电子能力逐渐减弱,故答案为:橙红;紫红;
(6)由(5)可知答案为:同一主族元素从上到下元素原子的得电子能力逐渐减弱;
(7)由(5)可知答案为:;;同一主族元素,各元素原子的最外层电子数相同,从上到下,电子层数依次增多,原子半径依次增大,原子得电子能力逐渐减弱。
19.(1) SiO2+2CSi+2CO↑ SiO2
(2)精馏(或蒸馏)
(3) 制取盐酸(或其他合理答案) 3SiCl4+4NH3Si3N4+12HCl
【分析】石英砂的主要成分是SiO2,和焦炭反应生成粗硅和CO,粗硅和氯气反应生成SiCl4,生成的SiCl4可以用来制光导纤维,也可以和氨气反应得到Si3N4。
(1)
反应I是二氧化硅与焦炭反应生成硅,化学方程式为SiO2+2CSi+2CO↑,氧化剂为SiO2;
(2)
根据表格数据,多种杂质的沸点不同,图中“操作X”的名称为蒸馏;
(3)
反应III和IV均有氯化氢生成,可以用来制取盐酸;反应IV的化学方程式为3SiCl4+4NH3Si3N4+12HCl。
20. Al2O3+ 6H+= 2Al3++ 3H2O SiO2+2OH-= SiO+ H2O NaA1O2+CO2+2H2O=A1(OH)3↓+NaHCO3 不能 A1(OH)3沉淀会溶于过量的盐酸中 NaHCO3 制纯碱或做发酵粉等
【分析】由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3。
【详解】(1)Al2O3与盐酸反应生成氯化铝和水,氧化物不能拆,离子方程式为:Al2O3+6H+═2Al3++3H2O;
(2)二氧化硅与氢氧化钠反应生成硅酸钠和水,二氧化硅不能拆,故离子反应方程式为:SiO2+2OH-= SiO+ H2O;
(3)流程甲滤液D含有偏铝酸钠,通入过量CO2反应生成氢氧化铝沉淀,反应的化学方程式为NaA1O2+CO2+2H2O=A1(OH)3↓+NaHCO3;
(4)“通入过量CO2”不能改用盐酸,因为A1(OH)3沉淀会溶于过量的盐酸中;
(5)由分析可知滤液E、K中溶质的主要成分是NaHCO3,NaHCO3用途有制纯碱或做发酵粉等。
答案第1页,共2页
答案第1页,共2页
2022——2023学年鲁科版(2019)高一化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列物质不与二氧化硅反应的是
A.烧碱 B.氢氟酸 C.硝酸 D.生石灰
2.短周期主族元素A、B、C、D、E、F的原子序数依次增大,A的某种核素没有中子,B、C、D、E在周期表中的相对位置如图,且四种元素原子序数之和为37。下列说法不正确的是
B C D
E
A.B的某种核素可用来判定文物的年代
B.A、C、D三种元素可组成可溶于水的盐
C.原子半径由大到小顺序:E>F>C>A
D.最简单气态氢化物的稳定性:D
A.原子序数A>B B.离子半径A->B2+
C.原子半径A>B D.电子数A>B
4.氮族元素随原子核外电子层数的增加,下列变化规律的叙述有错误的是
A.非金属性逐渐减弱,金属性逐渐增强
B.单质的密度依次增大
C.氮、磷、砷单质的熔、沸点依次升高
D.单质与氢化合能力依次增强
5.向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL1mol·L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是
A.b曲线表示的离子方程式为:AlO+H++H2O=Al(OH)3↓
B.d和c曲线表示的离子反应是相同的
C.M点时Al(OH)3的质量等于3.9g
D.原混合溶液中的与AlO的物质的量之比为1︰2
6.砹(At)是放射性元素,它的化学性质符合卤素性质的变化规律,下列说法正确的是
A.HAt很稳定 B.AgAt易溶于水
C.砹易溶于有机溶剂 D.砹(At2)是白色固体
7.如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
下列关于元素在周期表中的位置的叙述正确的是
A.K位于元素周期表中第四周期第IIB族,属于ds区元素
B.J位于元素周期表中第四周期第IVB族,属于d区元素
C.F位于元素周期表中第三周期第IIA族,属于s区元素
D.I位于元素周期表中第三周期第VIIA族,属于ds区元素
8.下列微粒半径的比值大于1的是
A. B. C. D.
9.X、Y分别代表两种非金属元素,下列不能说明非金属性X比Y强的是
A.X的氧化物对应水化物的酸性比Y的氧化物对应水化物的酸性强
B.的还原性强于
C.X的单质能将Y的阴离子Y氧化为
D.X、Y的单质分别与化合,产物中前者的稳定性比后者强
10.下列实验或事实能证明相应结论的是
A.实验Ⅰ可验证金属性:
B.实验Ⅱ可验证金属性:
C.实验Ⅲ可验证非金属性:
D.实验W可验证非金属性:
11.已知短周期元素Y、Z、M、Q和R在周期表中的相对位置如图所示,其中Y的最高化合价为+3价。下列说法错误的是
A.原子半径:Y>Z>M
B.Y与R形成的化合物属于非电解质
C.Z的氢化物常温下可能为固体
D.M最高价氧化物对应水化物能与其简单氢化物反应
12.德国制药商赫希斯特公司于1987年首次合成了罗红霉素,它一般用于治疗呼吸道、尿道和软组织感染,其化学式为。X、Y、Z、M属于四种短周期元素,原子序数依次增大,X的核外电子数是X元素主族序数的2倍;Y、Z、M为同周期相邻元素,Y元素的最高正价与最低负价的绝对值均等于主族序数,Z原子的最外层电子数是次外层电子数的2.5倍。下列说法不正确的是
A.原子半径:Y
D.Z、M简单离子半径:Z>M
13.已知短周期主族元素A、B、C、D、E的相对原子质量依次增大,其中D、E为金属元素,A和E的原子序数之和与B和C的原子序数之和相等,E是地壳中含量最多的金属元素。它们的原子半径和最外层电子数的大小关系如图所示。下列说法正确的是
A.B与C的简单氢化物的稳定性:
B.C、D、E的简单离子的半径大小关系:
C.A、D均能和C形成两种化合物
D.B与E的最高价氧化物对应的水化物能发生化学反应
二、多选题
14.X、Y、Z、M是四种短周期主族元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比X原子的少1。M是同周期主族元素中半径最大的。下列说法错误的是
A.X、Y、Z的最简单氢化物中,X的最简单氢化物沸点最高
B.四种元素简单离子的半径大小为Y>X>Z>M
C.Y的最高价氧化物对应水化物的化学式可表示为HYO3
D.X、Y、M可以组成多种化合物
15.如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是
A.电负性:Y>M>Z
B.离子半径:
C.分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子的轨道表示式为
三、实验题
16.某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在了纸片上,不对应,需整理):
实验方案 实验现象
①砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞溶液 A.浮于水面,熔成小球,在水面上无定向移动并随之消失,溶液变成红色
②向新制的H2S饱和溶液中滴加新制的氯水 B.产生大量气体,可在空气中燃烧,溶液变成浅红色
③钠与滴有酚酞溶液的冷水反应 C.反应不剧烈,产生的气体可以在空气中燃烧
④用砂纸打磨后的镁带与2 mol·L-1的盐酸反应 D.剧烈反应,产生的气体可以在空气中燃烧
⑤用砂纸打磨后的铝条与2 mol·L-1的盐酸反应 E.生成白色胶状沉淀,继而沉淀消失
⑥向氯化铝溶液中滴加氢氧化钠溶液 F.生成淡黄色沉淀
请帮助该同学整理并完成实验报告。
(1)实验目的:_______。
(2)实验用品:_______、_______、砂纸、镊子、小刀、胶头滴管等。
(3)实验内容:
实验方案(填序号) 实验现象(填字母) 有关化学方程式
③ _______ _______
_______ B _______
④ _______ _______
⑤ _______ _______
_______ E _______
_______ F _______
(4)实验结论:
金属性:_______。
非金属性:_______。
17.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
Ⅰ.探究同周期元素性质的递变规律
(1)相同条件下,将钠、镁、铝各1 mol分别投入到足量的同浓度的稀盐酸中,试预测实验结果:___________与稀盐酸反应最剧烈;___________与稀盐酸反应产生的气体最多。
(2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀,可证明S的非金属性比Si强,反应的离子方程式为___________。
Ⅱ.探究同主族元素非金属性的递变规律
某研究性学习小组设计了一组实验来探究ⅦA族元素原子的得电子能力强弱规律。图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①、②处依次放置蘸有NaBr溶液、NaOH浓溶液的棉球。
(3)写出装置B中仪器a的名称___________。
(4)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,依据该反应原理选择___________(填“A”或“B”或“C”)装置制取氯气。
(5)反应装置的导气管连接装置D的X导管,①处发生反应的离子方程式为:___________。②处发生反应的离子方程式为:___________。
18.某研究性学习小组设计了几组实验验证元素周期律。
Ⅰ.探究碱金属元素性质的递变规律
(1)实验用品:玻璃管(直径6~10mm,长100mm)、试管夹、小刀、镊子、滤纸、钾粒、钠粒、玻璃棒、酒精灯、火柴、洗耳球等。
(2)实验时,加热玻璃管至其中的钠粒(钾粒)熔化后,立即用洗耳球向玻璃管内鼓入空气,可以观察到玻璃管内的钠(钾)粒燃烧,且________比________燃烧更剧烈。
(3)从该实验中获得的结论是________________________。
Ⅱ.探究同周期主族元素金属性的强弱规律
(4)甲同学想验证同周期主族元素金属性强弱规律,最好选用第________周期的________(填元素符号)三种元素。请设计最简单的实验进行验证,并说明分别观察到的现象:
①________________________________________________________________;
②________________________________________________________________;
其理论解释是______________________________________________________。
这三种元素最高价氧化物的水化物的碱性强弱顺序为________________(填化学式)。
Ⅲ.探究同一主族元素性质的递变规律
(5)实验内容(在表中横线处填写相关内容):
序号 实验方案 实验现象
① 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再加入少量四氯化碳,振荡后静置 液体分为两层,下层呈________色
② 向盛有少量碘化钠溶液的试管中滴加少量新制的溴水振荡,再加入少量四氯化碳,振荡后静置 液体分为两层,下层呈________色
(6)实验结论:________________________________________。
(7)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为________________、________________。
②请用本单元所学内容简单说明得出上述结论的原因:_________________________________。
四、工业流程题
19.光纤通讯是光导纤维传送信号的一种通讯手段,氮化硅是一种优良的高温结构陶瓷,可用于火箭发动机和高温电极材料。合成光导纤维及氮化硅的工艺流程如下:
回答下列问题:
(1)反应Ⅰ的化学方程式为___________,氧化剂为___________(填化学式)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 SiCl4 SiHCl3 SiH2Cl2 HCl BCl3 PCl3
质量分数 0.545 0.405 0.046 2 0.000 3 0.001 93 0.001 57
沸点/℃ 57.6 31.8 8.2 -85 12.5 75.5
图中“操作X”的名称为___________。
(3)反应Ⅲ和Ⅳ中尾气的用途为___________;反应Ⅳ的化学方程式为___________。
20.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的通常有两种工艺。因向铝土矿中加入NaOH时形成的赤泥(残渣)中常含有铝硅酸钠,故流程乙常处理SiO2含量小于8%的铝土矿,若SiO2含量较高则可采用流程甲来处理。
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_______。
(2)流程乙加入烧碱后生成SiO的离子方程式为_______。
(3)流程甲滤液D中通入过量CO2的化学方程式为_______。
(4)“通入过量CO2”能否改用盐酸_______,原因是_______。
(5)滤液E、K中溶质的主要成分是_______(填化学式),写出该溶质的一种用途_______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.SiO2和烧碱反应生成硅酸钠和氢气,故A不选;
B.SiO2和氢氟酸反应生成SiF4和水,故B不选;
C.硝酸不与SiO2反应,故C不选;
D.SiO2和生石灰反应生成硅酸钙,故D不选;
故选C。
2.D
【分析】A的某种核素没有中子,故A为H元素;全部为短周期元素,根据图示位置关系,B 、C、 D第二周期,E、F为第三周期,且D、E同族。B、 C、 D、 E四种元素原子序数之和为37,则设D的原子序数为x,则x-2+x-1+x+x+8=37,则x=8,故B为C元素,C为N元素,D为O元素,E为S元素,都为主族元素,所以F为Cl元素;
【详解】A.B元素为碳,含碳的化合物在自然界中种类最多,A正确;
B.A、C、D三元素可组成化合物硝酸铵,可溶于水,B正确;
C.E、F第三周期,C为第二周期,A为第一周期,周期数越大,电子层数越多,半径越大,故,E、F半径大于C,C半径大于A;E、F同周期且F原子序数大于E,从左至右,原子半径依次减小,因此E半径大于F;所以原子半径由大到小顺序:E>F>C>A,C正确;
D.非金属性:D>E,非金属越强,气态氢化物的稳定性越强,因此氢化物的稳定性:D>E,D错误;
故选D。
3.B
【分析】A和B是短周期的元素,它们的离子A-和B2+有相同的电子层结构,则其核外电子数相同,所以原子序数是A<B,且B位于A的下一周期;
【详解】A.B的原子序数=离子核外电子数+2、A的原子序数=离子核外电子数-1,两种离子核外电子数相等,所以原子序数A
C.B位于A下一周期,B原子核外电子层数大于A,原子半径:A
4.D
【详解】A.同主族元素从上到下,非金属性逐渐减弱,金属性逐渐增强,故A正确;
B.单质的密度依次增大,故B正确;
C.氮、磷、砷都是非金属元素,单质由分子构成,相对分子质量逐渐增大,熔沸点逐渐升高,故C正确;
D.同主族元素从上到下,非金属性逐渐减弱,单质与氢化合能力依次减弱,故D错误;
选D。
5.C
【分析】Na2CO3、NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO+H++H2O═Al(OH)3↓,a线表示AlO减少;第二阶段,AlO反应完毕,发生反应CO+H+═HCO,b线表示CO减少,c线表示HCO的增加;第三阶段,CO反应完毕,发生反应HCO+H+═CO2↑+H2O,d线表示HCO减少,此阶段Al(OH)3不参与反应。
【详解】A.由分析可知,b曲线表示的离子方程式为:CO+H+═HCO,A错误;
B.由分析可知,d和c曲线表示的离子反应是不相同的,B错误;
C.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)=0.05mol,m[Al(OH)3]=0.05mol×78g/mol=3.9g,C正确;
D.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO+H+═HCO3-,可知CO与AlO的物质的量之比为1:1,D错误;
故选C。
6.C
【分析】砹(At)为第六周期第ⅦA族元素;
【详解】A.卤族元素随着原子半径增大,卤化氢的稳定性减弱,Hat不稳定,A错误;
B.氟化银到碘化银溶解性减小,则AgAt难溶于水,B错误;
C.同主族由上而下,溴、碘易溶于有机溶剂,则砹易溶于有机溶剂,C正确;
D.同主族由上而下,卤素单质颜色变深,砹(At2)不是白色固体,D错误;
故选C。
7.C
【分析】根据图中元素周期表可知,A为Li,B为Be,C为C,D为N,E为Na,F为Mg,G为Al,H为S,I为Cl,J为Cr,K为Cu,M为Br,L为Ba。
【详解】A.K位于元素周期表中第四周期第ⅠB族,属于ds区元素,A错误;
B.J位于元素周期表中第四周期第ⅥB族,属于d区元素,B错误;
C.F位于元素周期表中第三周期第ⅡA族,属于s区元素,C正确;
D.I位于元素周期表中第三周期第ⅦA族,属于p区元素,D错误;
故答案选C。
8.B
【详解】A.和的核外均有一个电子层,但的核电荷数大,故半径更小,A错误;
B.和Cl的核外均有3个电子层,且核内均有17个质子,但的核外电子数多于Cl,故半径更大,B正确;
C.和的核外均有2个电子层,但的核电荷数更大,故半径更小,C错误;
D.的核外有2个电子层,而的核外有3个电子层,故的半径更大,D错误;
答案选B。
9.A
【详解】A.元素非金属性强弱可由最高价氧化物对应水化物的酸性强弱来判断,选项中没有指明是否是最高价氧化物,无法判断非金属性强弱,A正确;
B.元素非金属性越弱,其离子的还原性越强,B错误;
C.单质能与发生置换反应生成,说明非金属性:,C错误:
D.单质与化合,根据产物的稳定性可知非金属性:,D错误;
故答案选A。
10.D
【详解】A.验证元素的金属性的强弱,可由金属单质与酸反应置换出氢气的难易程度来判断,而不是与溶液反应,故A不符合题意;
B.的金属性强于,故B不符合题意;
C.与溶液反应生成溴,使左侧棉球变为橙色,未反应的继续与溶液反应置换出,使右侧棉球变为蓝色,能证明非金属性:,但不能证明非金属性:,故C不符合题意;
D.实验Ⅳ可证明酸性,这三种酸为的最高价氧化物对应的水化物,故能验证非金属性:,故D符合题意;
故答案选D。
11.B
【分析】由题图可知Z、M为第二周期元素,其他为第三周期元素。由Y的最高化合价为价,可知Y为Al元素,结合元素在周期表中的位置可确定Z为C、M为N、Q为S、R为Cl元素。
【详解】A.同周期从左到右原子半径减小,同主族从上到下原子半径增大,结合三种元素在周期表中的位置可确定原子半径:Al>C>N,A正确;
B.AlCl3在溶液中能导电,属于电解质,B错误;
C.碳元素的氢化物可能是气体、液体或固体,C正确;
D.HNO3能与NH3反应生成NH4NO3,D正确;
故选:B。
12.A
【分析】根据X的核外电子数是X元素主族序数的2倍,可推知X为H元素;由Z原子的最外层电子数是次外层电子数的2.5倍,可推知Z为N元素;由Y、Z、M为同周期相邻元素,Y元素的最高正价与最低负价的绝对值均等于主族序数,可推知Y为C元素、M为O元素。
【详解】A.同周期主族元素从左到右原子半径依次减小,则原子半径:,A错误;
B.非金属性:,则最高价氧化物对应水化物的酸性:,B正确;
C.具有强氧化性,可用于杀菌、消毒,C正确;
D.核外电子排布相同的离子,核电荷数小的半径大,故离子半径:,D正确;
故选A。
13.C
【分析】判断原子半径、最外层电子数时,要从正五边形到顶点的距离大小来判断,从原子半径图可以看出,原子半径:,结合最外层电子数:,可知A为H元素,D为Na元素,A和E的原子序数之和与B和C的原子序数之和相等,E是地壳中含量最多的金属元素,可知E为Al元素,结合最外层电子数可知B为C元素,C为O元素,据此解答。
【详解】A.非金属性:,非金属性越强,简单氢化物越稳定,简单氢化物的稳定性:,A项错误;
B.C、D、E的简单离子分别为,三种离子的核外电子排布相同,核电荷数大的半径小,所以半径:,B项错误
C.A与C可形成和两种化合物,D与C可形成和两种化合物,C项正确;
D.B和E的最高价氧化物的水化物分别为,不能与发生反应,D项错误;
答案选C。
14.BC
【分析】X、Y、Z、M是4种短周期元素,X原子最外层电子数是其电子层数的3倍,X原子有2个电子层,最外层电子数为6,则X为O元素,X、Y位于同一主族,则Y为S元素;Z原子的核外电子数比X原子少1,又X与Z位于同一周期,则Z为N元素;M是同周期中半径最大的元素,应处于IA族元素,由Y与M同一周期,则M为Na元素。
【详解】根据上述分析可知,X、Y、Z、M分别是O、S、N和Na,则
A.X为O元素,H2O常温下为液体,而氨气、硫化氢为气态,故水的沸点最高,A正确;
B.离子的核外电子层数越多半径越大,S2-半径最大,Na+、O2-、N3-核外电子排布相同,其核电核数越大,离子半径越小,则四种元素简单离子的半径由大到小依次为Y(S2-)>Z(N3-)>X(O2-)>M(Na+),B错误;
C.S的最高价氧化物对应水化物的化学式为H2SO4,C错误;
D.O、S、Na可以组成Na2SO4、Na2SO3等化合物,D正确。
答案选BC。
15.AC
【分析】题图为元素周期表中短周期的一部分,由X、Y、Z、M在周期表中的位置关系可知,X为He元素,Y为F元素,M为Cl元素,Z为S元素。
【详解】A.同周期元素自左而右非金属性增强,同主族元素自上而下非金属性减弱,非金属性,故电负性,A正确;
B.电子层数相同,核电荷数越大离子半径越小,电子层数不同时,电子层越多离子半径越大,离子半径:,B错误;
C.为,分子中S元素化合价为价,,S原子最外层满足8电子稳定结构,Cl元素化合价为价,,Cl原子最外层满足8电子稳定结构,C正确;
D.Z为S元素,最外层有6个电子,其基态原子的最外层电子的轨道表示式为,D错误;
故答案选AC。
16. 验证Na、Mg、Al元素从左到右金属性递减,S、Cl元素从左到右非金属性递增的规律 试管 酒精灯 A ① D C ⑥ 、 ② Na>Mg>Al S
(2)分析实验可知,需要用到的仪器有试管、酒精灯、砂纸、镊子、小刀、胶头滴管等;
(3)实验内容:
③钠与水反应生成氢氧化钠与氢气,与滴有酚酞溶液的冷水反应现象为钠浮于水面,熔成小球,在水面上无定向移动并随之消失,溶液变成红色,选A;反应的化学方程式为;
B.现象为产生大量气体,可在空气中燃烧,溶液变成浅红色,应是镁条与滴有酚酞的热水反应生成氢氧化镁和氢气的现象,答案选①;反应的化学方程式为;
④用砂纸打磨后的镁带与2 mol·L-1的盐酸反应生成氯化镁和氢气,反应现象比镁与热水反应剧烈,现象为剧烈反应,产生的气体可以在空气中燃烧,选D;反应的化学方程式为;
⑤用砂纸打磨后的铝条与2 mol·L-1的盐酸反应生成氯化铝和氢气,铝没有镁活泼,没有④剧烈,现象为反应不剧烈,产生的气体可以在空气中燃烧,选C;反应的化学方程式为;
E.现象为生成白色胶状沉淀,继而沉淀消失,是可溶性铝盐中滴加强碱生成氢氧化铝、继而氢氧化铝溶于氢氧化钠的现象,选⑥;反应的化学方程式为、;
F.生成淡黄色沉淀,该淡黄色沉淀应为硫单质,因此该现象为置换出硫单质的反应的现象,选②;反应的化学方程式为;
(4)同周期从左往右金属性减弱,非金属性增强,因此有:
金属性:Na>Mg>Al;
非金属性:S
【分析】I.(1)金属性Na>Mg>Al,金属越活泼,与酸反应越剧烈,均1mol时Al失去电子最多; (2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀生成硅酸,利用强酸制弱酸;
Ⅱ.实验室制备氯气可用二氧化锰和浓盐酸在加热条件下反应,也可用高锰酸钾与浓盐酸反应制备,反应较为剧烈,无需加热即可进行,氯气具有强氧化性,能与NaBr溶液发生置换反应生成单质Br2,氯气有毒,用碱吸收,在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
【详解】I.(1)金属活泼性顺序为:钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钠;生成1mol氢气需要得到2mol电子,1mol钠失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,故答案为:钠;铝;
(2) 利用强酸制弱酸,向Na2SiO3溶液中加入稀H2SO4出现白色沉淀生成硅酸,离子方程式为:+2H+=H2SiO3↓;故答案为:+2H+=H2SiO3↓;
Ⅱ.(3)装置B中仪器a的名称为分液漏斗,故答案为:分液漏斗;
(4)高锰酸钾与浓盐酸反应较为剧烈,无需加热即可进行,是固体和液体不加热制备气体装置,选择A,故答案为:A;
(5)①氯气与NaBr溶液反应生成Br2,反应的离子方程式为Cl2+2Br-=2Cl-+Br2,故答案为:C12+2Br-=2Cl-+Br2;
②氯气在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。
18. 钾粒 钠粒 K的金属性强于Na 三 Na、Mg、Al 取大小相同的三小粒金属分别投入蒸馏水中,Na剧烈反应,而Mg、Al无明显现象 取大小相同的镁块和铝块分别投入相同浓度的稀盐酸中,Mg反应较剧烈,产生大量气泡; Al反应比Mg缓慢,有较多的气泡产生同周期主族元素从左到右,原子半径逐渐减小,核电荷数逐渐增多,原子核对最外层电子的吸引力逐渐增大,原子失电子能力逐渐减弱,故金属性逐渐减弱 橙红 紫红 同一主族元素从上到下元素原子的得电子能力逐渐减弱 同一主族元素,各元素原子的最外层电子数相同,从上到下,电子层数依次增多,原子半径依次增大,原子得电子能力逐渐减弱
【详解】Ⅰ.(2)根据实验目的,将处理好的Na、K放在玻璃管内加热并用洗耳球向玻璃管内鼓入空气,观察现象来判断反应的剧烈程度,从而得出Na、K金属性的相对强弱。由于Na、K同主族,K的原子半径大于Na,K在反应中更易失电子,金属性更强,燃烧更为剧烈,故答案为:钾粒;钠粒;
(3)K反应更剧烈,说明K的金属性强于Na,故答案为:K的金属性强于Na;
Ⅱ.(4)由于第周期元素的代表性强且Na、Mg、Al等单质是实验室中的常见药品、实验易操作、现象明显,所以选择第三周期的Na、Mg、Al与水或盐酸反应来探究同周期主族元素的性质递变规律;Na、Mg、Al同周期,随着原子序数的递增,原子半径逐渐减小,原子失电子能力逐渐减弱,其单质与水或盐酸反应的能力也逐渐减弱,从而证明它们的金属性逐渐减弱,故答案为:三;Na、Mg、Al;取大小相同的三小粒金属分别投入蒸馏水中,Na剧烈反应,而Mg、Al无明显现象;取大小相同的镁块和铝块分别投入相同浓度的稀盐酸中,Mg反应较剧烈,产生大量气泡;Al反应比Mg缓慢,有较多的气泡产生同周期主族元素从左到右,原子半径逐渐减小,核电荷数逐渐增多,原子核对最外层电子的吸引力逐渐增大,原子失电子能力逐渐减弱,故金属性逐渐减弱;
Ⅲ.(5)向NaBr溶液中加入新制的氯水,发生反应,证明氧化性;再加入后振荡静置,液体分层,上层接近无色,下层呈橙红色。向NaI溶液中加入新制的溴水,发生反应,证明氧化性;再加入后,振荡静置,液体分层,上层接近无色,下层呈紫红色。两个实验说明:同一主族元素从上到下元素原子的得电子能力逐渐减弱,故答案为:橙红;紫红;
(6)由(5)可知答案为:同一主族元素从上到下元素原子的得电子能力逐渐减弱;
(7)由(5)可知答案为:;;同一主族元素,各元素原子的最外层电子数相同,从上到下,电子层数依次增多,原子半径依次增大,原子得电子能力逐渐减弱。
19.(1) SiO2+2CSi+2CO↑ SiO2
(2)精馏(或蒸馏)
(3) 制取盐酸(或其他合理答案) 3SiCl4+4NH3Si3N4+12HCl
【分析】石英砂的主要成分是SiO2,和焦炭反应生成粗硅和CO,粗硅和氯气反应生成SiCl4,生成的SiCl4可以用来制光导纤维,也可以和氨气反应得到Si3N4。
(1)
反应I是二氧化硅与焦炭反应生成硅,化学方程式为SiO2+2CSi+2CO↑,氧化剂为SiO2;
(2)
根据表格数据,多种杂质的沸点不同,图中“操作X”的名称为蒸馏;
(3)
反应III和IV均有氯化氢生成,可以用来制取盐酸;反应IV的化学方程式为3SiCl4+4NH3Si3N4+12HCl。
20. Al2O3+ 6H+= 2Al3++ 3H2O SiO2+2OH-= SiO+ H2O NaA1O2+CO2+2H2O=A1(OH)3↓+NaHCO3 不能 A1(OH)3沉淀会溶于过量的盐酸中 NaHCO3 制纯碱或做发酵粉等
【分析】由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3。
【详解】(1)Al2O3与盐酸反应生成氯化铝和水,氧化物不能拆,离子方程式为:Al2O3+6H+═2Al3++3H2O;
(2)二氧化硅与氢氧化钠反应生成硅酸钠和水,二氧化硅不能拆,故离子反应方程式为:SiO2+2OH-= SiO+ H2O;
(3)流程甲滤液D含有偏铝酸钠,通入过量CO2反应生成氢氧化铝沉淀,反应的化学方程式为NaA1O2+CO2+2H2O=A1(OH)3↓+NaHCO3;
(4)“通入过量CO2”不能改用盐酸,因为A1(OH)3沉淀会溶于过量的盐酸中;
(5)由分析可知滤液E、K中溶质的主要成分是NaHCO3,NaHCO3用途有制纯碱或做发酵粉等。
答案第1页,共2页
答案第1页,共2页
