2022-2023学年下学期高二化学人教版(2019)选择性必修2 第2.1节 第一课时 共价键(共39张PPT)
文档属性
| 名称 | 2022-2023学年下学期高二化学人教版(2019)选择性必修2 第2.1节 第一课时 共价键(共39张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-20 15:55:47 | ||
图片预览









文档简介
(共39张PPT)
第一课时 共价键
第二章
2022-2023学年下学期高二化学人教版(2019)选择性必修2 ★★★
素养目标
1.认识原子间通过原子轨道重叠形成共价键,从微观结构认识分子的产生原因,培养宏观辨识与微观探析的核心素养。
2.根据原子轨道的重叠方式,了解共价键可分为σ键和π键等类型;结合原子轨道的伸展方向,了解共价键具有饱和性和方向性。
课前篇 素养初探
【知识铺垫】
1.s原子轨道电子云轮廓图是球形的,p原子轨道电子云轮廓图是哑铃状的。
2.共价键的本质是成键原子之间通过共用电子对产生静电作用。
【自主梳理】
1.共价键
共价键是原子间通过共用电子对所形成的相互作用。
2.共价键的类型(按成键原子的原子轨道重叠方式分类)
(1)共价键的类型
分类标准 类型
共用电子对数 单键、双键、三键
共用电子对是否偏移 极性键、非极性键
原子轨道重叠方式 σ键、π键
(2)σ键
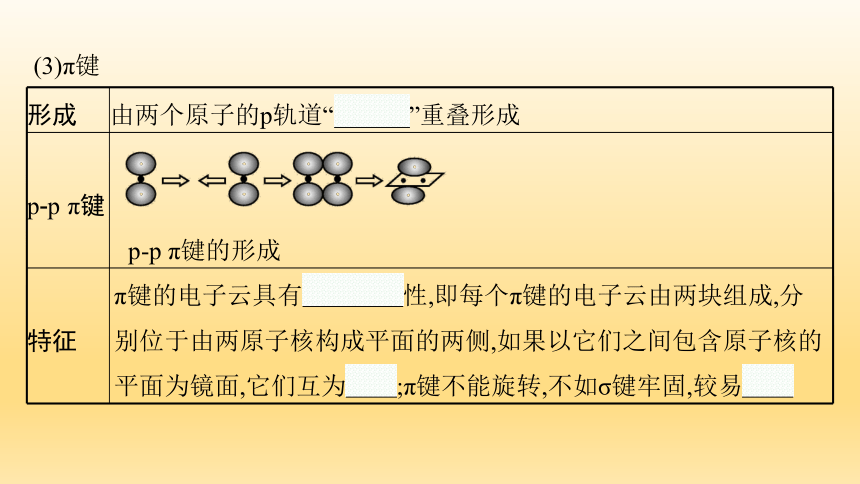
(3)π键
形成 由两个原子的p轨道“肩并肩”重叠形成
p-p π键
p-p π键的形成
特征 π键的电子云具有镜面对称性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像;π键不能旋转,不如σ键牢固,较易断裂
(4)判断σ键、π键的一般规律
共价单键为 σ 键;共价双键中有一个 σ 键、一个 π 键;共价三键由一个σ键和 两 个π键组成。
【微思考】两个原子间可以只形成σ键,也可以只形成π键吗
提示 π键不能独立存在,π键电子云由两块组成,是以σ键所连接的两个原子成镜面对称的。
3.共价键的形成条件
原子 Na Cl H Cl C O
电负性 0.9 3.0 2.1 3.0 2.5 3.5
电负性之差(绝对值) 2.1 0.9 1.0 结论:当成键原子的电负性相差很大时,形成的电子对不会被共用,形成的将是离子键;而共价键是电负性相差不大的原子之间形成的化学键。
【自我检测】
1.判断下列说法的正误,正确的画“√”,错误的画“×”。
(1)所有共价键都有饱和性( )
(2)N2分子中σ键与π键的个数比是2∶1( )
(3)CO2分子中有一个σ键和一个π键( )
(4)一般来说,σ键比π键强度大,更稳定( )
(5)形成Cl2分子时,p轨道的重叠方式可以为 ( )
(6)σ键和π键都只存在于共价化合物中( )
√
×
×
√
×
×
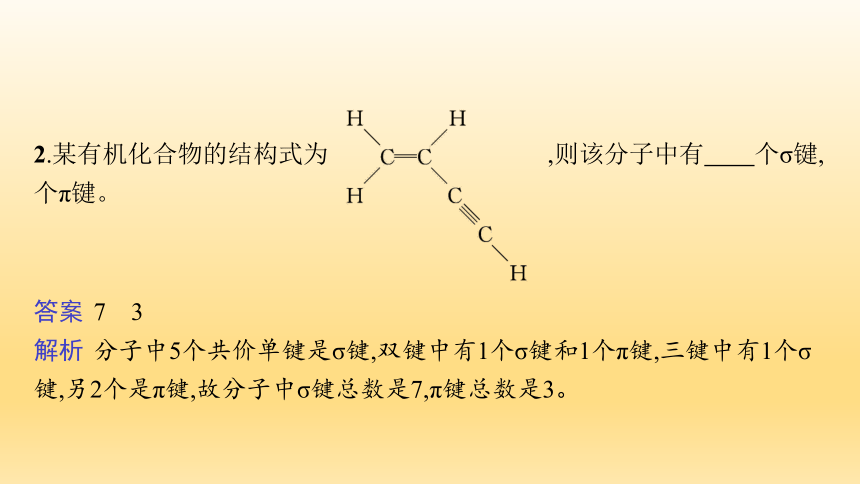
2.某有机化合物的结构式为 ,则该分子中有 个σ键, 个π键。
答案 7 3
解析 分子中5个共价单键是σ键,双键中有1个σ键和1个π键,三键中有1个σ键,另2个是π键,故分子中σ键总数是7,π键总数是3。
课堂篇 素养提升
探究1
共价键的本质与类型
【问题探究】
水分子的空间结构模型 过氧化氢分子的空间结构模型
(1)水分子中的共价键是哪些原子形成的哪类共价键
提示 水分子中的共价键是由O原子与H原子形成的σ键。
(2)过氧化氢分子中的O、H元素的化合价分别是多少 为什么
提示 过氧化氢分子中O、H元素的化合价分别是-1价、+1价。过氧化氢分子中有两类共价键,O—O间的共价键是非极性键,共用电子对不偏移;O—H是极性键,氧的电负性较H大,共用电子对偏向氧。
(3)共价键可以存在于哪些物质中 举例说明。
提示 共价键可以存在于共价单质中,如H2、O2、N2等;可以存在于共价化合物中,如H2O、H2SO4、CH4等;也可以存在于离子化合物中,如NaOH、NH4Cl、Na2O2等。
【深化拓展】
1.共价键的本质
共价键的本质是原子之间形成共用电子对(或原子轨道的重叠)。
2.共价键存在的范围
(1)共价化合物[原子间以共用电子对(共价键)形成的化合物]中。原子之间通过共价键结合,共价化合物中一定存在共价键。如SO2、CO2、CH4、H2O2、CS2、H2SO4等。
(2)非金属单质分子中。如O2、F2、H2、C60、单质硫、白磷(P4)等(稀有气体为单原子分子,不存在化学键),双原子(或多原子)分子中一定存在共价键(但红磷等分子结构较复杂,常以元素符号代表其单质)。
金刚石、晶体硅中原子间也存在共价键
(3)部分离子化合物(离子化合物中阴、阳离子为原子团时一定存在共价键)中。如Na2SO4的 中存在共价键,NaOH的OH-中存在共价键,NH4Cl的
中存在共价键,Na2O2的 中存在共价键等。
3.共价键的特征
共价键的特征:共价键具有饱和性和方向性。
(1)共价键的饱和性
按照共用电子对理论,一个原子有几个未成对电子,便可以与几个自旋相反的电子配对成键,这就是共价键的“饱和性”。H原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3等分子。
(2)共价键的方向性
原子之间形成共价键时,两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现的概率越大,形成的共价键越牢固。电子所在的原子轨道都具有一定的形状,原子轨道要取得最大重叠决定了共价键必然具有方向性。
【素能应用】
典例1下列说法正确的是( )
A.若把H2S写成H3S,则违背了共价键的饱和性
B.H3O+的存在说明共价键不应有饱和性
C.所有共价键都有方向性
D.金属元素与非金属元素的原子间只形成离子键
答案 A
解析 硫原子有两个未成对电子,根据共价键的饱和性,形成的氢化物为H2S,A项正确;H2O只能结合1个H+形成H3O+,证明共价键有饱和性,B项错误;H2分子中两个氢原子的1s轨道发生重叠形成H—H σ键,因为s轨道电子云轮廓图呈球形,所以H2分子中的H—H没有方向性,C项错误;AlCl3是铝原子与氯原子通过共价键形成的共价化合物,D项错误。
【微点拨】有关共价键特征问题的思维流程
①共价键的饱和性→决定分子的组成。
②共价键的方向性→决定分子的空间结构。
③成键原子的运动特点→两原子轨道发生重叠后,电子在两核间出现的概率增大。
变式设问 H2S分子中两个共价键的夹角接近90°,原因是什么
提示 S原子的价层电子排布式是3s23p4,有2个未成对电子,并且分布在相互垂直的两个p轨道中,当与两个H原子配对成键时,形成的两个共价键间夹角接近90°,这体现了共价键的方向性,是由p轨道的伸展方向决定的。
规律总结 共价键方向性和饱和性的正确理解
(1)共价键的饱和性是由成键原子的未成对电子数决定的,它决定了分子的组成。
(2)共价键的方向性是由成键原子的轨道的方向性决定的,它决定了分子的空间结构。
(3)所有的共价键都有饱和性,但不是所有的共价键都有方向性,如两个1s轨道“H原子与H原子”重叠形成的s-s σ键没有方向性。
变式训练1下列各组物质中,所有化学键都是共价键的是( )
A.H2S和Na2O2
B.H2O2和CaF2
C.NH3和N2
D.HNO3和NaCl
答案 C
解析 A项,Na2O2中既有离子键又有共价键,不符合题意;B项,CaF2中只有离子键,不符合题意;D项,NaCl属于离子化合物,没有共价键,不符合题意。
探究2
σ键与π键的区别及与单键、双键、三键的关系
【问题探究】
观察下图中乙烷、乙烯和乙炔分子的球棍模型,回答相关问题。
问题思考:
(1)乙烯和乙炔分子中的碳原子间,既存在σ键,又存在π键,σ键和π键的成键方式有何不同
提示 σ键是原子轨道以“头碰头”方式发生重叠成键;π键是p轨道与p轨道以“肩并肩”方式发生重叠成键。
(2)从乙烷、乙烯和乙炔分子中存在的σ键和π键来看,σ键和π键的存在条件和数目有何规律
提示 σ键可以独立存在,π键不能单独存在。
所有的单键都是σ键;双键中有一个σ键和一个π键;三键中有一个σ键和两个π键。
(3)乙烯和乙炔的化学性质为什么比乙烷活泼
提示 乙烯分子中的碳碳双键和乙炔分子中的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠程度较小,不稳定,容易断裂。而乙烷分子中没有π键,σ键原子轨道重叠程度大,比较稳定,不易断裂。
【深化拓展】
σ键和π键的比较
共价键类型 σ键 π键
原子轨道重叠方式 沿键轴方向(“头碰头”)重叠 沿键轴方向平行
重叠(“肩并肩”)
原子轨道重叠部位 两原子核之间,在键轴处 键轴上方和下方
原子轨道重叠程度 大 小
键的强度 较大 较小
化学活泼性 不活泼 活泼
【素能应用】
典例2下列说法不正确的是( )
A.σ键一般比π键原子轨道重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有1个σ键
C.气体单质中,一定有σ键,可能有π键
D.一个N2分子中有1个σ键,2个π键
答案 C
解析 气体单质分子中,可能有σ键,如Cl2;可能有π键,如N2;也可能没有化学键,如稀有气体分子。
易错警示 共价键的认识误区
(1)σ键与π键的实质相同,都是由原子间通过共用电子对形成的。
(2)σ键与π键由于原子轨道的重叠程度不同而导致了两者的稳定性不同。
(3)判断共价键的类型时一定要明确原子之间的共价键个数,根据个数再进行判断。
(4)分子中存在π键,则一定存在σ键,但若存在σ键,却不一定存在π键。
变式训练2已知甲醛、CO、石黑烯的结构如下图所示:
(1)1 mol HCHO分子中含有σ键的数目为 (设NA为阿伏加德罗常数的值)。
(2)已知CS2与CO2的分子结构相似,则CS2分子中的共价键的类型有 。
(3)Ni能与CO形成正四面体形的共价化合物Ni(CO)4,1 mol Ni(CO)4中含有
mol σ键。
(4)石墨烯是一种由单层碳原子构成的平面结构新型材料,下图中1号C与相邻C形成σ键的个数为 。
答案 (1)3NA (2)σ键、π键 (3)8 (4)3
解析 (1)HCHO的结构式为 ,则1 mol HCHO分子中含有3 mol σ键。
(2)CS2与CO2分子结构相似,C与S原子形成双键,每个双键包含1个σ键和1个π键,故CS2分子中含有的共价键类型为σ键和π键。
(3)CO分子的电子式为 ,故1个CO分子中存在1个σ键,而Ni(CO)4中Ni与每个CO分子之间还存在σ键,故1 mol Ni(CO)4中含有8 mol σ键。
(4)由题图可以看出,每个碳原子能与三个相邻碳原子形成单键,故1号碳原子与相邻碳原子能形成3个σ键。
素养脉络
随堂检测
1.原子间形成分子时,决定各原子相互结合的数量关系的是( )
A.共价键的方向性
B.共价键的饱和性
C.形成共价键原子的大小
D.共价键的稳定性
答案 B
2.关于σ键和π键的比较,下列说法不正确的是( )
A.σ键是轴对称的,π键是镜面对称的
B.σ键是“头碰头”式重叠,π键是“肩并肩” 式重叠
C.σ键不能断裂,π键容易断裂
D.氢原子只能形成σ键,氧原子可以形成σ键和π键
答案 C
解析 σ键较稳定,不易断裂,而不是不能断裂。化学反应的实质是旧键的断裂和新键的形成。
3.下列物质的分子中,没有π键的是( )
A.CO2
B.N2
C.CH≡CH
D.HClO
答案 D
4.下图表示氢原子的电子云重叠示意图。以下各种说法错误的是( )
A.图中电子云重叠表示电子在核间出现的概率大
B.是两个氢原子核外的1s原子轨道发生重叠形成共价键
C.氢原子的核外电子呈云雾状,在两核间分布得密一些,将两核吸引
D.氢原子之间形成σ键,s-s σ键没有方向性
答案 C
解析 电子云是对核外电子运动状态的一种形象化描述,并不是指电子呈云雾状,图中小点的疏密只表示电子出现概率的大小,C项错误;s电子云是球形对称的,s-s σ键无方向性,D项正确。
5.有以下物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2
⑧H2O2 ⑨HCN(H—C≡N)。
(1)只含有极性键的是 (填序号,下同);
(2)只含有非极性键的是 ;
(3)既有极性键,又有非极性键的是 ;
(4)只有σ键的是 ;
(5)既有σ键又有π键的是 ;
(6)含有由两个原子的s轨道重叠形成的σ键的是 ;
(7)含有由一个原子的p轨道与另一个原子的p轨道重叠形成π键的是 。
答案 (1)①③⑨ (2)②④⑦ (3)⑤⑥⑧ (4)①②③⑥⑦⑧ (5)④⑤⑨ (6)⑦ (7)④⑤⑨
解析 由同种元素形成的共价键是非极性键,由不同种元素形成的共价键是极性键。在形成的共价键中,单键都是σ键,双键或三键中既有σ键又有π键,π键由两个原子的p轨道“肩并肩”重叠形成。
第一课时 共价键
第二章
2022-2023学年下学期高二化学人教版(2019)选择性必修2 ★★★
素养目标
1.认识原子间通过原子轨道重叠形成共价键,从微观结构认识分子的产生原因,培养宏观辨识与微观探析的核心素养。
2.根据原子轨道的重叠方式,了解共价键可分为σ键和π键等类型;结合原子轨道的伸展方向,了解共价键具有饱和性和方向性。
课前篇 素养初探
【知识铺垫】
1.s原子轨道电子云轮廓图是球形的,p原子轨道电子云轮廓图是哑铃状的。
2.共价键的本质是成键原子之间通过共用电子对产生静电作用。
【自主梳理】
1.共价键
共价键是原子间通过共用电子对所形成的相互作用。
2.共价键的类型(按成键原子的原子轨道重叠方式分类)
(1)共价键的类型
分类标准 类型
共用电子对数 单键、双键、三键
共用电子对是否偏移 极性键、非极性键
原子轨道重叠方式 σ键、π键
(2)σ键
(3)π键
形成 由两个原子的p轨道“肩并肩”重叠形成
p-p π键
p-p π键的形成
特征 π键的电子云具有镜面对称性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像;π键不能旋转,不如σ键牢固,较易断裂
(4)判断σ键、π键的一般规律
共价单键为 σ 键;共价双键中有一个 σ 键、一个 π 键;共价三键由一个σ键和 两 个π键组成。
【微思考】两个原子间可以只形成σ键,也可以只形成π键吗
提示 π键不能独立存在,π键电子云由两块组成,是以σ键所连接的两个原子成镜面对称的。
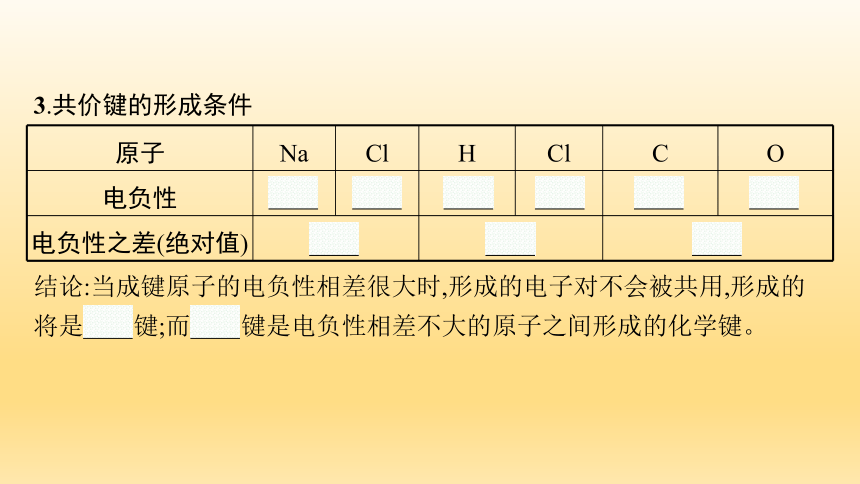
3.共价键的形成条件
原子 Na Cl H Cl C O
电负性 0.9 3.0 2.1 3.0 2.5 3.5
电负性之差(绝对值) 2.1 0.9 1.0 结论:当成键原子的电负性相差很大时,形成的电子对不会被共用,形成的将是离子键;而共价键是电负性相差不大的原子之间形成的化学键。
【自我检测】
1.判断下列说法的正误,正确的画“√”,错误的画“×”。
(1)所有共价键都有饱和性( )
(2)N2分子中σ键与π键的个数比是2∶1( )
(3)CO2分子中有一个σ键和一个π键( )
(4)一般来说,σ键比π键强度大,更稳定( )
(5)形成Cl2分子时,p轨道的重叠方式可以为 ( )
(6)σ键和π键都只存在于共价化合物中( )
√
×
×
√
×
×
2.某有机化合物的结构式为 ,则该分子中有 个σ键, 个π键。
答案 7 3
解析 分子中5个共价单键是σ键,双键中有1个σ键和1个π键,三键中有1个σ键,另2个是π键,故分子中σ键总数是7,π键总数是3。
课堂篇 素养提升
探究1
共价键的本质与类型
【问题探究】
水分子的空间结构模型 过氧化氢分子的空间结构模型
(1)水分子中的共价键是哪些原子形成的哪类共价键
提示 水分子中的共价键是由O原子与H原子形成的σ键。
(2)过氧化氢分子中的O、H元素的化合价分别是多少 为什么
提示 过氧化氢分子中O、H元素的化合价分别是-1价、+1价。过氧化氢分子中有两类共价键,O—O间的共价键是非极性键,共用电子对不偏移;O—H是极性键,氧的电负性较H大,共用电子对偏向氧。
(3)共价键可以存在于哪些物质中 举例说明。
提示 共价键可以存在于共价单质中,如H2、O2、N2等;可以存在于共价化合物中,如H2O、H2SO4、CH4等;也可以存在于离子化合物中,如NaOH、NH4Cl、Na2O2等。
【深化拓展】
1.共价键的本质
共价键的本质是原子之间形成共用电子对(或原子轨道的重叠)。
2.共价键存在的范围
(1)共价化合物[原子间以共用电子对(共价键)形成的化合物]中。原子之间通过共价键结合,共价化合物中一定存在共价键。如SO2、CO2、CH4、H2O2、CS2、H2SO4等。
(2)非金属单质分子中。如O2、F2、H2、C60、单质硫、白磷(P4)等(稀有气体为单原子分子,不存在化学键),双原子(或多原子)分子中一定存在共价键(但红磷等分子结构较复杂,常以元素符号代表其单质)。
金刚石、晶体硅中原子间也存在共价键
(3)部分离子化合物(离子化合物中阴、阳离子为原子团时一定存在共价键)中。如Na2SO4的 中存在共价键,NaOH的OH-中存在共价键,NH4Cl的
中存在共价键,Na2O2的 中存在共价键等。
3.共价键的特征
共价键的特征:共价键具有饱和性和方向性。
(1)共价键的饱和性
按照共用电子对理论,一个原子有几个未成对电子,便可以与几个自旋相反的电子配对成键,这就是共价键的“饱和性”。H原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3等分子。
(2)共价键的方向性
原子之间形成共价键时,两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现的概率越大,形成的共价键越牢固。电子所在的原子轨道都具有一定的形状,原子轨道要取得最大重叠决定了共价键必然具有方向性。
【素能应用】
典例1下列说法正确的是( )
A.若把H2S写成H3S,则违背了共价键的饱和性
B.H3O+的存在说明共价键不应有饱和性
C.所有共价键都有方向性
D.金属元素与非金属元素的原子间只形成离子键
答案 A
解析 硫原子有两个未成对电子,根据共价键的饱和性,形成的氢化物为H2S,A项正确;H2O只能结合1个H+形成H3O+,证明共价键有饱和性,B项错误;H2分子中两个氢原子的1s轨道发生重叠形成H—H σ键,因为s轨道电子云轮廓图呈球形,所以H2分子中的H—H没有方向性,C项错误;AlCl3是铝原子与氯原子通过共价键形成的共价化合物,D项错误。
【微点拨】有关共价键特征问题的思维流程
①共价键的饱和性→决定分子的组成。
②共价键的方向性→决定分子的空间结构。
③成键原子的运动特点→两原子轨道发生重叠后,电子在两核间出现的概率增大。
变式设问 H2S分子中两个共价键的夹角接近90°,原因是什么
提示 S原子的价层电子排布式是3s23p4,有2个未成对电子,并且分布在相互垂直的两个p轨道中,当与两个H原子配对成键时,形成的两个共价键间夹角接近90°,这体现了共价键的方向性,是由p轨道的伸展方向决定的。
规律总结 共价键方向性和饱和性的正确理解
(1)共价键的饱和性是由成键原子的未成对电子数决定的,它决定了分子的组成。
(2)共价键的方向性是由成键原子的轨道的方向性决定的,它决定了分子的空间结构。
(3)所有的共价键都有饱和性,但不是所有的共价键都有方向性,如两个1s轨道“H原子与H原子”重叠形成的s-s σ键没有方向性。
变式训练1下列各组物质中,所有化学键都是共价键的是( )
A.H2S和Na2O2
B.H2O2和CaF2
C.NH3和N2
D.HNO3和NaCl
答案 C
解析 A项,Na2O2中既有离子键又有共价键,不符合题意;B项,CaF2中只有离子键,不符合题意;D项,NaCl属于离子化合物,没有共价键,不符合题意。
探究2
σ键与π键的区别及与单键、双键、三键的关系
【问题探究】
观察下图中乙烷、乙烯和乙炔分子的球棍模型,回答相关问题。
问题思考:
(1)乙烯和乙炔分子中的碳原子间,既存在σ键,又存在π键,σ键和π键的成键方式有何不同
提示 σ键是原子轨道以“头碰头”方式发生重叠成键;π键是p轨道与p轨道以“肩并肩”方式发生重叠成键。
(2)从乙烷、乙烯和乙炔分子中存在的σ键和π键来看,σ键和π键的存在条件和数目有何规律
提示 σ键可以独立存在,π键不能单独存在。
所有的单键都是σ键;双键中有一个σ键和一个π键;三键中有一个σ键和两个π键。
(3)乙烯和乙炔的化学性质为什么比乙烷活泼
提示 乙烯分子中的碳碳双键和乙炔分子中的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠程度较小,不稳定,容易断裂。而乙烷分子中没有π键,σ键原子轨道重叠程度大,比较稳定,不易断裂。
【深化拓展】
σ键和π键的比较
共价键类型 σ键 π键
原子轨道重叠方式 沿键轴方向(“头碰头”)重叠 沿键轴方向平行
重叠(“肩并肩”)
原子轨道重叠部位 两原子核之间,在键轴处 键轴上方和下方
原子轨道重叠程度 大 小
键的强度 较大 较小
化学活泼性 不活泼 活泼
【素能应用】
典例2下列说法不正确的是( )
A.σ键一般比π键原子轨道重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有1个σ键
C.气体单质中,一定有σ键,可能有π键
D.一个N2分子中有1个σ键,2个π键
答案 C
解析 气体单质分子中,可能有σ键,如Cl2;可能有π键,如N2;也可能没有化学键,如稀有气体分子。
易错警示 共价键的认识误区
(1)σ键与π键的实质相同,都是由原子间通过共用电子对形成的。
(2)σ键与π键由于原子轨道的重叠程度不同而导致了两者的稳定性不同。
(3)判断共价键的类型时一定要明确原子之间的共价键个数,根据个数再进行判断。
(4)分子中存在π键,则一定存在σ键,但若存在σ键,却不一定存在π键。
变式训练2已知甲醛、CO、石黑烯的结构如下图所示:
(1)1 mol HCHO分子中含有σ键的数目为 (设NA为阿伏加德罗常数的值)。
(2)已知CS2与CO2的分子结构相似,则CS2分子中的共价键的类型有 。
(3)Ni能与CO形成正四面体形的共价化合物Ni(CO)4,1 mol Ni(CO)4中含有
mol σ键。
(4)石墨烯是一种由单层碳原子构成的平面结构新型材料,下图中1号C与相邻C形成σ键的个数为 。
答案 (1)3NA (2)σ键、π键 (3)8 (4)3
解析 (1)HCHO的结构式为 ,则1 mol HCHO分子中含有3 mol σ键。
(2)CS2与CO2分子结构相似,C与S原子形成双键,每个双键包含1个σ键和1个π键,故CS2分子中含有的共价键类型为σ键和π键。
(3)CO分子的电子式为 ,故1个CO分子中存在1个σ键,而Ni(CO)4中Ni与每个CO分子之间还存在σ键,故1 mol Ni(CO)4中含有8 mol σ键。
(4)由题图可以看出,每个碳原子能与三个相邻碳原子形成单键,故1号碳原子与相邻碳原子能形成3个σ键。
素养脉络
随堂检测
1.原子间形成分子时,决定各原子相互结合的数量关系的是( )
A.共价键的方向性
B.共价键的饱和性
C.形成共价键原子的大小
D.共价键的稳定性
答案 B
2.关于σ键和π键的比较,下列说法不正确的是( )
A.σ键是轴对称的,π键是镜面对称的
B.σ键是“头碰头”式重叠,π键是“肩并肩” 式重叠
C.σ键不能断裂,π键容易断裂
D.氢原子只能形成σ键,氧原子可以形成σ键和π键
答案 C
解析 σ键较稳定,不易断裂,而不是不能断裂。化学反应的实质是旧键的断裂和新键的形成。
3.下列物质的分子中,没有π键的是( )
A.CO2
B.N2
C.CH≡CH
D.HClO
答案 D
4.下图表示氢原子的电子云重叠示意图。以下各种说法错误的是( )
A.图中电子云重叠表示电子在核间出现的概率大
B.是两个氢原子核外的1s原子轨道发生重叠形成共价键
C.氢原子的核外电子呈云雾状,在两核间分布得密一些,将两核吸引
D.氢原子之间形成σ键,s-s σ键没有方向性
答案 C
解析 电子云是对核外电子运动状态的一种形象化描述,并不是指电子呈云雾状,图中小点的疏密只表示电子出现概率的大小,C项错误;s电子云是球形对称的,s-s σ键无方向性,D项正确。
5.有以下物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2
⑧H2O2 ⑨HCN(H—C≡N)。
(1)只含有极性键的是 (填序号,下同);
(2)只含有非极性键的是 ;
(3)既有极性键,又有非极性键的是 ;
(4)只有σ键的是 ;
(5)既有σ键又有π键的是 ;
(6)含有由两个原子的s轨道重叠形成的σ键的是 ;
(7)含有由一个原子的p轨道与另一个原子的p轨道重叠形成π键的是 。
答案 (1)①③⑨ (2)②④⑦ (3)⑤⑥⑧ (4)①②③⑥⑦⑧ (5)④⑤⑨ (6)⑦ (7)④⑤⑨
解析 由同种元素形成的共价键是非极性键,由不同种元素形成的共价键是极性键。在形成的共价键中,单键都是σ键,双键或三键中既有σ键又有π键,π键由两个原子的p轨道“肩并肩”重叠形成。
