8.1.1 烷烃与同系物 课件(共18张PPT) 2022-2023学年高一化学 苏教版2019 必修第二册
文档属性
| 名称 | 8.1.1 烷烃与同系物 课件(共18张PPT) 2022-2023学年高一化学 苏教版2019 必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-21 08:15:33 | ||
图片预览





文档简介
(共18张PPT)
8.1.1 烷烃与同系物
学习目标
1.认识烷烃的性质和命名
2.掌握同系物的概念
课前导入
默写甲烷的取代反应,书写甲烷的结构式。
CH4 + Cl2 CH3Cl + HCl
光
CH3Cl + Cl2 CH2Cl2 + HCl
光
CH2Cl2 + Cl2 CHCl3 + HCl
光
CHCl3 + Cl2 CCl4 + HCl
光
一氯甲烷(无色气体)
二氯甲烷(难溶于水的无色液体)
三氯甲烷又叫氯仿 (有机溶剂)
四氯化碳(有机溶剂、灭火剂)
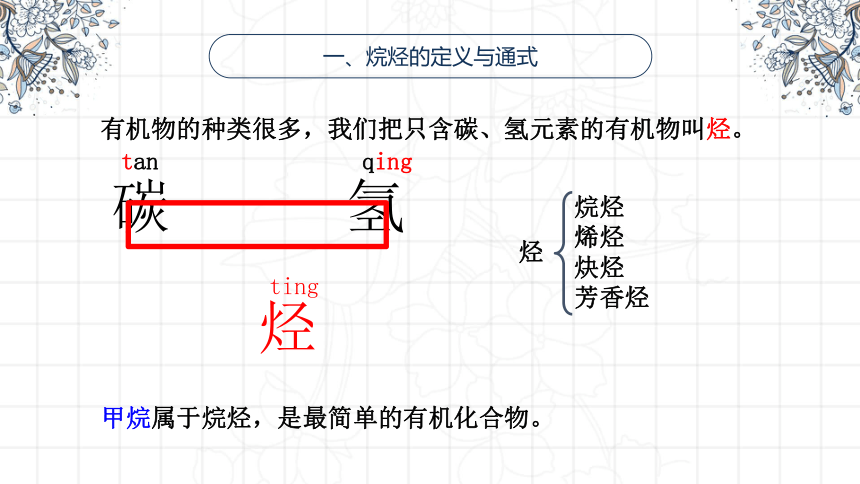
一、烷烃的定义与通式
有机物的种类很多,我们把只含碳、氢元素的有机物叫烃。
甲烷属于烷烃,是最简单的有机化合物。
碳 氢
tan qing
ting
烃
烃
烷烃
烯烃
炔烃
芳香烃
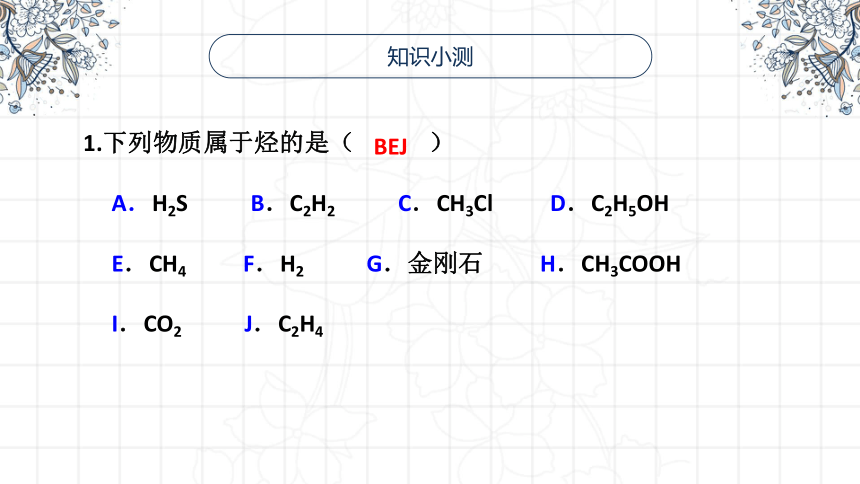
知识小测
1.下列物质属于烃的是( )
A.H2S B.C2H2 C.CH3Cl D.C2H5OH
E.CH4 F.H2 G.金刚石 H.CH3COOH
I.CO2 J.C2H4
BEJ
一、烷烃的性质与通式
①概念:烃分子中碳原子之间都以________结合,剩余价键均与氢原子结合, 使碳原子的化合价都达到“饱和”,这样的烃叫做饱和烃,也称为烷烃。
②烷烃的通式:___________。
单键
CnH2n+2
符合这一通式的一定是烷烃
1.烷烃的概念与通式
碳原子的成键方式
(一)碳原子的成键特点
碳原子最外层有4个电子,在化学反应中不易失去或得到电子
通常与H、O、S、N等非金属原子以共价键的成键方式形成共价化合物
(二)碳原子的成键数目
有机化合物中,每个碳原子都与其他原子形成4个共价键
+6
2 4
C
碳原子的成键方式
(三)、碳原子的成键方式
1.成键的类型:碳原子与碳原子之间可以形成单键、双键或三键。
2.碳骨架形式:碳原子之间可构成链状结构,也可构成环状结构。
一、烷烃的性质与通式
2.烷烃的命名:
烷烃CnH2n+2的命名 实例
C4H10的名称为________
C9H20的名称为________
C14H30的名称为________
丁烷
壬烷
十四烷
n≤10时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,其后加“烷”字
n>10时,以汉字数字加“烷”字代表
一、烷烃的性质与通式
3.烷烃的燃烧通式:
①甲烷的燃烧方程式
CH4+2O2 CO2+2H2O
点燃
②烷烃的燃烧通式
三、同系物与同分异构
C4H10
CH4
C2H6
C3H8
1.同系物:
结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
①定义:
②特点:
(1)同系物结构相似,决定了化学性质相似
(2)同系物的相对分子质量相差“14n”
(3)所有烷烃互为同系物
三、同系物与同分异构
2.同分异构:
化合物具有相同的分子式,但具有不同结构的现象。
①同分异构现象:
②同分异构体:
具有同分异构现象的化合物互称为同分异构体。
练习
判断下列烷烃是否为同分异构体
课堂练习
BD
1.以下关于甲烷的说法中错误的是( )
A.甲烷分子是由极性键构成的分子
B.甲烷分子具有平面正方形结构
C.甲烷分子中四个C—H键是完全相同的键
D.甲烷分子中具有非极性键
课堂练习
2.如图所示均能表示甲烷的分子结构,下列说法错误的是( )
A.Ⅰ将各原子看成了质点,为立体结构示意图
B.Ⅱ为电子式,表示甲烷分子中有8个电子
C.Ⅲ为球棍模型,棍代表甲烷分子内含有的共价键
D.Ⅳ为空间填充模型,能表示出甲烷的空间结构及各原子的相对大小
B
课堂练习
3、下列反应属于取代反应的是( )
A.②③ B.①③ C.②④ D.③④
D
课堂练习
4.下列有关烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键
②烷烃能使酸性KMnO4溶液褪色
③分子通式为CnH2n+2的烃不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色
A.①③⑤ B.②③
C.①④ D.①②④
C
作业布置
1.预习石油炼制乙烯《导与练》大本 P47~51页
2.写课时作业P123~124合格考题组
3.以及等级考题组第12、16题
观
看
谢
谢
8.1.1 烷烃与同系物
学习目标
1.认识烷烃的性质和命名
2.掌握同系物的概念
课前导入
默写甲烷的取代反应,书写甲烷的结构式。
CH4 + Cl2 CH3Cl + HCl
光
CH3Cl + Cl2 CH2Cl2 + HCl
光
CH2Cl2 + Cl2 CHCl3 + HCl
光
CHCl3 + Cl2 CCl4 + HCl
光
一氯甲烷(无色气体)
二氯甲烷(难溶于水的无色液体)
三氯甲烷又叫氯仿 (有机溶剂)
四氯化碳(有机溶剂、灭火剂)
一、烷烃的定义与通式
有机物的种类很多,我们把只含碳、氢元素的有机物叫烃。
甲烷属于烷烃,是最简单的有机化合物。
碳 氢
tan qing
ting
烃
烃
烷烃
烯烃
炔烃
芳香烃
知识小测
1.下列物质属于烃的是( )
A.H2S B.C2H2 C.CH3Cl D.C2H5OH
E.CH4 F.H2 G.金刚石 H.CH3COOH
I.CO2 J.C2H4
BEJ
一、烷烃的性质与通式
①概念:烃分子中碳原子之间都以________结合,剩余价键均与氢原子结合, 使碳原子的化合价都达到“饱和”,这样的烃叫做饱和烃,也称为烷烃。
②烷烃的通式:___________。
单键
CnH2n+2
符合这一通式的一定是烷烃
1.烷烃的概念与通式
碳原子的成键方式
(一)碳原子的成键特点
碳原子最外层有4个电子,在化学反应中不易失去或得到电子
通常与H、O、S、N等非金属原子以共价键的成键方式形成共价化合物
(二)碳原子的成键数目
有机化合物中,每个碳原子都与其他原子形成4个共价键
+6
2 4
C
碳原子的成键方式
(三)、碳原子的成键方式
1.成键的类型:碳原子与碳原子之间可以形成单键、双键或三键。
2.碳骨架形式:碳原子之间可构成链状结构,也可构成环状结构。
一、烷烃的性质与通式
2.烷烃的命名:
烷烃CnH2n+2的命名 实例
C4H10的名称为________
C9H20的名称为________
C14H30的名称为________
丁烷
壬烷
十四烷
n≤10时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,其后加“烷”字
n>10时,以汉字数字加“烷”字代表
一、烷烃的性质与通式
3.烷烃的燃烧通式:
①甲烷的燃烧方程式
CH4+2O2 CO2+2H2O
点燃
②烷烃的燃烧通式
三、同系物与同分异构
C4H10
CH4
C2H6
C3H8
1.同系物:
结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
①定义:
②特点:
(1)同系物结构相似,决定了化学性质相似
(2)同系物的相对分子质量相差“14n”
(3)所有烷烃互为同系物
三、同系物与同分异构
2.同分异构:
化合物具有相同的分子式,但具有不同结构的现象。
①同分异构现象:
②同分异构体:
具有同分异构现象的化合物互称为同分异构体。
练习
判断下列烷烃是否为同分异构体
课堂练习
BD
1.以下关于甲烷的说法中错误的是( )
A.甲烷分子是由极性键构成的分子
B.甲烷分子具有平面正方形结构
C.甲烷分子中四个C—H键是完全相同的键
D.甲烷分子中具有非极性键
课堂练习
2.如图所示均能表示甲烷的分子结构,下列说法错误的是( )
A.Ⅰ将各原子看成了质点,为立体结构示意图
B.Ⅱ为电子式,表示甲烷分子中有8个电子
C.Ⅲ为球棍模型,棍代表甲烷分子内含有的共价键
D.Ⅳ为空间填充模型,能表示出甲烷的空间结构及各原子的相对大小
B
课堂练习
3、下列反应属于取代反应的是( )
A.②③ B.①③ C.②④ D.③④
D
课堂练习
4.下列有关烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键
②烷烃能使酸性KMnO4溶液褪色
③分子通式为CnH2n+2的烃不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色
A.①③⑤ B.②③
C.①④ D.①②④
C
作业布置
1.预习石油炼制乙烯《导与练》大本 P47~51页
2.写课时作业P123~124合格考题组
3.以及等级考题组第12、16题
观
看
谢
谢
