备考2023年中考化学真题专项练习(全国通用)-53金属与盐溶液反应(含解析)
文档属性
| 名称 | 备考2023年中考化学真题专项练习(全国通用)-53金属与盐溶液反应(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 103.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-19 22:44:37 | ||
图片预览



文档简介
备考2023年中考化学真题专项练习(全国通用)-53金属与盐溶液反应
一、单选题
1.(2022·内蒙古呼伦贝尔·统考中考真题)下表物质中含有少量杂质,其中除杂方法正确的是
选项 物质 杂质 除去杂质的方法
A H2 水蒸气 通过盛有足量浓硫酸的洗气瓶
B Fe Fe2O3 加入足量稀盐酸,然后过滤
C 盐酸 硫酸 加入过量BaCl2溶液,然后过滤
D CuCl2溶液 ZnCl2 加入过量锌粉,然后过滤
A.A B.B C.C D.D
2.(2022·江苏镇江·统考中考真题)下列实验操作能达到实验目的的是
选项 物质 目的 主要实验操作
A 蚕丝、羊毛线 鉴别 取样,灼烧,闻气味
B Fe粉和CuSO4粉末 分离 溶解、过滤、洗涤、烘干,蒸发结晶
C 与NaOH中和后,盐酸是否有剩余 检验 取样,滴加AgNO3溶液,观察有无沉淀
D Ca(NO3)2溶液中混有CaCl2 除杂 加入过量的Na2CO3溶液,搅拌、过滤、洗涤,将所得固体溶于适量稀硝酸
A.A B.B C.C D.D
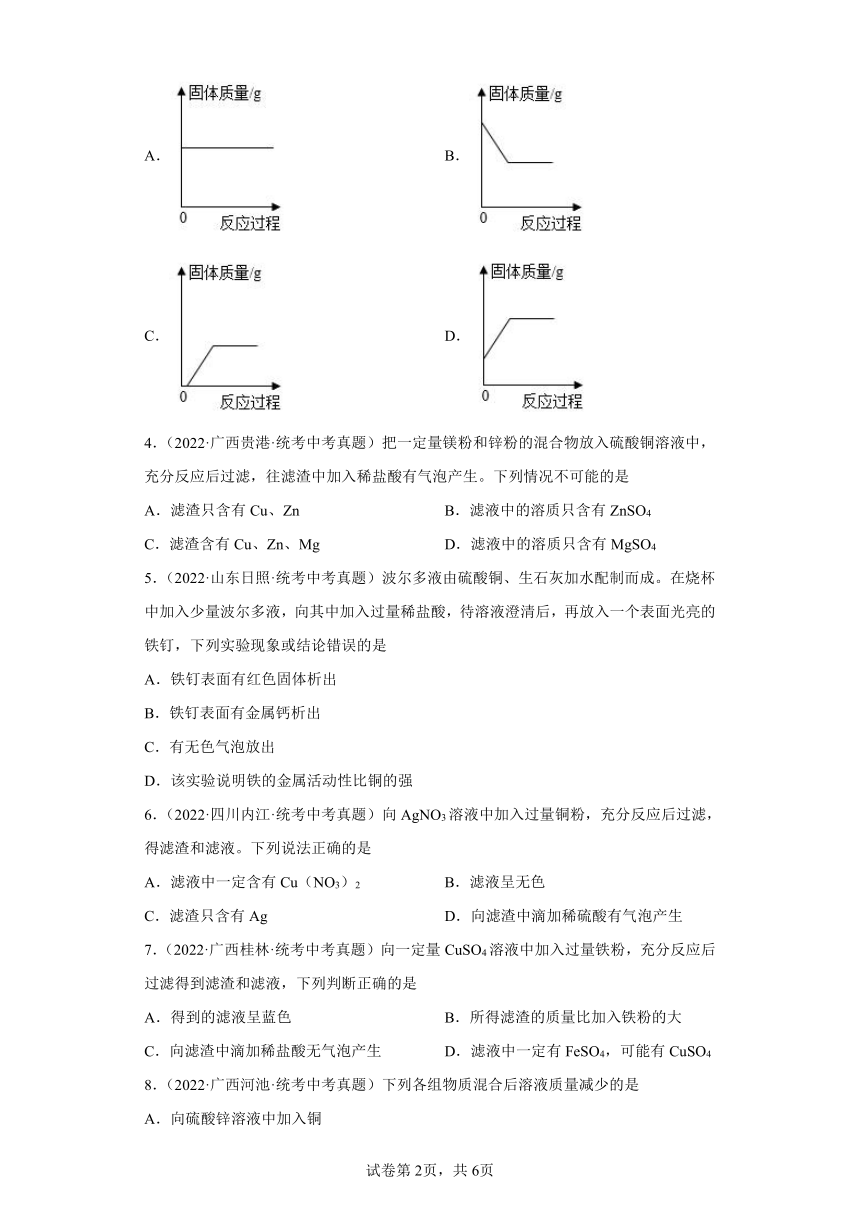
3.(2022·湖北荆门·统考中考真题)将m克加入到含n克CuSO4的溶液中,下列图像能正确表示反应中固体质量变化的是
A. B.
C. D.
4.(2022·广西贵港·统考中考真题)把一定量镁粉和锌粉的混合物放入硫酸铜溶液中,充分反应后过滤,往滤渣中加入稀盐酸有气泡产生。下列情况不可能的是
A.滤渣只含有Cu、Zn B.滤液中的溶质只含有ZnSO4
C.滤渣含有Cu、Zn、Mg D.滤液中的溶质只含有MgSO4
5.(2022·山东日照·统考中考真题)波尔多液由硫酸铜、生石灰加水配制而成。在烧杯中加入少量波尔多液,向其中加入过量稀盐酸,待溶液澄清后,再放入一个表面光亮的铁钉,下列实验现象或结论错误的是
A.铁钉表面有红色固体析出
B.铁钉表面有金属钙析出
C.有无色气泡放出
D.该实验说明铁的金属活动性比铜的强
6.(2022·四川内江·统考中考真题)向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液。下列说法正确的是
A.滤液中一定含有Cu(NO3)2 B.滤液呈无色
C.滤渣只含有Ag D.向滤渣中滴加稀硫酸有气泡产生
7.(2022·广西桂林·统考中考真题)向一定量CuSO4溶液中加入过量铁粉,充分反应后过滤得到滤渣和滤液,下列判断正确的是
A.得到的滤液呈蓝色 B.所得滤渣的质量比加入铁粉的大
C.向滤渣中滴加稀盐酸无气泡产生 D.滤液中一定有FeSO4,可能有CuSO4
8.(2022·广西河池·统考中考真题)下列各组物质混合后溶液质量减少的是
A.向硫酸锌溶液中加入铜
B.向NaCl溶液中加入NaCl
C.向稀盐酸中加入锌粒
D.向硫酸铜溶液中加入铁粉
9.(2022·广西梧州·统考中考真题)我国湿法炼铜的工艺在宋、元时期已相当成熟。小军同学在实验室模拟湿法炼铜,他取48.0g铁片放入一定质量的氯化铜溶液中,反应一段时间后, 得到50.0g固体。则所得固体中铁的质量分数为
A.28.0% B.68.0% C.92.5% D.96.0%
10.(2022·广西百色·统考中考真题)金属活动性顺序在科学研究中有重要应用。将打磨过的铁丝插入含有硝酸银和硝酸锌的混合溶液中,铁丝表面会覆盖一层物质,这层物质是
A.银和锌 B.银 C.锌 D.银和铁
11.(2022·贵州黔东南·统考中考真题)化学的特征之一是通过化学变化创造物质,因此研究物质的转化是化学学习的重要内容。下列物质在一定条件下的转化,不能一步实现的是:
A.FeSO4→FeCl2 B.H2SO4→MgO C.CaCO3→CaO D.Zn→Cu
12.(2022·广西·统考中考真题)在给定条件下,下列物质间的每一步转化,均能通过一步反应实现的是
A. B.
C. D.
13.(2022·湖北·统考中考真题)下列有关物质的除杂方法不正确的是
选项 物质 所含杂质 除杂方法
A CO2 O2 将气体通过灼热的铜网,充分反应
B NaOH溶液 Na2CO3 加入适量稀盐酸,充分反应
C Al2(SO4)3溶液 CuSO4 加入适量的铝粉充分反应后,过滤
D KCl固体 MnO2 加水溶解后,过滤,蒸发结晶
A.A B.B C.C D.D
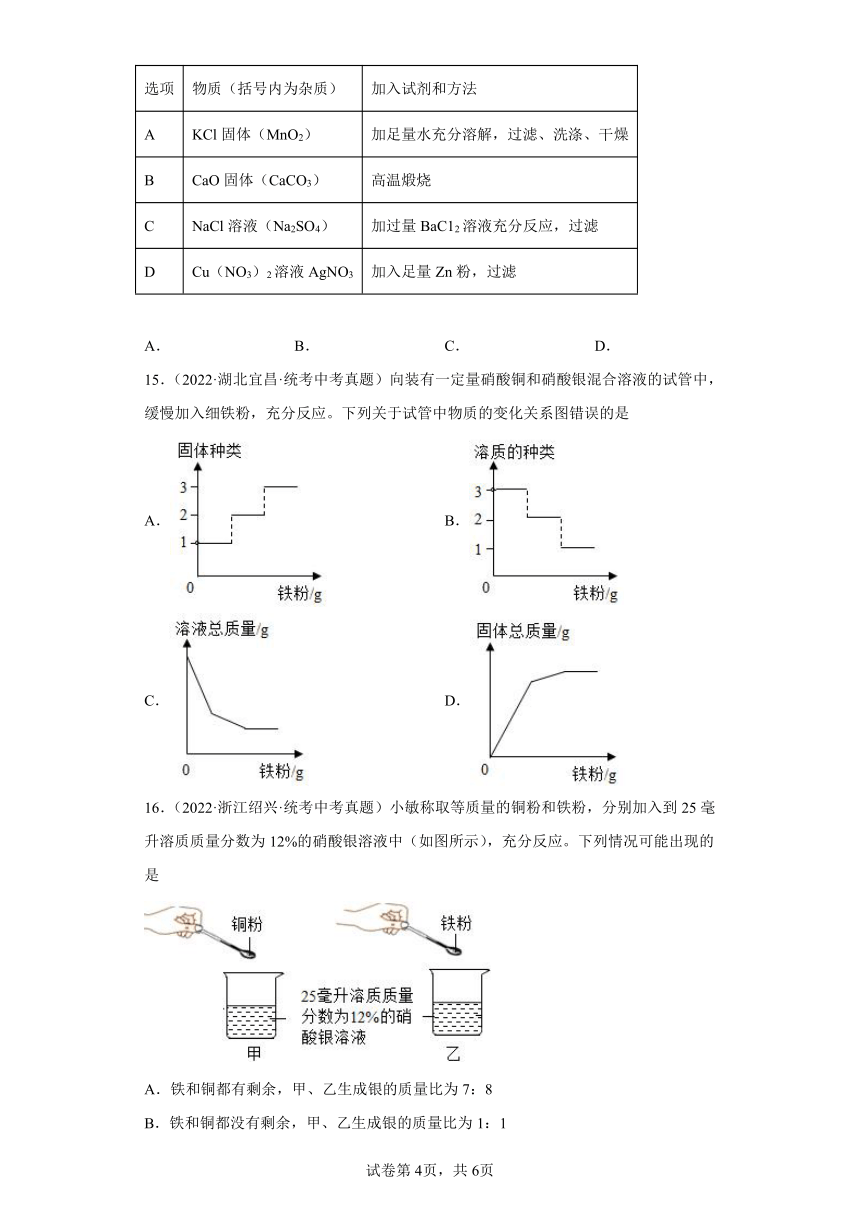
14.(2022·湖南湘潭·统考中考真题)下列除杂试剂和方法正确的是
选项 物质(括号内为杂质) 加入试剂和方法
A KCl固体(MnO2) 加足量水充分溶解,过滤、洗涤、干燥
B CaO固体(CaCO3) 高温煅烧
C NaCl溶液(Na2SO4) 加过量BaC12溶液充分反应,过滤
D Cu(NO3)2溶液AgNO3 加入足量Zn粉,过滤
A. B. C. D.
15.(2022·湖北宜昌·统考中考真题)向装有一定量硝酸铜和硝酸银混合溶液的试管中,缓慢加入细铁粉,充分反应。下列关于试管中物质的变化关系图错误的是
A. B.
C. D.
16.(2022·浙江绍兴·统考中考真题)小敏称取等质量的铜粉和铁粉,分别加入到25毫升溶质质量分数为12%的硝酸银溶液中(如图所示),充分反应。下列情况可能出现的是
A.铁和铜都有剩余,甲、乙生成银的质量比为7:8
B.铁和铜都没有剩余,甲、乙生成银的质量比为1:1
C.铁有剩余,铜没有剩余,甲、乙生成银的质量比为15:16
D.铜有剩余,铁没有剩余,甲、乙生成银的质量比为14:15
17.(2021·贵州黔西·中考真题)在Cu(NO3)2、Mg(NO3)2和AgNO3混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生。滤渣中没有
A.Cu B.Mg C.Ag D.Fe
18.(2021·江苏常州·统考中考真题)将某浓度CuCl2溶液和没有擦去氧化膜的镁条混合,观察到如下现象:镁条表面析出较多的紫红色固体,产生大量无色无味气体,过程中产生蓝色沉淀,同时测得反应体系溶液的pH变化曲线如图所示。下列说法错误的是
A.实验中氧化膜能与该溶液体系反应
B.镁条表面析出紫红色固体为金属铜
C.产生的无色无味气体不可能是氢气
D.产生蓝色沉淀可能是氢氧化铜固体
19.(2020·江苏·统考中考真题)向Cu(NO3)2和AgNO3的混合溶液中加入一定量的Fe粉,充分反应后过滤,再向滤渣中加入稀硫酸,发现有气泡产生。则对滤渣中固体成分推断正确的是
A.滤渣中一定含有Fe、Cu、Ag
B.滤渣中一定含有Fe和Cu,一定没有Ag
C.滤渣中一定含有Cu和Ag,可能含有Fe
D.滤渣中一定含有Fe,可能含有Cu和Ag
20.(2020·辽宁丹东·中考真题)下列物质可通过金属与稀盐酸反应直接得到的是( )
A.CuCl2 B.AgCl C.ZnCl2 D.FeCl3
二、多选题
21.(2020·江苏·统考中考真题)蚀刻印刷电路后的溶液为FeCl3、FeCl2和CuCl2的混合溶液。如图是向200.0g该溶液中加入铁粉的质量与溶液质量变化的关系。下列说法正确的是
A.0~a段发生的反应为2FeCl3+Fe=3FeCl2
B.x=16.8
C.原溶液中FeCl3与CuCl2的质量之比为65:81
D.取出c点溶液中的固体,投入足量CuCl2溶液,可得32.0gCu
22.(2020·山东济南·统考中考真题)向一定质量的AgNO3和Zn(NO3)2的混合溶液中加入ag铁粉,充分反应后过滤,得到一定温度下的滤液(不饱和)和滤渣,向滤液中加入稀盐酸,有白色沉淀生成。下列有关说法中,合理的是
A.滤液一定为浅绿色
B.滤渣质量一定大于ag
C.滤液中一定有Ag+、Fe2+和Zn2+
D.滤渣中加入稀盐酸一定有大量气泡冒出
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A、浓硫酸具有吸水性,氢气不和硫酸反应,故气体通过盛有足量浓硫酸的洗气瓶可以除去氢气中的水蒸气,选项正确;
B、氧化铁、铁两种物质都和盐酸反应,故该方法不能除去铁中含有的氧化铁,选项不正确;
C、硫酸和氯化钡反应生成硫酸钡沉淀和盐酸,但是加入过量的氯化钡和盐酸混合在一起,引入了新的杂质,故该方法不能除去盐酸中的硫酸,选项不正确;
D、氯化铜溶液和锌反应生成氯化锌和铜,把原物质氯化铜除去了,而杂质氯化锌没有除去,故该方法不能除去氯化铜溶液中的氯化锌,选项不正确。
故选A。
2.D
【详解】A.蚕丝、羊毛灼烧时都有烧焦羽毛的气味,则无法鉴别,该选项不正确;
B.加水后,铁和硫酸铜能发生反应生成铜和硫酸亚铁,该选项不正确;
C.氢氧化钠和盐酸反应生成氯化钠和水,氯化钠能与硝酸银反应生成氯化银沉淀,则不管是否盐酸有剩余,都会有沉淀,该选项不正确;
D.氯化钙、硝酸钙均能与碳酸钠反应生成碳酸钙沉淀,过滤后将碳酸钙沉淀加入稀硝酸中,碳酸钙与稀硝酸反应生成硝酸钙、水和二氧化碳,则可得到硝酸钙,该选项正确,
故选D。
3.D
【详解】将铁放入硫酸铜溶液中,铁会与硫酸铜溶液反应生成铜单质,,固体质量会比反应前质量增加,反应前含有固体铁,所以刚开始反应时固体质量不能为零,故选D。
4.B
【分析】在金属活动性顺序中,排在氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来。根据金属活动性顺序镁>锌>氢>铜,镁先与硫酸铜溶液反应生成铜和硫酸镁,镁反应完全之后,锌会与硫酸铜溶液反应生成铜和硫酸锌,充分反应后过滤,往滤渣中加入稀盐酸有气泡产生,说明滤渣中含有氢前金属,所以滤渣中一定含有锌,可能含有镁,由于硫酸铜的量不确定,所以滤渣中一定含有铜和锌,可能含有镁,滤液中的溶质一定含有硫酸镁,可能含有硫酸锌,一定不含硫酸铜。
【详解】A、充分反应后过滤,往滤渣中加入稀盐酸有气泡产生,说明滤渣中含有氢前金属,当镁恰好与硫酸铜反应完全时,此时滤渣只含有铜、锌,故A正确;
B、根据金属活动性顺序镁>锌>氢>铜,镁先与硫酸铜溶液反应生成铜和硫酸镁,镁反应完全之后,锌才会与硫酸铜溶液反应生成铜和硫酸锌,属于滤液中的溶质一定含有硫酸镁,可能含有硫酸锌,一定不含硫酸铜,故B错误;
C、由分析可知,滤渣中一定含有铜、锌,可能含有镁,所以当镁过量时,滤渣可能含有铜、锌、镁,故C正确;
D、由分析可知,滤液中的溶质一定含有硫酸镁,可能含有硫酸锌,一定不含硫酸铜,当硫酸铜与镁恰好完全反应时,此时滤液中的溶质只含有硫酸镁,故D正确;
故选B。
5.B
【分析】波尔多液由硫酸铜、生石灰加水配制而成,生石灰与水反应生成熟石灰氢氧化钙,再向波尔多液中加入过量的稀盐酸,反应后澄清的溶液中溶质的成分为硫酸铜、氯化钙和盐酸。
【详解】A、因为溶液中含有硫酸铜,铁的金属活动性比铜强,会与硫酸铜反应生成红色的金属铜,故A不符合题意;
B、铁的金属活动性比钙弱,所以铁不能与氯化钙反应,不会有钙析出,故B符合题意;
C、因为溶液中含有稀盐酸,铁会与稀盐酸反应生成无色气体氢气,故C不符合题意;
D、铁能将铜从它的盐溶液中置换出来,所以能证明铁的金属活动性比铜强,故D不符合题意。
故选B。
6.A
【分析】向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液,滤渣中一定含有过量的铜和银(硝酸银和铜反应生成),滤液中一定含有硝酸铜,一定没有硝酸银。
【详解】A、滤液中一定含有Cu(NO3)2,选项正确;
B、滤液中含有硝酸铜,所以呈蓝色,选项错误;
C、滤渣含有Ag和过量的铜,选项错误;
D、向滤渣铜和银中滴加稀硫酸没有气泡产生,因为都是氢后金属,选项错误。
故选:A。
7.B
【详解】A、铁与硫酸铜反应生成硫酸亚铁和铜,硫酸亚铁溶于水后溶液呈浅绿色,向一定量CuSO4溶液中加入过量铁粉,反应后的溶液中的溶质只有硫酸亚铁,溶液呈浅绿色,选项错误;
B、铁与硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu,由化学方程式可知,参加反应的铁与生成的铜的质量比=56:64,则所得滤渣的质量比加入铁粉的大,选项正确;
C、向一定量CuSO4溶液中加入过量铁粉,反应后过滤,滤渣中含有铜和铁,向滤渣中滴加稀盐酸后,铁与稀盐酸反应生成氯化亚铁和氢气,观察到有气泡产生,选项错误;
D、铁与硫酸铜反应生成硫酸亚铁和铜,向一定量CuSO4溶液中加入过量铁粉,则硫酸铜完全反应,所以滤液中一定有FeSO4,一定没有CuSO4,选项错误,故选B。
8.D
【详解】A、铜的位置排在锌的后面,向硫酸锌溶液中加入铜,不反应,溶液质量不变,故选项错误。
B、向NaCl溶液中加入NaCl,因为不知道原氯化钠溶液是否饱和,若原氯化钠溶液为不饱和溶液,则氯化钠能继续溶解,溶质质量增加,若原氯化钠溶液为饱和溶液,则氯化钠不能继续溶解,溶质质量不变,故选项错误。
C、向稀盐酸中加入锌粒生成氯化锌溶液和氢气,参加反应的锌的质量大于生成氢气的质量,则混合后溶液质量增加,故选项错误。
D、向硫酸铜溶液中加入铁粉生成硫酸亚铁溶液和铜,反应的化学方程式为Fe+CuSO4=FeSO4+Cu,每56份质量的铁可置换出64份质量的铜,溶液的质量会减少,故选项正确。
故选:D。
9.B
【详解】由方程式可知铁和铜的质量关系为56~64,设:参加反应的铁的质量为a,则生成铜的质量为,那么有,则a=14g,所以所得固体中铁的质量分数为。
故选:B。
10.B
【分析】根据金属活动性顺序可知,活泼金属放入到其他金属的盐溶液中,金属能与比这种金属活动性弱的金属盐溶液发生置换反应。由Zn>Fe>Ag可知:将打磨过的铁丝插入含有硝酸银和硝酸锌的混合溶液中,铁丝与硝酸银溶液反应,而不与硝酸锌溶液反应,故铁丝表面覆盖的物质是铁与硝酸银反应被置换出来的银单质。
【详解】故选B。
11.B
【详解】A、硫酸亚铁能与氯化钡反应生成硫酸钡和氯化亚铁,不符合题意;
B、硫酸不能一步转化为氧化镁,符合题意;
C、碳酸钙高温煅烧生成氧化钙和二氧化碳,不符合题意;
D、锌和硫酸铜反应生成硫酸锌和铜,不符合题意。
故选B。
12.C
【详解】A、铁在氧气中燃烧生成的是四氧化三铁,而不是氧化铁,故铁和氧气点燃要生成氧化铁,无法一步实现,不符合题意;
B、二氧化碳和氯化钠不能反应,故二氧化碳和氯化钠无法生成碳酸钠,不符合题意;
C、氧化铜加入稀盐酸能生成硫酸铜,再加入铁,能发生置换反应生成硫酸亚铁,均能一步实现,符合题意;
D、氢氧化钠溶液通入三氧化硫,生成的是硫酸钠而不是亚硫酸钠,故氢氧化钠和三氧化硫无法一步生成亚硫酸钠,不符合题意。
故选C。
13.B
【详解】A、CO2中混有的O2,将气体通过灼热的铜网,充分反应,铜会与氧气反应生成氧化铜,正确。
B、NaOH溶液中混有Na2CO3,加入适量稀盐酸,充分反应,稀盐酸会与氢氧化钠反应,也会与碳酸钠反应,违背除杂原则,选项错误。
C、Al2(SO4)3溶液中混有CuSO4,加入适量的铝粉充分反应后,过滤,铝会与硫酸铜反应生成硫酸铝,正确。
D、KCl固体中混有MnO2,加水溶解后,过滤,蒸发结晶即可得到氯化钾,二氧化锰在滤渣中,正确。
故选:B。
14.B
【详解】A、氯化钾溶于水,二氧化锰难溶于水,加入足量水充分溶解,过滤,蒸发结晶可得氯化钾,不符合题意;
B、碳酸钙高温煅烧生成氧化钙和二氧化碳,可除去杂质,符合题意;
C、加入过量的氯化钡溶液,氯化钡和硫酸钠反应生成硫酸钡和氯化钠,虽然除去了杂质,但是氯化钡过量,引入了新的杂质氯化钡,不符合题意;
D、加入足量锌粉,锌和硝酸银反应生成硝酸锌和银,锌和硝酸铜反应生成硝酸锌和铜,不但除去了杂质,也除去了原物质,不符合题意。
故选B。
15.D
【分析】根据金属的活泼性顺序铁>铜>银可知,硝酸铜和硝酸银的混合液中加入铁粉,铁先和硝酸银反应生成硝酸亚铁和银,当硝酸银消耗完全后铁和硝酸铜继续反应生成硝酸亚铁和铜,当硝酸铜液消耗完全后反应停止。发生的反应的方程式分别为、;
【详解】A、根据分析,铁粉加入一定量的混合液后,先有银单质析出,之后铁粉继续和硝酸铜反应有铜析出,最后铁粉过量时有铁剩余,则固体种类随着铁粉的加入,由银转变为银和铜,最终剩余固体为银、铜和铁三种,故A正确;
B、根据分析,未加入铁粉时混合液中溶质为硝酸银和硝酸铜两种;当加入少量铁粉后,铁和硝酸银反应生成硝酸亚铁,此时溶液中溶质包括硝酸银、硝酸铜、硝酸亚铁三种;当加入的铁粉恰好和硝酸银完全反应时,溶质包含硝酸亚铁和硝酸铜两种;当加入铁粉恰好和硝酸银、硝酸铜都恰好完全反应或者铁粉过量,反应后的溶液中溶质只有硝酸亚铁一种物质,故B正确;
C、根据分析可知,铁粉加入后先和硝酸银反应生成硝酸亚铁和银,56份质量的铁可以置换出216份质量的银,溶液质量快速减小;当铁和硝酸铜反应时,56份质量的铁可以置换出64份质量的铜,溶液质量较慢减小。当反应停止时,溶液总质量不再变化。故C正确;
D、根据分析可知,铁粉加入后先和硝酸银反应生成硝酸亚铁和银,56份质量的铁可以置换出216份质量的银,固体质量快速增大;当铁和硝酸铜反应时,56份质量的铁可以置换出64份质量的铜,溶液质量较慢增大。当反应停止时,随着铁粉的继续加入,固体质量会继续增大,而不是不变,故D错误;
故选D。
16.C
【分析】根据题目中的数据解和化学方程式进行分析。
【详解】由于金属的活动性顺序是铁>铜>银,等质量的铜粉和铁粉,反应的质量关系是:
A、铁和铜都有剩余时,因为消耗的硝酸银溶液的体积和溶质质量分数相同,甲、乙生成银的质量比为1:1,选项错误;
B、设加入铁和铜的质量为m,铁和铜都没有剩余,根据化学方程式,则生成银的质量比为:,选项错误;
C、由化学方程式可知,消耗等质量的硝酸银需要铁的质量少于铜的质量。所以加入等质量的铁和铜,可能铁有剩余而铜没有剩余。如铁有剩余而铜没有剩余则铁置换出的银的质量大于等于铜置换出银的质量,且铜和铁置换出银的质量比大于7:8,置换出银的质量比为15:16符合要求。选项正确。
D、由化学方程式可知,消耗等质量的硝酸银需要铁的质量少于铜的质量。所以加入等质量的铁和铜不可能铜有剩余而铁被完全消耗,选项错误;
故选:C。
17.B
【详解】
铁的金属活动性比银、铜强,比镁弱,Cu(NO3)2、Mg(NO3)2和AgNO3混合溶液中加入一定量的铁粉,不能与Mg(NO3)2溶液反应,铁先与AgNO3反应生成硝酸亚铁和银, AgNO3反应完,若还有铁粉,铁才能与Cu(NO3)2反应生成硝酸亚铁和铜。充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生,说明滤渣中含有铁,说明铁是过量的,则滤渣中一定含有银、铜、铁,一定没有镁。故选:B。
18.C
【详解】A.氯化铜属于强酸弱碱盐,氯化铜水解使溶液呈酸性,根据金属氧化物的性质可知氧化膜能与该溶液体系反应,故A正确;
B.镁可以置换出氯化铜溶液中的铜,所以镁条表面析出紫红色固体为金属铜,故B正确;
C.氯化铜是强酸弱碱盐,氯化铜水解使水溶液呈酸性,镁与酸反应生成盐和氢气,故C错误;
D.氯化铜水解生成氢氧化铜和氯化氢,随着氢气的不断析出,促进氯化铜的水解,当氢氧化铜达到一定量后会生成蓝色沉淀氢氧化铜,故D正确。
故选C。
19.A
【详解】根据金属活动性铁>铜>银,向Cu(NO3)2和AgNO3的混合溶液中加入一定量的Fe粉,铁先与AgNO3反应生成硝酸亚铁和银,AgNO3反应完,若还有铁粉,铁才能与Cu(NO3)2反应生成硝酸亚铁和铜。充分反应后过滤,再向滤渣中加入稀硫酸,发现有气泡产生,因为银、铜均不能与稀硫酸反应,铁能与稀硫酸反应生成氢气,所以滤渣中含有铁,因此滤渣中一定含有Fe、Cu、Ag。故选A。
20.C
【分析】排在氢前面的金属能与酸反应生成盐和氢气,氢后面的金属不与酸反应,铁和酸反应生成亚铁盐,不能生成正三价的铁盐,据此进行分析判断。
【详解】A、在金属活动性顺序中,铜排在氢后面,铜和盐酸不能发生反应,不能生成氯化铜,故选项错误;
B、在金属活动性顺序中,银排在氢后面,银和盐酸不能发生反应,不能生成氯化银,故选项错误;
C、在金属活动性顺序中,锌排在氢前面,锌和盐酸反应生成氯化锌和氢气,故选项正确;
D、在金属活动性顺序中,铁排在氢前面,能和盐酸反应生成氯化亚铁和氢气,不能生成氯化铁,故选项错误。
故选:C。
21.AC
【分析】分析图象可知:0~a段是铁与氯化铁反应,a~b段是铁与氯化铜反应,b~c段的质量不变,说明铁粉剩余。
【详解】A、向、和的混合溶液中加入铁粉后,由图可知,0~a段溶液的质量随着铁粉的加入不断增大,发生的反应是,故A说法正确;
B、a~b段溶液的质量随着铁粉的加入不断减少,发生的化学反应是,设a~b段加入的铁粉的质量为y,根据质量守恒定律,固体增加的质量=溶液减少的质量=205.6g-203.2g=2.4g;
y=16.8g
参加反应的铁粉质量为16.8g,所以x=5.6g+16.8g=22.4g,B说法不正确;
C、由图可知,0~a段参加反应的铁粉质量为5.6g,代入A中的化学方程式,即可算出的质量为32.5g,同理,根据选项B中的化学方程式可以计算出的质量为40.5g,则原溶液中与的质量比为32.5g:40.5g=65:81,C说法正确;
D、由上述分析可知,c点固体为铁粉与铜粉的混合物,把固体加入足量的溶液后发生的反应与a~b段相同,所以c点参与反应的铁粉质量为28.0g-5.6g=22.4g,代入化学方程式,即可计算出生成铜的质量为25.6g,D说法不正确。
故选AC。
22.ABC
【详解】由金属的活动性可知,锌比铁活泼,铁比银活泼,向某AgNO3和Zn(NO3)2的混合溶液中加入ag的Fe粉时,铁能和硝酸银反应生成硝酸亚铁和银,不能与硝酸锌反应;充分反应后过滤,向滤液中加入稀盐酸,有白色沉淀生成,说明了铁量不足,不能将硝酸银完全反应。所以:
A、由于滤液中含有硝酸亚铁,滤液一定为浅绿色,故A说法合理;
B、由铁与硝酸银的反应可知,每56份质量的铁能置换出216份质量的银,所以滤渣质量一定大于ag,故B说法合理;
C、由上述分析可知,滤液中一定有Ag+、Fe2+和Zn2+,故C说法合理;
D、由上述分析可知,滤渣中只含有银,加入稀盐酸一定没有有气泡冒出,故D说法不合理。
故选:ABC。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2022·内蒙古呼伦贝尔·统考中考真题)下表物质中含有少量杂质,其中除杂方法正确的是
选项 物质 杂质 除去杂质的方法
A H2 水蒸气 通过盛有足量浓硫酸的洗气瓶
B Fe Fe2O3 加入足量稀盐酸,然后过滤
C 盐酸 硫酸 加入过量BaCl2溶液,然后过滤
D CuCl2溶液 ZnCl2 加入过量锌粉,然后过滤
A.A B.B C.C D.D
2.(2022·江苏镇江·统考中考真题)下列实验操作能达到实验目的的是
选项 物质 目的 主要实验操作
A 蚕丝、羊毛线 鉴别 取样,灼烧,闻气味
B Fe粉和CuSO4粉末 分离 溶解、过滤、洗涤、烘干,蒸发结晶
C 与NaOH中和后,盐酸是否有剩余 检验 取样,滴加AgNO3溶液,观察有无沉淀
D Ca(NO3)2溶液中混有CaCl2 除杂 加入过量的Na2CO3溶液,搅拌、过滤、洗涤,将所得固体溶于适量稀硝酸
A.A B.B C.C D.D
3.(2022·湖北荆门·统考中考真题)将m克加入到含n克CuSO4的溶液中,下列图像能正确表示反应中固体质量变化的是
A. B.
C. D.
4.(2022·广西贵港·统考中考真题)把一定量镁粉和锌粉的混合物放入硫酸铜溶液中,充分反应后过滤,往滤渣中加入稀盐酸有气泡产生。下列情况不可能的是
A.滤渣只含有Cu、Zn B.滤液中的溶质只含有ZnSO4
C.滤渣含有Cu、Zn、Mg D.滤液中的溶质只含有MgSO4
5.(2022·山东日照·统考中考真题)波尔多液由硫酸铜、生石灰加水配制而成。在烧杯中加入少量波尔多液,向其中加入过量稀盐酸,待溶液澄清后,再放入一个表面光亮的铁钉,下列实验现象或结论错误的是
A.铁钉表面有红色固体析出
B.铁钉表面有金属钙析出
C.有无色气泡放出
D.该实验说明铁的金属活动性比铜的强
6.(2022·四川内江·统考中考真题)向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液。下列说法正确的是
A.滤液中一定含有Cu(NO3)2 B.滤液呈无色
C.滤渣只含有Ag D.向滤渣中滴加稀硫酸有气泡产生
7.(2022·广西桂林·统考中考真题)向一定量CuSO4溶液中加入过量铁粉,充分反应后过滤得到滤渣和滤液,下列判断正确的是
A.得到的滤液呈蓝色 B.所得滤渣的质量比加入铁粉的大
C.向滤渣中滴加稀盐酸无气泡产生 D.滤液中一定有FeSO4,可能有CuSO4
8.(2022·广西河池·统考中考真题)下列各组物质混合后溶液质量减少的是
A.向硫酸锌溶液中加入铜
B.向NaCl溶液中加入NaCl
C.向稀盐酸中加入锌粒
D.向硫酸铜溶液中加入铁粉
9.(2022·广西梧州·统考中考真题)我国湿法炼铜的工艺在宋、元时期已相当成熟。小军同学在实验室模拟湿法炼铜,他取48.0g铁片放入一定质量的氯化铜溶液中,反应一段时间后, 得到50.0g固体。则所得固体中铁的质量分数为
A.28.0% B.68.0% C.92.5% D.96.0%
10.(2022·广西百色·统考中考真题)金属活动性顺序在科学研究中有重要应用。将打磨过的铁丝插入含有硝酸银和硝酸锌的混合溶液中,铁丝表面会覆盖一层物质,这层物质是
A.银和锌 B.银 C.锌 D.银和铁
11.(2022·贵州黔东南·统考中考真题)化学的特征之一是通过化学变化创造物质,因此研究物质的转化是化学学习的重要内容。下列物质在一定条件下的转化,不能一步实现的是:
A.FeSO4→FeCl2 B.H2SO4→MgO C.CaCO3→CaO D.Zn→Cu
12.(2022·广西·统考中考真题)在给定条件下,下列物质间的每一步转化,均能通过一步反应实现的是
A. B.
C. D.
13.(2022·湖北·统考中考真题)下列有关物质的除杂方法不正确的是
选项 物质 所含杂质 除杂方法
A CO2 O2 将气体通过灼热的铜网,充分反应
B NaOH溶液 Na2CO3 加入适量稀盐酸,充分反应
C Al2(SO4)3溶液 CuSO4 加入适量的铝粉充分反应后,过滤
D KCl固体 MnO2 加水溶解后,过滤,蒸发结晶
A.A B.B C.C D.D
14.(2022·湖南湘潭·统考中考真题)下列除杂试剂和方法正确的是
选项 物质(括号内为杂质) 加入试剂和方法
A KCl固体(MnO2) 加足量水充分溶解,过滤、洗涤、干燥
B CaO固体(CaCO3) 高温煅烧
C NaCl溶液(Na2SO4) 加过量BaC12溶液充分反应,过滤
D Cu(NO3)2溶液AgNO3 加入足量Zn粉,过滤
A. B. C. D.
15.(2022·湖北宜昌·统考中考真题)向装有一定量硝酸铜和硝酸银混合溶液的试管中,缓慢加入细铁粉,充分反应。下列关于试管中物质的变化关系图错误的是
A. B.
C. D.
16.(2022·浙江绍兴·统考中考真题)小敏称取等质量的铜粉和铁粉,分别加入到25毫升溶质质量分数为12%的硝酸银溶液中(如图所示),充分反应。下列情况可能出现的是
A.铁和铜都有剩余,甲、乙生成银的质量比为7:8
B.铁和铜都没有剩余,甲、乙生成银的质量比为1:1
C.铁有剩余,铜没有剩余,甲、乙生成银的质量比为15:16
D.铜有剩余,铁没有剩余,甲、乙生成银的质量比为14:15
17.(2021·贵州黔西·中考真题)在Cu(NO3)2、Mg(NO3)2和AgNO3混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生。滤渣中没有
A.Cu B.Mg C.Ag D.Fe
18.(2021·江苏常州·统考中考真题)将某浓度CuCl2溶液和没有擦去氧化膜的镁条混合,观察到如下现象:镁条表面析出较多的紫红色固体,产生大量无色无味气体,过程中产生蓝色沉淀,同时测得反应体系溶液的pH变化曲线如图所示。下列说法错误的是
A.实验中氧化膜能与该溶液体系反应
B.镁条表面析出紫红色固体为金属铜
C.产生的无色无味气体不可能是氢气
D.产生蓝色沉淀可能是氢氧化铜固体
19.(2020·江苏·统考中考真题)向Cu(NO3)2和AgNO3的混合溶液中加入一定量的Fe粉,充分反应后过滤,再向滤渣中加入稀硫酸,发现有气泡产生。则对滤渣中固体成分推断正确的是
A.滤渣中一定含有Fe、Cu、Ag
B.滤渣中一定含有Fe和Cu,一定没有Ag
C.滤渣中一定含有Cu和Ag,可能含有Fe
D.滤渣中一定含有Fe,可能含有Cu和Ag
20.(2020·辽宁丹东·中考真题)下列物质可通过金属与稀盐酸反应直接得到的是( )
A.CuCl2 B.AgCl C.ZnCl2 D.FeCl3
二、多选题
21.(2020·江苏·统考中考真题)蚀刻印刷电路后的溶液为FeCl3、FeCl2和CuCl2的混合溶液。如图是向200.0g该溶液中加入铁粉的质量与溶液质量变化的关系。下列说法正确的是
A.0~a段发生的反应为2FeCl3+Fe=3FeCl2
B.x=16.8
C.原溶液中FeCl3与CuCl2的质量之比为65:81
D.取出c点溶液中的固体,投入足量CuCl2溶液,可得32.0gCu
22.(2020·山东济南·统考中考真题)向一定质量的AgNO3和Zn(NO3)2的混合溶液中加入ag铁粉,充分反应后过滤,得到一定温度下的滤液(不饱和)和滤渣,向滤液中加入稀盐酸,有白色沉淀生成。下列有关说法中,合理的是
A.滤液一定为浅绿色
B.滤渣质量一定大于ag
C.滤液中一定有Ag+、Fe2+和Zn2+
D.滤渣中加入稀盐酸一定有大量气泡冒出
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A、浓硫酸具有吸水性,氢气不和硫酸反应,故气体通过盛有足量浓硫酸的洗气瓶可以除去氢气中的水蒸气,选项正确;
B、氧化铁、铁两种物质都和盐酸反应,故该方法不能除去铁中含有的氧化铁,选项不正确;
C、硫酸和氯化钡反应生成硫酸钡沉淀和盐酸,但是加入过量的氯化钡和盐酸混合在一起,引入了新的杂质,故该方法不能除去盐酸中的硫酸,选项不正确;
D、氯化铜溶液和锌反应生成氯化锌和铜,把原物质氯化铜除去了,而杂质氯化锌没有除去,故该方法不能除去氯化铜溶液中的氯化锌,选项不正确。
故选A。
2.D
【详解】A.蚕丝、羊毛灼烧时都有烧焦羽毛的气味,则无法鉴别,该选项不正确;
B.加水后,铁和硫酸铜能发生反应生成铜和硫酸亚铁,该选项不正确;
C.氢氧化钠和盐酸反应生成氯化钠和水,氯化钠能与硝酸银反应生成氯化银沉淀,则不管是否盐酸有剩余,都会有沉淀,该选项不正确;
D.氯化钙、硝酸钙均能与碳酸钠反应生成碳酸钙沉淀,过滤后将碳酸钙沉淀加入稀硝酸中,碳酸钙与稀硝酸反应生成硝酸钙、水和二氧化碳,则可得到硝酸钙,该选项正确,
故选D。
3.D
【详解】将铁放入硫酸铜溶液中,铁会与硫酸铜溶液反应生成铜单质,,固体质量会比反应前质量增加,反应前含有固体铁,所以刚开始反应时固体质量不能为零,故选D。
4.B
【分析】在金属活动性顺序中,排在氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来。根据金属活动性顺序镁>锌>氢>铜,镁先与硫酸铜溶液反应生成铜和硫酸镁,镁反应完全之后,锌会与硫酸铜溶液反应生成铜和硫酸锌,充分反应后过滤,往滤渣中加入稀盐酸有气泡产生,说明滤渣中含有氢前金属,所以滤渣中一定含有锌,可能含有镁,由于硫酸铜的量不确定,所以滤渣中一定含有铜和锌,可能含有镁,滤液中的溶质一定含有硫酸镁,可能含有硫酸锌,一定不含硫酸铜。
【详解】A、充分反应后过滤,往滤渣中加入稀盐酸有气泡产生,说明滤渣中含有氢前金属,当镁恰好与硫酸铜反应完全时,此时滤渣只含有铜、锌,故A正确;
B、根据金属活动性顺序镁>锌>氢>铜,镁先与硫酸铜溶液反应生成铜和硫酸镁,镁反应完全之后,锌才会与硫酸铜溶液反应生成铜和硫酸锌,属于滤液中的溶质一定含有硫酸镁,可能含有硫酸锌,一定不含硫酸铜,故B错误;
C、由分析可知,滤渣中一定含有铜、锌,可能含有镁,所以当镁过量时,滤渣可能含有铜、锌、镁,故C正确;
D、由分析可知,滤液中的溶质一定含有硫酸镁,可能含有硫酸锌,一定不含硫酸铜,当硫酸铜与镁恰好完全反应时,此时滤液中的溶质只含有硫酸镁,故D正确;
故选B。
5.B
【分析】波尔多液由硫酸铜、生石灰加水配制而成,生石灰与水反应生成熟石灰氢氧化钙,再向波尔多液中加入过量的稀盐酸,反应后澄清的溶液中溶质的成分为硫酸铜、氯化钙和盐酸。
【详解】A、因为溶液中含有硫酸铜,铁的金属活动性比铜强,会与硫酸铜反应生成红色的金属铜,故A不符合题意;
B、铁的金属活动性比钙弱,所以铁不能与氯化钙反应,不会有钙析出,故B符合题意;
C、因为溶液中含有稀盐酸,铁会与稀盐酸反应生成无色气体氢气,故C不符合题意;
D、铁能将铜从它的盐溶液中置换出来,所以能证明铁的金属活动性比铜强,故D不符合题意。
故选B。
6.A
【分析】向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液,滤渣中一定含有过量的铜和银(硝酸银和铜反应生成),滤液中一定含有硝酸铜,一定没有硝酸银。
【详解】A、滤液中一定含有Cu(NO3)2,选项正确;
B、滤液中含有硝酸铜,所以呈蓝色,选项错误;
C、滤渣含有Ag和过量的铜,选项错误;
D、向滤渣铜和银中滴加稀硫酸没有气泡产生,因为都是氢后金属,选项错误。
故选:A。
7.B
【详解】A、铁与硫酸铜反应生成硫酸亚铁和铜,硫酸亚铁溶于水后溶液呈浅绿色,向一定量CuSO4溶液中加入过量铁粉,反应后的溶液中的溶质只有硫酸亚铁,溶液呈浅绿色,选项错误;
B、铁与硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu,由化学方程式可知,参加反应的铁与生成的铜的质量比=56:64,则所得滤渣的质量比加入铁粉的大,选项正确;
C、向一定量CuSO4溶液中加入过量铁粉,反应后过滤,滤渣中含有铜和铁,向滤渣中滴加稀盐酸后,铁与稀盐酸反应生成氯化亚铁和氢气,观察到有气泡产生,选项错误;
D、铁与硫酸铜反应生成硫酸亚铁和铜,向一定量CuSO4溶液中加入过量铁粉,则硫酸铜完全反应,所以滤液中一定有FeSO4,一定没有CuSO4,选项错误,故选B。
8.D
【详解】A、铜的位置排在锌的后面,向硫酸锌溶液中加入铜,不反应,溶液质量不变,故选项错误。
B、向NaCl溶液中加入NaCl,因为不知道原氯化钠溶液是否饱和,若原氯化钠溶液为不饱和溶液,则氯化钠能继续溶解,溶质质量增加,若原氯化钠溶液为饱和溶液,则氯化钠不能继续溶解,溶质质量不变,故选项错误。
C、向稀盐酸中加入锌粒生成氯化锌溶液和氢气,参加反应的锌的质量大于生成氢气的质量,则混合后溶液质量增加,故选项错误。
D、向硫酸铜溶液中加入铁粉生成硫酸亚铁溶液和铜,反应的化学方程式为Fe+CuSO4=FeSO4+Cu,每56份质量的铁可置换出64份质量的铜,溶液的质量会减少,故选项正确。
故选:D。
9.B
【详解】由方程式可知铁和铜的质量关系为56~64,设:参加反应的铁的质量为a,则生成铜的质量为,那么有,则a=14g,所以所得固体中铁的质量分数为。
故选:B。
10.B
【分析】根据金属活动性顺序可知,活泼金属放入到其他金属的盐溶液中,金属能与比这种金属活动性弱的金属盐溶液发生置换反应。由Zn>Fe>Ag可知:将打磨过的铁丝插入含有硝酸银和硝酸锌的混合溶液中,铁丝与硝酸银溶液反应,而不与硝酸锌溶液反应,故铁丝表面覆盖的物质是铁与硝酸银反应被置换出来的银单质。
【详解】故选B。
11.B
【详解】A、硫酸亚铁能与氯化钡反应生成硫酸钡和氯化亚铁,不符合题意;
B、硫酸不能一步转化为氧化镁,符合题意;
C、碳酸钙高温煅烧生成氧化钙和二氧化碳,不符合题意;
D、锌和硫酸铜反应生成硫酸锌和铜,不符合题意。
故选B。
12.C
【详解】A、铁在氧气中燃烧生成的是四氧化三铁,而不是氧化铁,故铁和氧气点燃要生成氧化铁,无法一步实现,不符合题意;
B、二氧化碳和氯化钠不能反应,故二氧化碳和氯化钠无法生成碳酸钠,不符合题意;
C、氧化铜加入稀盐酸能生成硫酸铜,再加入铁,能发生置换反应生成硫酸亚铁,均能一步实现,符合题意;
D、氢氧化钠溶液通入三氧化硫,生成的是硫酸钠而不是亚硫酸钠,故氢氧化钠和三氧化硫无法一步生成亚硫酸钠,不符合题意。
故选C。
13.B
【详解】A、CO2中混有的O2,将气体通过灼热的铜网,充分反应,铜会与氧气反应生成氧化铜,正确。
B、NaOH溶液中混有Na2CO3,加入适量稀盐酸,充分反应,稀盐酸会与氢氧化钠反应,也会与碳酸钠反应,违背除杂原则,选项错误。
C、Al2(SO4)3溶液中混有CuSO4,加入适量的铝粉充分反应后,过滤,铝会与硫酸铜反应生成硫酸铝,正确。
D、KCl固体中混有MnO2,加水溶解后,过滤,蒸发结晶即可得到氯化钾,二氧化锰在滤渣中,正确。
故选:B。
14.B
【详解】A、氯化钾溶于水,二氧化锰难溶于水,加入足量水充分溶解,过滤,蒸发结晶可得氯化钾,不符合题意;
B、碳酸钙高温煅烧生成氧化钙和二氧化碳,可除去杂质,符合题意;
C、加入过量的氯化钡溶液,氯化钡和硫酸钠反应生成硫酸钡和氯化钠,虽然除去了杂质,但是氯化钡过量,引入了新的杂质氯化钡,不符合题意;
D、加入足量锌粉,锌和硝酸银反应生成硝酸锌和银,锌和硝酸铜反应生成硝酸锌和铜,不但除去了杂质,也除去了原物质,不符合题意。
故选B。
15.D
【分析】根据金属的活泼性顺序铁>铜>银可知,硝酸铜和硝酸银的混合液中加入铁粉,铁先和硝酸银反应生成硝酸亚铁和银,当硝酸银消耗完全后铁和硝酸铜继续反应生成硝酸亚铁和铜,当硝酸铜液消耗完全后反应停止。发生的反应的方程式分别为、;
【详解】A、根据分析,铁粉加入一定量的混合液后,先有银单质析出,之后铁粉继续和硝酸铜反应有铜析出,最后铁粉过量时有铁剩余,则固体种类随着铁粉的加入,由银转变为银和铜,最终剩余固体为银、铜和铁三种,故A正确;
B、根据分析,未加入铁粉时混合液中溶质为硝酸银和硝酸铜两种;当加入少量铁粉后,铁和硝酸银反应生成硝酸亚铁,此时溶液中溶质包括硝酸银、硝酸铜、硝酸亚铁三种;当加入的铁粉恰好和硝酸银完全反应时,溶质包含硝酸亚铁和硝酸铜两种;当加入铁粉恰好和硝酸银、硝酸铜都恰好完全反应或者铁粉过量,反应后的溶液中溶质只有硝酸亚铁一种物质,故B正确;
C、根据分析可知,铁粉加入后先和硝酸银反应生成硝酸亚铁和银,56份质量的铁可以置换出216份质量的银,溶液质量快速减小;当铁和硝酸铜反应时,56份质量的铁可以置换出64份质量的铜,溶液质量较慢减小。当反应停止时,溶液总质量不再变化。故C正确;
D、根据分析可知,铁粉加入后先和硝酸银反应生成硝酸亚铁和银,56份质量的铁可以置换出216份质量的银,固体质量快速增大;当铁和硝酸铜反应时,56份质量的铁可以置换出64份质量的铜,溶液质量较慢增大。当反应停止时,随着铁粉的继续加入,固体质量会继续增大,而不是不变,故D错误;
故选D。
16.C
【分析】根据题目中的数据解和化学方程式进行分析。
【详解】由于金属的活动性顺序是铁>铜>银,等质量的铜粉和铁粉,反应的质量关系是:
A、铁和铜都有剩余时,因为消耗的硝酸银溶液的体积和溶质质量分数相同,甲、乙生成银的质量比为1:1,选项错误;
B、设加入铁和铜的质量为m,铁和铜都没有剩余,根据化学方程式,则生成银的质量比为:,选项错误;
C、由化学方程式可知,消耗等质量的硝酸银需要铁的质量少于铜的质量。所以加入等质量的铁和铜,可能铁有剩余而铜没有剩余。如铁有剩余而铜没有剩余则铁置换出的银的质量大于等于铜置换出银的质量,且铜和铁置换出银的质量比大于7:8,置换出银的质量比为15:16符合要求。选项正确。
D、由化学方程式可知,消耗等质量的硝酸银需要铁的质量少于铜的质量。所以加入等质量的铁和铜不可能铜有剩余而铁被完全消耗,选项错误;
故选:C。
17.B
【详解】
铁的金属活动性比银、铜强,比镁弱,Cu(NO3)2、Mg(NO3)2和AgNO3混合溶液中加入一定量的铁粉,不能与Mg(NO3)2溶液反应,铁先与AgNO3反应生成硝酸亚铁和银, AgNO3反应完,若还有铁粉,铁才能与Cu(NO3)2反应生成硝酸亚铁和铜。充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生,说明滤渣中含有铁,说明铁是过量的,则滤渣中一定含有银、铜、铁,一定没有镁。故选:B。
18.C
【详解】A.氯化铜属于强酸弱碱盐,氯化铜水解使溶液呈酸性,根据金属氧化物的性质可知氧化膜能与该溶液体系反应,故A正确;
B.镁可以置换出氯化铜溶液中的铜,所以镁条表面析出紫红色固体为金属铜,故B正确;
C.氯化铜是强酸弱碱盐,氯化铜水解使水溶液呈酸性,镁与酸反应生成盐和氢气,故C错误;
D.氯化铜水解生成氢氧化铜和氯化氢,随着氢气的不断析出,促进氯化铜的水解,当氢氧化铜达到一定量后会生成蓝色沉淀氢氧化铜,故D正确。
故选C。
19.A
【详解】根据金属活动性铁>铜>银,向Cu(NO3)2和AgNO3的混合溶液中加入一定量的Fe粉,铁先与AgNO3反应生成硝酸亚铁和银,AgNO3反应完,若还有铁粉,铁才能与Cu(NO3)2反应生成硝酸亚铁和铜。充分反应后过滤,再向滤渣中加入稀硫酸,发现有气泡产生,因为银、铜均不能与稀硫酸反应,铁能与稀硫酸反应生成氢气,所以滤渣中含有铁,因此滤渣中一定含有Fe、Cu、Ag。故选A。
20.C
【分析】排在氢前面的金属能与酸反应生成盐和氢气,氢后面的金属不与酸反应,铁和酸反应生成亚铁盐,不能生成正三价的铁盐,据此进行分析判断。
【详解】A、在金属活动性顺序中,铜排在氢后面,铜和盐酸不能发生反应,不能生成氯化铜,故选项错误;
B、在金属活动性顺序中,银排在氢后面,银和盐酸不能发生反应,不能生成氯化银,故选项错误;
C、在金属活动性顺序中,锌排在氢前面,锌和盐酸反应生成氯化锌和氢气,故选项正确;
D、在金属活动性顺序中,铁排在氢前面,能和盐酸反应生成氯化亚铁和氢气,不能生成氯化铁,故选项错误。
故选:C。
21.AC
【分析】分析图象可知:0~a段是铁与氯化铁反应,a~b段是铁与氯化铜反应,b~c段的质量不变,说明铁粉剩余。
【详解】A、向、和的混合溶液中加入铁粉后,由图可知,0~a段溶液的质量随着铁粉的加入不断增大,发生的反应是,故A说法正确;
B、a~b段溶液的质量随着铁粉的加入不断减少,发生的化学反应是,设a~b段加入的铁粉的质量为y,根据质量守恒定律,固体增加的质量=溶液减少的质量=205.6g-203.2g=2.4g;
y=16.8g
参加反应的铁粉质量为16.8g,所以x=5.6g+16.8g=22.4g,B说法不正确;
C、由图可知,0~a段参加反应的铁粉质量为5.6g,代入A中的化学方程式,即可算出的质量为32.5g,同理,根据选项B中的化学方程式可以计算出的质量为40.5g,则原溶液中与的质量比为32.5g:40.5g=65:81,C说法正确;
D、由上述分析可知,c点固体为铁粉与铜粉的混合物,把固体加入足量的溶液后发生的反应与a~b段相同,所以c点参与反应的铁粉质量为28.0g-5.6g=22.4g,代入化学方程式,即可计算出生成铜的质量为25.6g,D说法不正确。
故选AC。
22.ABC
【详解】由金属的活动性可知,锌比铁活泼,铁比银活泼,向某AgNO3和Zn(NO3)2的混合溶液中加入ag的Fe粉时,铁能和硝酸银反应生成硝酸亚铁和银,不能与硝酸锌反应;充分反应后过滤,向滤液中加入稀盐酸,有白色沉淀生成,说明了铁量不足,不能将硝酸银完全反应。所以:
A、由于滤液中含有硝酸亚铁,滤液一定为浅绿色,故A说法合理;
B、由铁与硝酸银的反应可知,每56份质量的铁能置换出216份质量的银,所以滤渣质量一定大于ag,故B说法合理;
C、由上述分析可知,滤液中一定有Ag+、Fe2+和Zn2+,故C说法合理;
D、由上述分析可知,滤渣中只含有银,加入稀盐酸一定没有有气泡冒出,故D说法不合理。
故选:ABC。
答案第1页,共2页
答案第1页,共2页
同课章节目录
