备考2023年中考化学真题专项练习(全国通用)-86有关溶液的计算(含解析)
文档属性
| 名称 | 备考2023年中考化学真题专项练习(全国通用)-86有关溶液的计算(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 260.6KB | ||
| 资源类型 | 教案 | ||
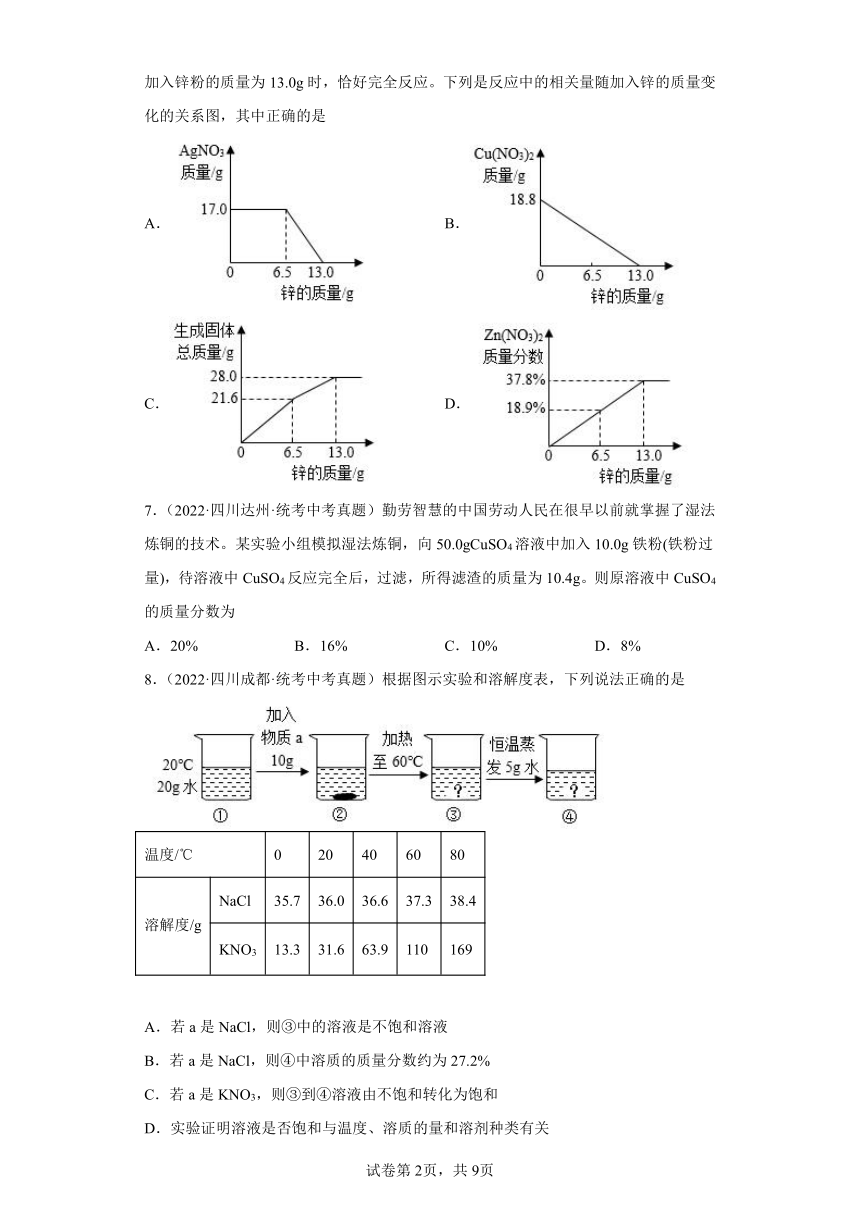
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
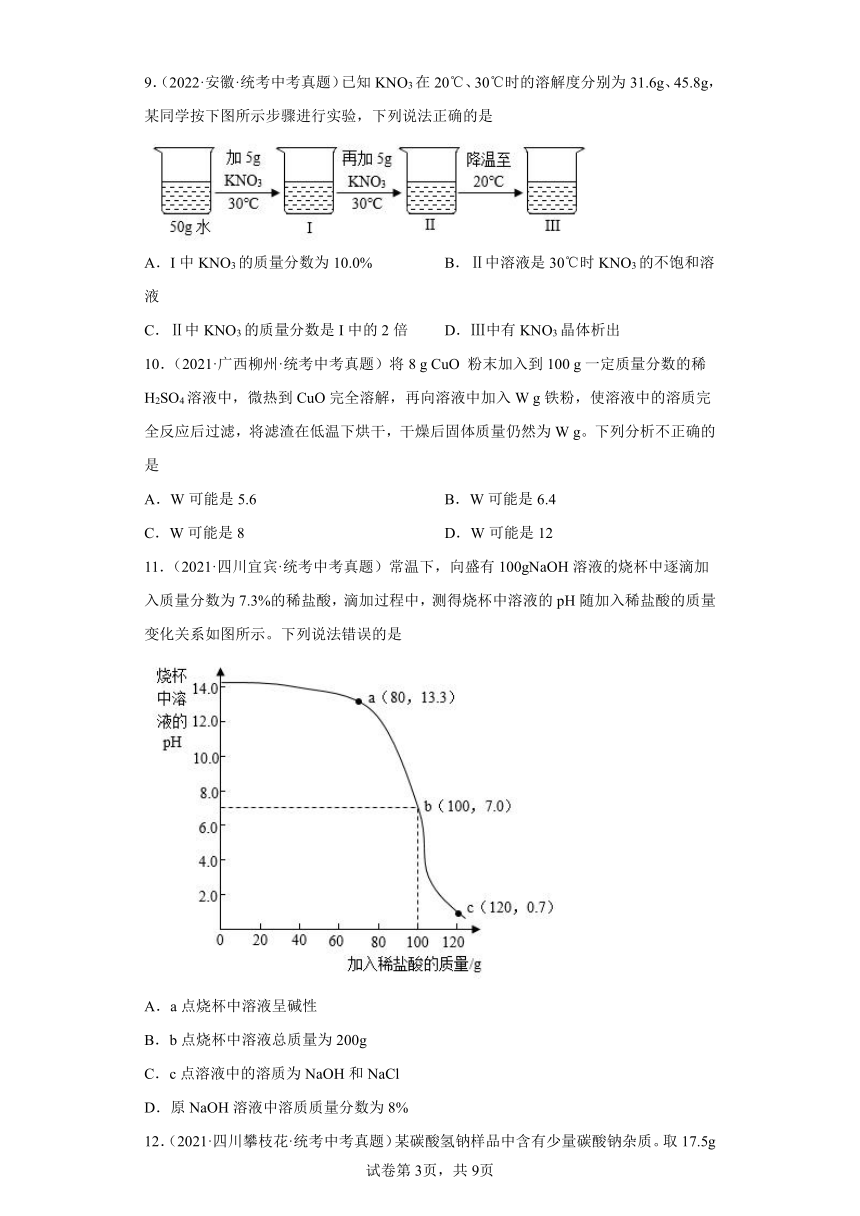
| 更新时间 | 2023-04-20 06:51:03 | ||
图片预览

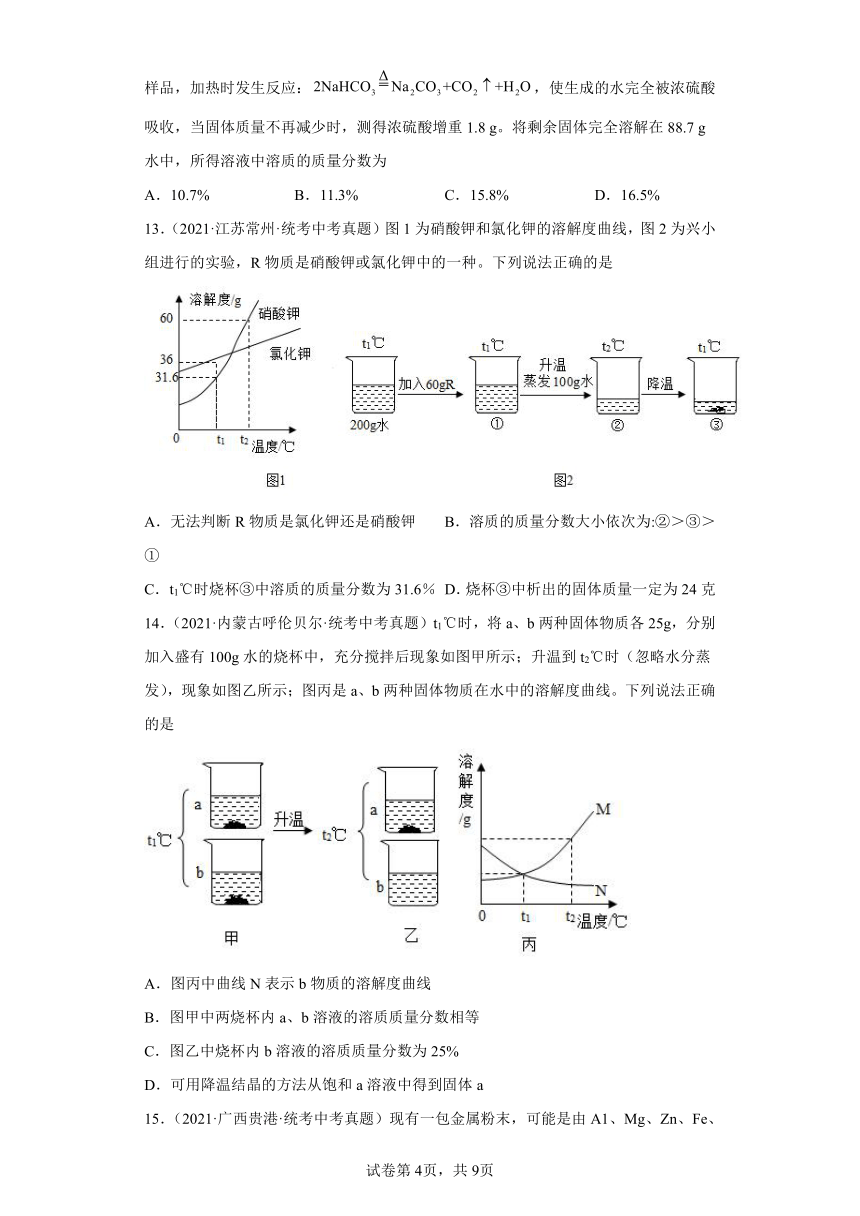

文档简介
备考2023年中考化学真题专项练习(全国通用)-86有关溶液的计算
一、单选题
1.(2022·山东青岛·统考中考真题)医生常用生理盐水(溶质质量分数为0.9%)给患者输液。下列对生理盐水的理解不正确的是
A.生理盐水中氯化钠是溶质,水是溶剂
B.生理盐水中氯化钠与水的质量比为9:1000
C.每输入100g生理盐水,进入患者体内的氯化钠质量为0.9g
D.输液时,输液管中和输液瓶中生理盐水的溶质质量分数相同
2.(2022·山东烟台·统考中考真题)实验室用固体氯化钠配制50g溶质质量分数为16%的氯化钠溶液。下列说法正确的是
A.所需固体氯化钠的质量是8.0g
B.固体氯化钠可以直接放在托盘天平的左盘上称量
C.溶解固体氯化钠时,用玻璃棒搅拌能增大氯化钠的溶解度
D.用量筒量取42mL水时,若仰视读数,会导致配制的溶液溶质质量分数偏大
3.(2022·黑龙江绥化·统考中考真题)恰好中和100g溶质质量分数为8.0%的氢氧化钠溶液,需要100g溶质质量分数为7.3%的稀盐酸。若将稀盐酸换成100g溶质质量分数为7.3%的稀硫酸与其反应,则充分反应后溶液的pH
A.小于7 B.大于7 C.等于7 D.无法判断
4.(2022·福建·统考中考真题)从植物“地不容”中提取抑制新冠病毒的新药—千金藤素,需用到5%的Na2CO3溶液。若配制100g该溶液,需要称取Na2CO3的质量为
A.95g B.90g C.20g D.5 g
5.(2022·湖南邵阳·统考中考真题)实验室配制50g溶质质量分数为10%的氯化钠溶液,下列说法正确的是
A.计算得出所需氯化钠固体的质量为5g
B.将氯化钠固体直接放在托盘天平的右盘进行称量
C.溶解氯化钠时用玻璃棒搅拌,其目的是增大氯化钠的溶解度
D.将配制好的溶液装瓶时,有少量液体洒出,会造成溶液的溶质质量分数偏小
6.(2022·浙江宁波·统考中考真题)将锌粉持续加入到100g含有AgNO3和Cu(NO3)2两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,其中正确的是
A. B.
C. D.
7.(2022·四川达州·统考中考真题)勤劳智慧的中国劳动人民在很早以前就掌握了湿法炼铜的技术。某实验小组模拟湿法炼铜,向50.0gCuSO4溶液中加入10.0g铁粉(铁粉过量),待溶液中CuSO4反应完全后,过滤,所得滤渣的质量为10.4g。则原溶液中CuSO4的质量分数为
A.20% B.16% C.10% D.8%
8.(2022·四川成都·统考中考真题)根据图示实验和溶解度表,下列说法正确的是
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
A.若a是NaCl,则③中的溶液是不饱和溶液
B.若a是NaCl,则④中溶质的质量分数约为27.2%
C.若a是KNO3,则③到④溶液由不饱和转化为饱和
D.实验证明溶液是否饱和与温度、溶质的量和溶剂种类有关
9.(2022·安徽·统考中考真题)已知KNO3在20℃、30℃时的溶解度分别为31.6g、45.8g,某同学按下图所示步骤进行实验,下列说法正确的是
A.I中KNO3的质量分数为10.0% B.Ⅱ中溶液是30℃时KNO3的不饱和溶液
C.Ⅱ中KNO3的质量分数是I中的2倍 D.Ⅲ中有KNO3晶体析出
10.(2021·广西柳州·统考中考真题)将8 g CuO 粉末加入到100 g一定质量分数的稀H2SO4溶液中,微热到CuO完全溶解,再向溶液中加入W g铁粉,使溶液中的溶质完全反应后过滤,将滤渣在低温下烘干,干燥后固体质量仍然为W g。下列分析不正确的是
A.W可能是5.6 B.W可能是6.4
C.W可能是8 D.W可能是12
11.(2021·四川宜宾·统考中考真题)常温下,向盛有100gNaOH溶液的烧杯中逐滴加入质量分数为7.3%的稀盐酸,滴加过程中,测得烧杯中溶液的pH随加入稀盐酸的质量变化关系如图所示。下列说法错误的是
A.a点烧杯中溶液呈碱性
B.b点烧杯中溶液总质量为200g
C.c点溶液中的溶质为NaOH和NaCl
D.原NaOH溶液中溶质质量分数为8%
12.(2021·四川攀枝花·统考中考真题)某碳酸氢钠样品中含有少量碳酸钠杂质。取17.5g样品,加热时发生反应:,使生成的水完全被浓硫酸吸收,当固体质量不再减少时,测得浓硫酸增重1.8 g。将剩余固体完全溶解在88.7 g水中,所得溶液中溶质的质量分数为
A.10.7% B.11.3% C.15.8% D.16.5%
13.(2021·江苏常州·统考中考真题)图1为硝酸钾和氯化钾的溶解度曲线,图2为兴小组进行的实验,R物质是硝酸钾或氯化钾中的一种。下列说法正确的是
A.无法判断R物质是氯化钾还是硝酸钾 B.溶质的质量分数大小依次为:②>③>①
C.t1℃时烧杯③中溶质的质量分数为31.6% D.烧杯③中析出的固体质量一定为24克
14.(2021·内蒙古呼伦贝尔·统考中考真题)t1℃时,将a、b两种固体物质各25g,分别加入盛有100g水的烧杯中,充分搅拌后现象如图甲所示;升温到t2℃时(忽略水分蒸发),现象如图乙所示;图丙是a、b两种固体物质在水中的溶解度曲线。下列说法正确的是
A.图丙中曲线N表示b物质的溶解度曲线
B.图甲中两烧杯内a、b溶液的溶质质量分数相等
C.图乙中烧杯内b溶液的溶质质量分数为25%
D.可用降温结晶的方法从饱和a溶液中得到固体a
15.(2021·广西贵港·统考中考真题)现有一包金属粉末,可能是由A1、Mg、Zn、Fe、Ag中的一种或几种组成。取该样品2.4g,向其加入100g一定溶质质量分数的稀硫酸,恰好完全反应,产生0.2g H2,溶液呈无色,无固体剩余。则下列结论正确的是
A.该样品的组成仅有两种可能 B.所用稀硫酸的溶质质量分数为19.6%
C.该样品中一定含有Mg D.所得溶液中溶质的总质量为12g
16.(2021·浙江宁波·统考中考真题)在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液,充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是
A.所加溶液质量为M1g时,生成Cu的质量为m1g
B.bc段发生的是Cu和AgNO3溶液的反应
C.m3的值为21.6
D.e点溶液中不含Cu(NO3)2
17.(2021·江西·统考中考真题)向 100g 质量分数为 4%的氢氧化钠溶液中逐滴加入氯化镁溶液,相关量的变化如下图。下列说法错误的是
A.a点的值为2.9
B.b 点对应的溶液能使无色酚酞溶液变红
C.c 点时两者恰好完全反应
D.d 点对应的溶液含有三种溶质
18.(2021·四川成都·统考中考真题)将10g质量分数为98%的浓硫酸配制成10%的稀硫酸。有关步骤的说法正确的是
A.计算需水98g B.量取水时,仰视读数
C.将水注入浓硫酸中,并不断搅拌 D.配制好后,装瓶贴标签
19.(2020·湖南岳阳·统考中考真题)某同学需要配制50g质量分数为15%的氯化钠溶液,步骤如下图所示,下列分析正确的是
A.配制过程中出现了两处操作错误
B.实验操作步骤为:计算、称量、量取、蒸发
C.若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏小
D.配制时应称量氯化钠固体质量为7.0g
20.(2020·广西柳州·统考中考真题)现有一包5g固体混合物,可能含有Zn、ZnO、Zn(OH)2、ZnCO3。将其加入到10%的稀硫酸中,固体混合物全部溶解,消耗的稀硫酸为49g,则混合物中肯定含有的物质是
A.Zn
B.ZnO
C.Zn(OH)2
D.ZnCO3
21.(2020·江苏常州·统考中考真题)盐水选种是把种子放在一定浓度的盐水里,利用浮力把好坏种子分开来。20℃时,技术员将一包氯化钠【20℃,S(NaCl)=36g】放入容器中,分三次加入水,充分搅拌,记录情况如下:
次数 第一次 第二次 第三次
加水质量 1000g 1000g 1000g
烧杯内NaCl晶体剩余情况 有 无 无
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是
A.10.71%<ω≤19.35%
B.12%<ω≤24%
C.10.71%≤ω<21.43%
D.12%≤ω<24%
22.(2020·河北·统考中考真题)向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是
A.M点时,剩余固体是铜和氧化铜
B.M、N点时,溶液中的溶质均只有CuCl2
C.N、P点时,溶液的pH:N>P
D.混合物中铜的质量为(a-b)g
23.(2020·黑龙江绥化·统考中考真题)硫酸镁和硫酸的混合溶液中,硫元素的质量分数占4.8%。向100g该混合溶液中加入氢氧化钠溶液,恰好完全反应,测得消耗氢氧化钠溶液的质量为100g。下列说法不正确的是
A.氢氧化钠溶液中溶质质量分数为12.0%
B.所得溶液中溶质质量为21.3g
C.生成氢氧化镁沉淀的质量为8.7g
D.氢氧化钠溶液中钠元素质量为6.9g
24.(2020·黑龙江哈尔滨·统考中考真题)实验室欲测定一包黄铜样品中锌的质量分数(假设样品中只含铜和锌),取50g黄铜样品粉末于烧杯中,先加入100g稀硫酸,充分反应后得固液混合物149.8g,再继续加入200g相同浓度的稀硫酸,充分反应后过滤,得滤液312.6g,则黄铜样品中锌的质量分数为
A.39% B.74% C.61% D.26%
25.(2020·四川德阳·统考中考真题)黄铜的颜色与黄金相似,在生活中常常误认为黄金。兴趣小组为探究某黄铜(铜锌合金)中锌的含量,向10.0g该黄铜中加稀硫酸,测得实验数据如图所示。以下分析错误的是( )
A.a点时,锌有剩余
B.c点时,硫酸没有完全参与反应
C.该黄铜中锌的质量分数为44%
D.所用稀硫酸的溶质质量分数为8.29%
二、多选题
26.(2022·天津·统考中考真题)碳酸钠和碳酸氢钠是生活中常见的盐。已知碳酸钠很稳定受热不易分解,碳酸氢钠受热易分解,其反应原理为:。某同学进行如下实验:将碳酸钠和碳酸氢钠的混合物 13.7 g 充分加热至质量不再改变,冷却至室温,再向其中加入 100 g 质量分数为 7.3%的盐酸恰好完全反应。下列分析正确的是
A.原混合物中钠元素的质量为 4.6 g
B.整个实验过程中产生二氧化碳的质量为 4.4 g
C.反应后所得溶液的溶质质量分数为 11.7%
D.原混合物中碳酸钠的质量为 5.3 g
27.(2021·江苏镇江·统考中考真题)将Ba(OH)2溶液滴入H2SO4、CuSO4的100.0g混合溶液中,测得产生的沉淀质量与滴加Ba(OH)2溶液体积的关系如图所示。下列说法正确的是
A.M点溶液的pH小于Q点
B.N点溶液中有两种溶质
C.混合溶液中H2SO4的质量分数为9.8%
D.若V1:V2=1:3,则m=44.75
28.(2021·黑龙江·统考中考真题)某不纯的K2CO3样品中,可能含有NaCl、Na2CO3中的一种或两种,现取13.8g样品,向其中加入100g稀盐酸,恰好完全反应,得到室温下不饱和溶液109.4g。下列有关说法正确的是
A.生成CO2的质量是4.4g B.样品中可能含有NaCl
C.样品中一定含有Na2CO3和NaCl D.所加的稀盐酸中溶质质量分数为3.65%
29.(2020·山东济南·统考中考真题)常温下,向一定质量的CaCO3和Mg(OH)2的固体混合物中,加入过量稀盐酸,充分反应,得到不饱和溶液甲和气体乙,将生成的气体乙通入足量NaOH溶液,反应结束后(气体全部被吸收),所得不饱和溶液质量增加4.4g。下列有关说法中,正确的是
A.生成的CO2质量为4.4g
B.反应过程中涉及到中和反应
C.溶液甲中钙元素的质量为4g
D.溶液甲中只含两种溶质
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、生理盐水即溶质质量分数为0.9%的氯化钠溶液,故氯化钠是溶质,水是溶剂,不符合题意;
B、,故生理盐水中氯化钠与水的质量比为9:991,符合题意;
C、每输入100g生理盐水,进入患者体内的氯化钠质量为,不符合题意;
D、输液时,上方的输液瓶中生理盐水受重力随着输液管流到病人血管中,输液管中的生理盐水来自于输液瓶,两者是同一溶液,故其溶质质量分数相同,不符合题意。
故选B。
2.A
【详解】A、所需固体氯化钠的质量是50g×16%=8.0g,说法正确;
B、因为氯化钠会粘在天平盘中,不易倒出,要放在天平上的纸上,不能直接放在天平上,说法错误;
C、溶解固体氯化钠时,用玻璃棒搅拌可加速溶质溶解,但不能增大氯化钠的溶解度,说法错误;
D、用量筒量取42mL水时,若仰视读数,量取的水大于42mL,会导致配制的溶液溶质质量分数偏小,说法错误。
故选A。
3.B
【详解】恰好中和100g溶质质量分数为8.0%的氢氧化钠溶液,需要100g溶质质量分数为7.3%的稀盐酸,因为氢氧化钠与稀盐酸的质量关系为40~36.5;若将稀盐酸换成100g溶质质量分数为7.3%的稀硫酸与其反应,由方程式可知,氢氧化钠与稀硫酸反应关系为80~98,所以当8g氢氧化钠与7.3g稀硫酸反应时,稀硫酸量不足会被完全反应,而氢氧化钠没有反应完过量了,溶液显碱性,则充分反应后溶液的pH大于7。
故选:B。
4.D
【详解】根据题意需要称取碳酸钠的质量为,故选:D。
5.A
【详解】A、所需氯化钠固体的质量为:50g×10%=5g,符合题意;
B、用托盘天平称量物品时,应遵循“左物右码”的原则,氯化钠应放在左盘上进行称量,且氯化钠固体不能直接放在托盘上进行称量,应放在称量纸上进行称量,不符合题意;
C、溶解氯化钠时用玻璃棒搅拌,其目的是加快溶解速率,不能增大溶解度,不符合题意;
D、将配制好的溶液装瓶时,有少量液体洒出,溶液具有均一性,不会影响溶液的溶质质量分数的大小,不符合题意。
故选A。
6.C
【分析】将锌粉持续加入到100g含有AgNO3和Cu(NO3)2两种溶质的混合溶液中,锌先与硝酸银反应生成银和硝酸锌,化学方程式为Zn+2AgNO3=Zn(NO3)2+2Ag,每65份质量的锌完全反应生成216份质量的银,溶液质量减小,硝酸银反应结束,锌再与硝酸铜反应生成硝酸锌和铜,化学方程式为Zn+Cu(NO3)2=Zn(NO3)2+Cu,每65份质量的锌完全反应生成64份质量的铜,溶液质量增加,当加入锌粉的质量为6.5g时,溶液质量最小,说明硝酸银恰好完全反应。
【详解】A、由分析可知,混合溶液中硝酸银质量为34g,当加入锌从0到6.5g,锌与硝酸银反应,硝酸银质量减小,锌为6.5g,硝酸银质量为0,故A错误;
B、锌先与硝酸银反应生成银和硝酸锌,此时硝酸铜质量不变,当锌大于6.5g锌与硝酸铜反应,硝酸铜质量减小,当锌质量为13g时硝酸铜完全反应,硝酸铜质量为0,故B错误;
C、由分析可知,6.5g锌反应生成银质量为21.6g,当锌的质量为13g时生成固体总质量为21.6g+6.4g=28.0g,故C正确。
D、当锌为6.5g时硝酸锌的质量分数为 ≈22.3%,当锌质量为13g,硝酸锌的质量分数为 ≈20.5%,故D错误。
故选:C。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
7.B
【分析】设硫酸铜的质量为x
x=8g
原溶液中CuSO4的质量分数为
【详解】故选B。
8.B
【详解】A、60℃时,NaCl的溶解是37.3 g,所以60℃时,20 g水最多能溶解氯化钠的质量是,故③中的溶液是60℃时氯化钠饱和溶液,故A错误;
B、由上述分析可知,③中的溶液是60℃时氯化钠的饱和溶液,由③恒温度蒸发5g 水后所得④中溶液仍为60℃的NaCl的饱和溶液,根据饱和溶液的溶质质量分数的计算方法可得④中溶质的质量分数,故B正确;
C、60℃时,KNO3的溶解是110 g,所以60℃时,20 g水最多能溶解KNO3的质量是,15g水最多能溶解KNO3的质量是,所以③和④中的溶液都是60℃时硝酸钾的不饱和溶液,故C错误;
D、实验证明溶液是否饱和与温度、溶质的量和溶剂质量有关,与溶剂的种类无关,故D错误。故选B。
9.B
【详解】A. I中硝酸钾全部溶解,溶质质量分数为。错误。
B. Ⅱ中溶剂质量为50g。30℃时硝酸钾溶解度为45.8g,则该温度50g水中最多溶解22.9g硝酸钾达到饱和,而此时加入的硝酸钾质量为5g+5g=10,溶液是不饱和溶液。正确。
C. Ⅱ中KNO3的质量分数为,不是I中的2倍,错误。
D. 20℃时硝酸钾的溶解度为31.6g,则50g水中最多溶解15.8g硝酸钾,而加入硝酸钾的质量为10g,能全部溶解,不会有晶体析出。错误。
故选:B。
10.A
【分析】铁与稀硫酸反应生成硫酸亚铁和氢气,铁与硫酸铜反应生成硫酸亚铁和铜,反应中铁、铜质量比为56∶64,若加入铁粉后,铁只与硫酸铜反应,则反应后固体质量增加,根据题干信息,反应前后所加铁粉质量与所得固体质量相等,说明最初加入8 g氧化铜完全反应后稀硫酸有剩余,即W g铁粉中一部分与稀硫酸反应,另一部分与硫酸铜反应。氧化铜与稀硫酸反应生成硫酸铜和水,反应中氧化铜、硫酸铜的质量比为80∶160,因此8 g氧化铜完全溶解生成硫酸铜质量为16 g,铁与硫酸铜的反应中铁、硫酸铜质量比为56∶160,因此16 g硫酸铜反应消耗铁的质量为5.6 g。若W是5.6,生成铜的质量为6.4 g,A说法不正确;若W大于5.6,则除5.6 g与稀硫酸铜反应外,其余部分铁与剩余的稀硫酸反应,干燥后固体质量可能不变。
【详解】A、若W是5.6,生成铜的质量为6.4 g,A说法不正确;
B、根据分析,若W大于5.6,则除5.6 g与稀硫酸铜反应外,其余部分铁与剩余的稀硫酸反应,干燥后固体质量可能不变,W可能是6.4>5.6g,正确;
C、根据分析,若W大于5.6,则除5.6 g与稀硫酸铜反应外,其余部分铁与剩余的稀硫酸反应,干燥后固体质量可能不变,W可能是8>5.6g,正确;
D、根据分析,若W大于5.6,则除5.6 g与稀硫酸铜反应外,其余部分铁与剩余的稀硫酸反应,干燥后固体质量可能不变,W可能是12>5.6g,正确;
故选:A。
11.C
【详解】A、由图可知,a点pH>7,溶液显碱性,不符合题意;
B、b点时,加入稀盐酸的质量为100g,氢氧化钠和稀盐酸反应生成氯化钠和水,则溶液总质量为:100g+100g=200g,不符合题意;
C、c点时,pH<7,此时稀盐酸过量,氢氧化钠和稀盐酸反应生成氯化钠和水,此时溶液中的溶质为NaCl、HCl,符合题意;
D、解:设原NaOH溶液中溶质质量分数为x
x=8%
不符合题意。
故选C。
12.B
【详解】浓硫酸增加的质量1.8g即为生成水的质量,设碳酸氢钠质量为x,完全分解生成碳酸钠质量为y,则:
将剩余固体完全溶解在88.7 g水中,所得溶液中溶质的质量分数为:
。
故选B。
13.B
【分析】t1℃时60gR完全溶于200g水中,证明此时R的溶解度≥30g,升温到t2℃时并蒸发100g水,能完全溶解,证明此时R的溶解度≥60g,结合曲线可得R是硝酸钾。
【详解】A、由分析可知R是硝酸钾,故选项错误;
B、t1℃时60gR完全溶解,溶液①的溶质质量分数为;溶液②与溶液①溶质质量相等,溶剂为100g,则溶液②的溶质质量分数为 ;结合分析R在t1℃时溶解度为31.6,溶液③为饱和溶液,溶液③的溶质质量分数为 ,所以溶质的质量分数大小依次为:②>③>①,故选项正确;
C、t1℃时烧杯③中溶质的质量分数为,故选项错误;
D、烧杯为饱和溶液,溶质质量为31.6g,则析出固体质量为60g-31.6g=28.4g,故选项错误。
故选B
14.B
【分析】结合图甲、图乙可知,b物质的溶解度随着温度升高而增大,a物质的溶解度随着温度升高而减小,故图丙中曲线M表示b物质的溶解度曲线,曲线N表示a物质的溶解度曲线;
由图甲可知,t1℃时,a、b均是饱和饱和溶液,结合图丙可知,t1℃时a、b两物质溶解度相等,故图甲中两烧杯内a、b溶液的溶质质量分数相等;图乙中烧杯b内固体全部溶解,b溶液的溶质质量分数为;a物质的溶解度随温度降低而增大,降低温度,a的溶解度增大,饱和溶液变成不饱和溶液,故不能用降温结晶的方法从饱和a溶液中得到固体a。
【详解】A、结合图甲、图乙可知,b物质的溶解度随着温度升高而增大,故图丙中曲线M表示b物质的溶解度曲线,选项错误;
B、由图丙可知t1℃时,a、b溶解度相等,且图甲为相等质量的a、b分别加入相等质量的水中,所以图甲中两烧杯内a、b溶液的溶质质量分数相等,选项正确;
C、图乙中烧杯内b完全溶解,溶液的溶质质量分数为,选项错误;
D、a物质的溶解度随着温度升高而减小,不能使用降温结晶,选项错误。
故选B。
15.D
【分析】设生成0.2g氢气,需要镁、锌和铝的质量分别为、、
【详解】A、金属粉末与稀硫酸反应,得到无色溶液,固体无剩余,说明粉末中一定不包括铁和银,通过上面计算可知,金属粉末可能组成为镁、铝和锌、铝、镁和锌,组成有三种可能,说法错误;
B、由质量守恒定律可知:生成的氢气中氢元素都来源于硫酸中的氢元素,生成0.2g氢气,100g一定溶质质量分数的稀硫酸中氢元素的质量=0.2g,则硫酸溶液中硫酸的质量=,稀硫酸的溶质质量分数=,说法错误;
C、由A可知,该样品中不一定含有镁,说法错误;
D、反应后所得溶液中溶质的为金属硫酸盐,金属的质量=2.4g,硫酸根的质量=,所得溶液中溶质的质量=9.6g+2.4g=12g;
答案:D。
16.C
【分析】首先,ab段,铁粉与硝酸铜发生置换反应,M1点时,硝酸铜被完全消耗,之后bc段铁粉与硝酸银发生置换反应,直到M2点时铁粉消耗完毕,然后cd段之前生成的铜与硝酸银发生置换反应,直至M3点时,铜被完全消耗;
【详解】A、设有质量为x的铁粉与硝酸铜反应,并生成质量为y的铜,
解方程组得y=8(m1-5.6)g,不符合题意;
B、bc段是铁粉与硝酸银发生置换反应,不符合题意;
C、M3点时铁粉被完全消耗,沉淀完全是Ag,整体反应过程相当于铁粉与硝酸银发生置换反应,设生成Ag的质量为x,则有:
解得x=21.6g,符合题意;
D、cd段之前生成的铜与硝酸银发生置换反应生成了银单质和硝酸铜溶液,后面在滴加硝酸银也不会与硝酸铜反应,因此e点含有硝酸铜存在,不符合题意。
故选C。
【点睛】bc的斜率大于cd的斜率,而相对原子质量是Ag>Cu>Fe,在结合题干和所学知识,可以得出b点的转折是因为硝酸铜被完全消耗,而不是铁粉被完全消耗。
17.D
【详解】A、a点对应的值是恰好完全反应后生成的氢氧化镁的质量,设该质量为x
,
生成氢氧化镁的质量为2.9g,此选项表述正确;
B、b 点对应的溶液是氢氧化钠还未反应完,故溶液能使无色酚酞溶液变红,此选项表述正确;
C、c 点时继续滴加氯化镁,生成沉淀的质量不再增加,说明两者恰好完全反应,此选项表述正确;
D、d 点对应的溶液是氢氧化钠已完全反应,且滴加的氯化镁过量,故此时溶液中含有氯化钠和氯化镁两种溶质,此选项表述不正确。
故选D。
18.D
【详解】A、溶质质量=(10×98%)g=9.8g,10%=溶质质量÷溶液质量,溶液质量=(9.8÷10% )=98g,溶剂质量=(98-9.8)g=88.2g,不符合题意;
B、量取水时,视线要与液体凹液面平齐,不符合题意;
C、稀释浓硫酸时,应该浓硫酸加入水中,不符合题意;
D、配制好后,装瓶贴标签,符合题意。
故选D。
19.A
【详解】A、配制过程的错误是:①托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了;②量筒量取液体读数时,视线与液体的凹液面最低处保持水平,图中仰视读数;符合题意。
B、配制50g质量分数为15%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,无需进行蒸发;不符合题意。
C、若所有操作都正确,完全溶解后有液滴溅出,溶液具有均一性,溶质质量分数不变;不符合题意。
D、溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为15%的氯化钠溶液,需氯化钠的质量=50g×15%=7.5g;不符合题意。
故选A。
20.D
【详解】固体混合物与硫酸反应后均生成硫酸锌,硫酸锌中硫酸根的质量为:;
设参与反应的锌的质量为x,则在硫酸锌化学式中有关系:
解得x=3.25g
固体混合物的质量为5g,则样品中锌的质量分数为:;
锌的质量分数为100%;
ZnO中锌的质量分数为;
Zn(OH)2中锌的质量分数为;
ZnCO3中锌的质量分数为;
故该物质中一定含ZnCO3,答案为D。
21.A
【详解】20℃时,NaCl溶解度为36g;此时1000g水中最多可溶解NaCl的质量为360g;
第一次:加入1000g水,食盐固体有剩余,则NaCl的总质量大于360g;
第二次:再加入1000g水,食盐固体没有剩余,则NaCl的总质量小于或等于720g;
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是,即10.71%<ω≤19.35%。
故选:A。
22.D
【分析】氧化铜和稀盐酸反应生成氯化铜和水。
【详解】A、向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,M点时,氧化铜未反应完全,则剩余固体是铜和氧化铜,故A正确;
B、M、N点时,氧化铜和稀盐酸反应生成氯化铜和水,则溶液中的溶质均只有CuCl2,故B正确;
C、N点时,氧化铜和稀盐酸反应完全,溶液显中性,溶液的pH大于7,P点时,稀盐酸过量,溶液的pH小于7,则N、P点时,溶液的pH:N>P,故C正确;
D、N点时,氧化铜和稀盐酸反应完全,则混合物中铜的质量为bg,故D不正确。故选D。
23.C
【分析】向硫酸镁与硫酸的混合溶液中加入氢氧化钠溶液,会发生两个化学反应和
设钠元素的质量为 ,生成的硫酸钠的质量为,氢氧化钠溶液中溶质的质量分数为,由和可得出关系:
; ;
解得:=6.9g,=21.3g,=12%
【详解】A、由分析中得出的数据可知,=12%,则氢氧化钠溶液中溶质的质量分数为12%,故A选项说法正确;
B、生成的硫酸钠的质量为=21.3g,恰好完全反应,则溶液中溶质为硫酸钠,溶质质量为21.3g,故B选项说法正确;
C、假设当原混合溶液中溶质完全是硫酸镁的时候,可以生成的氢氧化镁沉淀质量为
解得=8.7g
然而已知溶液是硫酸镁与硫酸的混合溶液,生成的氢氧化镁质量一定小于8.7g,故C选项说法错误;
D、根据分析中的计算,钠元素的质量为=6.9g,故D选项说法正确。
故选C。
24.D
【分析】锌和稀硫酸反应生成硫酸锌和氢气。
【详解】设锌的质量为x,参与反应稀硫酸的质量为y,生成硫酸锌的质量为z
由题意可知滤液中质量的增加是生成的硫酸盐的质量大于反应消耗的硫酸质量,即溶液质量差为,即,则,x=13g,,y=19.6g,,z=32.2g,锌的质量分数为,故选D。
25.D
【分析】黄铜是铜锌合金,向该黄铜中滴加稀硫酸,锌与稀硫酸反应生成硫酸锌和氢气,铜与稀硫酸不反应,随着稀硫酸的加入,固体质量逐渐减小,待锌与稀硫酸完全反应后,固体质量不再变化,最后剩余固体的质量就是黄铜中铜的质量。
【详解】A、由图可知,a点时,固体质量还在减少,说明锌未完全反应,锌有剩余,不符合题意;
B、由图可知,c点时,稀硫酸过量,硫酸没有完全参与反应,不符合题意;
C、剩余固体的质量就是黄铜中铜的质量,即黄铜中铜的质量为5.6g,则黄铜中锌的质量为:10.0g-5.6g=4.4g,故该黄铜中锌的质量分数为,不符合题意;
D、解:设所用稀硫酸的溶质质量分数为x
x=9.8% ,符合题意;故选D。
26.AD
【分析】碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳,碳酸钠和碳酸氢钠的混合物加热至质量不再改变时,剩余的固体为碳酸钠,向其中加入100 g 质量分数为 7.3%的盐酸恰好完全反应,设:参加反应碳酸钠的质量为x,生成氯化钠的质量为y,生成二氧化碳的质量为z则所以碳酸钠和碳酸氢钠的混合物 13.7 g 加热至质量不再改变时固体质量为10.6g,固体质量减少,设:13.7 g 混合物中碳酸氢钠的质量为m则
【详解】A、根据质量守恒,原混合物中钠元素的质量与加热后剩余的固体碳酸钠中钠元素的质量守恒,则10.6g碳酸钠中钠元素的质量为,故A符合题意;
B、由分析知,碳酸钠与盐酸反应生成二氧化碳的质量为4.4g,碳酸氢钠受热分解也生成二氧化碳,所以整个实验过程中产生二氧化碳的质量大于4.4 g,故B不符合题意;
C、由分析知,反应后所得溶液中溶质是氯化钠质量为11.7g,所得溶液的质量为:,反应后所得溶液的溶质质量分数为:,故C不符合题意;
D、由分析知,混合物中碳酸氢钠的质量为8.4g,所以原混合物中碳酸钠的质量为:,故D符合题意。
故选AD。
27.AD
【分析】将Ba(OH)2溶液滴入H2SO4、CuSO4的100.0g混合溶液中,氢氧化钡先与硫酸反应生成硫酸钡沉淀和水,再与硫酸铜反应生成硫酸钡沉淀和氢氧化铜沉淀,结合题干数据,利用化学方程式计算。
【详解】A、0至V1生成硫酸钡一种沉淀,加入的Ba(OH)2溶液体积达V1时,H2SO4反应完全,V1至V2段溶液中只有硫酸铜一种溶质,V1至V2段硫酸铜与氢氧化钡反应,生成为BaSO4和Cu(OH)2两种沉淀,加入的Ba(OH)2溶液体积达V2时,CuSO4反应完全,M点溶液中含有H2SO4,显酸性,pH<7,Q点溶液中含有过量的Ba(OH)2,显碱性,pH>7,A选项正确;
B、由选项A中分析可知,N点溶液中只有CuSO4一种溶质,B错误;
C、加入的Ba(OH)2溶液体积达V1时,H2SO4反应完全,生成BaSO4的质量为11.65 g,
设参与反应的H2SO4的质量为x,参加反应的氢氧化钡质量为y。
混合溶液中H2SO4的质量分数为
故C错误。
D.若V1:V0=1:3,即与CuSO4反应的Ba(OH)2的量是与H2SO4反应的Ba(OH)2的量的2倍,H2SO4的质量为4.9g,与H2SO4反应的Ba(OH)2的质量为8.55g,与CuSO4反应的Ba(OH)2的质量为8.55 g×2=17.1 g,m的质量即最终得到沉淀的质量,则m的质量等于氢氧化钡与硫酸生成硫酸钡的质量加上氢氧化钡与硫酸铜反应生成硫酸钡和氢氧化铜的质量和。
设与硫酸铜反应生成硫酸钡质量为,生成氢氧化铜质量为。
m=11.65 g+9.8g+23.3g=44.75 g,D正确。
故选:AD。
28.AC
【详解】A、碳酸盐和酸反应生成气体逸出,总质量的减少就是生成二氧化碳气体的质量13.8g+100g-109.4g=4.4g,正确;
B、
由化学方程式体现的质量关系可知,13.8g碳酸钾完全反应生成二氧化碳4.4g;已知,不纯的K2CO3样品中,可能含有NaCl、Na2CO3中的一种或两种;氯化钠和稀盐酸不生成气体,碳酸钠和稀盐酸生成二氧化碳气体:
由于样品中一定含有杂质,氯化钠生成气体质量为0,碳酸钠生成气体质量为5.73g>4.4g,则样品中一定含有Na2CO3和NaCl,错误;
C、由选项B分析可知,样品中一定含有Na2CO3和NaCl,正确;
D. 无论是盐酸和碳酸钾还是碳酸钠反应,氯化氢和二氧化碳的质量关系都是相同的
由质量关系可知,所加的稀盐酸中溶质质量分数为,错误。
故选AC。
29.ABC
【详解】A.向一定质量的CaCO3和Mg(OH)2的固体混合物中,加入过量稀盐酸,产生的气体是CO2,CO2与NaOH反应方程式为CO2+2NaOH=Na2CO3+H2O,生成的CO2通入足量NaOH溶液原理,溶液质量增加4.4g,依据质量守恒定律可知,生成的CO2质量为4.4g,A正确,符合题意;
B.酸与碱反应生成盐和水的反应称为中和反应,氢氧化镁是碱,盐酸是酸,向一定质量的CaCO3和Mg(OH)2的固体混合物中,加入过量稀盐酸,氢氧化镁与盐酸反应生成氯化镁和水的反应属于中和反应,所以反应过程中涉及到中和反应,B正确,符合题意;
C.向一定质量的CaCO3和Mg(OH)2的固体混合物中,加入过量稀盐酸的反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑和Mg(OH)2+2HCl=MgCl2+2H2O,则溶液甲中含有CaCl2,其中的钙元素的质量与碳酸钙中钙元素的质量相等,分析CaCO3+2HCl=CaCl2+H2O+CO2↑反应可得如下关系
设钙元素的质量为x
则溶液甲中钙元素的质量为4g,C正确,符合题意;
D.依据向一定质量的CaCO3和Mg(OH)2的固体混合物中,加入过量稀盐酸的反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑和Mg(OH)2+2HCl=MgCl2+2H2O,由于加入的盐酸过量,所以溶液甲中的溶质为CaCl2、MgCl2和HCl,即溶液甲中含三种溶质,D错误,不符合题意;
故选:ABC。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2022·山东青岛·统考中考真题)医生常用生理盐水(溶质质量分数为0.9%)给患者输液。下列对生理盐水的理解不正确的是
A.生理盐水中氯化钠是溶质,水是溶剂
B.生理盐水中氯化钠与水的质量比为9:1000
C.每输入100g生理盐水,进入患者体内的氯化钠质量为0.9g
D.输液时,输液管中和输液瓶中生理盐水的溶质质量分数相同
2.(2022·山东烟台·统考中考真题)实验室用固体氯化钠配制50g溶质质量分数为16%的氯化钠溶液。下列说法正确的是
A.所需固体氯化钠的质量是8.0g
B.固体氯化钠可以直接放在托盘天平的左盘上称量
C.溶解固体氯化钠时,用玻璃棒搅拌能增大氯化钠的溶解度
D.用量筒量取42mL水时,若仰视读数,会导致配制的溶液溶质质量分数偏大
3.(2022·黑龙江绥化·统考中考真题)恰好中和100g溶质质量分数为8.0%的氢氧化钠溶液,需要100g溶质质量分数为7.3%的稀盐酸。若将稀盐酸换成100g溶质质量分数为7.3%的稀硫酸与其反应,则充分反应后溶液的pH
A.小于7 B.大于7 C.等于7 D.无法判断
4.(2022·福建·统考中考真题)从植物“地不容”中提取抑制新冠病毒的新药—千金藤素,需用到5%的Na2CO3溶液。若配制100g该溶液,需要称取Na2CO3的质量为
A.95g B.90g C.20g D.5 g
5.(2022·湖南邵阳·统考中考真题)实验室配制50g溶质质量分数为10%的氯化钠溶液,下列说法正确的是
A.计算得出所需氯化钠固体的质量为5g
B.将氯化钠固体直接放在托盘天平的右盘进行称量
C.溶解氯化钠时用玻璃棒搅拌,其目的是增大氯化钠的溶解度
D.将配制好的溶液装瓶时,有少量液体洒出,会造成溶液的溶质质量分数偏小
6.(2022·浙江宁波·统考中考真题)将锌粉持续加入到100g含有AgNO3和Cu(NO3)2两种溶质的混合溶液中,充分反应。当加入锌粉的质量为6.5g时,溶液质量最小;当加入锌粉的质量为13.0g时,恰好完全反应。下列是反应中的相关量随加入锌的质量变化的关系图,其中正确的是
A. B.
C. D.
7.(2022·四川达州·统考中考真题)勤劳智慧的中国劳动人民在很早以前就掌握了湿法炼铜的技术。某实验小组模拟湿法炼铜,向50.0gCuSO4溶液中加入10.0g铁粉(铁粉过量),待溶液中CuSO4反应完全后,过滤,所得滤渣的质量为10.4g。则原溶液中CuSO4的质量分数为
A.20% B.16% C.10% D.8%
8.(2022·四川成都·统考中考真题)根据图示实验和溶解度表,下列说法正确的是
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
A.若a是NaCl,则③中的溶液是不饱和溶液
B.若a是NaCl,则④中溶质的质量分数约为27.2%
C.若a是KNO3,则③到④溶液由不饱和转化为饱和
D.实验证明溶液是否饱和与温度、溶质的量和溶剂种类有关
9.(2022·安徽·统考中考真题)已知KNO3在20℃、30℃时的溶解度分别为31.6g、45.8g,某同学按下图所示步骤进行实验,下列说法正确的是
A.I中KNO3的质量分数为10.0% B.Ⅱ中溶液是30℃时KNO3的不饱和溶液
C.Ⅱ中KNO3的质量分数是I中的2倍 D.Ⅲ中有KNO3晶体析出
10.(2021·广西柳州·统考中考真题)将8 g CuO 粉末加入到100 g一定质量分数的稀H2SO4溶液中,微热到CuO完全溶解,再向溶液中加入W g铁粉,使溶液中的溶质完全反应后过滤,将滤渣在低温下烘干,干燥后固体质量仍然为W g。下列分析不正确的是
A.W可能是5.6 B.W可能是6.4
C.W可能是8 D.W可能是12
11.(2021·四川宜宾·统考中考真题)常温下,向盛有100gNaOH溶液的烧杯中逐滴加入质量分数为7.3%的稀盐酸,滴加过程中,测得烧杯中溶液的pH随加入稀盐酸的质量变化关系如图所示。下列说法错误的是
A.a点烧杯中溶液呈碱性
B.b点烧杯中溶液总质量为200g
C.c点溶液中的溶质为NaOH和NaCl
D.原NaOH溶液中溶质质量分数为8%
12.(2021·四川攀枝花·统考中考真题)某碳酸氢钠样品中含有少量碳酸钠杂质。取17.5g样品,加热时发生反应:,使生成的水完全被浓硫酸吸收,当固体质量不再减少时,测得浓硫酸增重1.8 g。将剩余固体完全溶解在88.7 g水中,所得溶液中溶质的质量分数为
A.10.7% B.11.3% C.15.8% D.16.5%
13.(2021·江苏常州·统考中考真题)图1为硝酸钾和氯化钾的溶解度曲线,图2为兴小组进行的实验,R物质是硝酸钾或氯化钾中的一种。下列说法正确的是
A.无法判断R物质是氯化钾还是硝酸钾 B.溶质的质量分数大小依次为:②>③>①
C.t1℃时烧杯③中溶质的质量分数为31.6% D.烧杯③中析出的固体质量一定为24克
14.(2021·内蒙古呼伦贝尔·统考中考真题)t1℃时,将a、b两种固体物质各25g,分别加入盛有100g水的烧杯中,充分搅拌后现象如图甲所示;升温到t2℃时(忽略水分蒸发),现象如图乙所示;图丙是a、b两种固体物质在水中的溶解度曲线。下列说法正确的是
A.图丙中曲线N表示b物质的溶解度曲线
B.图甲中两烧杯内a、b溶液的溶质质量分数相等
C.图乙中烧杯内b溶液的溶质质量分数为25%
D.可用降温结晶的方法从饱和a溶液中得到固体a
15.(2021·广西贵港·统考中考真题)现有一包金属粉末,可能是由A1、Mg、Zn、Fe、Ag中的一种或几种组成。取该样品2.4g,向其加入100g一定溶质质量分数的稀硫酸,恰好完全反应,产生0.2g H2,溶液呈无色,无固体剩余。则下列结论正确的是
A.该样品的组成仅有两种可能 B.所用稀硫酸的溶质质量分数为19.6%
C.该样品中一定含有Mg D.所得溶液中溶质的总质量为12g
16.(2021·浙江宁波·统考中考真题)在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液,充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是
A.所加溶液质量为M1g时,生成Cu的质量为m1g
B.bc段发生的是Cu和AgNO3溶液的反应
C.m3的值为21.6
D.e点溶液中不含Cu(NO3)2
17.(2021·江西·统考中考真题)向 100g 质量分数为 4%的氢氧化钠溶液中逐滴加入氯化镁溶液,相关量的变化如下图。下列说法错误的是
A.a点的值为2.9
B.b 点对应的溶液能使无色酚酞溶液变红
C.c 点时两者恰好完全反应
D.d 点对应的溶液含有三种溶质
18.(2021·四川成都·统考中考真题)将10g质量分数为98%的浓硫酸配制成10%的稀硫酸。有关步骤的说法正确的是
A.计算需水98g B.量取水时,仰视读数
C.将水注入浓硫酸中,并不断搅拌 D.配制好后,装瓶贴标签
19.(2020·湖南岳阳·统考中考真题)某同学需要配制50g质量分数为15%的氯化钠溶液,步骤如下图所示,下列分析正确的是
A.配制过程中出现了两处操作错误
B.实验操作步骤为:计算、称量、量取、蒸发
C.若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏小
D.配制时应称量氯化钠固体质量为7.0g
20.(2020·广西柳州·统考中考真题)现有一包5g固体混合物,可能含有Zn、ZnO、Zn(OH)2、ZnCO3。将其加入到10%的稀硫酸中,固体混合物全部溶解,消耗的稀硫酸为49g,则混合物中肯定含有的物质是
A.Zn
B.ZnO
C.Zn(OH)2
D.ZnCO3
21.(2020·江苏常州·统考中考真题)盐水选种是把种子放在一定浓度的盐水里,利用浮力把好坏种子分开来。20℃时,技术员将一包氯化钠【20℃,S(NaCl)=36g】放入容器中,分三次加入水,充分搅拌,记录情况如下:
次数 第一次 第二次 第三次
加水质量 1000g 1000g 1000g
烧杯内NaCl晶体剩余情况 有 无 无
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是
A.10.71%<ω≤19.35%
B.12%<ω≤24%
C.10.71%≤ω<21.43%
D.12%≤ω<24%
22.(2020·河北·统考中考真题)向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是
A.M点时,剩余固体是铜和氧化铜
B.M、N点时,溶液中的溶质均只有CuCl2
C.N、P点时,溶液的pH:N>P
D.混合物中铜的质量为(a-b)g
23.(2020·黑龙江绥化·统考中考真题)硫酸镁和硫酸的混合溶液中,硫元素的质量分数占4.8%。向100g该混合溶液中加入氢氧化钠溶液,恰好完全反应,测得消耗氢氧化钠溶液的质量为100g。下列说法不正确的是
A.氢氧化钠溶液中溶质质量分数为12.0%
B.所得溶液中溶质质量为21.3g
C.生成氢氧化镁沉淀的质量为8.7g
D.氢氧化钠溶液中钠元素质量为6.9g
24.(2020·黑龙江哈尔滨·统考中考真题)实验室欲测定一包黄铜样品中锌的质量分数(假设样品中只含铜和锌),取50g黄铜样品粉末于烧杯中,先加入100g稀硫酸,充分反应后得固液混合物149.8g,再继续加入200g相同浓度的稀硫酸,充分反应后过滤,得滤液312.6g,则黄铜样品中锌的质量分数为
A.39% B.74% C.61% D.26%
25.(2020·四川德阳·统考中考真题)黄铜的颜色与黄金相似,在生活中常常误认为黄金。兴趣小组为探究某黄铜(铜锌合金)中锌的含量,向10.0g该黄铜中加稀硫酸,测得实验数据如图所示。以下分析错误的是( )
A.a点时,锌有剩余
B.c点时,硫酸没有完全参与反应
C.该黄铜中锌的质量分数为44%
D.所用稀硫酸的溶质质量分数为8.29%
二、多选题
26.(2022·天津·统考中考真题)碳酸钠和碳酸氢钠是生活中常见的盐。已知碳酸钠很稳定受热不易分解,碳酸氢钠受热易分解,其反应原理为:。某同学进行如下实验:将碳酸钠和碳酸氢钠的混合物 13.7 g 充分加热至质量不再改变,冷却至室温,再向其中加入 100 g 质量分数为 7.3%的盐酸恰好完全反应。下列分析正确的是
A.原混合物中钠元素的质量为 4.6 g
B.整个实验过程中产生二氧化碳的质量为 4.4 g
C.反应后所得溶液的溶质质量分数为 11.7%
D.原混合物中碳酸钠的质量为 5.3 g
27.(2021·江苏镇江·统考中考真题)将Ba(OH)2溶液滴入H2SO4、CuSO4的100.0g混合溶液中,测得产生的沉淀质量与滴加Ba(OH)2溶液体积的关系如图所示。下列说法正确的是
A.M点溶液的pH小于Q点
B.N点溶液中有两种溶质
C.混合溶液中H2SO4的质量分数为9.8%
D.若V1:V2=1:3,则m=44.75
28.(2021·黑龙江·统考中考真题)某不纯的K2CO3样品中,可能含有NaCl、Na2CO3中的一种或两种,现取13.8g样品,向其中加入100g稀盐酸,恰好完全反应,得到室温下不饱和溶液109.4g。下列有关说法正确的是
A.生成CO2的质量是4.4g B.样品中可能含有NaCl
C.样品中一定含有Na2CO3和NaCl D.所加的稀盐酸中溶质质量分数为3.65%
29.(2020·山东济南·统考中考真题)常温下,向一定质量的CaCO3和Mg(OH)2的固体混合物中,加入过量稀盐酸,充分反应,得到不饱和溶液甲和气体乙,将生成的气体乙通入足量NaOH溶液,反应结束后(气体全部被吸收),所得不饱和溶液质量增加4.4g。下列有关说法中,正确的是
A.生成的CO2质量为4.4g
B.反应过程中涉及到中和反应
C.溶液甲中钙元素的质量为4g
D.溶液甲中只含两种溶质
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、生理盐水即溶质质量分数为0.9%的氯化钠溶液,故氯化钠是溶质,水是溶剂,不符合题意;
B、,故生理盐水中氯化钠与水的质量比为9:991,符合题意;
C、每输入100g生理盐水,进入患者体内的氯化钠质量为,不符合题意;
D、输液时,上方的输液瓶中生理盐水受重力随着输液管流到病人血管中,输液管中的生理盐水来自于输液瓶,两者是同一溶液,故其溶质质量分数相同,不符合题意。
故选B。
2.A
【详解】A、所需固体氯化钠的质量是50g×16%=8.0g,说法正确;
B、因为氯化钠会粘在天平盘中,不易倒出,要放在天平上的纸上,不能直接放在天平上,说法错误;
C、溶解固体氯化钠时,用玻璃棒搅拌可加速溶质溶解,但不能增大氯化钠的溶解度,说法错误;
D、用量筒量取42mL水时,若仰视读数,量取的水大于42mL,会导致配制的溶液溶质质量分数偏小,说法错误。
故选A。
3.B
【详解】恰好中和100g溶质质量分数为8.0%的氢氧化钠溶液,需要100g溶质质量分数为7.3%的稀盐酸,因为氢氧化钠与稀盐酸的质量关系为40~36.5;若将稀盐酸换成100g溶质质量分数为7.3%的稀硫酸与其反应,由方程式可知,氢氧化钠与稀硫酸反应关系为80~98,所以当8g氢氧化钠与7.3g稀硫酸反应时,稀硫酸量不足会被完全反应,而氢氧化钠没有反应完过量了,溶液显碱性,则充分反应后溶液的pH大于7。
故选:B。
4.D
【详解】根据题意需要称取碳酸钠的质量为,故选:D。
5.A
【详解】A、所需氯化钠固体的质量为:50g×10%=5g,符合题意;
B、用托盘天平称量物品时,应遵循“左物右码”的原则,氯化钠应放在左盘上进行称量,且氯化钠固体不能直接放在托盘上进行称量,应放在称量纸上进行称量,不符合题意;
C、溶解氯化钠时用玻璃棒搅拌,其目的是加快溶解速率,不能增大溶解度,不符合题意;
D、将配制好的溶液装瓶时,有少量液体洒出,溶液具有均一性,不会影响溶液的溶质质量分数的大小,不符合题意。
故选A。
6.C
【分析】将锌粉持续加入到100g含有AgNO3和Cu(NO3)2两种溶质的混合溶液中,锌先与硝酸银反应生成银和硝酸锌,化学方程式为Zn+2AgNO3=Zn(NO3)2+2Ag,每65份质量的锌完全反应生成216份质量的银,溶液质量减小,硝酸银反应结束,锌再与硝酸铜反应生成硝酸锌和铜,化学方程式为Zn+Cu(NO3)2=Zn(NO3)2+Cu,每65份质量的锌完全反应生成64份质量的铜,溶液质量增加,当加入锌粉的质量为6.5g时,溶液质量最小,说明硝酸银恰好完全反应。
【详解】A、由分析可知,混合溶液中硝酸银质量为34g,当加入锌从0到6.5g,锌与硝酸银反应,硝酸银质量减小,锌为6.5g,硝酸银质量为0,故A错误;
B、锌先与硝酸银反应生成银和硝酸锌,此时硝酸铜质量不变,当锌大于6.5g锌与硝酸铜反应,硝酸铜质量减小,当锌质量为13g时硝酸铜完全反应,硝酸铜质量为0,故B错误;
C、由分析可知,6.5g锌反应生成银质量为21.6g,当锌的质量为13g时生成固体总质量为21.6g+6.4g=28.0g,故C正确。
D、当锌为6.5g时硝酸锌的质量分数为 ≈22.3%,当锌质量为13g,硝酸锌的质量分数为 ≈20.5%,故D错误。
故选:C。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
7.B
【分析】设硫酸铜的质量为x
x=8g
原溶液中CuSO4的质量分数为
【详解】故选B。
8.B
【详解】A、60℃时,NaCl的溶解是37.3 g,所以60℃时,20 g水最多能溶解氯化钠的质量是,故③中的溶液是60℃时氯化钠饱和溶液,故A错误;
B、由上述分析可知,③中的溶液是60℃时氯化钠的饱和溶液,由③恒温度蒸发5g 水后所得④中溶液仍为60℃的NaCl的饱和溶液,根据饱和溶液的溶质质量分数的计算方法可得④中溶质的质量分数,故B正确;
C、60℃时,KNO3的溶解是110 g,所以60℃时,20 g水最多能溶解KNO3的质量是,15g水最多能溶解KNO3的质量是,所以③和④中的溶液都是60℃时硝酸钾的不饱和溶液,故C错误;
D、实验证明溶液是否饱和与温度、溶质的量和溶剂质量有关,与溶剂的种类无关,故D错误。故选B。
9.B
【详解】A. I中硝酸钾全部溶解,溶质质量分数为。错误。
B. Ⅱ中溶剂质量为50g。30℃时硝酸钾溶解度为45.8g,则该温度50g水中最多溶解22.9g硝酸钾达到饱和,而此时加入的硝酸钾质量为5g+5g=10,溶液是不饱和溶液。正确。
C. Ⅱ中KNO3的质量分数为,不是I中的2倍,错误。
D. 20℃时硝酸钾的溶解度为31.6g,则50g水中最多溶解15.8g硝酸钾,而加入硝酸钾的质量为10g,能全部溶解,不会有晶体析出。错误。
故选:B。
10.A
【分析】铁与稀硫酸反应生成硫酸亚铁和氢气,铁与硫酸铜反应生成硫酸亚铁和铜,反应中铁、铜质量比为56∶64,若加入铁粉后,铁只与硫酸铜反应,则反应后固体质量增加,根据题干信息,反应前后所加铁粉质量与所得固体质量相等,说明最初加入8 g氧化铜完全反应后稀硫酸有剩余,即W g铁粉中一部分与稀硫酸反应,另一部分与硫酸铜反应。氧化铜与稀硫酸反应生成硫酸铜和水,反应中氧化铜、硫酸铜的质量比为80∶160,因此8 g氧化铜完全溶解生成硫酸铜质量为16 g,铁与硫酸铜的反应中铁、硫酸铜质量比为56∶160,因此16 g硫酸铜反应消耗铁的质量为5.6 g。若W是5.6,生成铜的质量为6.4 g,A说法不正确;若W大于5.6,则除5.6 g与稀硫酸铜反应外,其余部分铁与剩余的稀硫酸反应,干燥后固体质量可能不变。
【详解】A、若W是5.6,生成铜的质量为6.4 g,A说法不正确;
B、根据分析,若W大于5.6,则除5.6 g与稀硫酸铜反应外,其余部分铁与剩余的稀硫酸反应,干燥后固体质量可能不变,W可能是6.4>5.6g,正确;
C、根据分析,若W大于5.6,则除5.6 g与稀硫酸铜反应外,其余部分铁与剩余的稀硫酸反应,干燥后固体质量可能不变,W可能是8>5.6g,正确;
D、根据分析,若W大于5.6,则除5.6 g与稀硫酸铜反应外,其余部分铁与剩余的稀硫酸反应,干燥后固体质量可能不变,W可能是12>5.6g,正确;
故选:A。
11.C
【详解】A、由图可知,a点pH>7,溶液显碱性,不符合题意;
B、b点时,加入稀盐酸的质量为100g,氢氧化钠和稀盐酸反应生成氯化钠和水,则溶液总质量为:100g+100g=200g,不符合题意;
C、c点时,pH<7,此时稀盐酸过量,氢氧化钠和稀盐酸反应生成氯化钠和水,此时溶液中的溶质为NaCl、HCl,符合题意;
D、解:设原NaOH溶液中溶质质量分数为x
x=8%
不符合题意。
故选C。
12.B
【详解】浓硫酸增加的质量1.8g即为生成水的质量,设碳酸氢钠质量为x,完全分解生成碳酸钠质量为y,则:
将剩余固体完全溶解在88.7 g水中,所得溶液中溶质的质量分数为:
。
故选B。
13.B
【分析】t1℃时60gR完全溶于200g水中,证明此时R的溶解度≥30g,升温到t2℃时并蒸发100g水,能完全溶解,证明此时R的溶解度≥60g,结合曲线可得R是硝酸钾。
【详解】A、由分析可知R是硝酸钾,故选项错误;
B、t1℃时60gR完全溶解,溶液①的溶质质量分数为;溶液②与溶液①溶质质量相等,溶剂为100g,则溶液②的溶质质量分数为 ;结合分析R在t1℃时溶解度为31.6,溶液③为饱和溶液,溶液③的溶质质量分数为 ,所以溶质的质量分数大小依次为:②>③>①,故选项正确;
C、t1℃时烧杯③中溶质的质量分数为,故选项错误;
D、烧杯为饱和溶液,溶质质量为31.6g,则析出固体质量为60g-31.6g=28.4g,故选项错误。
故选B
14.B
【分析】结合图甲、图乙可知,b物质的溶解度随着温度升高而增大,a物质的溶解度随着温度升高而减小,故图丙中曲线M表示b物质的溶解度曲线,曲线N表示a物质的溶解度曲线;
由图甲可知,t1℃时,a、b均是饱和饱和溶液,结合图丙可知,t1℃时a、b两物质溶解度相等,故图甲中两烧杯内a、b溶液的溶质质量分数相等;图乙中烧杯b内固体全部溶解,b溶液的溶质质量分数为;a物质的溶解度随温度降低而增大,降低温度,a的溶解度增大,饱和溶液变成不饱和溶液,故不能用降温结晶的方法从饱和a溶液中得到固体a。
【详解】A、结合图甲、图乙可知,b物质的溶解度随着温度升高而增大,故图丙中曲线M表示b物质的溶解度曲线,选项错误;
B、由图丙可知t1℃时,a、b溶解度相等,且图甲为相等质量的a、b分别加入相等质量的水中,所以图甲中两烧杯内a、b溶液的溶质质量分数相等,选项正确;
C、图乙中烧杯内b完全溶解,溶液的溶质质量分数为,选项错误;
D、a物质的溶解度随着温度升高而减小,不能使用降温结晶,选项错误。
故选B。
15.D
【分析】设生成0.2g氢气,需要镁、锌和铝的质量分别为、、
【详解】A、金属粉末与稀硫酸反应,得到无色溶液,固体无剩余,说明粉末中一定不包括铁和银,通过上面计算可知,金属粉末可能组成为镁、铝和锌、铝、镁和锌,组成有三种可能,说法错误;
B、由质量守恒定律可知:生成的氢气中氢元素都来源于硫酸中的氢元素,生成0.2g氢气,100g一定溶质质量分数的稀硫酸中氢元素的质量=0.2g,则硫酸溶液中硫酸的质量=,稀硫酸的溶质质量分数=,说法错误;
C、由A可知,该样品中不一定含有镁,说法错误;
D、反应后所得溶液中溶质的为金属硫酸盐,金属的质量=2.4g,硫酸根的质量=,所得溶液中溶质的质量=9.6g+2.4g=12g;
答案:D。
16.C
【分析】首先,ab段,铁粉与硝酸铜发生置换反应,M1点时,硝酸铜被完全消耗,之后bc段铁粉与硝酸银发生置换反应,直到M2点时铁粉消耗完毕,然后cd段之前生成的铜与硝酸银发生置换反应,直至M3点时,铜被完全消耗;
【详解】A、设有质量为x的铁粉与硝酸铜反应,并生成质量为y的铜,
解方程组得y=8(m1-5.6)g,不符合题意;
B、bc段是铁粉与硝酸银发生置换反应,不符合题意;
C、M3点时铁粉被完全消耗,沉淀完全是Ag,整体反应过程相当于铁粉与硝酸银发生置换反应,设生成Ag的质量为x,则有:
解得x=21.6g,符合题意;
D、cd段之前生成的铜与硝酸银发生置换反应生成了银单质和硝酸铜溶液,后面在滴加硝酸银也不会与硝酸铜反应,因此e点含有硝酸铜存在,不符合题意。
故选C。
【点睛】bc的斜率大于cd的斜率,而相对原子质量是Ag>Cu>Fe,在结合题干和所学知识,可以得出b点的转折是因为硝酸铜被完全消耗,而不是铁粉被完全消耗。
17.D
【详解】A、a点对应的值是恰好完全反应后生成的氢氧化镁的质量,设该质量为x
,
生成氢氧化镁的质量为2.9g,此选项表述正确;
B、b 点对应的溶液是氢氧化钠还未反应完,故溶液能使无色酚酞溶液变红,此选项表述正确;
C、c 点时继续滴加氯化镁,生成沉淀的质量不再增加,说明两者恰好完全反应,此选项表述正确;
D、d 点对应的溶液是氢氧化钠已完全反应,且滴加的氯化镁过量,故此时溶液中含有氯化钠和氯化镁两种溶质,此选项表述不正确。
故选D。
18.D
【详解】A、溶质质量=(10×98%)g=9.8g,10%=溶质质量÷溶液质量,溶液质量=(9.8÷10% )=98g,溶剂质量=(98-9.8)g=88.2g,不符合题意;
B、量取水时,视线要与液体凹液面平齐,不符合题意;
C、稀释浓硫酸时,应该浓硫酸加入水中,不符合题意;
D、配制好后,装瓶贴标签,符合题意。
故选D。
19.A
【详解】A、配制过程的错误是:①托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了;②量筒量取液体读数时,视线与液体的凹液面最低处保持水平,图中仰视读数;符合题意。
B、配制50g质量分数为15%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,无需进行蒸发;不符合题意。
C、若所有操作都正确,完全溶解后有液滴溅出,溶液具有均一性,溶质质量分数不变;不符合题意。
D、溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为15%的氯化钠溶液,需氯化钠的质量=50g×15%=7.5g;不符合题意。
故选A。
20.D
【详解】固体混合物与硫酸反应后均生成硫酸锌,硫酸锌中硫酸根的质量为:;
设参与反应的锌的质量为x,则在硫酸锌化学式中有关系:
解得x=3.25g
固体混合物的质量为5g,则样品中锌的质量分数为:;
锌的质量分数为100%;
ZnO中锌的质量分数为;
Zn(OH)2中锌的质量分数为;
ZnCO3中锌的质量分数为;
故该物质中一定含ZnCO3,答案为D。
21.A
【详解】20℃时,NaCl溶解度为36g;此时1000g水中最多可溶解NaCl的质量为360g;
第一次:加入1000g水,食盐固体有剩余,则NaCl的总质量大于360g;
第二次:再加入1000g水,食盐固体没有剩余,则NaCl的总质量小于或等于720g;
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是,即10.71%<ω≤19.35%。
故选:A。
22.D
【分析】氧化铜和稀盐酸反应生成氯化铜和水。
【详解】A、向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,M点时,氧化铜未反应完全,则剩余固体是铜和氧化铜,故A正确;
B、M、N点时,氧化铜和稀盐酸反应生成氯化铜和水,则溶液中的溶质均只有CuCl2,故B正确;
C、N点时,氧化铜和稀盐酸反应完全,溶液显中性,溶液的pH大于7,P点时,稀盐酸过量,溶液的pH小于7,则N、P点时,溶液的pH:N>P,故C正确;
D、N点时,氧化铜和稀盐酸反应完全,则混合物中铜的质量为bg,故D不正确。故选D。
23.C
【分析】向硫酸镁与硫酸的混合溶液中加入氢氧化钠溶液,会发生两个化学反应和
设钠元素的质量为 ,生成的硫酸钠的质量为,氢氧化钠溶液中溶质的质量分数为,由和可得出关系:
; ;
解得:=6.9g,=21.3g,=12%
【详解】A、由分析中得出的数据可知,=12%,则氢氧化钠溶液中溶质的质量分数为12%,故A选项说法正确;
B、生成的硫酸钠的质量为=21.3g,恰好完全反应,则溶液中溶质为硫酸钠,溶质质量为21.3g,故B选项说法正确;
C、假设当原混合溶液中溶质完全是硫酸镁的时候,可以生成的氢氧化镁沉淀质量为
解得=8.7g
然而已知溶液是硫酸镁与硫酸的混合溶液,生成的氢氧化镁质量一定小于8.7g,故C选项说法错误;
D、根据分析中的计算,钠元素的质量为=6.9g,故D选项说法正确。
故选C。
24.D
【分析】锌和稀硫酸反应生成硫酸锌和氢气。
【详解】设锌的质量为x,参与反应稀硫酸的质量为y,生成硫酸锌的质量为z
由题意可知滤液中质量的增加是生成的硫酸盐的质量大于反应消耗的硫酸质量,即溶液质量差为,即,则,x=13g,,y=19.6g,,z=32.2g,锌的质量分数为,故选D。
25.D
【分析】黄铜是铜锌合金,向该黄铜中滴加稀硫酸,锌与稀硫酸反应生成硫酸锌和氢气,铜与稀硫酸不反应,随着稀硫酸的加入,固体质量逐渐减小,待锌与稀硫酸完全反应后,固体质量不再变化,最后剩余固体的质量就是黄铜中铜的质量。
【详解】A、由图可知,a点时,固体质量还在减少,说明锌未完全反应,锌有剩余,不符合题意;
B、由图可知,c点时,稀硫酸过量,硫酸没有完全参与反应,不符合题意;
C、剩余固体的质量就是黄铜中铜的质量,即黄铜中铜的质量为5.6g,则黄铜中锌的质量为:10.0g-5.6g=4.4g,故该黄铜中锌的质量分数为,不符合题意;
D、解:设所用稀硫酸的溶质质量分数为x
x=9.8% ,符合题意;故选D。
26.AD
【分析】碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳,碳酸钠和碳酸氢钠的混合物加热至质量不再改变时,剩余的固体为碳酸钠,向其中加入100 g 质量分数为 7.3%的盐酸恰好完全反应,设:参加反应碳酸钠的质量为x,生成氯化钠的质量为y,生成二氧化碳的质量为z则所以碳酸钠和碳酸氢钠的混合物 13.7 g 加热至质量不再改变时固体质量为10.6g,固体质量减少,设:13.7 g 混合物中碳酸氢钠的质量为m则
【详解】A、根据质量守恒,原混合物中钠元素的质量与加热后剩余的固体碳酸钠中钠元素的质量守恒,则10.6g碳酸钠中钠元素的质量为,故A符合题意;
B、由分析知,碳酸钠与盐酸反应生成二氧化碳的质量为4.4g,碳酸氢钠受热分解也生成二氧化碳,所以整个实验过程中产生二氧化碳的质量大于4.4 g,故B不符合题意;
C、由分析知,反应后所得溶液中溶质是氯化钠质量为11.7g,所得溶液的质量为:,反应后所得溶液的溶质质量分数为:,故C不符合题意;
D、由分析知,混合物中碳酸氢钠的质量为8.4g,所以原混合物中碳酸钠的质量为:,故D符合题意。
故选AD。
27.AD
【分析】将Ba(OH)2溶液滴入H2SO4、CuSO4的100.0g混合溶液中,氢氧化钡先与硫酸反应生成硫酸钡沉淀和水,再与硫酸铜反应生成硫酸钡沉淀和氢氧化铜沉淀,结合题干数据,利用化学方程式计算。
【详解】A、0至V1生成硫酸钡一种沉淀,加入的Ba(OH)2溶液体积达V1时,H2SO4反应完全,V1至V2段溶液中只有硫酸铜一种溶质,V1至V2段硫酸铜与氢氧化钡反应,生成为BaSO4和Cu(OH)2两种沉淀,加入的Ba(OH)2溶液体积达V2时,CuSO4反应完全,M点溶液中含有H2SO4,显酸性,pH<7,Q点溶液中含有过量的Ba(OH)2,显碱性,pH>7,A选项正确;
B、由选项A中分析可知,N点溶液中只有CuSO4一种溶质,B错误;
C、加入的Ba(OH)2溶液体积达V1时,H2SO4反应完全,生成BaSO4的质量为11.65 g,
设参与反应的H2SO4的质量为x,参加反应的氢氧化钡质量为y。
混合溶液中H2SO4的质量分数为
故C错误。
D.若V1:V0=1:3,即与CuSO4反应的Ba(OH)2的量是与H2SO4反应的Ba(OH)2的量的2倍,H2SO4的质量为4.9g,与H2SO4反应的Ba(OH)2的质量为8.55g,与CuSO4反应的Ba(OH)2的质量为8.55 g×2=17.1 g,m的质量即最终得到沉淀的质量,则m的质量等于氢氧化钡与硫酸生成硫酸钡的质量加上氢氧化钡与硫酸铜反应生成硫酸钡和氢氧化铜的质量和。
设与硫酸铜反应生成硫酸钡质量为,生成氢氧化铜质量为。
m=11.65 g+9.8g+23.3g=44.75 g,D正确。
故选:AD。
28.AC
【详解】A、碳酸盐和酸反应生成气体逸出,总质量的减少就是生成二氧化碳气体的质量13.8g+100g-109.4g=4.4g,正确;
B、
由化学方程式体现的质量关系可知,13.8g碳酸钾完全反应生成二氧化碳4.4g;已知,不纯的K2CO3样品中,可能含有NaCl、Na2CO3中的一种或两种;氯化钠和稀盐酸不生成气体,碳酸钠和稀盐酸生成二氧化碳气体:
由于样品中一定含有杂质,氯化钠生成气体质量为0,碳酸钠生成气体质量为5.73g>4.4g,则样品中一定含有Na2CO3和NaCl,错误;
C、由选项B分析可知,样品中一定含有Na2CO3和NaCl,正确;
D. 无论是盐酸和碳酸钾还是碳酸钠反应,氯化氢和二氧化碳的质量关系都是相同的
由质量关系可知,所加的稀盐酸中溶质质量分数为,错误。
故选AC。
29.ABC
【详解】A.向一定质量的CaCO3和Mg(OH)2的固体混合物中,加入过量稀盐酸,产生的气体是CO2,CO2与NaOH反应方程式为CO2+2NaOH=Na2CO3+H2O,生成的CO2通入足量NaOH溶液原理,溶液质量增加4.4g,依据质量守恒定律可知,生成的CO2质量为4.4g,A正确,符合题意;
B.酸与碱反应生成盐和水的反应称为中和反应,氢氧化镁是碱,盐酸是酸,向一定质量的CaCO3和Mg(OH)2的固体混合物中,加入过量稀盐酸,氢氧化镁与盐酸反应生成氯化镁和水的反应属于中和反应,所以反应过程中涉及到中和反应,B正确,符合题意;
C.向一定质量的CaCO3和Mg(OH)2的固体混合物中,加入过量稀盐酸的反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑和Mg(OH)2+2HCl=MgCl2+2H2O,则溶液甲中含有CaCl2,其中的钙元素的质量与碳酸钙中钙元素的质量相等,分析CaCO3+2HCl=CaCl2+H2O+CO2↑反应可得如下关系
设钙元素的质量为x
则溶液甲中钙元素的质量为4g,C正确,符合题意;
D.依据向一定质量的CaCO3和Mg(OH)2的固体混合物中,加入过量稀盐酸的反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑和Mg(OH)2+2HCl=MgCl2+2H2O,由于加入的盐酸过量,所以溶液甲中的溶质为CaCl2、MgCl2和HCl,即溶液甲中含三种溶质,D错误,不符合题意;
故选:ABC。
答案第1页,共2页
答案第1页,共2页
同课章节目录
