1.3.3氧化还原反应方程式的配平方法复习学案(含答案)-高一化学人教版必修一
文档属性
| 名称 | 1.3.3氧化还原反应方程式的配平方法复习学案(含答案)-高一化学人教版必修一 |  | |
| 格式 | doc | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-20 15:50:35 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
1.3.3氧化还原反应方程式的配平方法复习学案
一、氧化还原反应方程式的配平方法
1.三个原则
得失电子守恒——氧化剂得到的电子总数和还原剂失去的电子总数相等。
电荷守恒——若是离子反应,反应前后正 (负) 电荷总数相等。
质量守恒——反应前后的原子种类和数目相等。
2.基本方法
“化合价升降法”是最基本的配平方法,配平过程的一般步骤为:
一标——根据反应物和生成物的化学式,标出发生变价元素的化合价。
二等——使变价元素的化合价升降的总数相等,即求出化合价升降的最小公倍数。
三定——根据化合价升高与降低的最小公倍数,定出参加氧化还原反应的物质的化学计量数。
四平——用观察法配平其他各物质的化学计量数,配平化学方程式。
五查——检查是否符合原子守恒、得失电子守恒、电荷守恒。
【例题】配平方程式:C + HNO3(浓) → NO2 ↑ +CO2 ↑ +H2O
3.配平技巧
(1)正向配平法
在氧化还原反应中,含有同种元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质,这样的反应叫做归中反应。
技巧:在配平归中反应时,一般从氧化剂和还原剂入手,采用正向配平法。
【例题】配平方程式:SO2 + H2S → S ↓ +H2O
(2)逆向配平法
在氧化还原反应中,若氧化反应和还原反应发生在同一分子内同一价态的元素上,使该元素的原子(或离子)一部分化合价升高 (被氧化),另一部分化合价降低 (被还原),这样的反应称为歧化反应。
技巧:在配平歧化反应时,一般从氧化产物和还原产物入手,逆向配平。
【例题】配平方程式:Cl2 + KOH → KCl + KClO3 + H2O
(3)缺项配平
顾名思义,在一个氧化还原反应中缺少反应物或生成物。
技巧:一般是把反应物和生成物中的所有原子进行比较,通过观察增加或减少了哪种元素:
① 若增加的元素是除 H、O 以外的非金属,未知物一般是相应的酸;
② 若增加的元素是金属,未知物一般是相应的碱;
③ 若反应前后经部分配平后发现两边氢、氧原子不平衡,则未知物是水。
【例题】KMnO4 + KNO2 + —MnSO4 + K2SO4 + KNO3 + H2O
二、氧化还原反应计算
1.主要类型
(1)求氧化剂与还原剂或氧化产物与还原产物数量之比或质量之比。
(2)通过计算确定元素的化合价或氧化产物、还原产物的组成。
(3)根据氧化还原反应的先后次序进行计算。
2.基本方法 ―电子守恒法
对于氧化还原反应的计算,关键是根据氧化还原反应的实质 ―反应中氧化剂得到电子总数与还原剂失去电子总数相等,即得失电子守恒,列出守恒关系式求解。其解题的一般步骤为:
(1)找出氧化剂、还原剂及相应的还原产物和氧化产物。
(2)找准一个原子或离子得失电子数。(注意化学式中粒子的个数)
(3)根据题中物质的数量和得失电子守恒列出等式。
n(氧化剂)× 变价原子个数 × 化合价变化值 (高价 低价)
= n(还原剂)× 变价原子个数 × 化合价变化值 (高价 低价)。
一、单选题
1.(上海市静安区2022-2023学年高三下学期二模测试化学试题)几种物质的转化关系如图所示。
下列判断正确的是
A.反应1中Fe3+是还原产物
B.反应2中H2S得电子
C.反应2的离子方程式: H2S + 2Fe3+=2Fe2+ + S↓+2H+
D.反应1中每生成1 mol NO,生成的Fe3+也是1 mol
二、填空题
2.(2023春·福建莆田·高一校考阶段练习)配平下列反应方程式。
(1)普通配平类
①_______
_______FeSO4 + _______KNO3 + _______H2SO4=_______K2SO4 + _______Fe2(SO4)3 +_______NO↑ +_______H2O
②_______
_______KI + _______KIO3 +_______H2SO4=_______I2 +_______K2SO4 +_______H2O
③_______
_______MnO +_______H+ +_______Cl-=_______Mn2+ +_______Cl2↑+_______H2O
④_______
_______NH3 +_______O2 _______NO+ _______H2O
(2)缺项配平类
①_______
_______ClO- +_______Fe(OH)3 +_______=_______Cl- +_______FeO + _______H2O
②_______
_______MnO +_______H2O2 +_______=_______Mn2+ + _______O2↑ +_______H2O
③某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有Al2O3、C、N2、AlN、CO。请将反应物与生成物分别填入以下空格内,并配平。_______
++→+
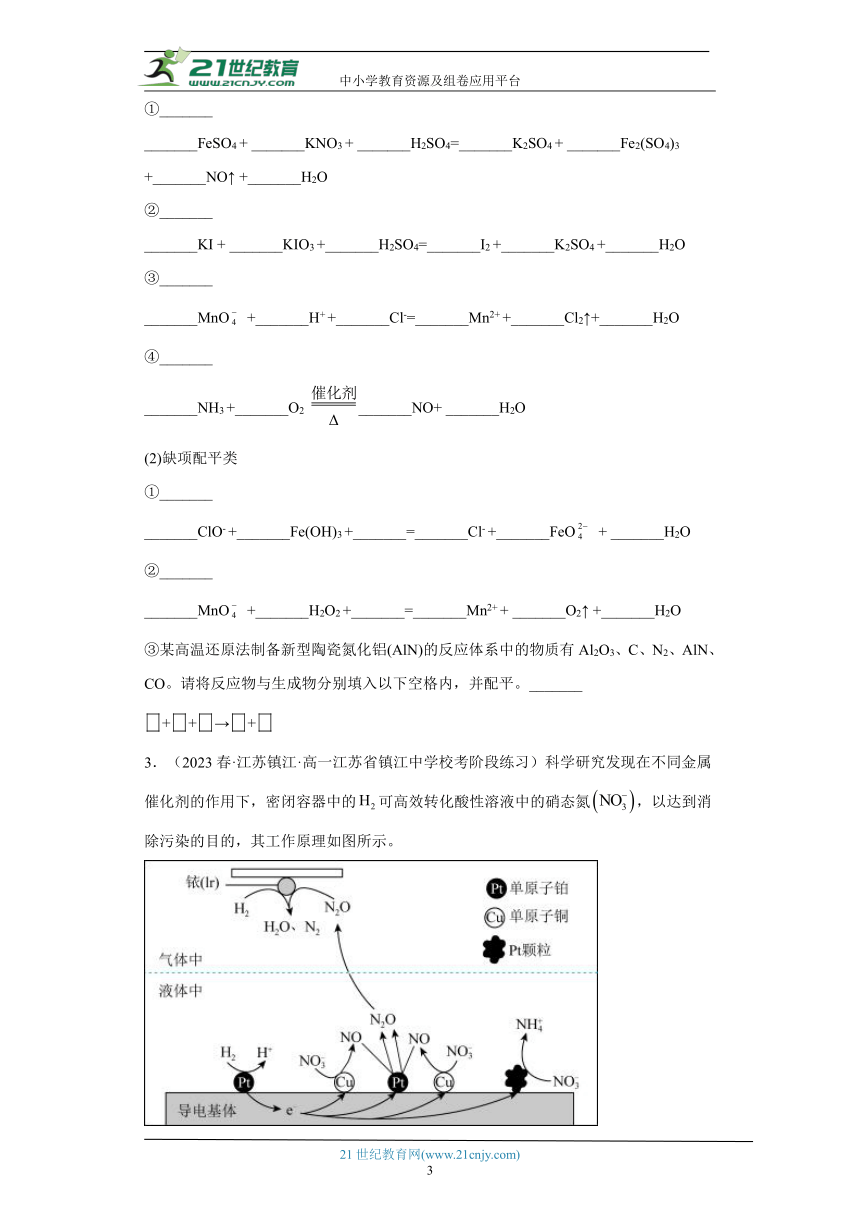
3.(2023春·江苏镇江·高一江苏省镇江中学校考阶段练习)科学研究发现在不同金属催化剂的作用下,密闭容器中的可高效转化酸性溶液中的硝态氮,以达到消除污染的目的,其工作原理如图所示。
(1)导电基体上消除含氮污染物具体历程可描述为:在导电基体的单原子铂上失去转化为,电子进入导电基体中进行传导,______为,在单原子铂表面得到一部分还原为,_______。其中导电基体上生成的总反应离子方程式为______。
(2)导电基体上的颗粒增多____________(用“无影响”,“有利于”或“不利于”填空)降低溶液中的含氮量,原因_______。
(3)若导电基体上只有单原子,含氮污染物_______(用“能”或“不能”填空)被消除,原因______。
(4)铱的表面发生反应的化学方程式:______________。
4.(2022秋·四川泸州·高一校考阶段练习)化学与生产、生活、环境息息相关。从化学视角回答下列问题:
(1)亚硝酸钠被称为工业盐,有毒,但在肉类制品加工中又可以加入极少量用作发色剂、防微生物剂、防腐剂,在漂白、电镀和金属处理等方面有应用。已知NaNO2能发生反应:_____NaNO2+_____HI→_____NO↑+_____I2+_____NaI+_____H2O
①配平上述化学方程式___________。
②该反应中HI表现的性质有___________;氧化剂与还原剂的个数之比为___________;
(2)胶体是一种生活中常见的分散系,区分胶体的方法___________;向煮沸的蒸馏水中逐滴加入几滴饱和的FeCl3溶液,继续煮沸至___________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体的化学方程式为___________,向Fe(OH)3胶体中加入稀H2SO4会先产生沉淀后溶解,请写出沉淀溶解的离子方程式:___________。
5.(2023秋·江西宜春·高一校考期末)现有下列8种物质:①CO ②氨水 ③次磷酸(H3PO2) ④酒精 ⑤铝丝 ⑥过氧化钠 ⑦氧化钙 ⑧苏打。根据要求,回答下列问题:
(1)以上物质属于电解质的是_______(填序号,下同);属于碱性氧化物的是_______。
(2)在工业上次磷酸(H3PO2)常用于化学镀银,发生的反应如下:
①配平该方程式,并用单线桥表示该反应的电子转移:_______。
②中,P元素的化合价为_______;该反应中,还原产物是_______。
6.(2023春·上海青浦·高一上海市朱家角中学校考阶段练习)某一反应体系中有反应物和生成物共八种物质:KMnO4、SO2、CuS、H2SO4、CuSO4、K2SO4、MnSO4、H2O。反应中氧化过程如下:CuS→SO2。
(1)该反应中被还原的元素是_______,CuS发生氧化反应的实质是_______。
(2)若反应过程中转移了3mol电子,则参加反应的CuS的物质的量为_______mol。
(3)写出并配平该反应的化学方程式_______。
(4)当KMnO4过量时,KMnO4会继续与SO2发生加下反应:2KMnO4+5SO2+2H2O→2H2SO4+K2SO4+2MnSO4。标出上述反应的电子转移数目和方向:_______该反应中氧化产物与还原产物的物质的量之比为_______。
7.(2022秋·海南海口·高一海口一中校考期中)完成下列填空。
(1)标出下列标“·”的元素的化合价:
_______ _______ _______ _______
(2)写出的电离方程式:_______
(3)配平与反应的离子方程式:______
8.(2023秋·四川凉山·高一宁南中学校考期末)根据所学知识回答下列问题:
(1)①写出Fe2(SO4)3在水溶液中的电离方程式:______。
②FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为:_____。
③写出Al与氢氧化钠溶液反应的离子方程式:_____。
(2)高铁酸钠(Na2FeO4)是一种新型净水剂。制取高铁酸钠所发生的反应如下:
______Fe(NO3)3+______NaOH+______Cl2=______Na2FeO4+______NaNO3+______NaCl+______H2O
①配平并用“双线桥”表示电子转移的方向和数目______。
②该反应中Na2FeO4是______(填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”)。
③若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则消耗的Cl2在标准状况下的体积为______L。
④黄色气体ClO2可用于污水杀菌和饮用水净化,ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为______。
(3)已知M2O可与R2-作用,R2-被氧化为R单质,M2O的还原产物中M为+3价;又知c(M2O)=0.3mol L-1的溶液100mL可与c(R2-)=0.6mol L-1的溶液150mL恰好完全反应,则n值为______。
9.(2023秋·江苏苏州·高二江苏省梁丰高级中学校考期末)世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全杀菌消毒剂,ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用。
(1)实验室制备ClO2的方法之一为:( H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是 。
A. KClO3在反应中得到电子 B. ClO2是氧化产物
C. H2C2O4在反应中被氧化 D.1mol KClO3参加反应有2mol电子转移
(2) KClO3和浓盐酸在一定温度下反应也会生成绿黄色的二氧化氯。其变化可表示为。
①浓盐酸在反应中表现出来的性质是___________;
②已知每产生0.1mol Cl2,则发生转移的电子的物质的量为0.2mol。ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒后的还原产物是氯离子,则其消毒的效率(以单位质量得到的电子数表示)是Cl2的______倍。(答案保留小数点后两位)
10.(2023·全国·高三专题练习)钒性能优良,用途广泛,有“金属维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分为V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是______。
(2)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式:______。
ClO+VO2++______=Cl-+VO+______。
(3)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应从而被吸收,则SO、Cl-、VO2+还原性由大到小的顺序是______。
(4)在20.00mLc(VO)=0.1mol L-1的溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是______(填标号)。
a.VO2+ b.V2+ c.V
11.(2023秋·河北邢台·高一邢台市第二中学校考期末)、、、、、组成的一个氧化还原反应体系中,发生的反应过程。
(1)①将以上物质分别填入下面对应的横线上,并配平化学方程式:_______。
_______+_______+_______=_______+_______+_______
②该反应中,被氧化的元素是_______(填元素名称);氧化剂是_______,氧化产物_______。
③反应中若产生的还原产物,则有_______电子转移。
(2)已知常温下在溶液中可发生如下两个反应:
①
②
由此可以确定Fe2+、Sn2+、Ce3+三种离子的还原性由强到弱的顺序是_______。
参考答案:
1.C
【详解】A.由图可知,反应1为,Fe3+是氧化产物,A错误;
B.由图可知,反应2中H2S转化为S,失去电子,B错误;
C.根据得失电子守恒和元素守恒配平可得反应2的离子方程式: H2S + 2Fe3+=2Fe2+ + S↓+2H+,C正确;
D.反应1为,每生成1 mol NO,生成的Fe3+是3 mol,D错误;
故选C。
2.(1) 6,2,4,1,3,2,4 5,1,3,3,3,3 2,16,10,2,5,8 4,5,4,6
(2) 3,2,4 OH-,3,2,5 2,5,6 H+,2,5,8 Al2O3+3C+N22AlN+3CO
【分析】(1)全变从左边配,即氧化剂、还原剂中都有元素化合价变化的,一般从左边反应物着手配平;
(2)自变从右边配,即自身氧化还原反应(包括分解、歧化)一般从右边产物着手配平;
缺项配平法,先利用得失电子数相等配平,再观察两边电荷。若反应物一边缺正电荷,一般加,生成物一边加水;若反应物一边缺负电荷,一般加OH-,生成物一边加水,然后再进行配平。当方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物;据此解答。
【详解】(1)①硝酸的还原产物是一氧化氮,所有的铁元素化合价升高了1价,所有的氮元素化合价降低了3价,所以硫酸亚铁前边系数是6,硫酸铁前边系数是3,硝酸钾前边系数是2,一氧化氮前边系数是2,根据元素守恒,硫酸的系数是4,硫酸钾的系数是1,水的系数是4,由电子守恒和原子守恒可知方程式为6FeSO4+2KNO3+4H2SO4=K2SO4+3Fe2(SO4)3+2NO↑+4H2O;答案为6,2,4,1,3,2,4;
②KI中I元素的化合价从-1价失电子升高到0价,KIO3中I元素的化合价从+5价得电子降低到0价,由电子守恒和原子守恒可知方程式为5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O;答案为5,1,3,3,3,3;
③中Mn元素的化合价从+7价得电子降低到+2价,Cl-中Cl元素的化合价从-1价失电子升高到0价,由电子守恒和原子守恒可知方程式为2+16H++10Cl-=2Mn2++5Cl2↑+8H2O;答案为2,16,10,2,5,8;
④NH3中N元素的化合价是-3价升高到+2价.所以N原子失去5个电子;O2中O元素的化合价从0价降低到-2价,应得到4个电子,根据得失电子守恒,5与4的最小公倍数是20,所以NH3、NO的系数是4,氧气的系数是5,根据元素守恒,H2O的系数是6,反应的方程式:4NH3+5O24NO+6H2O;故答案为:4,5,4,6;
(2)①Cl元素的化合价从+1价降低到-1价,Fe元素的化合价从+3价升高到+6价,由电子守恒和原子守恒可知方程式为3ClO- +2Fe(OH)3 +4OH-=3Cl- +2FeO +5 H2O;答案为3,2,4 OH-,3,2,5;
②Mn元素的化合价从+7价降低到+2价,H2O2中O元素的化合价从-1价升高到0价,由电子守恒和原子守恒可知方程式为2MnO +5H2O2 +6H+=2Mn2+ + 5O2↑ +8H2O
;答案为2,5,6 H+,2,5,8;
③A12O3是反应物,反应中A12O3→AlN,Al元素化合价不变化,根据氮元素守恒N2是反应物,反应中N2→AlN,N元素的化合价降低,根据电子转移守恒可知C是反应物,CO是生成物,反应中N2→AlN,N元素的化合价由0价降低为-3价,共降低6价,C→CO,C元素化合价由0价升高为+2价,共升高2价,化合价升降最小公倍数为6,故N2系数为1,C系数为3,根据N元素守恒可知AlN系数为2,根据Al元素守恒可知Al2O3系数为1,根据C元素守恒可知CO系数为3,所以其化学反应方程式为Al2O3+3C+N2=2AlN+3CO;答案为Al2O3+3C+N22AlN+3CO。
3.(1) 在单原子铜表面得到一部分电子还原 在Pt颗粒表面得到一部分还原为
(2) 不利于 在颗粒表面被还原为
(3) 不能 在单原子铂表面得到一部分还原为,若导电基体上只有单原子,不能被还原为NO
(4)
【详解】(1)根据图示,在导电基体的单原子铂上失去转化为,电子进入导电基体中进行传导,在单原子铜表面得到一部分电子还原为,在单原子铂表面得到一部分还原为,在Pt颗粒表面得到一部分还原为。其中导电基体上得电子发生还原反应生成,根据电子守恒,总反应离子方程式为。
(2)导电基体上的颗粒增多, 在颗粒表面被还原为,不利于降低溶液中的含氮量。
(3)在单原子铂表面得到一部分还原为,若导电基体上只有单原子,不能被还原为NO,含氮污染物不能被消除。
(4)铱的表面氢气和N2O反应生成N2和水,发生反应的化学方程式。
4.(1) 2,4,2,1,2,2 酸性、还原性; 1∶2;
(2) 丁达尔效应 溶液呈红褐色
【详解】(1)根据得失电子守恒,元素守恒配平可得,该反应中HI既表现出了还原性,又表现出了酸性生成了盐,根据得失电子守恒,氧化剂与还原剂的物质的量之比为:1∶2;
(2)胶体分散系中胶粒的直径在1-100nm,可发生光学现象:丁达尔效应,是鉴别胶体的主要方法;向沸水中加入氯化铁溶液,铁离子水解生成氢氧化铁,继续加热至溶液呈红褐色,得到的分散系为氢氧化铁胶体,向Fe(OH)3胶体中加入稀H2SO4胶体先聚沉,后Fe(OH)3与H2SO4发生中和反应,。
5.(1) ③⑥⑦⑧ ⑦
(2) +1 Ag
【详解】(1)电解质是溶于水或在熔融状态下能够导电的化合物;以上物质属于电解质的是③⑥⑦⑧;能和酸反应生成盐和水的氧化物属于碱性氧化物;属于碱性氧化物的是⑦;
(2)①反应中银化合价由+1变为0、磷元素化合价由+1变为+5,根据电子守恒、质量守恒可反应为,单线桥表示反应的电子转移情况,为 ;
②根据化合价代数为零可知,中,P元素的化合价为+1;该反应中,银元素化合价降低发生还原反应,还原产物是Ag。
6.(1) Mn -2价的硫失去电子变成+4价的硫(-2S→+4S,或者硫元素原子失去电子)
(2)0.5
(3)6KMnO4+5CuS+14H2SO4=3K2SO4+6MnSO4 +5CuSO4+5SO2↑+14H2O
(4) 5:2
【分析】题中已经告知氧化过程为CuS→SO2,则CuS作还原剂,KMnO4作氧化剂,还原产物为MnSO4,所以该反应为6KMnO4+5CuS+14H2SO4=3K2SO4+6MnSO4 +5CuSO4+5SO2↑+14H2O。
【详解】(1)被还原的元素是Mn,由+7价变为+2价;CuS发生氧化反应的实质是S元素失去电子,由-2价变为+4价;故答案为:Mn;-2价的硫失去电子变成+4价的硫(-2S→+4S,或者硫元素原子失去电子);
(2)1mol CuS变为1mol SO2,需要转移6mol电子,所以转移3mol电子消耗CuS 0.5mol;
(3)该反应的方程式为:6KMnO4+5CuS+14H2SO4→ 3K2SO4+6MnSO4 +5CuSO4+5SO2↑+14H2O;
(4)该反应中锰元素的化合价由+7价降低到+2价,硫元素由+4价升高到+6价,则用单线桥标出电子转移数目和方向为:;
该反应中,氧化产物为SO,还原产物为Mn2+,所以氧化产物与还原产物的物质的量之比为:(2+1+2):2=5:2。
7.(1)
(2)
(3)
【详解】(1)NH3中氢元素的化合价为+1,则氮元素的化合价为-3,即;Na2O2中钠元素的化合价为+1,则氧元素的化合价为-1,即;KClO4中钾元素、氧元素的化合价分别为+1、-2,则氯元素的化合价为+7,即;Fe3O4可写作,铁元素的化合价为+2、+3,即;
(2)属于盐,溶液中完全电离出钠离子和碳酸氢根离子,;
(3)反应中锰元素的化合价由+7变为+2,铁元素的化合价由+2变为+3,根据电子守恒、质量守恒可知,反应为。
8.(1) Fe2(SO4)3=2Fe3++3SO 2Fe3++2I-=2Fe2++I2 2Al+2H2O+2OH-=2AlO+3H2↑
(2) 氧化产物 3.36 2:5
(3)7
【详解】(1)①Fe2(SO4)3在水溶液中电离出Fe3+、SO,电离方程式为Fe2(SO4)3=2Fe3++3SO。
②FeCl3与氢碘酸发生氧化还原反应生成氯化亚铁、氯化氢和碘单质,反应的离子方程式为2Fe3++2I-=2Fe2++I2。
③Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2H2O+2OH-=2AlO+3H2↑。
(2)Fe(NO3)3中Fe元素化合价由+3升高为+6,Cl2中Cl元素化合价由0降低为-1,根据得失电子守恒可知Fe(NO3)3、Cl2的物质的量比为2:3,再根据元素守恒,配平方程式为2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+5H2O
,并用“双线桥”表示电子转移的方向和数目为。
②Fe(NO3)3中Fe元素化合价升高生成Na2FeO4, Na2FeO4是氧化产物。
③根据方程式,3mol氯气参加反应转移6mol电子,若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则消耗0.15molCl2,标准状况下的体积为3.36L。
④ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,Mn2+化合价由+2升高为+4,Mn2+是还原剂,ClO2中Cl元素化合价由+4降低为-1,ClO2是氧化剂,根据得失电子守恒,该反应过程中氧化剂与还原剂的物质的量之比为2:5。
(3)设M2O中M的化合价为x,根据得失电子守恒0.3mol L-1×0.1L×2×(x-3)= 0.6mol L-1×0.15L×2,解得x=6,2×6-2n=-2,n=7。
9.(1)AC
(2) 还原性和酸性 2.63
【详解】(1)A. 在反应中,KClO3中Cl元素由+5价降低到+4价,化合价降低,得到电子,A正确;
B. KClO3是氧化剂,则ClO2是还原产物,B不正确;
C. 在反应中,H2C2O4中C元素由+3价升高到+4价,H2C2O4在反应中作还原剂,被氧化,C正确;
D. KClO3中Cl元素由+5价降低到+4价,则1mol KClO3参加反应有1mol电子转移,D不正确;
故选AC。答案为:AC;
(2)①在反应中,HCl中的Cl元素一部分转化为Cl2,一部分转化为KCl,前者表现出还原性,后者表现出酸性,则浓盐酸表现出来的性质是还原性和酸性;
②消毒后,Cl2——2e-——2Cl-,ClO2——5e-——Cl-,则ClO2的消毒的效率(以单位质量得到的电子数表示)是Cl2的≈2.63倍。答案为:还原性和酸性;2.63。
10.(1)
(2)
(3)
(4)b
【详解】(1)由题意知,与稀硫酸、亚硫酸钾反应可生成和,根据质量守恒知生成物中还有水,化学反应方程式为;
(2)与反应生成和,氯元素的化合价由降低到,V元素的化合价由升高到,由得失电子守恒知,和的化学计量数为1,和的化学计量数为6,结合电荷守恒和元素守恒配平该离子方程式为;
(3)与盐酸反应生成,V元素的化合价降低,则中元素的化合价升高,产生的黄绿色气体为,由还原剂的还原性大于还原产物的可知,还原性,氯气与反应生成、、作还原剂,则还原性,故、还原性由大到小的顺序为;
(4)锌粉的物质的量为,设V元素在还原产物中的化合价为,根据氧化剂得电子总数等于还原剂失电子总数得,解得,则还原产物为,答案为:b。
11.(1) 5 + 2 + 14 = 5 + 2 + 7 锰 0.4
(2)Sn2+>Fe2+>Ce3+
【详解】(1)在、、、、、组成的一个氧化还原反应体系中,发生的反应过程:
①Bi元素从+5价降低到+3价,则Mn元素从+2价升高到+7价,则按得失电子数守恒、电荷守恒、元素质量守恒得配平的化学方程式:5 + 2 + 14 = 5 + 2 + 7。
②该反应中,锰元素化合价升高,则被氧化的元素是锰;反应物中Bi元素从+5价降低到+3价,氧化剂是,氧化产物。
③反应物中Bi元素从+5价降低到+3价,得还原产物即Bi3+,化合价降低2价,存在关系式Bi3+~2e-,则每反应中若产生的还原产物即Bi3+,有0.4电子转移。
(2)已知常温下在溶液中可发生如下两个反应:①②,根据氧化还原反应规律,还原剂的还原性强于还原产物的还原性,所以根据反应①可知,还原性:;根据反应②可知,还原性:;则由此可以确定Fe2+、Sn2+、Ce3+三种离子的还原性由强到弱的顺序是Sn2+>Fe2+>Ce3+。
试卷第1页,共3页
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
1.3.3氧化还原反应方程式的配平方法复习学案
一、氧化还原反应方程式的配平方法
1.三个原则
得失电子守恒——氧化剂得到的电子总数和还原剂失去的电子总数相等。
电荷守恒——若是离子反应,反应前后正 (负) 电荷总数相等。
质量守恒——反应前后的原子种类和数目相等。
2.基本方法
“化合价升降法”是最基本的配平方法,配平过程的一般步骤为:
一标——根据反应物和生成物的化学式,标出发生变价元素的化合价。
二等——使变价元素的化合价升降的总数相等,即求出化合价升降的最小公倍数。
三定——根据化合价升高与降低的最小公倍数,定出参加氧化还原反应的物质的化学计量数。
四平——用观察法配平其他各物质的化学计量数,配平化学方程式。
五查——检查是否符合原子守恒、得失电子守恒、电荷守恒。
【例题】配平方程式:C + HNO3(浓) → NO2 ↑ +CO2 ↑ +H2O
3.配平技巧
(1)正向配平法
在氧化还原反应中,含有同种元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质,这样的反应叫做归中反应。
技巧:在配平归中反应时,一般从氧化剂和还原剂入手,采用正向配平法。
【例题】配平方程式:SO2 + H2S → S ↓ +H2O
(2)逆向配平法
在氧化还原反应中,若氧化反应和还原反应发生在同一分子内同一价态的元素上,使该元素的原子(或离子)一部分化合价升高 (被氧化),另一部分化合价降低 (被还原),这样的反应称为歧化反应。
技巧:在配平歧化反应时,一般从氧化产物和还原产物入手,逆向配平。
【例题】配平方程式:Cl2 + KOH → KCl + KClO3 + H2O
(3)缺项配平
顾名思义,在一个氧化还原反应中缺少反应物或生成物。
技巧:一般是把反应物和生成物中的所有原子进行比较,通过观察增加或减少了哪种元素:
① 若增加的元素是除 H、O 以外的非金属,未知物一般是相应的酸;
② 若增加的元素是金属,未知物一般是相应的碱;
③ 若反应前后经部分配平后发现两边氢、氧原子不平衡,则未知物是水。
【例题】KMnO4 + KNO2 + —MnSO4 + K2SO4 + KNO3 + H2O
二、氧化还原反应计算
1.主要类型
(1)求氧化剂与还原剂或氧化产物与还原产物数量之比或质量之比。
(2)通过计算确定元素的化合价或氧化产物、还原产物的组成。
(3)根据氧化还原反应的先后次序进行计算。
2.基本方法 ―电子守恒法
对于氧化还原反应的计算,关键是根据氧化还原反应的实质 ―反应中氧化剂得到电子总数与还原剂失去电子总数相等,即得失电子守恒,列出守恒关系式求解。其解题的一般步骤为:
(1)找出氧化剂、还原剂及相应的还原产物和氧化产物。
(2)找准一个原子或离子得失电子数。(注意化学式中粒子的个数)
(3)根据题中物质的数量和得失电子守恒列出等式。
n(氧化剂)× 变价原子个数 × 化合价变化值 (高价 低价)
= n(还原剂)× 变价原子个数 × 化合价变化值 (高价 低价)。
一、单选题
1.(上海市静安区2022-2023学年高三下学期二模测试化学试题)几种物质的转化关系如图所示。
下列判断正确的是
A.反应1中Fe3+是还原产物
B.反应2中H2S得电子
C.反应2的离子方程式: H2S + 2Fe3+=2Fe2+ + S↓+2H+
D.反应1中每生成1 mol NO,生成的Fe3+也是1 mol
二、填空题
2.(2023春·福建莆田·高一校考阶段练习)配平下列反应方程式。
(1)普通配平类
①_______
_______FeSO4 + _______KNO3 + _______H2SO4=_______K2SO4 + _______Fe2(SO4)3 +_______NO↑ +_______H2O
②_______
_______KI + _______KIO3 +_______H2SO4=_______I2 +_______K2SO4 +_______H2O
③_______
_______MnO +_______H+ +_______Cl-=_______Mn2+ +_______Cl2↑+_______H2O
④_______
_______NH3 +_______O2 _______NO+ _______H2O
(2)缺项配平类
①_______
_______ClO- +_______Fe(OH)3 +_______=_______Cl- +_______FeO + _______H2O
②_______
_______MnO +_______H2O2 +_______=_______Mn2+ + _______O2↑ +_______H2O
③某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有Al2O3、C、N2、AlN、CO。请将反应物与生成物分别填入以下空格内,并配平。_______
++→+
3.(2023春·江苏镇江·高一江苏省镇江中学校考阶段练习)科学研究发现在不同金属催化剂的作用下,密闭容器中的可高效转化酸性溶液中的硝态氮,以达到消除污染的目的,其工作原理如图所示。
(1)导电基体上消除含氮污染物具体历程可描述为:在导电基体的单原子铂上失去转化为,电子进入导电基体中进行传导,______为,在单原子铂表面得到一部分还原为,_______。其中导电基体上生成的总反应离子方程式为______。
(2)导电基体上的颗粒增多____________(用“无影响”,“有利于”或“不利于”填空)降低溶液中的含氮量,原因_______。
(3)若导电基体上只有单原子,含氮污染物_______(用“能”或“不能”填空)被消除,原因______。
(4)铱的表面发生反应的化学方程式:______________。
4.(2022秋·四川泸州·高一校考阶段练习)化学与生产、生活、环境息息相关。从化学视角回答下列问题:
(1)亚硝酸钠被称为工业盐,有毒,但在肉类制品加工中又可以加入极少量用作发色剂、防微生物剂、防腐剂,在漂白、电镀和金属处理等方面有应用。已知NaNO2能发生反应:_____NaNO2+_____HI→_____NO↑+_____I2+_____NaI+_____H2O
①配平上述化学方程式___________。
②该反应中HI表现的性质有___________;氧化剂与还原剂的个数之比为___________;
(2)胶体是一种生活中常见的分散系,区分胶体的方法___________;向煮沸的蒸馏水中逐滴加入几滴饱和的FeCl3溶液,继续煮沸至___________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体的化学方程式为___________,向Fe(OH)3胶体中加入稀H2SO4会先产生沉淀后溶解,请写出沉淀溶解的离子方程式:___________。
5.(2023秋·江西宜春·高一校考期末)现有下列8种物质:①CO ②氨水 ③次磷酸(H3PO2) ④酒精 ⑤铝丝 ⑥过氧化钠 ⑦氧化钙 ⑧苏打。根据要求,回答下列问题:
(1)以上物质属于电解质的是_______(填序号,下同);属于碱性氧化物的是_______。
(2)在工业上次磷酸(H3PO2)常用于化学镀银,发生的反应如下:
①配平该方程式,并用单线桥表示该反应的电子转移:_______。
②中,P元素的化合价为_______;该反应中,还原产物是_______。
6.(2023春·上海青浦·高一上海市朱家角中学校考阶段练习)某一反应体系中有反应物和生成物共八种物质:KMnO4、SO2、CuS、H2SO4、CuSO4、K2SO4、MnSO4、H2O。反应中氧化过程如下:CuS→SO2。
(1)该反应中被还原的元素是_______,CuS发生氧化反应的实质是_______。
(2)若反应过程中转移了3mol电子,则参加反应的CuS的物质的量为_______mol。
(3)写出并配平该反应的化学方程式_______。
(4)当KMnO4过量时,KMnO4会继续与SO2发生加下反应:2KMnO4+5SO2+2H2O→2H2SO4+K2SO4+2MnSO4。标出上述反应的电子转移数目和方向:_______该反应中氧化产物与还原产物的物质的量之比为_______。
7.(2022秋·海南海口·高一海口一中校考期中)完成下列填空。
(1)标出下列标“·”的元素的化合价:
_______ _______ _______ _______
(2)写出的电离方程式:_______
(3)配平与反应的离子方程式:______
8.(2023秋·四川凉山·高一宁南中学校考期末)根据所学知识回答下列问题:
(1)①写出Fe2(SO4)3在水溶液中的电离方程式:______。
②FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为:_____。
③写出Al与氢氧化钠溶液反应的离子方程式:_____。
(2)高铁酸钠(Na2FeO4)是一种新型净水剂。制取高铁酸钠所发生的反应如下:
______Fe(NO3)3+______NaOH+______Cl2=______Na2FeO4+______NaNO3+______NaCl+______H2O
①配平并用“双线桥”表示电子转移的方向和数目______。
②该反应中Na2FeO4是______(填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”)。
③若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则消耗的Cl2在标准状况下的体积为______L。
④黄色气体ClO2可用于污水杀菌和饮用水净化,ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为______。
(3)已知M2O可与R2-作用,R2-被氧化为R单质,M2O的还原产物中M为+3价;又知c(M2O)=0.3mol L-1的溶液100mL可与c(R2-)=0.6mol L-1的溶液150mL恰好完全反应,则n值为______。
9.(2023秋·江苏苏州·高二江苏省梁丰高级中学校考期末)世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全杀菌消毒剂,ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用。
(1)实验室制备ClO2的方法之一为:( H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是 。
A. KClO3在反应中得到电子 B. ClO2是氧化产物
C. H2C2O4在反应中被氧化 D.1mol KClO3参加反应有2mol电子转移
(2) KClO3和浓盐酸在一定温度下反应也会生成绿黄色的二氧化氯。其变化可表示为。
①浓盐酸在反应中表现出来的性质是___________;
②已知每产生0.1mol Cl2,则发生转移的电子的物质的量为0.2mol。ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒后的还原产物是氯离子,则其消毒的效率(以单位质量得到的电子数表示)是Cl2的______倍。(答案保留小数点后两位)
10.(2023·全国·高三专题练习)钒性能优良,用途广泛,有“金属维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分为V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是______。
(2)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式:______。
ClO+VO2++______=Cl-+VO+______。
(3)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应从而被吸收,则SO、Cl-、VO2+还原性由大到小的顺序是______。
(4)在20.00mLc(VO)=0.1mol L-1的溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是______(填标号)。
a.VO2+ b.V2+ c.V
11.(2023秋·河北邢台·高一邢台市第二中学校考期末)、、、、、组成的一个氧化还原反应体系中,发生的反应过程。
(1)①将以上物质分别填入下面对应的横线上,并配平化学方程式:_______。
_______+_______+_______=_______+_______+_______
②该反应中,被氧化的元素是_______(填元素名称);氧化剂是_______,氧化产物_______。
③反应中若产生的还原产物,则有_______电子转移。
(2)已知常温下在溶液中可发生如下两个反应:
①
②
由此可以确定Fe2+、Sn2+、Ce3+三种离子的还原性由强到弱的顺序是_______。
参考答案:
1.C
【详解】A.由图可知,反应1为,Fe3+是氧化产物,A错误;
B.由图可知,反应2中H2S转化为S,失去电子,B错误;
C.根据得失电子守恒和元素守恒配平可得反应2的离子方程式: H2S + 2Fe3+=2Fe2+ + S↓+2H+,C正确;
D.反应1为,每生成1 mol NO,生成的Fe3+是3 mol,D错误;
故选C。
2.(1) 6,2,4,1,3,2,4 5,1,3,3,3,3 2,16,10,2,5,8 4,5,4,6
(2) 3,2,4 OH-,3,2,5 2,5,6 H+,2,5,8 Al2O3+3C+N22AlN+3CO
【分析】(1)全变从左边配,即氧化剂、还原剂中都有元素化合价变化的,一般从左边反应物着手配平;
(2)自变从右边配,即自身氧化还原反应(包括分解、歧化)一般从右边产物着手配平;
缺项配平法,先利用得失电子数相等配平,再观察两边电荷。若反应物一边缺正电荷,一般加,生成物一边加水;若反应物一边缺负电荷,一般加OH-,生成物一边加水,然后再进行配平。当方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物;据此解答。
【详解】(1)①硝酸的还原产物是一氧化氮,所有的铁元素化合价升高了1价,所有的氮元素化合价降低了3价,所以硫酸亚铁前边系数是6,硫酸铁前边系数是3,硝酸钾前边系数是2,一氧化氮前边系数是2,根据元素守恒,硫酸的系数是4,硫酸钾的系数是1,水的系数是4,由电子守恒和原子守恒可知方程式为6FeSO4+2KNO3+4H2SO4=K2SO4+3Fe2(SO4)3+2NO↑+4H2O;答案为6,2,4,1,3,2,4;
②KI中I元素的化合价从-1价失电子升高到0价,KIO3中I元素的化合价从+5价得电子降低到0价,由电子守恒和原子守恒可知方程式为5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O;答案为5,1,3,3,3,3;
③中Mn元素的化合价从+7价得电子降低到+2价,Cl-中Cl元素的化合价从-1价失电子升高到0价,由电子守恒和原子守恒可知方程式为2+16H++10Cl-=2Mn2++5Cl2↑+8H2O;答案为2,16,10,2,5,8;
④NH3中N元素的化合价是-3价升高到+2价.所以N原子失去5个电子;O2中O元素的化合价从0价降低到-2价,应得到4个电子,根据得失电子守恒,5与4的最小公倍数是20,所以NH3、NO的系数是4,氧气的系数是5,根据元素守恒,H2O的系数是6,反应的方程式:4NH3+5O24NO+6H2O;故答案为:4,5,4,6;
(2)①Cl元素的化合价从+1价降低到-1价,Fe元素的化合价从+3价升高到+6价,由电子守恒和原子守恒可知方程式为3ClO- +2Fe(OH)3 +4OH-=3Cl- +2FeO +5 H2O;答案为3,2,4 OH-,3,2,5;
②Mn元素的化合价从+7价降低到+2价,H2O2中O元素的化合价从-1价升高到0价,由电子守恒和原子守恒可知方程式为2MnO +5H2O2 +6H+=2Mn2+ + 5O2↑ +8H2O
;答案为2,5,6 H+,2,5,8;
③A12O3是反应物,反应中A12O3→AlN,Al元素化合价不变化,根据氮元素守恒N2是反应物,反应中N2→AlN,N元素的化合价降低,根据电子转移守恒可知C是反应物,CO是生成物,反应中N2→AlN,N元素的化合价由0价降低为-3价,共降低6价,C→CO,C元素化合价由0价升高为+2价,共升高2价,化合价升降最小公倍数为6,故N2系数为1,C系数为3,根据N元素守恒可知AlN系数为2,根据Al元素守恒可知Al2O3系数为1,根据C元素守恒可知CO系数为3,所以其化学反应方程式为Al2O3+3C+N2=2AlN+3CO;答案为Al2O3+3C+N22AlN+3CO。
3.(1) 在单原子铜表面得到一部分电子还原 在Pt颗粒表面得到一部分还原为
(2) 不利于 在颗粒表面被还原为
(3) 不能 在单原子铂表面得到一部分还原为,若导电基体上只有单原子,不能被还原为NO
(4)
【详解】(1)根据图示,在导电基体的单原子铂上失去转化为,电子进入导电基体中进行传导,在单原子铜表面得到一部分电子还原为,在单原子铂表面得到一部分还原为,在Pt颗粒表面得到一部分还原为。其中导电基体上得电子发生还原反应生成,根据电子守恒,总反应离子方程式为。
(2)导电基体上的颗粒增多, 在颗粒表面被还原为,不利于降低溶液中的含氮量。
(3)在单原子铂表面得到一部分还原为,若导电基体上只有单原子,不能被还原为NO,含氮污染物不能被消除。
(4)铱的表面氢气和N2O反应生成N2和水,发生反应的化学方程式。
4.(1) 2,4,2,1,2,2 酸性、还原性; 1∶2;
(2) 丁达尔效应 溶液呈红褐色
【详解】(1)根据得失电子守恒,元素守恒配平可得,该反应中HI既表现出了还原性,又表现出了酸性生成了盐,根据得失电子守恒,氧化剂与还原剂的物质的量之比为:1∶2;
(2)胶体分散系中胶粒的直径在1-100nm,可发生光学现象:丁达尔效应,是鉴别胶体的主要方法;向沸水中加入氯化铁溶液,铁离子水解生成氢氧化铁,继续加热至溶液呈红褐色,得到的分散系为氢氧化铁胶体,向Fe(OH)3胶体中加入稀H2SO4胶体先聚沉,后Fe(OH)3与H2SO4发生中和反应,。
5.(1) ③⑥⑦⑧ ⑦
(2) +1 Ag
【详解】(1)电解质是溶于水或在熔融状态下能够导电的化合物;以上物质属于电解质的是③⑥⑦⑧;能和酸反应生成盐和水的氧化物属于碱性氧化物;属于碱性氧化物的是⑦;
(2)①反应中银化合价由+1变为0、磷元素化合价由+1变为+5,根据电子守恒、质量守恒可反应为,单线桥表示反应的电子转移情况,为 ;
②根据化合价代数为零可知,中,P元素的化合价为+1;该反应中,银元素化合价降低发生还原反应,还原产物是Ag。
6.(1) Mn -2价的硫失去电子变成+4价的硫(-2S→+4S,或者硫元素原子失去电子)
(2)0.5
(3)6KMnO4+5CuS+14H2SO4=3K2SO4+6MnSO4 +5CuSO4+5SO2↑+14H2O
(4) 5:2
【分析】题中已经告知氧化过程为CuS→SO2,则CuS作还原剂,KMnO4作氧化剂,还原产物为MnSO4,所以该反应为6KMnO4+5CuS+14H2SO4=3K2SO4+6MnSO4 +5CuSO4+5SO2↑+14H2O。
【详解】(1)被还原的元素是Mn,由+7价变为+2价;CuS发生氧化反应的实质是S元素失去电子,由-2价变为+4价;故答案为:Mn;-2价的硫失去电子变成+4价的硫(-2S→+4S,或者硫元素原子失去电子);
(2)1mol CuS变为1mol SO2,需要转移6mol电子,所以转移3mol电子消耗CuS 0.5mol;
(3)该反应的方程式为:6KMnO4+5CuS+14H2SO4→ 3K2SO4+6MnSO4 +5CuSO4+5SO2↑+14H2O;
(4)该反应中锰元素的化合价由+7价降低到+2价,硫元素由+4价升高到+6价,则用单线桥标出电子转移数目和方向为:;
该反应中,氧化产物为SO,还原产物为Mn2+,所以氧化产物与还原产物的物质的量之比为:(2+1+2):2=5:2。
7.(1)
(2)
(3)
【详解】(1)NH3中氢元素的化合价为+1,则氮元素的化合价为-3,即;Na2O2中钠元素的化合价为+1,则氧元素的化合价为-1,即;KClO4中钾元素、氧元素的化合价分别为+1、-2,则氯元素的化合价为+7,即;Fe3O4可写作,铁元素的化合价为+2、+3,即;
(2)属于盐,溶液中完全电离出钠离子和碳酸氢根离子,;
(3)反应中锰元素的化合价由+7变为+2,铁元素的化合价由+2变为+3,根据电子守恒、质量守恒可知,反应为。
8.(1) Fe2(SO4)3=2Fe3++3SO 2Fe3++2I-=2Fe2++I2 2Al+2H2O+2OH-=2AlO+3H2↑
(2) 氧化产物 3.36 2:5
(3)7
【详解】(1)①Fe2(SO4)3在水溶液中电离出Fe3+、SO,电离方程式为Fe2(SO4)3=2Fe3++3SO。
②FeCl3与氢碘酸发生氧化还原反应生成氯化亚铁、氯化氢和碘单质,反应的离子方程式为2Fe3++2I-=2Fe2++I2。
③Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2H2O+2OH-=2AlO+3H2↑。
(2)Fe(NO3)3中Fe元素化合价由+3升高为+6,Cl2中Cl元素化合价由0降低为-1,根据得失电子守恒可知Fe(NO3)3、Cl2的物质的量比为2:3,再根据元素守恒,配平方程式为2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+5H2O
,并用“双线桥”表示电子转移的方向和数目为。
②Fe(NO3)3中Fe元素化合价升高生成Na2FeO4, Na2FeO4是氧化产物。
③根据方程式,3mol氯气参加反应转移6mol电子,若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则消耗0.15molCl2,标准状况下的体积为3.36L。
④ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,Mn2+化合价由+2升高为+4,Mn2+是还原剂,ClO2中Cl元素化合价由+4降低为-1,ClO2是氧化剂,根据得失电子守恒,该反应过程中氧化剂与还原剂的物质的量之比为2:5。
(3)设M2O中M的化合价为x,根据得失电子守恒0.3mol L-1×0.1L×2×(x-3)= 0.6mol L-1×0.15L×2,解得x=6,2×6-2n=-2,n=7。
9.(1)AC
(2) 还原性和酸性 2.63
【详解】(1)A. 在反应中,KClO3中Cl元素由+5价降低到+4价,化合价降低,得到电子,A正确;
B. KClO3是氧化剂,则ClO2是还原产物,B不正确;
C. 在反应中,H2C2O4中C元素由+3价升高到+4价,H2C2O4在反应中作还原剂,被氧化,C正确;
D. KClO3中Cl元素由+5价降低到+4价,则1mol KClO3参加反应有1mol电子转移,D不正确;
故选AC。答案为:AC;
(2)①在反应中,HCl中的Cl元素一部分转化为Cl2,一部分转化为KCl,前者表现出还原性,后者表现出酸性,则浓盐酸表现出来的性质是还原性和酸性;
②消毒后,Cl2——2e-——2Cl-,ClO2——5e-——Cl-,则ClO2的消毒的效率(以单位质量得到的电子数表示)是Cl2的≈2.63倍。答案为:还原性和酸性;2.63。
10.(1)
(2)
(3)
(4)b
【详解】(1)由题意知,与稀硫酸、亚硫酸钾反应可生成和,根据质量守恒知生成物中还有水,化学反应方程式为;
(2)与反应生成和,氯元素的化合价由降低到,V元素的化合价由升高到,由得失电子守恒知,和的化学计量数为1,和的化学计量数为6,结合电荷守恒和元素守恒配平该离子方程式为;
(3)与盐酸反应生成,V元素的化合价降低,则中元素的化合价升高,产生的黄绿色气体为,由还原剂的还原性大于还原产物的可知,还原性,氯气与反应生成、、作还原剂,则还原性,故、还原性由大到小的顺序为;
(4)锌粉的物质的量为,设V元素在还原产物中的化合价为,根据氧化剂得电子总数等于还原剂失电子总数得,解得,则还原产物为,答案为:b。
11.(1) 5 + 2 + 14 = 5 + 2 + 7 锰 0.4
(2)Sn2+>Fe2+>Ce3+
【详解】(1)在、、、、、组成的一个氧化还原反应体系中,发生的反应过程:
①Bi元素从+5价降低到+3价,则Mn元素从+2价升高到+7价,则按得失电子数守恒、电荷守恒、元素质量守恒得配平的化学方程式:5 + 2 + 14 = 5 + 2 + 7。
②该反应中,锰元素化合价升高,则被氧化的元素是锰;反应物中Bi元素从+5价降低到+3价,氧化剂是,氧化产物。
③反应物中Bi元素从+5价降低到+3价,得还原产物即Bi3+,化合价降低2价,存在关系式Bi3+~2e-,则每反应中若产生的还原产物即Bi3+,有0.4电子转移。
(2)已知常温下在溶液中可发生如下两个反应:①②,根据氧化还原反应规律,还原剂的还原性强于还原产物的还原性,所以根据反应①可知,还原性:;根据反应②可知,还原性:;则由此可以确定Fe2+、Sn2+、Ce3+三种离子的还原性由强到弱的顺序是Sn2+>Fe2+>Ce3+。
试卷第1页,共3页
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
