2.2 氯及其化合物 课件(共40张PPT) 2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2 氯及其化合物 课件(共40张PPT) 2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-22 08:36:39 | ||
图片预览










文档简介
(共40张PPT)
第二节 氯及其化合物
第二章 海水中的重要元素—钠和氯
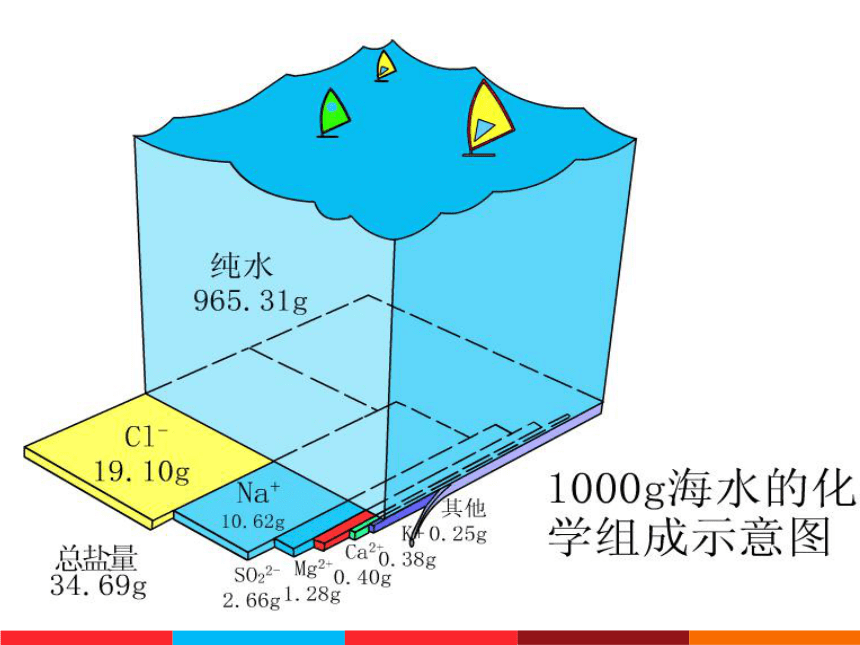
海洋是一个重要的资源宝库,大约有80多种元素蕴藏在湛蓝的海水里。在地壳中氯的含量为0.031%,大部分氯以氯化物的形式存在于表面积为36100万平方公里的海洋里,其总量约为30000万亿吨.
氯是人体所必须的宏量元素之一。人体中氯的含量一般为0.12%,这它主要存在于细胞外液中。缺少了它,人体机能就会失调。我们每天都需要食用食盐(主要成分为氯化钠),原因之一就是要满足人体对氯元素的需要。
氯元素的主要存在形式--氯化钠
第一课时 活泼的黄绿色气体--氯气
1915年4月22日下午5时,在第一次世界大战两军对峙的比利时伊珀尔战场。趁着顺风,德军一声令下开启了大约6000只预先埋伏的压缩氯气钢瓶。刹那间在68千米宽的正面形成2米高的黄绿色气体幕墙滚滚向前推进,纵深到达10-15公里,对手毫无防范,致使5千多人死亡,一万五千多人中毒致伤。一位战地记者进行了如此描述:“他们已经死亡,两手伸展着好像要挥去上方的死神。尸体遍野,他们极度痛苦的肺在喘息,满嘴都是黄色液体。”这就是战争史上的第一次化学战,从此,化学战作为最邪恶的战争被写入了人类战争的史册。这种气体就是我们研究的氯气。
请结合上述文字材料,总结氯气的物理性质。
氯气是一种黄绿色、有刺激性气味的有毒气体
(一)氯气的性质
1.物理性质
(1)氯气是黄绿色
(2)有刺激性气味,有毒的气体
(3)易液化
(4)密度比空气大
(5)能溶于水(1体积水可溶解2体积氯气)
——向上排空气法收集
不能用排水法收集,可用排饱和食盐水法收集
一、活泼的黄绿色气体——氯气
——液化的氯气叫液氯(纯净物)
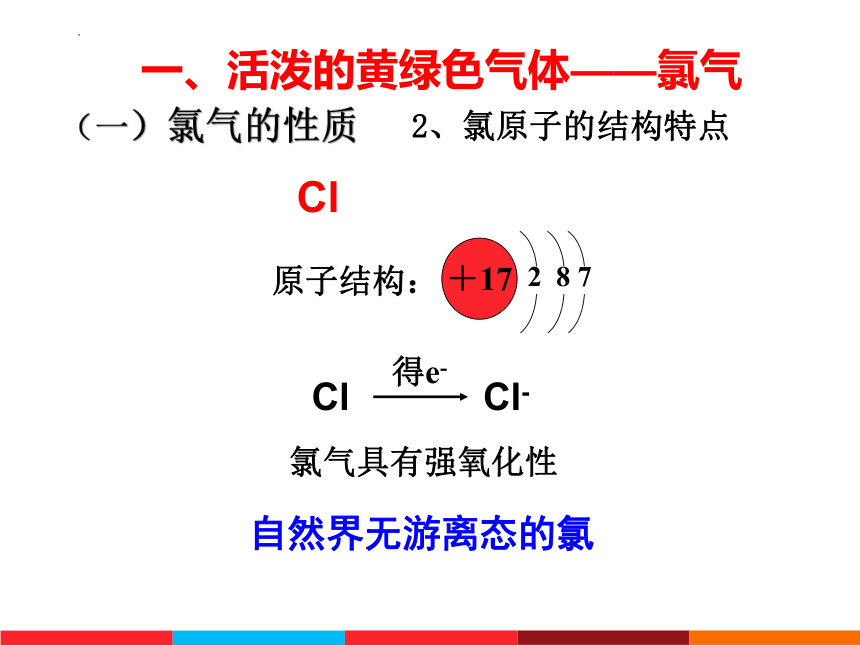
2、氯原子的结构特点
Cl
得e-
Cl-
一、活泼的黄绿色气体——氯气
原子结构:
+17
2 8 7
氯气具有强氧化性
Cl
(一)氯气的性质
自然界无游离态的氯
现象
钠与氯气反应
剧烈燃烧,火焰呈————色,生成————晶体
2Na + Cl2 === 2 NaCl
点燃
白色
黄
1、氯气与金属反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
①剧烈燃烧
②产生白烟
铁与氯气反应
现象
铁丝剧烈燃烧,产生—————色的————
2Fe + 3 Cl2 === 2 FeCl3
点燃
棕褐
烟
1、氯气与金属反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
铁在氯气中燃烧的反应现象
产生棕色的烟
氯气与铜反应
铜丝在氯气里剧烈燃烧,产生棕黄色的烟,产物溶于水后,溶液呈蓝绿色。
Cu + Cl2 === CuCl2
点燃
现象
反应规律:生成高价金属的氯化物
1、氯气与金属反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
产生棕黄色烟
2.怎样制取FeCl2
1.下列化合物中,不能由氯气和相应的金属直接反应来制取的是
A. FeCl3 B. CaCl2 C. FeCl2 D. KCl
Fe+2HCl FeCl2+H2↑
(C)
随堂测试
H2 + Cl2 === 2HCl
点燃
或光照
纯净的氢气在氯气中安静地燃烧,发出白色火焰,放出大量的热,瓶口有大量白雾产生。
实验现象
一定条件(点燃或光照)下氯气能与氢气反应
氢气和氯气的混合气体光照或点燃后发生爆炸。
2、氯气与非金属反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
思考与交流
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识
一定条件(点燃或光照)下氯气能与氢气反应
2、氯气与非金属反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
概念:
发光发热的剧烈化学反应
本质:
氧化还原反应
条件:
不一定有氧气参加
思考1:同学们去游泳池时,有没有闻到一股气味呢 为什么会有这种气味,其中放了什么呢
自来水厂用氯气杀菌,消毒,闻到的刺激性气味是余氯的气味。
思考2:这说明氯气可以溶于水吗?
Cl2能溶于水,1体积的水能溶解2体积的Cl2
思考3:氯气溶于水会发生化学反应吗?
3、氯气与水反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
Cl2 + H2O =
HCl + HClO
作氧化剂, 作还原剂
Cl2既是氧化剂,又是还原剂
Cl2
Cl2
3、氯气与水反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
1、这是一个氧化还原反应吗?
是
2、这个反应的氧化剂、还原剂分别是什么?
3、你可以把这个方程式改写成离子方程式吗?
Cl2 + H2O = 2H+ +2Cl- +O2-
Cl2 + H2O = 2H+ +Cl- +ClO-
Cl2 + H2O = H+ +Cl- +HClO
3.强氧化性
漂白作用
1.弱酸性
2.不稳定性
光照
2HClO 2HCl+O2↑
可用于自来水的杀菌、消毒,可用做漂白剂。
酸性:H2CO3 >HClO
一、活泼的黄绿色气体——氯气
(三)次氯酸的化学性质
用于游泳池的消毒
科学探究:氯水的漂白作用
实验2-8:
实验操作 实验现象 结论
将湿润的有色布条放入干燥氯气中
将干燥的有色布条放入干燥氯气中
有色布条褪色
有色布条不褪色
氯水有漂白作用
干燥氯气没有漂白作用
氯气的水溶液称为氯水,溶液呈浅黄绿色
结论:氯水有漂白性
液氯与氯水的区别?新制氯水与久置氯水的区别?
液氯 氯水
分类
成分
性质
纯净物
混合物
Cl2 ,HCl, HClO,
H2O
HCl, H2O
新制
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
久置
只有Cl2
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
只有酸性
(相当于稀盐酸)
(四)氯水
紫色石蕊 AgNO3aq Na2CO3aq
现象
反应微粒
1、填出氯水与某些物质反应的现象和微粒:
先变红后褪色
H+使变红
HClO漂白
白色沉淀
Cl-与Ag+
生成AgCl
有气泡
H+与CO32-
反应生成CO2
随堂练习:
2.(双选)下列关于氯水的叙述中正确的是
A.新制氯水中只含有Cl2和H2O分子
B.新制的氯水可使蓝色石蕊试纸先
变红后褪色.
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后,酸性增强.
BD
第二课时 氯气与碱的反应
复习回顾
请写出Cl2与水反应的化学方程式和离子方程式
Cl2+H2O HCl+HClO
Cl2+H2O H++Cl-+HClO
想一想
有效氯水需现配现用,且储存困难,因此实际生活中很少直接用氯水作消毒剂。
评价氯水直接作为消毒剂的优缺点。
氯气与碱溶液的反应
直接使用氯气作为漂白剂在使用上不方便,人们便制作了日常使用的漂白液和漂白粉,那么,这些漂白液和漂白粉的主要成分和有效成分是什么?它们是怎么制得的?
Cl2+2NaOH=NaCl+NaClO+H2O
漂白液
主要成分:NaCl和NaClO
有效成分:NaClO
漂白原理:次氯酸盐与酸发生复分解反应生成的HClO起漂白作用。(强酸制弱酸)
工业上:NaClO+HCl=NaCl+HClO
日常生活:2NaClO+CO2+H2O=Na2CO3 +2HClO
二、氯气与碱的反应
请仿照氯气与氢氧化钠的反应,写出氯气被熟石灰吸收的反应方程式
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
有效成分
漂粉精
漂白粉
Cl2+Ca(OH)2 ——
二、氯气与碱的反应
漂白粉的漂白原理是什么?
想一想
日常 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
工业 Ca(ClO)2+2HCl===CaCl2+2HClO
漂白原理:强酸制弱酸
酸性H2CO3 >HClO
漂白粉能起漂白和杀菌的作用,
其原理是什么?
Ca(ClO)2 HClO
转化
氯水、漂白液、漂白粉、漂粉精的漂白作用
都是因反应生成的HClO
漂粉精可用于游泳池的消毒
思考1:漂白液、漂白粉起漂白作用都是由于生成了HClO,为什么不直接用次氯酸作漂白剂?
次氯酸不稳定,次氯酸盐较稳定
思考2:可以把Cl2通入澄清石灰水中制漂白粉吗?
不可以,澄清石灰水中Ca(OH)2含量很少,应通入熟石灰中
二、氯气与碱的反应
思考3:你可以写出制备漂白液的离子方程式吗?
Cl2+2NaOH=NaCl+NaClO+H2O
离子方程式:Cl2+2OH-=Cl-+ClO-+H2O
1、用Cl2消毒的自来水配制下列溶液,不会引起药品变质的是( )
A NaCl B AgNO3 C NaOH D Ca(OH)2
2、下列物质中,不能使有色布条褪色的是 ( )
A NaClO溶液 B Ca(ClO)2 溶液
C 氯水 D CaCl2溶液
A
D
随堂测试
第三课时 氯气的制备及Cl-的检验
发生
装置
净化
装置
干燥
装置
收集
装置
吸收
装置
反应物状态及反应条件
气体及杂质的性质
气体的性质选择干燥剂
气体水溶性及密度
气体的毒性选择吸收剂
气体制备的一般过程
MnO2+4HCl(浓)=MnCl2+Cl2↑ +2H2O
▽
1、原理
Cl2的实验室制备方法
反应装置:______________________
_____用稀盐酸代替浓盐酸
体现盐酸的________________性
固体+液体加热的反应
酸性和还原
不能
还能使用以下方法制备
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
MnO2 + 4HCl (浓)== MnCl2 +2H2O +Cl2 ↑
注意:
1.MnO2为难溶于水的黑色固体
2.稀盐酸与MnO2不反应
3.反应要加热。
若有氯气泄漏,周围的人
往高处走还是往低处走
应顺风走还是逆风走
高处,氯气密度大于空气
逆风
若有足量MnO2和4mol浓盐酸加热条件下反应,可生成Cl2物质的量为多少?
小于1mol
2、除杂和干燥
MnO2+4HCl(浓)=MnCl2+Cl2 ↑ +H2O
▽
可能含有的杂质_________________
HCl H2O
除杂质和干燥的试剂______________________
饱和食盐水
浓硫酸或无水CaCl2
浓硫酸
饱和食盐水
氯化钙
饱和食盐水
3、收集方法
向上排空气法(密度比空气要大)
排饱和食盐水(在食盐水中的溶解度很小)
4、尾气吸收
用NaOH溶液吸收
饱和食盐水
NaOH溶液
向上排空气法
制氯气的反应装置
浓盐酸
MnO2
除HCl
除H2O
吸收尾气
Cl2
MnO2 + 4HCl (浓)==MnCl2 +2H2O + Cl2 ↑
NaCl溶液
浓硫酸
收集Cl2
NaOH溶液
随堂练习
D
Cl2
复习回顾
Ca(ClO)2
NaClO
HCl
HClO
FeCl3
Br2
①
②
③
④
⑤
⑥
⑦
实验现象
解释或离子方程式
加入AgNO3溶液后 加入 稀硝酸后
稀盐酸
NaCl溶液
Na2CO3溶液
NaOH溶液
自来水
白色沉淀
白色沉淀
沉淀消失,有气泡生成
沉淀不消失
沉淀不消失
Cl- + Ag+ =AgCl↓
CO32- +2Ag+ =Ag2CO3↓
Cl- + Ag+ =AgCl↓
Cl- + Ag+ =AgCl↓
白色沉淀
沉淀不消失
Ag2CO3+2H+=2Ag++CO2↑ + H2O
白色沉淀
白色沉淀,沉淀很快变黑
沉淀溶解
二、Cl-的检验
OH- +Ag+ =AgOH↓
2AgOH=Ag2O+H2O
二、Cl-的检验
某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对吗?
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀(沉淀不溶于稀硝酸),则被检液中含有Cl-。
从以上实验可知:
方法
在溶液里,多种阴离子与Ag+能结合生成沉淀,
但是呈白色不溶于稀HNO3的只有AgCl,所以,先加稀HNO3是排除其它离子的干扰(CO32- 等 )
THANKS
第二节 氯及其化合物
第二章 海水中的重要元素—钠和氯
海洋是一个重要的资源宝库,大约有80多种元素蕴藏在湛蓝的海水里。在地壳中氯的含量为0.031%,大部分氯以氯化物的形式存在于表面积为36100万平方公里的海洋里,其总量约为30000万亿吨.
氯是人体所必须的宏量元素之一。人体中氯的含量一般为0.12%,这它主要存在于细胞外液中。缺少了它,人体机能就会失调。我们每天都需要食用食盐(主要成分为氯化钠),原因之一就是要满足人体对氯元素的需要。
氯元素的主要存在形式--氯化钠
第一课时 活泼的黄绿色气体--氯气
1915年4月22日下午5时,在第一次世界大战两军对峙的比利时伊珀尔战场。趁着顺风,德军一声令下开启了大约6000只预先埋伏的压缩氯气钢瓶。刹那间在68千米宽的正面形成2米高的黄绿色气体幕墙滚滚向前推进,纵深到达10-15公里,对手毫无防范,致使5千多人死亡,一万五千多人中毒致伤。一位战地记者进行了如此描述:“他们已经死亡,两手伸展着好像要挥去上方的死神。尸体遍野,他们极度痛苦的肺在喘息,满嘴都是黄色液体。”这就是战争史上的第一次化学战,从此,化学战作为最邪恶的战争被写入了人类战争的史册。这种气体就是我们研究的氯气。
请结合上述文字材料,总结氯气的物理性质。
氯气是一种黄绿色、有刺激性气味的有毒气体
(一)氯气的性质
1.物理性质
(1)氯气是黄绿色
(2)有刺激性气味,有毒的气体
(3)易液化
(4)密度比空气大
(5)能溶于水(1体积水可溶解2体积氯气)
——向上排空气法收集
不能用排水法收集,可用排饱和食盐水法收集
一、活泼的黄绿色气体——氯气
——液化的氯气叫液氯(纯净物)
2、氯原子的结构特点
Cl
得e-
Cl-
一、活泼的黄绿色气体——氯气
原子结构:
+17
2 8 7
氯气具有强氧化性
Cl
(一)氯气的性质
自然界无游离态的氯
现象
钠与氯气反应
剧烈燃烧,火焰呈————色,生成————晶体
2Na + Cl2 === 2 NaCl
点燃
白色
黄
1、氯气与金属反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
①剧烈燃烧
②产生白烟
铁与氯气反应
现象
铁丝剧烈燃烧,产生—————色的————
2Fe + 3 Cl2 === 2 FeCl3
点燃
棕褐
烟
1、氯气与金属反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
铁在氯气中燃烧的反应现象
产生棕色的烟
氯气与铜反应
铜丝在氯气里剧烈燃烧,产生棕黄色的烟,产物溶于水后,溶液呈蓝绿色。
Cu + Cl2 === CuCl2
点燃
现象
反应规律:生成高价金属的氯化物
1、氯气与金属反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
产生棕黄色烟
2.怎样制取FeCl2
1.下列化合物中,不能由氯气和相应的金属直接反应来制取的是
A. FeCl3 B. CaCl2 C. FeCl2 D. KCl
Fe+2HCl FeCl2+H2↑
(C)
随堂测试
H2 + Cl2 === 2HCl
点燃
或光照
纯净的氢气在氯气中安静地燃烧,发出白色火焰,放出大量的热,瓶口有大量白雾产生。
实验现象
一定条件(点燃或光照)下氯气能与氢气反应
氢气和氯气的混合气体光照或点燃后发生爆炸。
2、氯气与非金属反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
思考与交流
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识
一定条件(点燃或光照)下氯气能与氢气反应
2、氯气与非金属反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
概念:
发光发热的剧烈化学反应
本质:
氧化还原反应
条件:
不一定有氧气参加
思考1:同学们去游泳池时,有没有闻到一股气味呢 为什么会有这种气味,其中放了什么呢
自来水厂用氯气杀菌,消毒,闻到的刺激性气味是余氯的气味。
思考2:这说明氯气可以溶于水吗?
Cl2能溶于水,1体积的水能溶解2体积的Cl2
思考3:氯气溶于水会发生化学反应吗?
3、氯气与水反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
Cl2 + H2O =
HCl + HClO
作氧化剂, 作还原剂
Cl2既是氧化剂,又是还原剂
Cl2
Cl2
3、氯气与水反应
一、活泼的黄绿色气体——氯气
(二)氯气的化学性质
1、这是一个氧化还原反应吗?
是
2、这个反应的氧化剂、还原剂分别是什么?
3、你可以把这个方程式改写成离子方程式吗?
Cl2 + H2O = 2H+ +2Cl- +O2-
Cl2 + H2O = 2H+ +Cl- +ClO-
Cl2 + H2O = H+ +Cl- +HClO
3.强氧化性
漂白作用
1.弱酸性
2.不稳定性
光照
2HClO 2HCl+O2↑
可用于自来水的杀菌、消毒,可用做漂白剂。
酸性:H2CO3 >HClO
一、活泼的黄绿色气体——氯气
(三)次氯酸的化学性质
用于游泳池的消毒
科学探究:氯水的漂白作用
实验2-8:
实验操作 实验现象 结论
将湿润的有色布条放入干燥氯气中
将干燥的有色布条放入干燥氯气中
有色布条褪色
有色布条不褪色
氯水有漂白作用
干燥氯气没有漂白作用
氯气的水溶液称为氯水,溶液呈浅黄绿色
结论:氯水有漂白性
液氯与氯水的区别?新制氯水与久置氯水的区别?
液氯 氯水
分类
成分
性质
纯净物
混合物
Cl2 ,HCl, HClO,
H2O
HCl, H2O
新制
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
久置
只有Cl2
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
只有酸性
(相当于稀盐酸)
(四)氯水
紫色石蕊 AgNO3aq Na2CO3aq
现象
反应微粒
1、填出氯水与某些物质反应的现象和微粒:
先变红后褪色
H+使变红
HClO漂白
白色沉淀
Cl-与Ag+
生成AgCl
有气泡
H+与CO32-
反应生成CO2
随堂练习:
2.(双选)下列关于氯水的叙述中正确的是
A.新制氯水中只含有Cl2和H2O分子
B.新制的氯水可使蓝色石蕊试纸先
变红后褪色.
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后,酸性增强.
BD
第二课时 氯气与碱的反应
复习回顾
请写出Cl2与水反应的化学方程式和离子方程式
Cl2+H2O HCl+HClO
Cl2+H2O H++Cl-+HClO
想一想
有效氯水需现配现用,且储存困难,因此实际生活中很少直接用氯水作消毒剂。
评价氯水直接作为消毒剂的优缺点。
氯气与碱溶液的反应
直接使用氯气作为漂白剂在使用上不方便,人们便制作了日常使用的漂白液和漂白粉,那么,这些漂白液和漂白粉的主要成分和有效成分是什么?它们是怎么制得的?
Cl2+2NaOH=NaCl+NaClO+H2O
漂白液
主要成分:NaCl和NaClO
有效成分:NaClO
漂白原理:次氯酸盐与酸发生复分解反应生成的HClO起漂白作用。(强酸制弱酸)
工业上:NaClO+HCl=NaCl+HClO
日常生活:2NaClO+CO2+H2O=Na2CO3 +2HClO
二、氯气与碱的反应
请仿照氯气与氢氧化钠的反应,写出氯气被熟石灰吸收的反应方程式
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
有效成分
漂粉精
漂白粉
Cl2+Ca(OH)2 ——
二、氯气与碱的反应
漂白粉的漂白原理是什么?
想一想
日常 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
工业 Ca(ClO)2+2HCl===CaCl2+2HClO
漂白原理:强酸制弱酸
酸性H2CO3 >HClO
漂白粉能起漂白和杀菌的作用,
其原理是什么?
Ca(ClO)2 HClO
转化
氯水、漂白液、漂白粉、漂粉精的漂白作用
都是因反应生成的HClO
漂粉精可用于游泳池的消毒
思考1:漂白液、漂白粉起漂白作用都是由于生成了HClO,为什么不直接用次氯酸作漂白剂?
次氯酸不稳定,次氯酸盐较稳定
思考2:可以把Cl2通入澄清石灰水中制漂白粉吗?
不可以,澄清石灰水中Ca(OH)2含量很少,应通入熟石灰中
二、氯气与碱的反应
思考3:你可以写出制备漂白液的离子方程式吗?
Cl2+2NaOH=NaCl+NaClO+H2O
离子方程式:Cl2+2OH-=Cl-+ClO-+H2O
1、用Cl2消毒的自来水配制下列溶液,不会引起药品变质的是( )
A NaCl B AgNO3 C NaOH D Ca(OH)2
2、下列物质中,不能使有色布条褪色的是 ( )
A NaClO溶液 B Ca(ClO)2 溶液
C 氯水 D CaCl2溶液
A
D
随堂测试
第三课时 氯气的制备及Cl-的检验
发生
装置
净化
装置
干燥
装置
收集
装置
吸收
装置
反应物状态及反应条件
气体及杂质的性质
气体的性质选择干燥剂
气体水溶性及密度
气体的毒性选择吸收剂
气体制备的一般过程
MnO2+4HCl(浓)=MnCl2+Cl2↑ +2H2O
▽
1、原理
Cl2的实验室制备方法
反应装置:______________________
_____用稀盐酸代替浓盐酸
体现盐酸的________________性
固体+液体加热的反应
酸性和还原
不能
还能使用以下方法制备
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
MnO2 + 4HCl (浓)== MnCl2 +2H2O +Cl2 ↑
注意:
1.MnO2为难溶于水的黑色固体
2.稀盐酸与MnO2不反应
3.反应要加热。
若有氯气泄漏,周围的人
往高处走还是往低处走
应顺风走还是逆风走
高处,氯气密度大于空气
逆风
若有足量MnO2和4mol浓盐酸加热条件下反应,可生成Cl2物质的量为多少?
小于1mol
2、除杂和干燥
MnO2+4HCl(浓)=MnCl2+Cl2 ↑ +H2O
▽
可能含有的杂质_________________
HCl H2O
除杂质和干燥的试剂______________________
饱和食盐水
浓硫酸或无水CaCl2
浓硫酸
饱和食盐水
氯化钙
饱和食盐水
3、收集方法
向上排空气法(密度比空气要大)
排饱和食盐水(在食盐水中的溶解度很小)
4、尾气吸收
用NaOH溶液吸收
饱和食盐水
NaOH溶液
向上排空气法
制氯气的反应装置
浓盐酸
MnO2
除HCl
除H2O
吸收尾气
Cl2
MnO2 + 4HCl (浓)==MnCl2 +2H2O + Cl2 ↑
NaCl溶液
浓硫酸
收集Cl2
NaOH溶液
随堂练习
D
Cl2
复习回顾
Ca(ClO)2
NaClO
HCl
HClO
FeCl3
Br2
①
②
③
④
⑤
⑥
⑦
实验现象
解释或离子方程式
加入AgNO3溶液后 加入 稀硝酸后
稀盐酸
NaCl溶液
Na2CO3溶液
NaOH溶液
自来水
白色沉淀
白色沉淀
沉淀消失,有气泡生成
沉淀不消失
沉淀不消失
Cl- + Ag+ =AgCl↓
CO32- +2Ag+ =Ag2CO3↓
Cl- + Ag+ =AgCl↓
Cl- + Ag+ =AgCl↓
白色沉淀
沉淀不消失
Ag2CO3+2H+=2Ag++CO2↑ + H2O
白色沉淀
白色沉淀,沉淀很快变黑
沉淀溶解
二、Cl-的检验
OH- +Ag+ =AgOH↓
2AgOH=Ag2O+H2O
二、Cl-的检验
某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对吗?
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀(沉淀不溶于稀硝酸),则被检液中含有Cl-。
从以上实验可知:
方法
在溶液里,多种阴离子与Ag+能结合生成沉淀,
但是呈白色不溶于稀HNO3的只有AgCl,所以,先加稀HNO3是排除其它离子的干扰(CO32- 等 )
THANKS
