2023年中考化学总复习课件 专题01 气体的制取及净化(共31张PPT)(人教版、广西专用)
文档属性
| 名称 | 2023年中考化学总复习课件 专题01 气体的制取及净化(共31张PPT)(人教版、广西专用) |  | |
| 格式 | pptx | ||
| 文件大小 | 512.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-21 22:45:42 | ||
图片预览



文档简介
(共31张PPT)
专题拓展一 气体的制取及净化
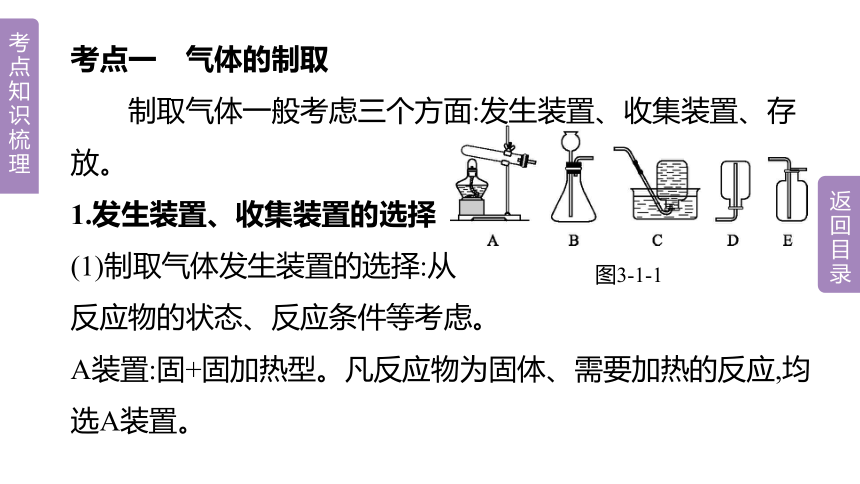
考点一 气体的制取
制取气体一般考虑三个方面:发生装置、收集装置、存放。
1.发生装置、收集装置的选择
(1)制取气体发生装置的选择:从
反应物的状态、反应条件等考虑。
A装置:固+固加热型。凡反应物为固体、需要加热的反应,均选A装置。
图3-1-1
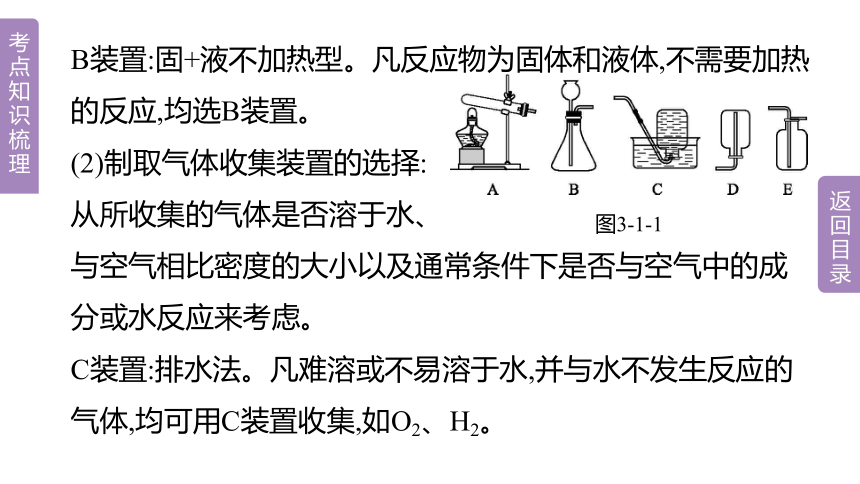
B装置:固+液不加热型。凡反应物为固体和液体,不需要加热的反应,均选B装置。
(2)制取气体收集装置的选择:
从所收集的气体是否溶于水、
与空气相比密度的大小以及通常条件下是否与空气中的成分或水反应来考虑。
C装置:排水法。凡难溶或不易溶于水,并与水不发生反应的气体,均可用C装置收集,如O2、H2。
图3-1-1
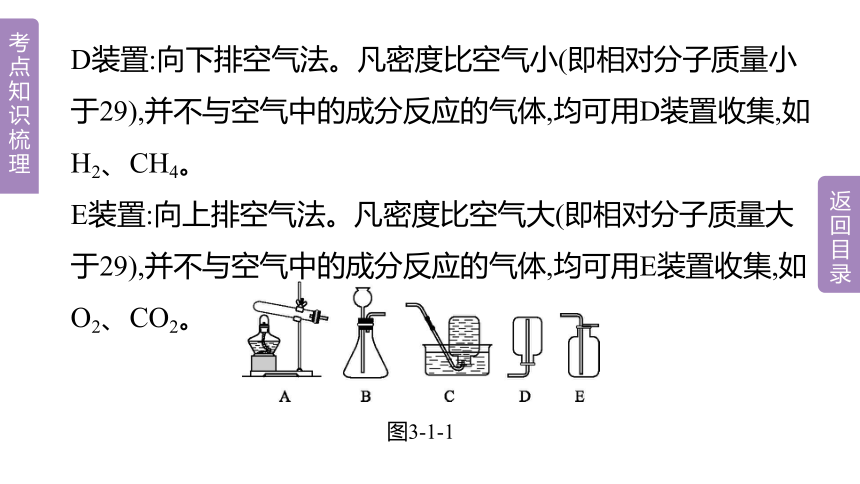
D装置:向下排空气法。凡密度比空气小(即相对分子质量小于29),并不与空气中的成分反应的气体,均可用D装置收集,如H2、CH4。
E装置:向上排空气法。凡密度比空气大(即相对分子质量大于29),并不与空气中的成分反应的气体,均可用E装置收集,如O2、CO2。
图3-1-1
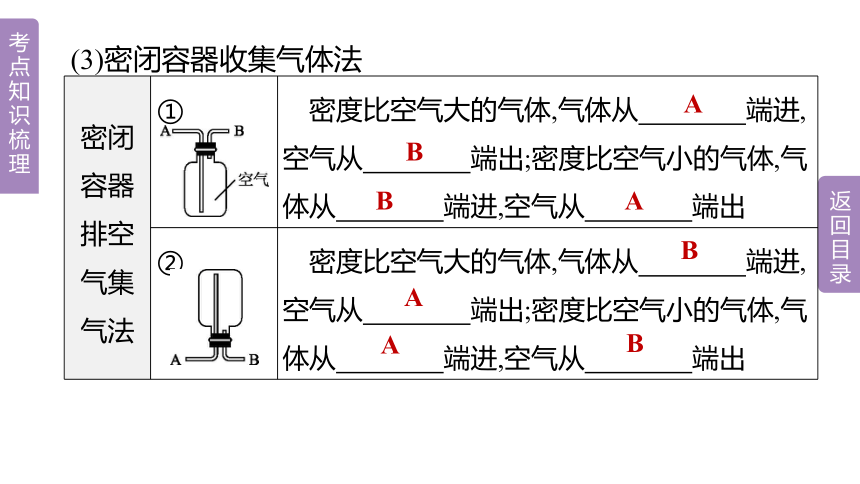
(3)密闭容器收集气体法
密闭容器排空气集气法 ① 密度比空气大的气体,气体从 端进,空气从 端出;密度比空气小的气体,气体从 端进,空气从 端出
② 密度比空气大的气体,气体从 端进,空气从 端出;密度比空气小的气体,气体从 端进,空气从 端出
A
B
B
A
B
A
A
B
(续表)
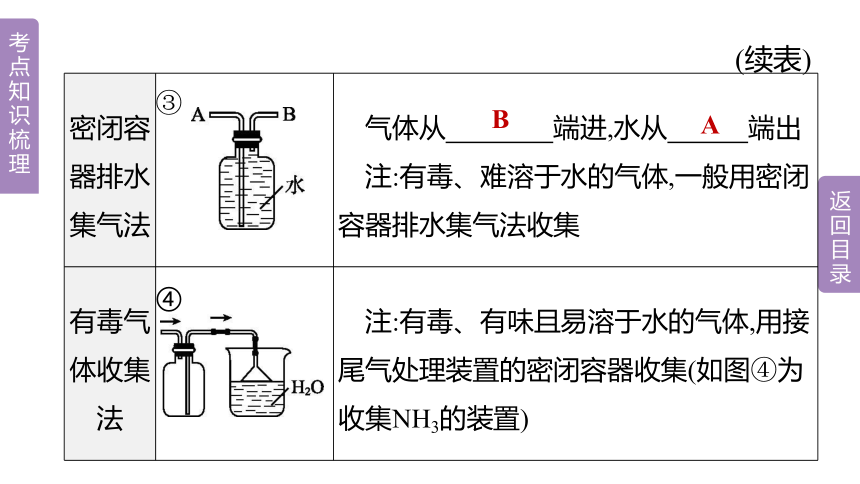
密闭容器排水集气法 ③ 气体从 端进,水从 端出
注:有毒、难溶于水的气体,一般用密闭容器排水集气法收集
有毒气体收集法 ④ 注:有毒、有味且易溶于水的气体,用接尾气处理装置的密闭容器收集(如图④为收集NH3的装置)
B
A
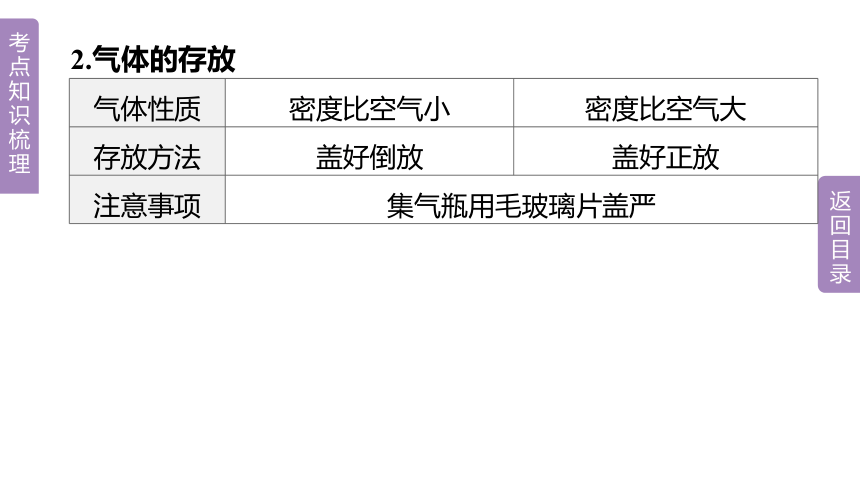
2.气体的存放
气体性质 密度比空气小 密度比空气大
存放方法 盖好倒放 盖好正放
注意事项 集气瓶用毛玻璃片盖严 考点二 气体的检验
待检验的气体 方法和现象 化学原理(写化学方程式)
O2 , 证明是氧气
H2 导出点燃,能在空气中燃烧,发出 色火焰,用冷而干燥的烧杯罩在火焰上方,杯壁有
CO2
将带火星的木条伸入气体中,木条复燃
淡蓝
水珠
将气体通入澄清石灰水中,石灰水变浑浊
CO2+Ca(OH)2
===CaCO3↓+H2O
考点三 气体的净化
1.选用除杂试剂的原则:除杂试剂只能与杂质气体反应,不能与要净化的气体反应。
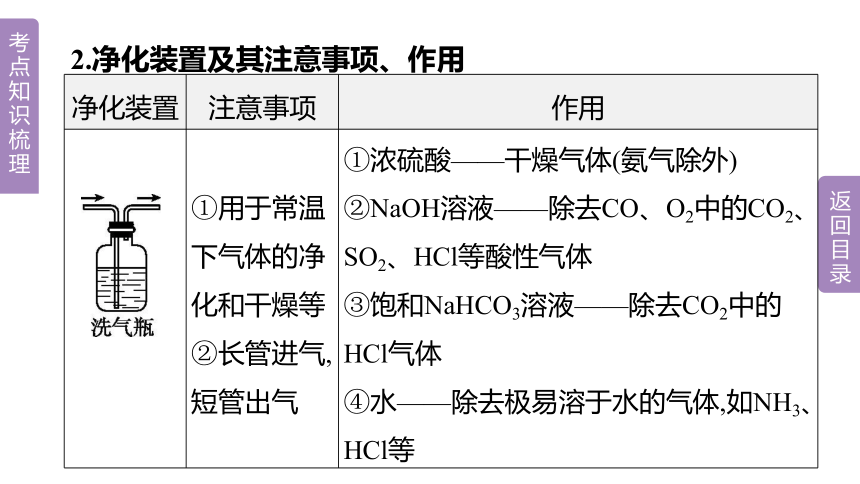
2.净化装置及其注意事项、作用
净化装置 注意事项 作用
①用于常温下气体的净化和干燥等 ②长管进气,短管出气 ①浓硫酸——干燥气体(氨气除外)
②NaOH溶液——除去CO、O2中的CO2、SO2、HCl等酸性气体
③饱和NaHCO3溶液——除去CO2中的HCl气体
④水——除去极易溶于水的气体,如NH3、HCl等
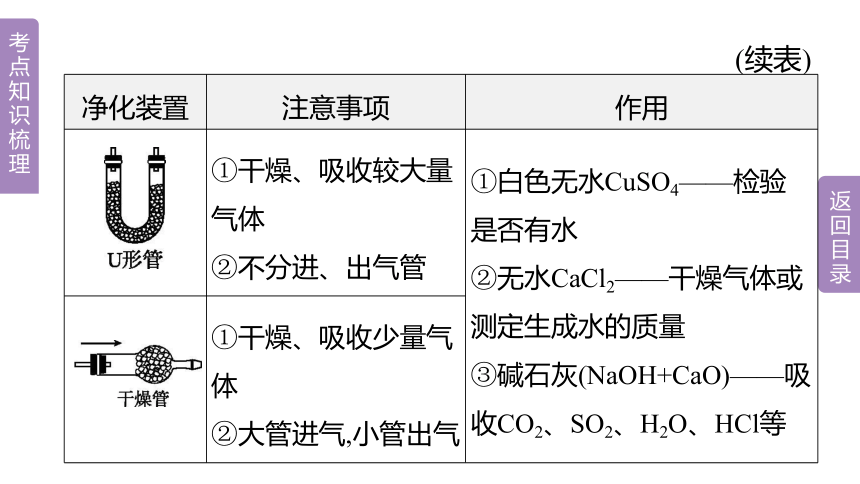
(续表)
净化装置 注意事项 作用
①干燥、吸收较大量气体 ②不分进、出气管 ①白色无水CuSO4——检验是否有水
②无水CaCl2——干燥气体或测定生成水的质量
③碱石灰(NaOH+CaO)——吸收CO2、SO2、H2O、HCl等
①干燥、吸收少量气体 ②大管进气,小管出气 (续表)
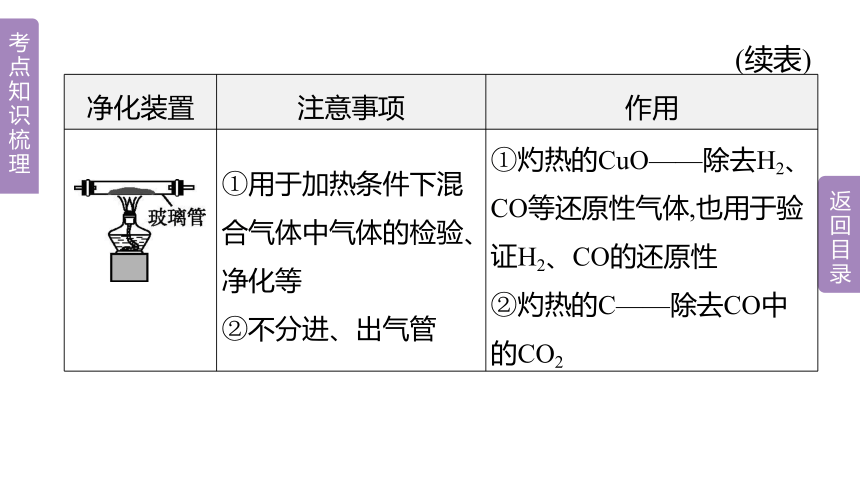
净化装置 注意事项 作用
①用于加热条件下混合气体中气体的检验、净化等 ②不分进、出气管 ①灼热的CuO——除去H2、CO等还原性气体,也用于验证H2、CO的还原性
②灼热的C——除去CO中的CO2
3.气体的干燥
选用干燥剂的原则:干燥剂只能吸收气体中的水分,不能与所干燥的气体发生反应。
干燥剂 可干燥的气体 不能干燥的气体
浓硫酸 H2、O2、CO2、CO、HCl、CH4、SO2、N2等中性、酸性气体 不能干燥碱性气体,如
无水氯化钙(CaCl2) 除氨气(NH3)外的其他气体,如H2、O2、CO、CO2、HCl等 NH3
NH3
(续表)
干燥剂 可干燥的气体 不能干燥的气体
氢氧化钠固体、生石灰或碱石灰 H2、O2、CO、NH3、CH4、N2等中性、碱性气体 不能干燥酸性气体,如 、HCl、SO2、H2S等
CO2
4.除杂和干燥的先后顺序
若用洗气瓶除杂,一般除杂在前,干燥在后,防止收集到的气体不纯,混有 ;若用加热装置除杂,一般是干燥在前,除杂在后,防止加热时气体中的水引起玻璃管炸裂。
水蒸气
[思考]①制O2要除的杂质:水蒸气(H2O)。选用试剂 除去水蒸气。
②制CO2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl)。先将气体通过 溶液,再通过 除去杂质。
③用盐酸和锌粒制H2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl,用稀硫酸制取H2无此杂质)。先将气体通过__________
,再通过 除去杂质;也可直接通过装有________
的干燥管除去杂质。
浓硫酸
饱和碳酸氢钠
浓硫酸
氢氧化钠溶
液
浓硫酸
氢氧化钠
固体(或生石灰、碱石灰)
考点四 组装顺序
一般应遵循:制取气体装置→除杂质装置→气体干燥装置→验证气体性质装置→尾气处理装置。
考点五 实验注意点
1.防爆炸:点燃可燃性气体(如H2、CO、CH4)或用CO、H2还原CuO、Fe2O3之前,要检验气体纯度。
2.防中毒:进行有关有毒气体(如CO、SO2、NO2、NO)的实验时,注意通风及尾气处理。
3.防倒吸:加热法制取并用排水法收集气体,要注意熄灯顺序;极易溶于水的气体,可将出气口连接倒置的漏斗颈部管口,使漏斗大口靠近水面。
考点六 制气创新设计
图3-1-2
[思考]A~F制气装置有什么共同的优点 它们是通过什么操作来实现固液接触或分离的
[答案]节约药品,方便操作,能控制反应随时发生和停止。A~D 通过弹簧夹来控制固液接触或分离,E通过挤压软塑料瓶来使固液接触,F通过上下提拉试管来使固液接触或分离。
类型一 常见气体的制备和净化
掌握O2、CO2、H2的实验室制备和净化原理。
例1[2022·黄冈]请你根据所学知识并结合图3-1-3所示装置回答有关问题。
图3-1-3
(1)装置D中仪器a的名称是 。
水槽
(2)实验室用装置B制取氧气,反应的化学方程式为
。
(3)实验室制取氢气选用的装置组合是 。
(4)若用F装置收集二氧化碳,气体应从 (填“m”或“n”)端通入。
图3-1-3
2H2O2 2H2O+O2↑
BD(或BE、BF)
m
类型二 陌生气体的制备和净化
在掌握O2、CO2、H2的实验室制备和净化原理的基础上,根据题目信息,对比归纳,学会对一些陌生气体[如氨气(NH3)、氯气(Cl2)、二氧化氮(NO2)、二氧化硫(SO2)、硫化氢(H2S)、甲烷(CH4)]进行制备和净化。
例2 [2022·乐山]氨气(NH3)是一种重要化工原料,有刺激性气味,密度比空气小。某兴趣小组用加热NH4Cl和Ca(OH)2固体的方法制备、收集干燥的NH3,实验装置如图3-1-4所示:
图3-1-4
已知:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。回答下列问题。
(1)图中仪器①的名称为 ,甲装置也可以用于实验室制备 (填“H2”“O2”或“CO2”)。
图3-1-4
试管
O2
(2)乙装置的作用是 。
(3)丙装置用于收集NH3,则乙中导管口a应与丙中导管 端相连。
(4)从保护环境角度,该实验在丙装置后还应接一个________
装置。
干燥气体
c
尾气处理
例3 依据下列实验装置图,回答问题。
图3-1-5
(1)通常情况下,H2S是一种无色、有臭鸡蛋气味的酸性气体,密度比空气的大,易溶于水。实验室常用硫化亚铁粉末和稀硫酸反应制取H2S。制H2S的发生装置和收集装置组合是 (填序号),为了防止H2S污染空气,尾气必须用 吸收。
BE
氢氧化钠溶液(合理即可)
(2)通常情况下,CH4是一种无色、无味的气体,难溶于水。实验室常用无水醋酸钠和碱石灰共热反应制取,制CH4的发生装置和收集装置组合是 (填序号)。
图3-1-5
AD(或AG)
(3)通常情况下,SO2是一种无色、有刺激性气味的气体,密度比空气的大,易溶于水且其水溶液显酸性。实验室用亚硫酸钠粉末和稀硫酸反应制取SO2的发生装置是 (填序号),尾气必须用碱溶液吸收,吸收的目的是 。
图3-1-5
B
防止SO2逸出,污染空气
(4)实验室中可用浓氨水与生石灰制取氨气。可用I装置收集NH3,试分析氨气具有的性质: (写出两条)。
图3-1-6
密度比空气的小,极易溶于水
(5)采用盐酸和石灰石制得的二氧化碳中常含有氯化氢气体和水蒸气。为控制反应的发生和停止,可选用的发生装置为
。为获得纯净、干燥的二氧化碳气体,可选用图3-1-6所示的Ⅰ装置和Ⅱ装置进行除杂和干燥,导管口连接的正确顺序是:气体→ → →
→ 。
图3-1-6
C
c
d
a
b
专题拓展一 气体的制取及净化
考点一 气体的制取
制取气体一般考虑三个方面:发生装置、收集装置、存放。
1.发生装置、收集装置的选择
(1)制取气体发生装置的选择:从
反应物的状态、反应条件等考虑。
A装置:固+固加热型。凡反应物为固体、需要加热的反应,均选A装置。
图3-1-1
B装置:固+液不加热型。凡反应物为固体和液体,不需要加热的反应,均选B装置。
(2)制取气体收集装置的选择:
从所收集的气体是否溶于水、
与空气相比密度的大小以及通常条件下是否与空气中的成分或水反应来考虑。
C装置:排水法。凡难溶或不易溶于水,并与水不发生反应的气体,均可用C装置收集,如O2、H2。
图3-1-1
D装置:向下排空气法。凡密度比空气小(即相对分子质量小于29),并不与空气中的成分反应的气体,均可用D装置收集,如H2、CH4。
E装置:向上排空气法。凡密度比空气大(即相对分子质量大于29),并不与空气中的成分反应的气体,均可用E装置收集,如O2、CO2。
图3-1-1
(3)密闭容器收集气体法
密闭容器排空气集气法 ① 密度比空气大的气体,气体从 端进,空气从 端出;密度比空气小的气体,气体从 端进,空气从 端出
② 密度比空气大的气体,气体从 端进,空气从 端出;密度比空气小的气体,气体从 端进,空气从 端出
A
B
B
A
B
A
A
B
(续表)
密闭容器排水集气法 ③ 气体从 端进,水从 端出
注:有毒、难溶于水的气体,一般用密闭容器排水集气法收集
有毒气体收集法 ④ 注:有毒、有味且易溶于水的气体,用接尾气处理装置的密闭容器收集(如图④为收集NH3的装置)
B
A
2.气体的存放
气体性质 密度比空气小 密度比空气大
存放方法 盖好倒放 盖好正放
注意事项 集气瓶用毛玻璃片盖严 考点二 气体的检验
待检验的气体 方法和现象 化学原理(写化学方程式)
O2 , 证明是氧气
H2 导出点燃,能在空气中燃烧,发出 色火焰,用冷而干燥的烧杯罩在火焰上方,杯壁有
CO2
将带火星的木条伸入气体中,木条复燃
淡蓝
水珠
将气体通入澄清石灰水中,石灰水变浑浊
CO2+Ca(OH)2
===CaCO3↓+H2O
考点三 气体的净化
1.选用除杂试剂的原则:除杂试剂只能与杂质气体反应,不能与要净化的气体反应。
2.净化装置及其注意事项、作用
净化装置 注意事项 作用
①用于常温下气体的净化和干燥等 ②长管进气,短管出气 ①浓硫酸——干燥气体(氨气除外)
②NaOH溶液——除去CO、O2中的CO2、SO2、HCl等酸性气体
③饱和NaHCO3溶液——除去CO2中的HCl气体
④水——除去极易溶于水的气体,如NH3、HCl等
(续表)
净化装置 注意事项 作用
①干燥、吸收较大量气体 ②不分进、出气管 ①白色无水CuSO4——检验是否有水
②无水CaCl2——干燥气体或测定生成水的质量
③碱石灰(NaOH+CaO)——吸收CO2、SO2、H2O、HCl等
①干燥、吸收少量气体 ②大管进气,小管出气 (续表)
净化装置 注意事项 作用
①用于加热条件下混合气体中气体的检验、净化等 ②不分进、出气管 ①灼热的CuO——除去H2、CO等还原性气体,也用于验证H2、CO的还原性
②灼热的C——除去CO中的CO2
3.气体的干燥
选用干燥剂的原则:干燥剂只能吸收气体中的水分,不能与所干燥的气体发生反应。
干燥剂 可干燥的气体 不能干燥的气体
浓硫酸 H2、O2、CO2、CO、HCl、CH4、SO2、N2等中性、酸性气体 不能干燥碱性气体,如
无水氯化钙(CaCl2) 除氨气(NH3)外的其他气体,如H2、O2、CO、CO2、HCl等 NH3
NH3
(续表)
干燥剂 可干燥的气体 不能干燥的气体
氢氧化钠固体、生石灰或碱石灰 H2、O2、CO、NH3、CH4、N2等中性、碱性气体 不能干燥酸性气体,如 、HCl、SO2、H2S等
CO2
4.除杂和干燥的先后顺序
若用洗气瓶除杂,一般除杂在前,干燥在后,防止收集到的气体不纯,混有 ;若用加热装置除杂,一般是干燥在前,除杂在后,防止加热时气体中的水引起玻璃管炸裂。
水蒸气
[思考]①制O2要除的杂质:水蒸气(H2O)。选用试剂 除去水蒸气。
②制CO2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl)。先将气体通过 溶液,再通过 除去杂质。
③用盐酸和锌粒制H2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl,用稀硫酸制取H2无此杂质)。先将气体通过__________
,再通过 除去杂质;也可直接通过装有________
的干燥管除去杂质。
浓硫酸
饱和碳酸氢钠
浓硫酸
氢氧化钠溶
液
浓硫酸
氢氧化钠
固体(或生石灰、碱石灰)
考点四 组装顺序
一般应遵循:制取气体装置→除杂质装置→气体干燥装置→验证气体性质装置→尾气处理装置。
考点五 实验注意点
1.防爆炸:点燃可燃性气体(如H2、CO、CH4)或用CO、H2还原CuO、Fe2O3之前,要检验气体纯度。
2.防中毒:进行有关有毒气体(如CO、SO2、NO2、NO)的实验时,注意通风及尾气处理。
3.防倒吸:加热法制取并用排水法收集气体,要注意熄灯顺序;极易溶于水的气体,可将出气口连接倒置的漏斗颈部管口,使漏斗大口靠近水面。
考点六 制气创新设计
图3-1-2
[思考]A~F制气装置有什么共同的优点 它们是通过什么操作来实现固液接触或分离的
[答案]节约药品,方便操作,能控制反应随时发生和停止。A~D 通过弹簧夹来控制固液接触或分离,E通过挤压软塑料瓶来使固液接触,F通过上下提拉试管来使固液接触或分离。
类型一 常见气体的制备和净化
掌握O2、CO2、H2的实验室制备和净化原理。
例1[2022·黄冈]请你根据所学知识并结合图3-1-3所示装置回答有关问题。
图3-1-3
(1)装置D中仪器a的名称是 。
水槽
(2)实验室用装置B制取氧气,反应的化学方程式为
。
(3)实验室制取氢气选用的装置组合是 。
(4)若用F装置收集二氧化碳,气体应从 (填“m”或“n”)端通入。
图3-1-3
2H2O2 2H2O+O2↑
BD(或BE、BF)
m
类型二 陌生气体的制备和净化
在掌握O2、CO2、H2的实验室制备和净化原理的基础上,根据题目信息,对比归纳,学会对一些陌生气体[如氨气(NH3)、氯气(Cl2)、二氧化氮(NO2)、二氧化硫(SO2)、硫化氢(H2S)、甲烷(CH4)]进行制备和净化。
例2 [2022·乐山]氨气(NH3)是一种重要化工原料,有刺激性气味,密度比空气小。某兴趣小组用加热NH4Cl和Ca(OH)2固体的方法制备、收集干燥的NH3,实验装置如图3-1-4所示:
图3-1-4
已知:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。回答下列问题。
(1)图中仪器①的名称为 ,甲装置也可以用于实验室制备 (填“H2”“O2”或“CO2”)。
图3-1-4
试管
O2
(2)乙装置的作用是 。
(3)丙装置用于收集NH3,则乙中导管口a应与丙中导管 端相连。
(4)从保护环境角度,该实验在丙装置后还应接一个________
装置。
干燥气体
c
尾气处理
例3 依据下列实验装置图,回答问题。
图3-1-5
(1)通常情况下,H2S是一种无色、有臭鸡蛋气味的酸性气体,密度比空气的大,易溶于水。实验室常用硫化亚铁粉末和稀硫酸反应制取H2S。制H2S的发生装置和收集装置组合是 (填序号),为了防止H2S污染空气,尾气必须用 吸收。
BE
氢氧化钠溶液(合理即可)
(2)通常情况下,CH4是一种无色、无味的气体,难溶于水。实验室常用无水醋酸钠和碱石灰共热反应制取,制CH4的发生装置和收集装置组合是 (填序号)。
图3-1-5
AD(或AG)
(3)通常情况下,SO2是一种无色、有刺激性气味的气体,密度比空气的大,易溶于水且其水溶液显酸性。实验室用亚硫酸钠粉末和稀硫酸反应制取SO2的发生装置是 (填序号),尾气必须用碱溶液吸收,吸收的目的是 。
图3-1-5
B
防止SO2逸出,污染空气
(4)实验室中可用浓氨水与生石灰制取氨气。可用I装置收集NH3,试分析氨气具有的性质: (写出两条)。
图3-1-6
密度比空气的小,极易溶于水
(5)采用盐酸和石灰石制得的二氧化碳中常含有氯化氢气体和水蒸气。为控制反应的发生和停止,可选用的发生装置为
。为获得纯净、干燥的二氧化碳气体,可选用图3-1-6所示的Ⅰ装置和Ⅱ装置进行除杂和干燥,导管口连接的正确顺序是:气体→ → →
→ 。
图3-1-6
C
c
d
a
b
同课章节目录
