2023年中考化学总复习课件 专题05 物质的推断与工艺流程(共27张PPT)(人教版、广西专用)
文档属性
| 名称 | 2023年中考化学总复习课件 专题05 物质的推断与工艺流程(共27张PPT)(人教版、广西专用) |

|
|
| 格式 | pptx | ||
| 文件大小 | 519.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-21 00:00:00 | ||
图片预览






文档简介
(共27张PPT)
专题拓展五 物质的推断与工艺流程
工艺流程是将完整的化工生产过程或其中一部分用框图表示出来,题目常以物质生产和除杂为主。解答工艺流程题首先克服恐惧心理,认真审题,明确生产目的,解题时才能有的放矢。
物质的推断就是运用物质的特殊性质或特征反应推测物质是什么。推断题具有考查知识面广、综合性强、题型多变、思维容量大等特点。解题方法:①抓住“突破口”,顺推、逆推,逐点击破;②猜想与验证相结合;③两两组合(相遇组合),对比推断;④代入验证。
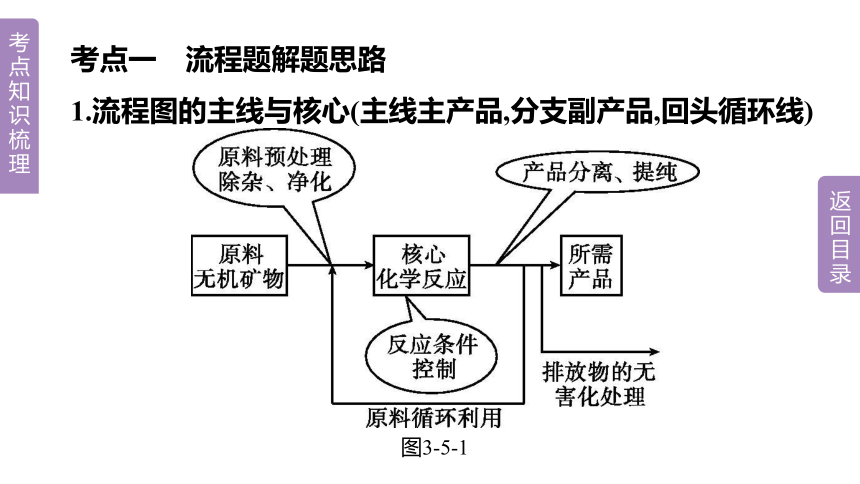
考点一 流程题解题思路
1.流程图的主线与核心(主线主产品,分支副产品,回头循环线)
图3-5-1
2.常见的答题热点
(1)粉碎目的:加速溶解或增大反应物的接触面积,加快反应速率。
(2)循环利用的物质:流程中箭头返回的物质或生产出与原料一样的副产品。
(3)核心反应化学方程式:箭头进去的一般是反应物,箭头出来的一般是生成物(还要注意水和氧气是否参加反应)。
(4)加入过量试剂的目的:将原物质中的杂质完全反应掉。
考点二 推断题突破口的选择
(一)以物质的颜色特征为突破口
根据物质的特殊颜色进行判断。包括常见固体、溶液、火焰的颜色等,详见第一部分中五。
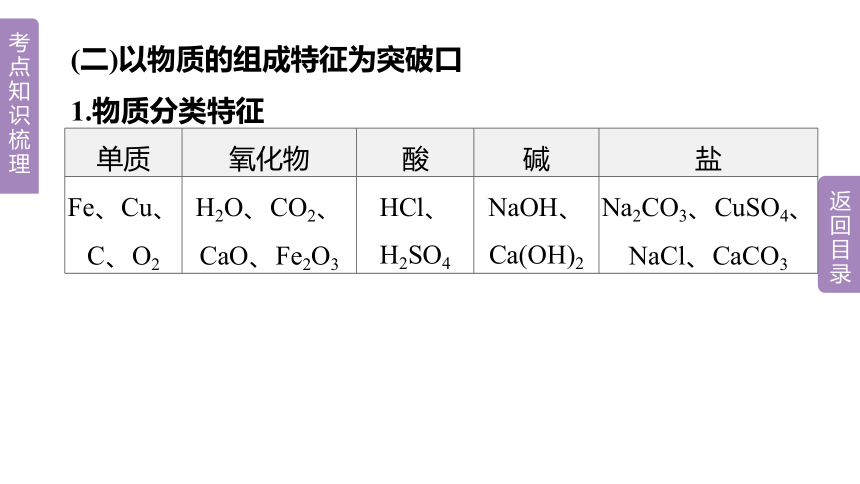
(二)以物质的组成特征为突破口
1.物质分类特征
单质 氧化物 酸 碱 盐
Fe、Cu、C、O2 H2O、CO2、CaO、Fe2O3 HCl、H2SO4 NaOH、Ca(OH)2 Na2CO3、CuSO4、NaCl、CaCO3
2.状态特征
常见固态单质 气态单质 气态化合物 常温下呈液态
Fe、Cu、C、S、P等 H2、O2、N2等 CO、CO2、CH4、SO2等 H2O、H2O2、C2H5OH、H2SO4等
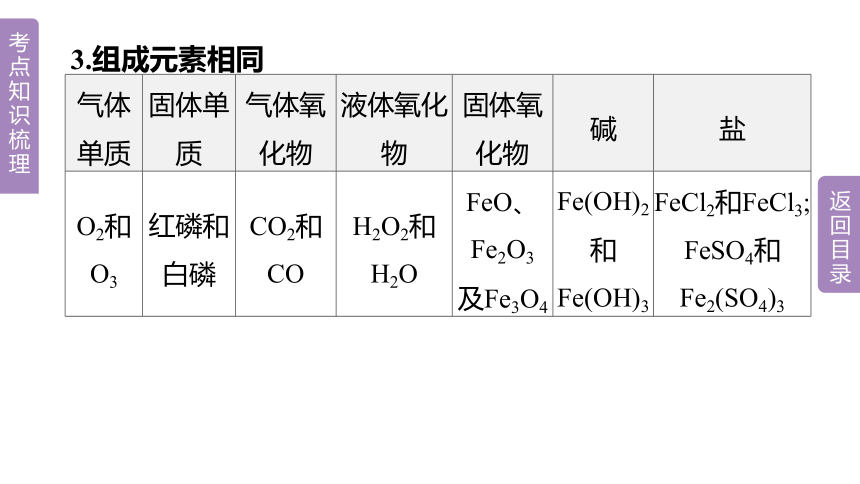
3.组成元素相同
气体单质 固体单质 气体氧化物 液体氧化物 固体氧化物 碱 盐
O2和O3 红磷和白磷 CO2和CO H2O2和H2O FeO、Fe2O3 及Fe3O4 Fe(OH)2和 Fe(OH)3 FeCl2和FeCl3;
FeSO4和Fe2(SO4)3
4.特征结构的微粒
(1)核外只有一个电子的原子是氢原子,核内无中子的原子是氢原子,仅有一个质子的阳离子是氢离子。
(2)与Ne原子的电子层结构相同或电子数相同的常见微粒:
①阳离子:Na+、Mg2+、Al3+;②阴离子:F-、O2-;③分子:H2O、HF、NH3、CH4。
(3)与Ar原子的电子层结构相同或电子数相同的常见微粒:
①阳离子:K+、Ca2+;②阴离子:Cl-、S2-;③分子:HCl、H2S。
5.元素或物质组成之最:详见第一部分中七。
(三)以物质的性质为突破口
1.酸、碱、盐的性质:详见第二部分第十单元、第十一单元考点知识梳理。
2.氧化物的性质
(1)金属氧化物的性质
①有4种金属氧化物能与水反应,生成对应的碱。(注意:元素的化合价不变)
如:K2O+H2O===2KOH;Na2O+H2O===2NaOH;CaO+H2O=== Ca(OH)2;BaO+H2O===Ba(OH)2。
②与酸反应,生成盐和水,如:Fe2O3 +6HCl===2FeCl3+3H2O。
(2)非金属氧化物的性质
①非金属氧化物(除CO、NO外)能与水反应,生成对应的酸。(注意:元素的化合价不变)
如:CO2+H2O===H2CO3;SO2+H2O===H2SO3;P2O5+3H2O===
2H3PO4。
②与碱反应,生成盐和水(CO、NO除外)。如:CO2+2NaOH ===Na2CO3+H2O。
(四)以物质的用途为突破口:详见第一部分中五。
(五)以特征反应为突破口
1.特征反应条件
①点燃:有O2参加的反应。
②通电:H2O电解。
③MnO2作催化剂:KClO3、H2O2分解。
④高温:CaCO3分解、C还原CuO、炼铁。
⑤加热:KClO3、KMnO4、Cu2(OH)2CO3分解等。
2.特征反应现象
(1)能使澄清石灰水变浑浊的无色无味气体是CO2。
(2)能使黑色的CuO变红(或红棕色的Fe2O3变黑)的气体是H2或CO,固体是C。
(3)能使燃着的木条燃烧得更旺的气体是O2,熄灭的气体是CO2或N2等;能使带火星的木条复燃的气体是O2。
(4)能使白色无水CuSO4粉末变蓝的气体是水蒸气。
(5)在O2中燃烧火星四射的物质是Fe。
(6)在空气中燃烧有水雾,且有使澄清石灰水变浑浊的气体生成的物质是有机物,如CH4、C2H5OH等。
(7)能溶于盐酸或稀硝酸的白色沉淀有CaCO3、BaCO3等;常见的不溶于稀硝酸的白色沉淀有AgCl、BaSO4。
3.特定实验现象
实验现象 可能情况分析
固体混合物加水后出现不溶物 a.原混合物中有不溶物,如CaCO3、Al(OH)3等
b.混合物中物质反应生成沉淀,如Na2SO4和BaCl2,Na2CO3和Ca(OH)2等
向固体混合物中加水得到无色溶液 混合物的水溶液中一定不含Fe2+、Fe3+、Cu2+、Mn
(续表)
实验现象 可能情况分析
生成有色沉淀 a.生成红褐色沉淀Fe(OH)3,是含Fe3+的盐与碱溶液反应,如FeCl3+3NaOH===Fe(OH)3↓+3NaCl
b.生成蓝色沉淀Cu(OH)2,是含Cu2+的盐与碱溶液反应,如2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
4.特定反应关系(如图3-5-2,填对应物质的化学式)
图3-5-2
CaCO3
H2O
CO
FeCl3
Cu(NO3)2
Na2CO3
例1 [2022·永州]为防止全球变暖,我国承诺在2060年要实现“碳中和”。减少化石燃料的使用,开发利用氢能,如图3-5-3是利用太阳能制氢的示意图。
(1)如图实现了能量之间的
相互转化,其中电解水的过
程是由电能转化为_______
(填“化学能”或“热能”)。
图3-5-3
化学能
(2)从微观的角度讲,每2个水分子分解,会产生 个氢分子。
(3)H2与CO2在一定条件下反
应,生成CH3OH(甲醇)和H2O,
该反应 (填“属于”或
“不属于”)置换反应。
(4)图中能够循环使用的物质是 (填化学式)。
图3-5-3
2
不属于
H2O
例2 [2022·柳州]为了充分利用资源、保护环境,柳州市大力推行垃圾分类投放。某校化学课外小组进行垃圾分类活动时,在垃圾处理厂发现一些铜锌合金材料(主要含Cu、Zn),查阅资料后,同学们设计利用此铜锌合金回收铜并制取ZnSO4的工艺流程如图3-5-4所示(反应条件已略去)。
图3-5-4
(1)从垃圾分类的角度分析,金属材料属于 。
A.厨余垃圾
B.可回收物
C.有害垃圾
D.其他垃圾
(2)金属活动性Zn (填“>”或“<”)Cu。加入稀硫酸之前须将合金粉碎,目的是_______________________________
。
图3-5-4
B
>
增大接触面积,提高反应速率,使反
应更充分、更完全(合理即可)
(3)请写出步骤①溶解过程中Cu发生反应的化学方程式:
。
(4)“溶解池”中也可在酸性条件下通入过量氧气代替H2O2,与加入过量H2O2相比的优点是 。
Cu+H2O2+H2SO4===CuSO4+2H2O
反应后不用除杂质(合理即可)
图3-5-4
(5)步骤②中加入NaOH溶液的量不能太多,请说出原因:
___________________________________________________
___________________________________________________
。
产物ZnSO4中会混入较多的Na2SO4杂质(或加入NaOH溶液
过多,会使Cu2+和Zn2+生成沉淀,无法制得Cu和ZnSO4,合理
即可)
图3-5-4
例3 [2022·襄阳]初中化学中常见的物质A~G有如图3-5-5所示的转化关系(“—”表示两种物质能够发生反应,“→”表示物质间存在着相应的转化关系,反应条件、部分反应物和生成物未列出)。已知B是一种黑色的固体,F是一种常用的溶剂,B、C、D、E是不同类别的物质。请分析后回答
下列问题。
(1)F的化学式为 。
图3-5-5
H2O
(2)请写出B→G的化学方程式:
_______________________________________
。
(3)请描述C与D反应的现象:
。
图3-5-5
4CO+Fe3O4 3Fe+4CO2(或2C+Fe3O4
3Fe+2CO2↑)
有气泡产生,溶液变成浅绿色
例4 [2022·宁波]有一包白色粉末,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,某兴趣小组做了如图3-5-6所示实验。
(1)无色溶液A中一定含有的溶
质是 。
(2)白色粉末的成分是__________________
。
图3-5-6
氯化钠(或NaCl)
氯化钡和碳酸钠(或
BaCl2和Na2CO3)
专题拓展五 物质的推断与工艺流程
工艺流程是将完整的化工生产过程或其中一部分用框图表示出来,题目常以物质生产和除杂为主。解答工艺流程题首先克服恐惧心理,认真审题,明确生产目的,解题时才能有的放矢。
物质的推断就是运用物质的特殊性质或特征反应推测物质是什么。推断题具有考查知识面广、综合性强、题型多变、思维容量大等特点。解题方法:①抓住“突破口”,顺推、逆推,逐点击破;②猜想与验证相结合;③两两组合(相遇组合),对比推断;④代入验证。
考点一 流程题解题思路
1.流程图的主线与核心(主线主产品,分支副产品,回头循环线)
图3-5-1
2.常见的答题热点
(1)粉碎目的:加速溶解或增大反应物的接触面积,加快反应速率。
(2)循环利用的物质:流程中箭头返回的物质或生产出与原料一样的副产品。
(3)核心反应化学方程式:箭头进去的一般是反应物,箭头出来的一般是生成物(还要注意水和氧气是否参加反应)。
(4)加入过量试剂的目的:将原物质中的杂质完全反应掉。
考点二 推断题突破口的选择
(一)以物质的颜色特征为突破口
根据物质的特殊颜色进行判断。包括常见固体、溶液、火焰的颜色等,详见第一部分中五。
(二)以物质的组成特征为突破口
1.物质分类特征
单质 氧化物 酸 碱 盐
Fe、Cu、C、O2 H2O、CO2、CaO、Fe2O3 HCl、H2SO4 NaOH、Ca(OH)2 Na2CO3、CuSO4、NaCl、CaCO3
2.状态特征
常见固态单质 气态单质 气态化合物 常温下呈液态
Fe、Cu、C、S、P等 H2、O2、N2等 CO、CO2、CH4、SO2等 H2O、H2O2、C2H5OH、H2SO4等
3.组成元素相同
气体单质 固体单质 气体氧化物 液体氧化物 固体氧化物 碱 盐
O2和O3 红磷和白磷 CO2和CO H2O2和H2O FeO、Fe2O3 及Fe3O4 Fe(OH)2和 Fe(OH)3 FeCl2和FeCl3;
FeSO4和Fe2(SO4)3
4.特征结构的微粒
(1)核外只有一个电子的原子是氢原子,核内无中子的原子是氢原子,仅有一个质子的阳离子是氢离子。
(2)与Ne原子的电子层结构相同或电子数相同的常见微粒:
①阳离子:Na+、Mg2+、Al3+;②阴离子:F-、O2-;③分子:H2O、HF、NH3、CH4。
(3)与Ar原子的电子层结构相同或电子数相同的常见微粒:
①阳离子:K+、Ca2+;②阴离子:Cl-、S2-;③分子:HCl、H2S。
5.元素或物质组成之最:详见第一部分中七。
(三)以物质的性质为突破口
1.酸、碱、盐的性质:详见第二部分第十单元、第十一单元考点知识梳理。
2.氧化物的性质
(1)金属氧化物的性质
①有4种金属氧化物能与水反应,生成对应的碱。(注意:元素的化合价不变)
如:K2O+H2O===2KOH;Na2O+H2O===2NaOH;CaO+H2O=== Ca(OH)2;BaO+H2O===Ba(OH)2。
②与酸反应,生成盐和水,如:Fe2O3 +6HCl===2FeCl3+3H2O。
(2)非金属氧化物的性质
①非金属氧化物(除CO、NO外)能与水反应,生成对应的酸。(注意:元素的化合价不变)
如:CO2+H2O===H2CO3;SO2+H2O===H2SO3;P2O5+3H2O===
2H3PO4。
②与碱反应,生成盐和水(CO、NO除外)。如:CO2+2NaOH ===Na2CO3+H2O。
(四)以物质的用途为突破口:详见第一部分中五。
(五)以特征反应为突破口
1.特征反应条件
①点燃:有O2参加的反应。
②通电:H2O电解。
③MnO2作催化剂:KClO3、H2O2分解。
④高温:CaCO3分解、C还原CuO、炼铁。
⑤加热:KClO3、KMnO4、Cu2(OH)2CO3分解等。
2.特征反应现象
(1)能使澄清石灰水变浑浊的无色无味气体是CO2。
(2)能使黑色的CuO变红(或红棕色的Fe2O3变黑)的气体是H2或CO,固体是C。
(3)能使燃着的木条燃烧得更旺的气体是O2,熄灭的气体是CO2或N2等;能使带火星的木条复燃的气体是O2。
(4)能使白色无水CuSO4粉末变蓝的气体是水蒸气。
(5)在O2中燃烧火星四射的物质是Fe。
(6)在空气中燃烧有水雾,且有使澄清石灰水变浑浊的气体生成的物质是有机物,如CH4、C2H5OH等。
(7)能溶于盐酸或稀硝酸的白色沉淀有CaCO3、BaCO3等;常见的不溶于稀硝酸的白色沉淀有AgCl、BaSO4。
3.特定实验现象
实验现象 可能情况分析
固体混合物加水后出现不溶物 a.原混合物中有不溶物,如CaCO3、Al(OH)3等
b.混合物中物质反应生成沉淀,如Na2SO4和BaCl2,Na2CO3和Ca(OH)2等
向固体混合物中加水得到无色溶液 混合物的水溶液中一定不含Fe2+、Fe3+、Cu2+、Mn
(续表)
实验现象 可能情况分析
生成有色沉淀 a.生成红褐色沉淀Fe(OH)3,是含Fe3+的盐与碱溶液反应,如FeCl3+3NaOH===Fe(OH)3↓+3NaCl
b.生成蓝色沉淀Cu(OH)2,是含Cu2+的盐与碱溶液反应,如2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
4.特定反应关系(如图3-5-2,填对应物质的化学式)
图3-5-2
CaCO3
H2O
CO
FeCl3
Cu(NO3)2
Na2CO3
例1 [2022·永州]为防止全球变暖,我国承诺在2060年要实现“碳中和”。减少化石燃料的使用,开发利用氢能,如图3-5-3是利用太阳能制氢的示意图。
(1)如图实现了能量之间的
相互转化,其中电解水的过
程是由电能转化为_______
(填“化学能”或“热能”)。
图3-5-3
化学能
(2)从微观的角度讲,每2个水分子分解,会产生 个氢分子。
(3)H2与CO2在一定条件下反
应,生成CH3OH(甲醇)和H2O,
该反应 (填“属于”或
“不属于”)置换反应。
(4)图中能够循环使用的物质是 (填化学式)。
图3-5-3
2
不属于
H2O
例2 [2022·柳州]为了充分利用资源、保护环境,柳州市大力推行垃圾分类投放。某校化学课外小组进行垃圾分类活动时,在垃圾处理厂发现一些铜锌合金材料(主要含Cu、Zn),查阅资料后,同学们设计利用此铜锌合金回收铜并制取ZnSO4的工艺流程如图3-5-4所示(反应条件已略去)。
图3-5-4
(1)从垃圾分类的角度分析,金属材料属于 。
A.厨余垃圾
B.可回收物
C.有害垃圾
D.其他垃圾
(2)金属活动性Zn (填“>”或“<”)Cu。加入稀硫酸之前须将合金粉碎,目的是_______________________________
。
图3-5-4
B
>
增大接触面积,提高反应速率,使反
应更充分、更完全(合理即可)
(3)请写出步骤①溶解过程中Cu发生反应的化学方程式:
。
(4)“溶解池”中也可在酸性条件下通入过量氧气代替H2O2,与加入过量H2O2相比的优点是 。
Cu+H2O2+H2SO4===CuSO4+2H2O
反应后不用除杂质(合理即可)
图3-5-4
(5)步骤②中加入NaOH溶液的量不能太多,请说出原因:
___________________________________________________
___________________________________________________
。
产物ZnSO4中会混入较多的Na2SO4杂质(或加入NaOH溶液
过多,会使Cu2+和Zn2+生成沉淀,无法制得Cu和ZnSO4,合理
即可)
图3-5-4
例3 [2022·襄阳]初中化学中常见的物质A~G有如图3-5-5所示的转化关系(“—”表示两种物质能够发生反应,“→”表示物质间存在着相应的转化关系,反应条件、部分反应物和生成物未列出)。已知B是一种黑色的固体,F是一种常用的溶剂,B、C、D、E是不同类别的物质。请分析后回答
下列问题。
(1)F的化学式为 。
图3-5-5
H2O
(2)请写出B→G的化学方程式:
_______________________________________
。
(3)请描述C与D反应的现象:
。
图3-5-5
4CO+Fe3O4 3Fe+4CO2(或2C+Fe3O4
3Fe+2CO2↑)
有气泡产生,溶液变成浅绿色
例4 [2022·宁波]有一包白色粉末,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,某兴趣小组做了如图3-5-6所示实验。
(1)无色溶液A中一定含有的溶
质是 。
(2)白色粉末的成分是__________________
。
图3-5-6
氯化钠(或NaCl)
氯化钡和碳酸钠(或
BaCl2和Na2CO3)
同课章节目录
