吉林省长春市新解放学校2022-2023学年高二下学期4月月考化学试题(含答案)
文档属性
| 名称 | 吉林省长春市新解放学校2022-2023学年高二下学期4月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 622.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-21 22:26:38 | ||
图片预览

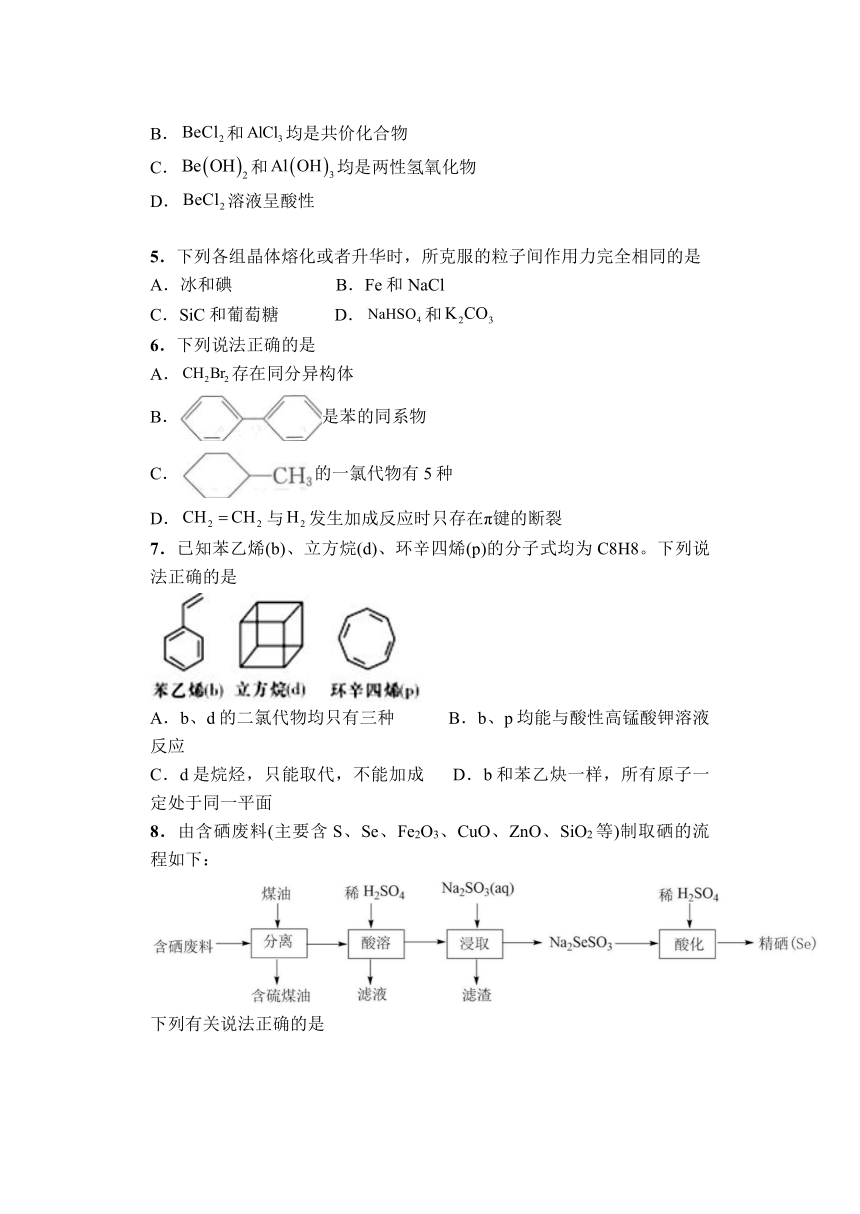
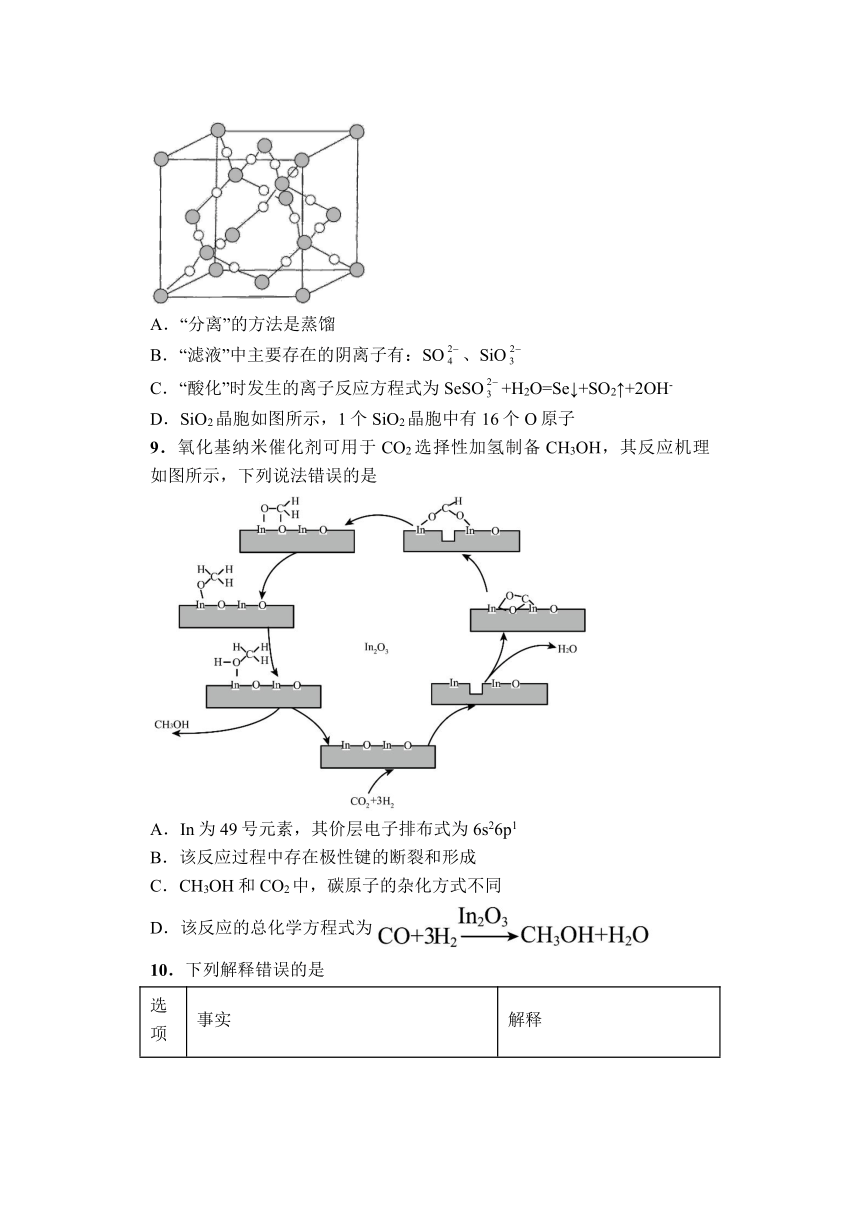

文档简介
新解放学校2022-2023学年高二下学期4月月考
化学
考试时间:60分钟 卷面分数:100分
可能用到的相对原子质量为:H 1 C 12 O 16 Na 23 Al 27 Si 28 Cl 35.5 Fe 56 Sb 122
一、单项选择题(每题3分,15小题共45分)
1.观察下列模型,判断下列说法错误的是
金刚石 碳化硅 二氧化硅 石墨烯
A.原子数相同的金刚石和碳化硅,共价键个数之比为1∶2
B.晶体中和键个数比为
C.石墨烯中碳原子和六元环个数比为2∶1
D.晶体堆积属于分子密堆积
2.烷烃的命名是其他种类有机物命名的基础,的名称是( )
A.1—甲基—4—乙基戊烷 B.2—乙基己烷
C.1,4—二甲基己烷 D.3—甲基庚烷
3.某烷烃的结构简式如下:若其中的一个氢原子被—OH取代,得到的产物有(不考虑立体异构)。
A.1种 B.2种 C.3种 D.4种
4.和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是
A.能与氨水反应生成
B.和均是共价化合物
C.和均是两性氢氧化物
D.溶液呈酸性
5.下列各组晶体熔化或者升华时,所克服的粒子间作用力完全相同的是
A.冰和碘 B.Fe和NaCl
C.SiC和葡萄糖 D.和
6.下列说法正确的是
A.存在同分异构体
B.是苯的同系物
C.的一氯代物有5种
D.与发生加成反应时只存在π键的断裂
7.已知苯乙烯(b)、立方烷(d)、环辛四烯(p)的分子式均为C8H8。下列说法正确的是
A.b、d的二氯代物均只有三种 B.b、p均能与酸性高锰酸钾溶液反应
C.d是烷烃,只能取代,不能加成 D.b和苯乙炔一样,所有原子一定处于同一平面
8.由含硒废料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)制取硒的流程如下:
下列有关说法正确的是
A.“分离”的方法是蒸馏
B.“滤液”中主要存在的阴离子有:SO、SiO
C.“酸化”时发生的离子反应方程式为SeSO+H2O=Se↓+SO2↑+2OH-
D.SiO2晶胞如图所示,1个SiO2晶胞中有16个O原子
9.氧化基纳米催化剂可用于CO2选择性加氢制备CH3OH,其反应机理如图所示,下列说法错误的是
A.In为49号元素,其价层电子排布式为6s26p1
B.该反应过程中存在极性键的断裂和形成
C.CH3OH和CO2中,碳原子的杂化方式不同
D.该反应的总化学方程式为
10.下列解释错误的是
选项 事实 解释
A 石墨的熔、沸点高于的 共价键的作用力强于分子间作用力
B 冰晶体中水分子周围的紧邻分子数为4,周围的紧邻分子数为12 水分子之间存在氢键,且氢键具有方向性
C MgO的熔点高于的 MgO的相对分子质量更大,分子间作用力更强
D N的第一电离能高于O的 N的2p轨道半充满,结构更稳定,能量更低
A.A B.B C.C D.D
11.《天工开物》记载:“凡火药以硝石、硫磺为主,草木灰为辅……而后火药成声”,涉及的主要反应为。设NA为阿伏加德罗常数的值,下列说法正确的是
A.和对应的晶体类型不同
B.标准状况下,11.2L 中含有的π键数为NA
C.12g金刚石中含有的非极性共价键数为4 NA
D.常温常压下,32g单质S含有的p电子数为4 NA
12.下列粒子的VSEPR模型为四面体形且其空间结构为三角锥形的是
A. B. C. D.
13.下列反应过程中无配合物形成的是
A.配制银氨溶液
B.向澄清石灰水中通入过量
C.向溶液中滴加过量氨水
D.向溶液中加入KSCN溶液
14.我国力争2030年前实现碳达峰,2060年前实现碳中和,这体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应来捕捉废气中的,下列有关化学用语表示正确的是
A.的分子结构模型:
B.的电子式:
C.的电子排布式:
D.基态C原子px轨道的电子云轮廓图:
15.某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是
A.氢化物沸点: B.原子半径:
C.第一电离能: D.阴、阳离子中均有配位键
二、非选择题(共4题,55分)
16.有下列物质:
① ② ③ ④ ⑤ ⑥ ⑦
(1)属于芳香烃的是______。
(2)属于苯的同系物的是______。
(3)⑤和⑥的一氯代物分别有______、______种。
17.丁二酮肟( )可与反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定的存在。请回答下列问题:
(1)Ni在元素周期表中的位置为___________。
(2)基态氧原子的核外电子的空间运动状态有___________种。
(3)丁二酮肟( )中涉及元素的电负性由大到小的顺序为___________;与氮同周期的硼在成键时,能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子的价电子轨道表示式:___________,该过程形成的原子光谱为___________(填“吸收”或“发射”)光谱。
(4)与Ni同周期的铜、锌两种元素位于元素周期表的___________区,两元素的第一电离能()、第二电离能()数据如表所示:
电离能/()
铜 746 1958
锌 906 1733
铜的小于锌,却大于锌的主要原因是___________。
18.如图为实验室制备乙炔并进行性质验证的装置(夹持仪器已略去)。
(1)仪器的名称是_______,仪器在安装前必须进行的操作是_______,为防止气体生成的速率过快,由A滴入B的试剂为_______。
(2)实验室制备乙炔的化学方程式为_______。
(3)装置C可选用的试剂为_______(写出一种即可),其作用为_______。
(4)反应开始后,D中发生的反应方程式为_______,
(5)实验结束后,B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是_______。
A. B. C. D.
(6)写出以乙炔和为原料,合成聚氯乙烯的方程式:_______,_______。
19.由于锂离子电池成本的日益上涨以及锂资源的不断消耗,钾离子电池成为近几年的研究热点。回答下列问题:
(1)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的负极电极材料。
①已知锑(Sb)为第五周期元素,与氮同族,Sb有___________个未成对电子。
②已知和KCl的熔点分别是73.4℃和770℃,分析两种物质熔点差异的原因:___。
(2)过渡金属氧化物在钾离子电池正极材料中得到广泛应用,如碳包覆的纳米材料,中P的杂化类型为__,该金属盐中不存在的微粒间作用力有____(填标号)。
a.σ键 b.离子键 c.金属键 d.氢键
(3)该锑钾(Sb-K)合金的晶胞结构如图a,图b表示晶胞的一部分。
①设1号原子的分数坐标为(0,0,0),2号原子的分数坐标为(1,1,1),则3号原子的分数坐标为___________。
②与Sb最邻近的K原子数为___________,若K原子的半径为a pm,Sb原子的半径为b pm,则该晶体中原子的空间利用率为___________(用含a、b的计算表达式表示)。
2022-2023学年高二化学月考试卷参考答案
1.A 2.D 3.B 4.A 5.D 6.C 7.B 8.D
9.A 10.C 11.B 12.A 13.B 14.D 15.D
16.(1)①②⑤⑥⑦ (2)①⑥⑦ (3) 2 5
17.(1)第四周期第Ⅷ族
(2)5
(3) 吸收
(4) ds 铜的价层电子排布式为,锌的价层电子排布式为,铜失去一个电子可以达到稳定的3d全满结构,因此铜的小于锌的,也由于3d全满结构稳定,再失去一个电子较困难,因此铜的大于锌的
18. (1) 分液漏斗 检查是否漏液 饱和食盐水
(2)CaC2+2H2O→Ca(OH)2+ CH≡CH↑
(3) 溶液 除去气体中的杂质
(4)CH≡CH+2Br2→CHBr2CHBr2
(5)A
(6) CH≡CH+HClCH2=CHCl nCH2=CHCl
19.(1) 3 从和KCl的熔点分别是73.4℃和770℃可以判断出属于分子晶体,而KCl属于离子晶体,因为属于分子晶体,而KCl属于离子晶体,分子晶体中分子间作用力是范德华力,离子晶体中阴、阳离子间作用力为离子键,离子键的键能大于范德华力,所以KCl熔点高于
(2) cd
(3) () 8
化学
考试时间:60分钟 卷面分数:100分
可能用到的相对原子质量为:H 1 C 12 O 16 Na 23 Al 27 Si 28 Cl 35.5 Fe 56 Sb 122
一、单项选择题(每题3分,15小题共45分)
1.观察下列模型,判断下列说法错误的是
金刚石 碳化硅 二氧化硅 石墨烯
A.原子数相同的金刚石和碳化硅,共价键个数之比为1∶2
B.晶体中和键个数比为
C.石墨烯中碳原子和六元环个数比为2∶1
D.晶体堆积属于分子密堆积
2.烷烃的命名是其他种类有机物命名的基础,的名称是( )
A.1—甲基—4—乙基戊烷 B.2—乙基己烷
C.1,4—二甲基己烷 D.3—甲基庚烷
3.某烷烃的结构简式如下:若其中的一个氢原子被—OH取代,得到的产物有(不考虑立体异构)。
A.1种 B.2种 C.3种 D.4种
4.和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是
A.能与氨水反应生成
B.和均是共价化合物
C.和均是两性氢氧化物
D.溶液呈酸性
5.下列各组晶体熔化或者升华时,所克服的粒子间作用力完全相同的是
A.冰和碘 B.Fe和NaCl
C.SiC和葡萄糖 D.和
6.下列说法正确的是
A.存在同分异构体
B.是苯的同系物
C.的一氯代物有5种
D.与发生加成反应时只存在π键的断裂
7.已知苯乙烯(b)、立方烷(d)、环辛四烯(p)的分子式均为C8H8。下列说法正确的是
A.b、d的二氯代物均只有三种 B.b、p均能与酸性高锰酸钾溶液反应
C.d是烷烃,只能取代,不能加成 D.b和苯乙炔一样,所有原子一定处于同一平面
8.由含硒废料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)制取硒的流程如下:
下列有关说法正确的是
A.“分离”的方法是蒸馏
B.“滤液”中主要存在的阴离子有:SO、SiO
C.“酸化”时发生的离子反应方程式为SeSO+H2O=Se↓+SO2↑+2OH-
D.SiO2晶胞如图所示,1个SiO2晶胞中有16个O原子
9.氧化基纳米催化剂可用于CO2选择性加氢制备CH3OH,其反应机理如图所示,下列说法错误的是
A.In为49号元素,其价层电子排布式为6s26p1
B.该反应过程中存在极性键的断裂和形成
C.CH3OH和CO2中,碳原子的杂化方式不同
D.该反应的总化学方程式为
10.下列解释错误的是
选项 事实 解释
A 石墨的熔、沸点高于的 共价键的作用力强于分子间作用力
B 冰晶体中水分子周围的紧邻分子数为4,周围的紧邻分子数为12 水分子之间存在氢键,且氢键具有方向性
C MgO的熔点高于的 MgO的相对分子质量更大,分子间作用力更强
D N的第一电离能高于O的 N的2p轨道半充满,结构更稳定,能量更低
A.A B.B C.C D.D
11.《天工开物》记载:“凡火药以硝石、硫磺为主,草木灰为辅……而后火药成声”,涉及的主要反应为。设NA为阿伏加德罗常数的值,下列说法正确的是
A.和对应的晶体类型不同
B.标准状况下,11.2L 中含有的π键数为NA
C.12g金刚石中含有的非极性共价键数为4 NA
D.常温常压下,32g单质S含有的p电子数为4 NA
12.下列粒子的VSEPR模型为四面体形且其空间结构为三角锥形的是
A. B. C. D.
13.下列反应过程中无配合物形成的是
A.配制银氨溶液
B.向澄清石灰水中通入过量
C.向溶液中滴加过量氨水
D.向溶液中加入KSCN溶液
14.我国力争2030年前实现碳达峰,2060年前实现碳中和,这体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应来捕捉废气中的,下列有关化学用语表示正确的是
A.的分子结构模型:
B.的电子式:
C.的电子排布式:
D.基态C原子px轨道的电子云轮廓图:
15.某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是
A.氢化物沸点: B.原子半径:
C.第一电离能: D.阴、阳离子中均有配位键
二、非选择题(共4题,55分)
16.有下列物质:
① ② ③ ④ ⑤ ⑥ ⑦
(1)属于芳香烃的是______。
(2)属于苯的同系物的是______。
(3)⑤和⑥的一氯代物分别有______、______种。
17.丁二酮肟( )可与反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定的存在。请回答下列问题:
(1)Ni在元素周期表中的位置为___________。
(2)基态氧原子的核外电子的空间运动状态有___________种。
(3)丁二酮肟( )中涉及元素的电负性由大到小的顺序为___________;与氮同周期的硼在成键时,能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子的价电子轨道表示式:___________,该过程形成的原子光谱为___________(填“吸收”或“发射”)光谱。
(4)与Ni同周期的铜、锌两种元素位于元素周期表的___________区,两元素的第一电离能()、第二电离能()数据如表所示:
电离能/()
铜 746 1958
锌 906 1733
铜的小于锌,却大于锌的主要原因是___________。
18.如图为实验室制备乙炔并进行性质验证的装置(夹持仪器已略去)。
(1)仪器的名称是_______,仪器在安装前必须进行的操作是_______,为防止气体生成的速率过快,由A滴入B的试剂为_______。
(2)实验室制备乙炔的化学方程式为_______。
(3)装置C可选用的试剂为_______(写出一种即可),其作用为_______。
(4)反应开始后,D中发生的反应方程式为_______,
(5)实验结束后,B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是_______。
A. B. C. D.
(6)写出以乙炔和为原料,合成聚氯乙烯的方程式:_______,_______。
19.由于锂离子电池成本的日益上涨以及锂资源的不断消耗,钾离子电池成为近几年的研究热点。回答下列问题:
(1)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的负极电极材料。
①已知锑(Sb)为第五周期元素,与氮同族,Sb有___________个未成对电子。
②已知和KCl的熔点分别是73.4℃和770℃,分析两种物质熔点差异的原因:___。
(2)过渡金属氧化物在钾离子电池正极材料中得到广泛应用,如碳包覆的纳米材料,中P的杂化类型为__,该金属盐中不存在的微粒间作用力有____(填标号)。
a.σ键 b.离子键 c.金属键 d.氢键
(3)该锑钾(Sb-K)合金的晶胞结构如图a,图b表示晶胞的一部分。
①设1号原子的分数坐标为(0,0,0),2号原子的分数坐标为(1,1,1),则3号原子的分数坐标为___________。
②与Sb最邻近的K原子数为___________,若K原子的半径为a pm,Sb原子的半径为b pm,则该晶体中原子的空间利用率为___________(用含a、b的计算表达式表示)。
2022-2023学年高二化学月考试卷参考答案
1.A 2.D 3.B 4.A 5.D 6.C 7.B 8.D
9.A 10.C 11.B 12.A 13.B 14.D 15.D
16.(1)①②⑤⑥⑦ (2)①⑥⑦ (3) 2 5
17.(1)第四周期第Ⅷ族
(2)5
(3) 吸收
(4) ds 铜的价层电子排布式为,锌的价层电子排布式为,铜失去一个电子可以达到稳定的3d全满结构,因此铜的小于锌的,也由于3d全满结构稳定,再失去一个电子较困难,因此铜的大于锌的
18. (1) 分液漏斗 检查是否漏液 饱和食盐水
(2)CaC2+2H2O→Ca(OH)2+ CH≡CH↑
(3) 溶液 除去气体中的杂质
(4)CH≡CH+2Br2→CHBr2CHBr2
(5)A
(6) CH≡CH+HClCH2=CHCl nCH2=CHCl
19.(1) 3 从和KCl的熔点分别是73.4℃和770℃可以判断出属于分子晶体,而KCl属于离子晶体,因为属于分子晶体,而KCl属于离子晶体,分子晶体中分子间作用力是范德华力,离子晶体中阴、阳离子间作用力为离子键,离子键的键能大于范德华力,所以KCl熔点高于
(2) cd
(3) () 8
同课章节目录
