专题1《化学反应与能量变化》单元检测题(含解析)2022-2023学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题1《化学反应与能量变化》单元检测题(含解析)2022-2023学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 423.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-23 16:13:33 | ||
图片预览

文档简介
专题1《化学反应与能量变化》单元检测题
一、单选题
1.热化学方程式:H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6kJ·mol-1的叙述正确的是
A.在25℃、101kPa时,一分子H2和Cl2反应,放出热量184.6kJ
B.在25℃、101kPa时,1molH2和Cl2完全反应生成2molHCl放出的热量为184.6kJ
C.在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2molHCl气体,放出的热量为184.6kJ
D.在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2molHCl气体,吸收的热量为184.6kJ
2.下列说法正确的是
A.金刚石和石墨是两种常见的同位素
B.金刚石转化成石墨时,原子的排列方式发生变化
C.由石墨比金刚石稳定可知:C(s,金刚石)=C(s,石墨) △H >0
D.C(s)的燃烧热△H = -393.5kJ·mol-1,则2C(s)+O2(g)=2CO(g)反应的△H = -787 kJ·mol-1
3.将1L含有0.4molCu(NO3)2和0.4molKCl的溶液,用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另一电极上放出的气体在标准状况下的体积为
A.3.36L B.5.60L C.6.72L D.大于5.60L,小于6.72L
4.下列燃烧反应的反应热是燃烧热的是
A.H2(g)+O2(g)=H2O(g) △H1
B.C(s)+O2(g)=CO(g) △H2
C.S(s)+O2(g)=SO2(g) △H3
D.H2S(g)+O2(g)=S(s)+H2O(l) △H4
5.我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
A.充电时,a电极接外电源正极
B.放电时,b电极发生氧化反应
C.放电时,每消耗0.65g锌,溶液中离子总数增加0.02NA
D.充电时,阳极反应为
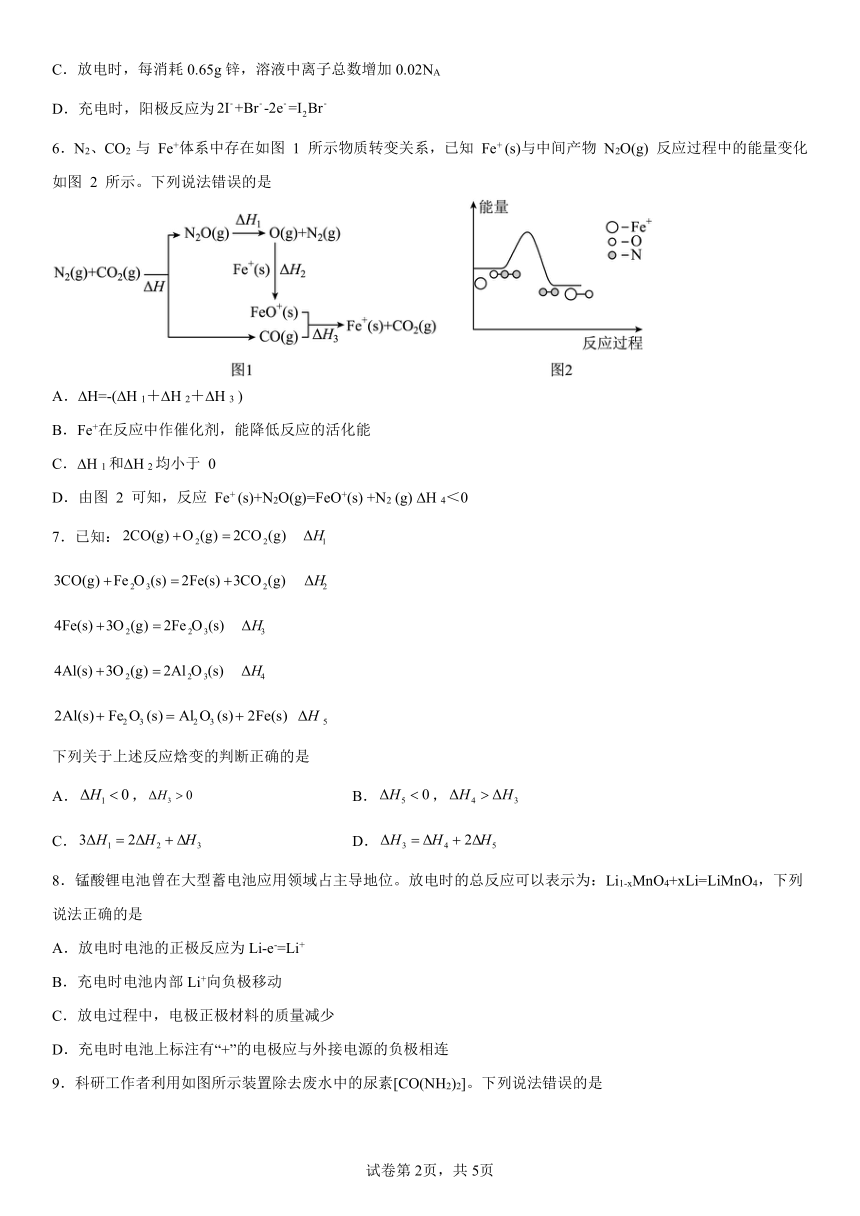
6.N2、CO2 与 Fe+体系中存在如图 1 所示物质转变关系,已知 Fe+ (s)与中间产物 N2O(g) 反应过程中的能量变化如图 2 所示。下列说法错误的是
A. H=-( H 1+ H 2+ H 3 )
B.Fe+在反应中作催化剂,能降低反应的活化能
C. H 1和 H 2均小于 0
D.由图 2 可知,反应 Fe+ (s)+N2O(g)=FeO+(s) +N2 (g) H 4<0
7.已知:
下列关于上述反应焓变的判断正确的是
A., B.,
C. D.
8.锰酸锂电池曾在大型蓄电池应用领域占主导地位。放电时的总反应可以表示为:Li1-xMnO4+xLi=LiMnO4,下列说法正确的是
A.放电时电池的正极反应为Li-e-=Li+
B.充电时电池内部Li+向负极移动
C.放电过程中,电极正极材料的质量减少
D.充电时电池上标注有“+”的电极应与外接电源的负极相连
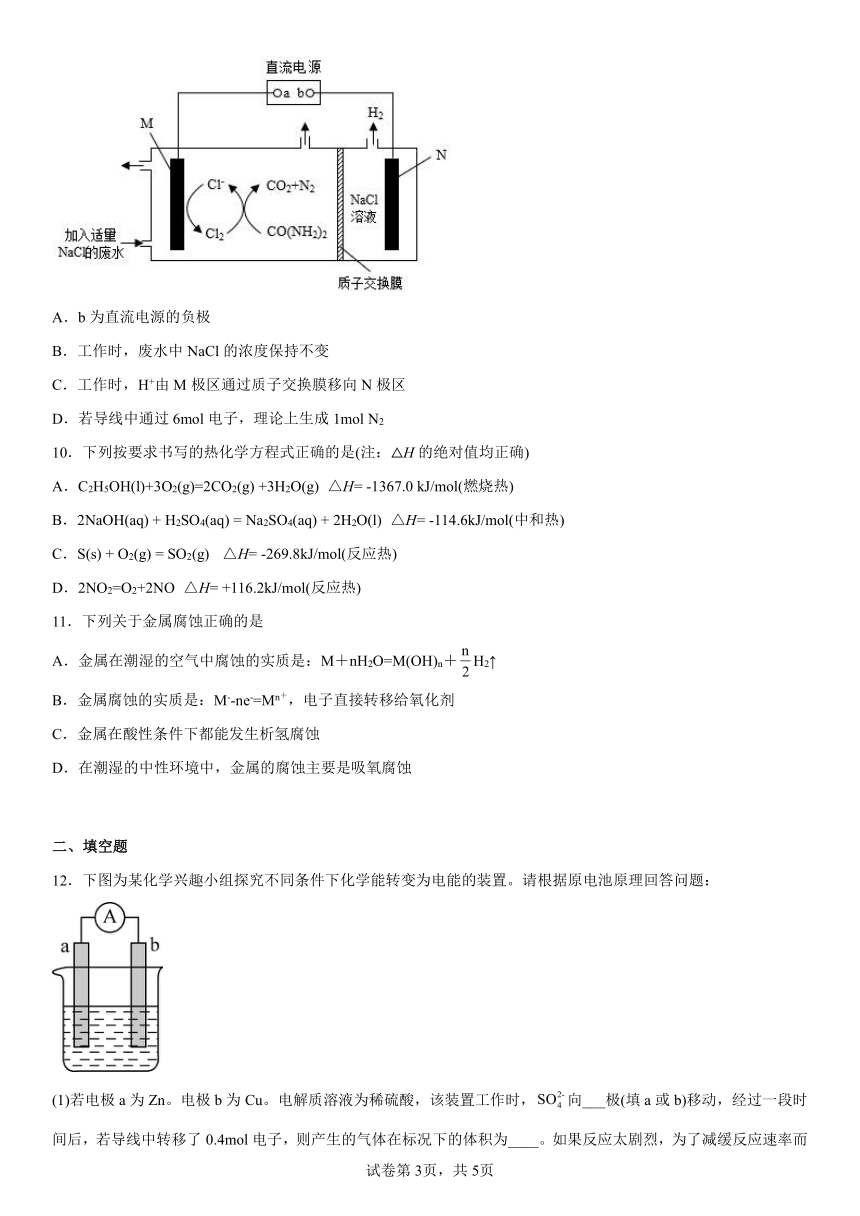
9.科研工作者利用如图所示装置除去废水中的尿素[CO(NH2)2]。下列说法错误的是
A.b为直流电源的负极
B.工作时,废水中NaCl的浓度保持不变
C.工作时,H+由M极区通过质子交换膜移向N极区
D.若导线中通过6mol电子,理论上生成1mol N2
10.下列按要求书写的热化学方程式正确的是(注:△H的绝对值均正确)
A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g) △H= -1367.0 kJ/mol(燃烧热)
B.2NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + 2H2O(l) △H= -114.6kJ/mol(中和热)
C.S(s) + O2(g) = SO2(g) △H= -269.8kJ/mol(反应热)
D.2NO2=O2+2NO △H= +116.2kJ/mol(反应热)
11.下列关于金属腐蚀正确的是
A.金属在潮湿的空气中腐蚀的实质是:M+nH2O=M(OH)n+H2↑
B.金属腐蚀的实质是:M--ne-=Mn+,电子直接转移给氧化剂
C.金属在酸性条件下都能发生析氢腐蚀
D.在潮湿的中性环境中,金属的腐蚀主要是吸氧腐蚀
二、填空题
12.下图为某化学兴趣小组探究不同条件下化学能转变为电能的装置。请根据原电池原理回答问题:
(1)若电极a为Zn。电极b为Cu。电解质溶液为稀硫酸,该装置工作时,向___极(填a或b)移动,经过一段时间后,若导线中转移了0.4mol电子,则产生的气体在标况下的体积为____。如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在烧杯中分别加入等体积的下列液体,你认为可行的是____(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液 E.KNO3溶液
(2)若电极a为Mg,电极b为Al,电解质溶液为氢氧化钠溶液,该原电池工作时,电子从__极(填a或b)流出。一段时间后,若反应转移3NA个电子,则理论上的电解质溶液质量变化是___g。
13.甲、乙两池电极材料都是铁棒与碳棒(如图)。请回答下列问题:
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒。
②在乙池中阳极的电极反应是_______________________________________。
(2)若两池中均盛放饱和NaCl溶液:
①写出乙池中总反应的离子方程式:_____________________________________。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。则该反应的化学方程式为___________________________。
14.利用如图装置,可以模拟铁的电化学防护。
(1)若为铜,为减缓铁的腐蚀,开关应置于 _______ 处,铁棒上发生的电极反应为 _______ ,该种防护方法称为 _______ 。
(2)若为锌棒,开关置于 _______ 处,铁棒上的电极反应为 _______ 该电化学防护法称为 _______ 。
15.COS氢解反应产生的CO可合成二甲醚(CH3OCH3),二甲醚燃料电池的工作原理如图所示。
该电池的负极反应式为___。
16.某原电池如图所示,电池总反应为2Ag+Cl2=2AgCl。
(1)放电时,交换膜____(“左侧”或“右侧”)溶液中有大量白色沉淀生成;若用氯化钠溶液代替盐酸,则电池总反应____(“会”或“不会”)随之改变。
(2)当电路中转移0.01mole-时,交换膜左侧溶液中约减少____mol离子。
17.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色.试回答以下问题:
(1)电源A极的名称是_______。甲装置中电解反应的总化学方程式_____________________。
(2)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(3)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式),G电极发生的反应是_____________________________。
(4)装置丁中的现象是__________________________,说明______________________。
18.高钴酸钠是钴元素目前发现的最高价化合物,实验室可通过电解硫酸钠与氯化钴的混合溶液获得氧化亚钴(CoO),并通过一系列反应来制备高钴酸钠,相关化学方程式如下:
CoCl2+H2OCoO↓+H2↑+Cl2↑;
CoO+O2 → Co3O4 (未配平)
Co3O4+Na2O+O2→Na3CoO4 (未配平)
请计算:
(1)以氯化钴为原料制备1.920 g的高钴酸钠,消耗标准状况下氧气的体积为______mL。
(2)若电解过程转移电子共0.100 mol,两极收集到气体标准状况下总体积2.016 L (不考虑气体的溶解),则可制得高钴酸钠的质量为________ (计算结果并写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A. 在25℃、101kPa时,不是一分子H2和Cl2反应,应是1molH2和Cl2反应,放出热量184.6kJ,故A错误;
B. 在25℃、101kPa时,1molH2和Cl2完全反应生成2molHCl放出的热量为184.6kJ,没有指明物质的状态,故B错误;
C. 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2molHCl气体,放出的热量为184.6kJ,故C正确;
D. 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2molHCl气体,不是吸收的热量为184.6kJ, ΔH=-184.6kJ·mol-1应是放出热量,故D错误;
故选C。
2.B
【详解】A.金刚石和石墨是碳元素的两种不同单质为同素异形体,故A错误;
B.石墨和金刚石排列方式不同,故金刚石转化成石墨时,原子的排列方式发生变化,故B正确;
C.由石墨比金刚石稳定可知,金刚石能量较高,金刚石转化为石墨为放热反应,焓变为负,故C错误;
D.C(s)的燃烧热ΔH=-393.5kJ/mol,对应的燃烧产物为二氧化碳气体,故无法计算2C(s)+O2(g)=2CO(g)反应的ΔH,故D错误;
故选:B。
3.B
【解析】电解1L含有0.4molCu(NO3)2和0.4molKCl的混合溶液时,阴极的反应式为Cu2++2e-=Cu,阳极的反应式依次为2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,结合两极转移电子数目相等分析解答。
【详解】电解1L含有0.4molCu(NO3)2和0.4molKCl的混合溶液时,阴极的反应式为Cu2++2e-=Cu,根据析出0.3molCu可知,阴极得到0.6mol电子;阳极的反应式依次为2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,氯离子完全析出时,生成n(Cl2)=0.2mol,转移电子0.4mol,
则生成氧气转移电子0.2mol,生成氧气0.05mol,所以阳极共生成(0.2+0.05)mol=0.25mol气体,在标准状况下,气体的体积=0.25mol×22.4L/mol=5.6L,故选B。
【点睛】明确阳极上析出气体的成分再结合转移电子相等是解答本题的关键。解答本题要注意阳极上先发生2Cl--2e-=Cl2↑,再发生4OH--4e-=O2↑+2H2O。
4.C
【分析】根据燃烧热定义:1mol纯物质完全燃烧生成稳定氧化物进行判断;
【详解】A.氢气燃烧生成稳定的氧化物水应该是液态,故A不正确;
B.碳燃烧生成稳定的氧化物应是二氧化碳,故B不正确;
C.硫燃烧生成稳定的氧化物二氧化硫,故C正确;
D.硫化氢燃烧生成稳定的氧化物,故应该生成二氧化硫,故D不正确;
故选答案C;
【点睛】此题考查燃烧热的热化学方程式判断,注意稳定氧化物的判断。
5.C
【分析】由电池装置图可知,a极I2Br-生成I-,则发生还原反应,应为原电池的正极,b极Zn失电子生成Zn2+,发生氧化反应,应为原电池的负极,充电时,a为阳极,b为阴极,以此解答该题。
【详解】A.充电时,a为阳极,接外电源正极,故A正确;
B.放电时,b极Zn失电子生成Zn2+,发生氧化反应,电极反应为Zn-2e-═Zn2+,故B正确;
C.放电时,负极电极反应为Zn-2e-═Zn2+,每消耗0.65g锌,即生成0.01molZn2+,正极反应I2Br-+2e-=2I-+Br-,溶液中离子总数增加0.03NA,故C错误。
D.充电时,a为阳极发生氧化反应,电极方程式2I-+Br--2e-=I2Br-,故D正确;
故选:C。
6.C
【详解】A.根据图示可知,N2(g)+CO2(g)=N2O(g)+CO(g) ΔH,N2O(g)=O(g)+N2(g) ΔH1,O(g)+Fe+(s)=FeO+(s) ΔH2,FeO+(s)+CO(g)= Fe+(s)+ CO2(g) ΔH3,根据盖斯定律可知,第一个反应=后面三个反应之和的逆反应, H=-( H 1+ H 2+ H 3 ),A正确;
B.从图1中可知,Fe+为反应的催化剂,可降低反应的活化能,B正确;
C.从图2中可知,Fe+(s)+ N2O(g)= FeO+(s)+ N2(g) ΔH<0,ΔH=(ΔH1+ΔH2),只能说明(ΔH1+ΔH2)<0,不能说明 H 1 和 H 2 均小于0,C错误;
D.ΔH=生成物总能量-反应物总能量,Fe+(s)+ N2O(g)= FeO+(s)+ N2(g) ΔH<0,D正确;
故答案选C。
7.C
【详解】A.所有的燃烧反应都属于放热反应,因此,A项错误;
B.铝热反应是一个放热反应,铝比铁还原性强,更活泼,铝和氧气燃烧放出的热量多,,B项错误;
C.根据盖斯定律可知,,C项正确;
D.根据盖斯定律可知,,D项错误;
答案选C。
8.B
【详解】A.放电时为原电池,正极得电子发生还原反应,Li-e-=Li+为负极反应,A错误;
B.充电时为电解池,电解池中阳离子向阴极移动,阴极即为放电时的负极,B正确;
C.放电过程中,正极反应为Li1-xMnO4+xe-+xLi+=LiMnO4,所以正极材料质量增加,C错误;
D.放电时,电池上标注有“+”的电极得电子发生还原反应,则充电时电池上标注有“+”的电极失电子发生氧化反应,为阳极,与外接电源的正极相连,D错误;
综上所述答案为B。
9.B
【详解】A.由图知,N极区生成H2,N极作阴极,故b为直流电源的负极,A项正确;
B.工作时,阳极区的反应为6Cl--6e-=3Cl2↑、3Cl2+CO(NH2)2+H2O=6Cl-+6H++CO2+N2,因消耗水而使废水中NaCl的浓度增大,B项错误;
C.工作时,H+由M极区通过质子交换膜移向N极区,C项正确;
D.由阳极区发生的反应知,若导线中通过6mol电子,理论上生成1 mol N2,D项正确;
故答案选B。
10.C
【详解】A.热化学方程式中,H2O呈气态而不是液态,则△H= -1367.0 kJ/mol不表示燃烧热,A不正确;
B.反应2NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + 2H2O(l)表示生成2molH2O(l)的热化学方程式,则△H= -114.6kJ/mol不表示中和热,B不正确;
C.反应S(s) + O2(g) = SO2(g)标明了所有物质的状态,则△H= -269.8kJ/mol表示反应热,C正确;
D.反应2NO2=O2+2NO中,所有物质的状态都未标明,则△H= +116.2kJ/mol不表示反应热,D不正确;
故选C。
11.D
【详解】A.金属在潮湿的空气中是吸氧腐蚀,实质是:M+nH2O+O2=M(OH)2n,A错误;
B.金属腐蚀的实质是:M_ne-=Mn+,化学腐蚀则电子直接转移给氧化剂,电化学腐蚀则电子转移到另一电极后与氧化剂结合,B错误;
C.较活泼的金属在酸性条件下能发生析氢腐蚀,有些不活泼的金属在酸性条件下不能发生析氢腐蚀,发生的是吸氧腐蚀,C错误;
D.在潮湿的中性环境中,金属的腐蚀主要是吸氧腐蚀,D正确;
故选D。
12. a 4.48L AB b 24
【详解】(1)若电极a为Zn,电极b为Cu,电解质溶液为稀硫酸,则电极a是负极,电极b是正极,该装置工作时,向a极(填a或b)移动,b电极上的电极反应式是,导线中转移了0.4mol电子,则产生的气体在标况下的体积为0.4mol÷2×22.4L/mol=4.48L,如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,加入的物质应该降低氢离子的浓度,又不能消耗氢离子,则符合题意的有AB,
故选:AB;
(2)若电极a为Mg,电极b为Al,电解质溶液为氢氧化钠溶液,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,铝元素的化合价升高铝电极作负极,则该原电池工作时,电子从b极流出,负极电极反应式是 ,正极反应式是,一段时间后,若反应转移3NA个电子,负极溶解27g铝,正极析出3g氢气,则理论上的电解质溶液质量变化是27g-3g=24g。
13. C Fe 4OH--4e-===2H2O+O2↑ 5Cl2+I2+6H2O===10HCl+2HIO3
【详解】(1)①甲池为原电池装置,Fe为负极,电极反应为Fe-2e-=Fe2+,C为正极,发生还原反应,电极反应式为Cu2++2e-=Cu;②乙装置为电解装置,根据电子移动的方向可知C为阳极,Fe为阴极,阳极反应为4OH--4e-=O2↑+2H2O,阴极反应为Cu2++2e-=Cu,所以甲池中的碳(C )和乙池中的铁(Fe)有红色物质析出;②在乙池中阳极的电极反应式是4OH--4e-=O2↑+2H2O,故答案为4OH--4e-=O2↑+2H2O;
(2)①氯化钠溶液中存在的离子是:氯离子、氢氧根离子、钠离子、氢离子,氯离子的放电能力大于氢氧根离子,氢离子的放电能力大于钠离子,所以该反应的生成物是氯气、氢气、氢氧化钠,总反应式为2Cl-+2H2O2OH-+H2↑+Cl2↑;②过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl。
14.(1) N 2H++2e-=H2↑ 外接电源的阴极保护法
(2) M 牺牲阳极的阴极保护法
【分析】根据装置图分析可知,当开关K连接在M处时,装置为原电池;当开关K连接在N处时,装置为电解池,以此分析;
【详解】(1)若 X 为铜,由于铁比铜活泼,为减缓铁的腐蚀,应使铁为电解池的阴极,故开关 K 应连接N处,则铁作阴极发生反应2H++2e-=H2↑,该种防护方法称为外加电源的阴极保护法;
故答案为:N;2H++2e-=H2↑;外加电源的阴极保护法;
(2)若X为锌,开关K置于M处,为原电池,Zn为负极被腐蚀,铁作正极被保护,正极反应为O2+4e-+H2O=4OH-,该电化学防护法称为牺牲阳极的阴极保护法;
故答案为:M;O2+4e-+H2O=4OH-;牺牲阳极的阴极保护法。
15.CH3OCH3-12e-+3H2O=2CO2↑+12H+
【详解】二甲醚燃料电池中,通入二甲醚的一极为电池的负极,据图可知负极产生氢离子,所以负极的电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+。
16.(1) 左侧 不会
(2)0.02
【分析】依据该原电池总反应为2Ag+Cl2=2AgCl可知,银化合价升高、发生氧化反应,氯气中的氯元素化合价降低、发生还原反应,所以银作原电池负极,Pt作原电池的正极,装置左侧即负极电极反应式为Ag-e-+Cl-=AgCl,正极电极反应式为Cl2+2e-=2Cl-,由于阳离子交换膜的作用,负极H+通过交换膜进入正极,形成闭合回路。
(1)
根据以上分析可知,装置左侧即负极电极反应式为Ag-e-+Cl-=AgCl,所以交换膜左侧溶液中有大量白色沉淀生成,又电池总反应为2Ag+Cl2═2AgCl,则用NaCl溶液代替盐酸,电池的总反应不会随之改变,故答案为:左侧;不会;
(2)
负极电极反应式为Ag-e-+Cl-=AgCl,原电池工作时,电路中转移0.01mole-,则负极消耗0.01molCl-,形成闭合回路移向正极的n(H+)=0.01mol,所以负极区即交换膜左侧溶液中约减少0.02mol离子,故答案为:0.02。
17. 正极 2CuSO4+2H2O2Cu+O2↑+2H2SO4 1:1 Ag AgNO3 Ag—e-=Ag+ Y 极颜色变深 氢氧化铁胶粒带正电
【详解】(1)向乙中滴入酚酞试液,在F极附近显红色,说明该极上氢离子放电,所以该电极是阴极,所以E电极是阳极,D电极是阴极,C电极是阳极,G电极是阳极,H电极是阴极,X电极是阳极,Y是阴极,A是电源的正极,B是原电池的负极,电解甲溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,所以电池反应式为:2CuSO4+2H2O2Cu+O2↑+2H2SO4,
故答案为正极;2CuSO4+2H2O2Cu+O2↑+2H2SO4;
(2)电解饱和食盐水的电解原理是2NaCl+2H2O2NaOH+H2↑+Cl2↑,产生的氢气和氯气体积比为1:1,
故答案为1:1;
(3)在铜上镀银时,G作阳极,镀层银作阳极,所以G的材料是银,电解质溶液是硝酸银溶液,G电极的电极反应为Ag—e-=Ag+;
故答案为Ag;AgNO3;Ag—e-=Ag+;
(4)氢氧化铁胶粒带正电荷,应移向电源的负极即向阴极移动,所以电极Y附近红褐色变深,
故答案为电极Y附近红褐色变深;氢氧化铁胶粒带正电。
18.(1)168.0##1.680 ×10-2
(2)5.76 g
【解析】(1)
该反应过程中Co由+2价升高到+5价,1.920 g高钴酸钠的物质的量=,则此时Co失去电子的物质的量=0.01mol×(5-2)=0.03mol,根据得失电子守恒,可知需要氧气的物质的量=,则氧气的体积=0.0075mol×22.4L/mol=0.168L,即168.0或者1.680 ×10-2ml;
(2)
电解过程中存在着电解氯化钴和电解水两个过程,设电解产生的Cl2 xmol,则同时产生的H2 xmol,设产生的O2 ymol,则同时产生H2 2ymol,依据转移电子为0.1mol可知,2x+4y=0.1;产生气体2.016L物质的量=,则x+x+y+2y=0.09mol,解两个方程组成的方程组可知,x=0.03mol,y=0.01mol,则参加反应的氯化钴的物质的量也为0.03mol,根据钴守恒可知,生成的高钴酸钠也是0.03mol,其质量=0.03mol×192g/mol=5.76g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.热化学方程式:H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6kJ·mol-1的叙述正确的是
A.在25℃、101kPa时,一分子H2和Cl2反应,放出热量184.6kJ
B.在25℃、101kPa时,1molH2和Cl2完全反应生成2molHCl放出的热量为184.6kJ
C.在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2molHCl气体,放出的热量为184.6kJ
D.在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2molHCl气体,吸收的热量为184.6kJ
2.下列说法正确的是
A.金刚石和石墨是两种常见的同位素
B.金刚石转化成石墨时,原子的排列方式发生变化
C.由石墨比金刚石稳定可知:C(s,金刚石)=C(s,石墨) △H >0
D.C(s)的燃烧热△H = -393.5kJ·mol-1,则2C(s)+O2(g)=2CO(g)反应的△H = -787 kJ·mol-1
3.将1L含有0.4molCu(NO3)2和0.4molKCl的溶液,用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另一电极上放出的气体在标准状况下的体积为
A.3.36L B.5.60L C.6.72L D.大于5.60L,小于6.72L
4.下列燃烧反应的反应热是燃烧热的是
A.H2(g)+O2(g)=H2O(g) △H1
B.C(s)+O2(g)=CO(g) △H2
C.S(s)+O2(g)=SO2(g) △H3
D.H2S(g)+O2(g)=S(s)+H2O(l) △H4
5.我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
A.充电时,a电极接外电源正极
B.放电时,b电极发生氧化反应
C.放电时,每消耗0.65g锌,溶液中离子总数增加0.02NA
D.充电时,阳极反应为
6.N2、CO2 与 Fe+体系中存在如图 1 所示物质转变关系,已知 Fe+ (s)与中间产物 N2O(g) 反应过程中的能量变化如图 2 所示。下列说法错误的是
A. H=-( H 1+ H 2+ H 3 )
B.Fe+在反应中作催化剂,能降低反应的活化能
C. H 1和 H 2均小于 0
D.由图 2 可知,反应 Fe+ (s)+N2O(g)=FeO+(s) +N2 (g) H 4<0
7.已知:
下列关于上述反应焓变的判断正确的是
A., B.,
C. D.
8.锰酸锂电池曾在大型蓄电池应用领域占主导地位。放电时的总反应可以表示为:Li1-xMnO4+xLi=LiMnO4,下列说法正确的是
A.放电时电池的正极反应为Li-e-=Li+
B.充电时电池内部Li+向负极移动
C.放电过程中,电极正极材料的质量减少
D.充电时电池上标注有“+”的电极应与外接电源的负极相连
9.科研工作者利用如图所示装置除去废水中的尿素[CO(NH2)2]。下列说法错误的是
A.b为直流电源的负极
B.工作时,废水中NaCl的浓度保持不变
C.工作时,H+由M极区通过质子交换膜移向N极区
D.若导线中通过6mol电子,理论上生成1mol N2
10.下列按要求书写的热化学方程式正确的是(注:△H的绝对值均正确)
A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g) △H= -1367.0 kJ/mol(燃烧热)
B.2NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + 2H2O(l) △H= -114.6kJ/mol(中和热)
C.S(s) + O2(g) = SO2(g) △H= -269.8kJ/mol(反应热)
D.2NO2=O2+2NO △H= +116.2kJ/mol(反应热)
11.下列关于金属腐蚀正确的是
A.金属在潮湿的空气中腐蚀的实质是:M+nH2O=M(OH)n+H2↑
B.金属腐蚀的实质是:M--ne-=Mn+,电子直接转移给氧化剂
C.金属在酸性条件下都能发生析氢腐蚀
D.在潮湿的中性环境中,金属的腐蚀主要是吸氧腐蚀
二、填空题
12.下图为某化学兴趣小组探究不同条件下化学能转变为电能的装置。请根据原电池原理回答问题:
(1)若电极a为Zn。电极b为Cu。电解质溶液为稀硫酸,该装置工作时,向___极(填a或b)移动,经过一段时间后,若导线中转移了0.4mol电子,则产生的气体在标况下的体积为____。如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在烧杯中分别加入等体积的下列液体,你认为可行的是____(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液 E.KNO3溶液
(2)若电极a为Mg,电极b为Al,电解质溶液为氢氧化钠溶液,该原电池工作时,电子从__极(填a或b)流出。一段时间后,若反应转移3NA个电子,则理论上的电解质溶液质量变化是___g。
13.甲、乙两池电极材料都是铁棒与碳棒(如图)。请回答下列问题:
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒。
②在乙池中阳极的电极反应是_______________________________________。
(2)若两池中均盛放饱和NaCl溶液:
①写出乙池中总反应的离子方程式:_____________________________________。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。则该反应的化学方程式为___________________________。
14.利用如图装置,可以模拟铁的电化学防护。
(1)若为铜,为减缓铁的腐蚀,开关应置于 _______ 处,铁棒上发生的电极反应为 _______ ,该种防护方法称为 _______ 。
(2)若为锌棒,开关置于 _______ 处,铁棒上的电极反应为 _______ 该电化学防护法称为 _______ 。
15.COS氢解反应产生的CO可合成二甲醚(CH3OCH3),二甲醚燃料电池的工作原理如图所示。
该电池的负极反应式为___。
16.某原电池如图所示,电池总反应为2Ag+Cl2=2AgCl。
(1)放电时,交换膜____(“左侧”或“右侧”)溶液中有大量白色沉淀生成;若用氯化钠溶液代替盐酸,则电池总反应____(“会”或“不会”)随之改变。
(2)当电路中转移0.01mole-时,交换膜左侧溶液中约减少____mol离子。
17.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色.试回答以下问题:
(1)电源A极的名称是_______。甲装置中电解反应的总化学方程式_____________________。
(2)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(3)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式),G电极发生的反应是_____________________________。
(4)装置丁中的现象是__________________________,说明______________________。
18.高钴酸钠是钴元素目前发现的最高价化合物,实验室可通过电解硫酸钠与氯化钴的混合溶液获得氧化亚钴(CoO),并通过一系列反应来制备高钴酸钠,相关化学方程式如下:
CoCl2+H2OCoO↓+H2↑+Cl2↑;
CoO+O2 → Co3O4 (未配平)
Co3O4+Na2O+O2→Na3CoO4 (未配平)
请计算:
(1)以氯化钴为原料制备1.920 g的高钴酸钠,消耗标准状况下氧气的体积为______mL。
(2)若电解过程转移电子共0.100 mol,两极收集到气体标准状况下总体积2.016 L (不考虑气体的溶解),则可制得高钴酸钠的质量为________ (计算结果并写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A. 在25℃、101kPa时,不是一分子H2和Cl2反应,应是1molH2和Cl2反应,放出热量184.6kJ,故A错误;
B. 在25℃、101kPa时,1molH2和Cl2完全反应生成2molHCl放出的热量为184.6kJ,没有指明物质的状态,故B错误;
C. 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2molHCl气体,放出的热量为184.6kJ,故C正确;
D. 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2molHCl气体,不是吸收的热量为184.6kJ, ΔH=-184.6kJ·mol-1应是放出热量,故D错误;
故选C。
2.B
【详解】A.金刚石和石墨是碳元素的两种不同单质为同素异形体,故A错误;
B.石墨和金刚石排列方式不同,故金刚石转化成石墨时,原子的排列方式发生变化,故B正确;
C.由石墨比金刚石稳定可知,金刚石能量较高,金刚石转化为石墨为放热反应,焓变为负,故C错误;
D.C(s)的燃烧热ΔH=-393.5kJ/mol,对应的燃烧产物为二氧化碳气体,故无法计算2C(s)+O2(g)=2CO(g)反应的ΔH,故D错误;
故选:B。
3.B
【解析】电解1L含有0.4molCu(NO3)2和0.4molKCl的混合溶液时,阴极的反应式为Cu2++2e-=Cu,阳极的反应式依次为2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,结合两极转移电子数目相等分析解答。
【详解】电解1L含有0.4molCu(NO3)2和0.4molKCl的混合溶液时,阴极的反应式为Cu2++2e-=Cu,根据析出0.3molCu可知,阴极得到0.6mol电子;阳极的反应式依次为2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,氯离子完全析出时,生成n(Cl2)=0.2mol,转移电子0.4mol,
则生成氧气转移电子0.2mol,生成氧气0.05mol,所以阳极共生成(0.2+0.05)mol=0.25mol气体,在标准状况下,气体的体积=0.25mol×22.4L/mol=5.6L,故选B。
【点睛】明确阳极上析出气体的成分再结合转移电子相等是解答本题的关键。解答本题要注意阳极上先发生2Cl--2e-=Cl2↑,再发生4OH--4e-=O2↑+2H2O。
4.C
【分析】根据燃烧热定义:1mol纯物质完全燃烧生成稳定氧化物进行判断;
【详解】A.氢气燃烧生成稳定的氧化物水应该是液态,故A不正确;
B.碳燃烧生成稳定的氧化物应是二氧化碳,故B不正确;
C.硫燃烧生成稳定的氧化物二氧化硫,故C正确;
D.硫化氢燃烧生成稳定的氧化物,故应该生成二氧化硫,故D不正确;
故选答案C;
【点睛】此题考查燃烧热的热化学方程式判断,注意稳定氧化物的判断。
5.C
【分析】由电池装置图可知,a极I2Br-生成I-,则发生还原反应,应为原电池的正极,b极Zn失电子生成Zn2+,发生氧化反应,应为原电池的负极,充电时,a为阳极,b为阴极,以此解答该题。
【详解】A.充电时,a为阳极,接外电源正极,故A正确;
B.放电时,b极Zn失电子生成Zn2+,发生氧化反应,电极反应为Zn-2e-═Zn2+,故B正确;
C.放电时,负极电极反应为Zn-2e-═Zn2+,每消耗0.65g锌,即生成0.01molZn2+,正极反应I2Br-+2e-=2I-+Br-,溶液中离子总数增加0.03NA,故C错误。
D.充电时,a为阳极发生氧化反应,电极方程式2I-+Br--2e-=I2Br-,故D正确;
故选:C。
6.C
【详解】A.根据图示可知,N2(g)+CO2(g)=N2O(g)+CO(g) ΔH,N2O(g)=O(g)+N2(g) ΔH1,O(g)+Fe+(s)=FeO+(s) ΔH2,FeO+(s)+CO(g)= Fe+(s)+ CO2(g) ΔH3,根据盖斯定律可知,第一个反应=后面三个反应之和的逆反应, H=-( H 1+ H 2+ H 3 ),A正确;
B.从图1中可知,Fe+为反应的催化剂,可降低反应的活化能,B正确;
C.从图2中可知,Fe+(s)+ N2O(g)= FeO+(s)+ N2(g) ΔH<0,ΔH=(ΔH1+ΔH2),只能说明(ΔH1+ΔH2)<0,不能说明 H 1 和 H 2 均小于0,C错误;
D.ΔH=生成物总能量-反应物总能量,Fe+(s)+ N2O(g)= FeO+(s)+ N2(g) ΔH<0,D正确;
故答案选C。
7.C
【详解】A.所有的燃烧反应都属于放热反应,因此,A项错误;
B.铝热反应是一个放热反应,铝比铁还原性强,更活泼,铝和氧气燃烧放出的热量多,,B项错误;
C.根据盖斯定律可知,,C项正确;
D.根据盖斯定律可知,,D项错误;
答案选C。
8.B
【详解】A.放电时为原电池,正极得电子发生还原反应,Li-e-=Li+为负极反应,A错误;
B.充电时为电解池,电解池中阳离子向阴极移动,阴极即为放电时的负极,B正确;
C.放电过程中,正极反应为Li1-xMnO4+xe-+xLi+=LiMnO4,所以正极材料质量增加,C错误;
D.放电时,电池上标注有“+”的电极得电子发生还原反应,则充电时电池上标注有“+”的电极失电子发生氧化反应,为阳极,与外接电源的正极相连,D错误;
综上所述答案为B。
9.B
【详解】A.由图知,N极区生成H2,N极作阴极,故b为直流电源的负极,A项正确;
B.工作时,阳极区的反应为6Cl--6e-=3Cl2↑、3Cl2+CO(NH2)2+H2O=6Cl-+6H++CO2+N2,因消耗水而使废水中NaCl的浓度增大,B项错误;
C.工作时,H+由M极区通过质子交换膜移向N极区,C项正确;
D.由阳极区发生的反应知,若导线中通过6mol电子,理论上生成1 mol N2,D项正确;
故答案选B。
10.C
【详解】A.热化学方程式中,H2O呈气态而不是液态,则△H= -1367.0 kJ/mol不表示燃烧热,A不正确;
B.反应2NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + 2H2O(l)表示生成2molH2O(l)的热化学方程式,则△H= -114.6kJ/mol不表示中和热,B不正确;
C.反应S(s) + O2(g) = SO2(g)标明了所有物质的状态,则△H= -269.8kJ/mol表示反应热,C正确;
D.反应2NO2=O2+2NO中,所有物质的状态都未标明,则△H= +116.2kJ/mol不表示反应热,D不正确;
故选C。
11.D
【详解】A.金属在潮湿的空气中是吸氧腐蚀,实质是:M+nH2O+O2=M(OH)2n,A错误;
B.金属腐蚀的实质是:M_ne-=Mn+,化学腐蚀则电子直接转移给氧化剂,电化学腐蚀则电子转移到另一电极后与氧化剂结合,B错误;
C.较活泼的金属在酸性条件下能发生析氢腐蚀,有些不活泼的金属在酸性条件下不能发生析氢腐蚀,发生的是吸氧腐蚀,C错误;
D.在潮湿的中性环境中,金属的腐蚀主要是吸氧腐蚀,D正确;
故选D。
12. a 4.48L AB b 24
【详解】(1)若电极a为Zn,电极b为Cu,电解质溶液为稀硫酸,则电极a是负极,电极b是正极,该装置工作时,向a极(填a或b)移动,b电极上的电极反应式是,导线中转移了0.4mol电子,则产生的气体在标况下的体积为0.4mol÷2×22.4L/mol=4.48L,如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,加入的物质应该降低氢离子的浓度,又不能消耗氢离子,则符合题意的有AB,
故选:AB;
(2)若电极a为Mg,电极b为Al,电解质溶液为氢氧化钠溶液,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,铝元素的化合价升高铝电极作负极,则该原电池工作时,电子从b极流出,负极电极反应式是 ,正极反应式是,一段时间后,若反应转移3NA个电子,负极溶解27g铝,正极析出3g氢气,则理论上的电解质溶液质量变化是27g-3g=24g。
13. C Fe 4OH--4e-===2H2O+O2↑ 5Cl2+I2+6H2O===10HCl+2HIO3
【详解】(1)①甲池为原电池装置,Fe为负极,电极反应为Fe-2e-=Fe2+,C为正极,发生还原反应,电极反应式为Cu2++2e-=Cu;②乙装置为电解装置,根据电子移动的方向可知C为阳极,Fe为阴极,阳极反应为4OH--4e-=O2↑+2H2O,阴极反应为Cu2++2e-=Cu,所以甲池中的碳(C )和乙池中的铁(Fe)有红色物质析出;②在乙池中阳极的电极反应式是4OH--4e-=O2↑+2H2O,故答案为4OH--4e-=O2↑+2H2O;
(2)①氯化钠溶液中存在的离子是:氯离子、氢氧根离子、钠离子、氢离子,氯离子的放电能力大于氢氧根离子,氢离子的放电能力大于钠离子,所以该反应的生成物是氯气、氢气、氢氧化钠,总反应式为2Cl-+2H2O2OH-+H2↑+Cl2↑;②过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl。
14.(1) N 2H++2e-=H2↑ 外接电源的阴极保护法
(2) M 牺牲阳极的阴极保护法
【分析】根据装置图分析可知,当开关K连接在M处时,装置为原电池;当开关K连接在N处时,装置为电解池,以此分析;
【详解】(1)若 X 为铜,由于铁比铜活泼,为减缓铁的腐蚀,应使铁为电解池的阴极,故开关 K 应连接N处,则铁作阴极发生反应2H++2e-=H2↑,该种防护方法称为外加电源的阴极保护法;
故答案为:N;2H++2e-=H2↑;外加电源的阴极保护法;
(2)若X为锌,开关K置于M处,为原电池,Zn为负极被腐蚀,铁作正极被保护,正极反应为O2+4e-+H2O=4OH-,该电化学防护法称为牺牲阳极的阴极保护法;
故答案为:M;O2+4e-+H2O=4OH-;牺牲阳极的阴极保护法。
15.CH3OCH3-12e-+3H2O=2CO2↑+12H+
【详解】二甲醚燃料电池中,通入二甲醚的一极为电池的负极,据图可知负极产生氢离子,所以负极的电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+。
16.(1) 左侧 不会
(2)0.02
【分析】依据该原电池总反应为2Ag+Cl2=2AgCl可知,银化合价升高、发生氧化反应,氯气中的氯元素化合价降低、发生还原反应,所以银作原电池负极,Pt作原电池的正极,装置左侧即负极电极反应式为Ag-e-+Cl-=AgCl,正极电极反应式为Cl2+2e-=2Cl-,由于阳离子交换膜的作用,负极H+通过交换膜进入正极,形成闭合回路。
(1)
根据以上分析可知,装置左侧即负极电极反应式为Ag-e-+Cl-=AgCl,所以交换膜左侧溶液中有大量白色沉淀生成,又电池总反应为2Ag+Cl2═2AgCl,则用NaCl溶液代替盐酸,电池的总反应不会随之改变,故答案为:左侧;不会;
(2)
负极电极反应式为Ag-e-+Cl-=AgCl,原电池工作时,电路中转移0.01mole-,则负极消耗0.01molCl-,形成闭合回路移向正极的n(H+)=0.01mol,所以负极区即交换膜左侧溶液中约减少0.02mol离子,故答案为:0.02。
17. 正极 2CuSO4+2H2O2Cu+O2↑+2H2SO4 1:1 Ag AgNO3 Ag—e-=Ag+ Y 极颜色变深 氢氧化铁胶粒带正电
【详解】(1)向乙中滴入酚酞试液,在F极附近显红色,说明该极上氢离子放电,所以该电极是阴极,所以E电极是阳极,D电极是阴极,C电极是阳极,G电极是阳极,H电极是阴极,X电极是阳极,Y是阴极,A是电源的正极,B是原电池的负极,电解甲溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,所以电池反应式为:2CuSO4+2H2O2Cu+O2↑+2H2SO4,
故答案为正极;2CuSO4+2H2O2Cu+O2↑+2H2SO4;
(2)电解饱和食盐水的电解原理是2NaCl+2H2O2NaOH+H2↑+Cl2↑,产生的氢气和氯气体积比为1:1,
故答案为1:1;
(3)在铜上镀银时,G作阳极,镀层银作阳极,所以G的材料是银,电解质溶液是硝酸银溶液,G电极的电极反应为Ag—e-=Ag+;
故答案为Ag;AgNO3;Ag—e-=Ag+;
(4)氢氧化铁胶粒带正电荷,应移向电源的负极即向阴极移动,所以电极Y附近红褐色变深,
故答案为电极Y附近红褐色变深;氢氧化铁胶粒带正电。
18.(1)168.0##1.680 ×10-2
(2)5.76 g
【解析】(1)
该反应过程中Co由+2价升高到+5价,1.920 g高钴酸钠的物质的量=,则此时Co失去电子的物质的量=0.01mol×(5-2)=0.03mol,根据得失电子守恒,可知需要氧气的物质的量=,则氧气的体积=0.0075mol×22.4L/mol=0.168L,即168.0或者1.680 ×10-2ml;
(2)
电解过程中存在着电解氯化钴和电解水两个过程,设电解产生的Cl2 xmol,则同时产生的H2 xmol,设产生的O2 ymol,则同时产生H2 2ymol,依据转移电子为0.1mol可知,2x+4y=0.1;产生气体2.016L物质的量=,则x+x+y+2y=0.09mol,解两个方程组成的方程组可知,x=0.03mol,y=0.01mol,则参加反应的氯化钴的物质的量也为0.03mol,根据钴守恒可知,生成的高钴酸钠也是0.03mol,其质量=0.03mol×192g/mol=5.76g。
答案第1页,共2页
答案第1页,共2页
