专题3《微粒间作用力与物质性质》练习题(含解析)2022-2023学年下学期高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题3《微粒间作用力与物质性质》练习题(含解析)2022-2023学年下学期高二化学苏教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 286.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-23 15:36:37 | ||
图片预览




文档简介
专题3《微粒间作用力与物质性质》练习题
一、单选题
1.根据相关递变规律,下列判断不正确的是
A.酸性:H2SiO3Br>Cl>F
C.阴离子配位数:CsCl>NaCl D.沸点:NH3>AsH3>PH3
2.下列说法不正确的是
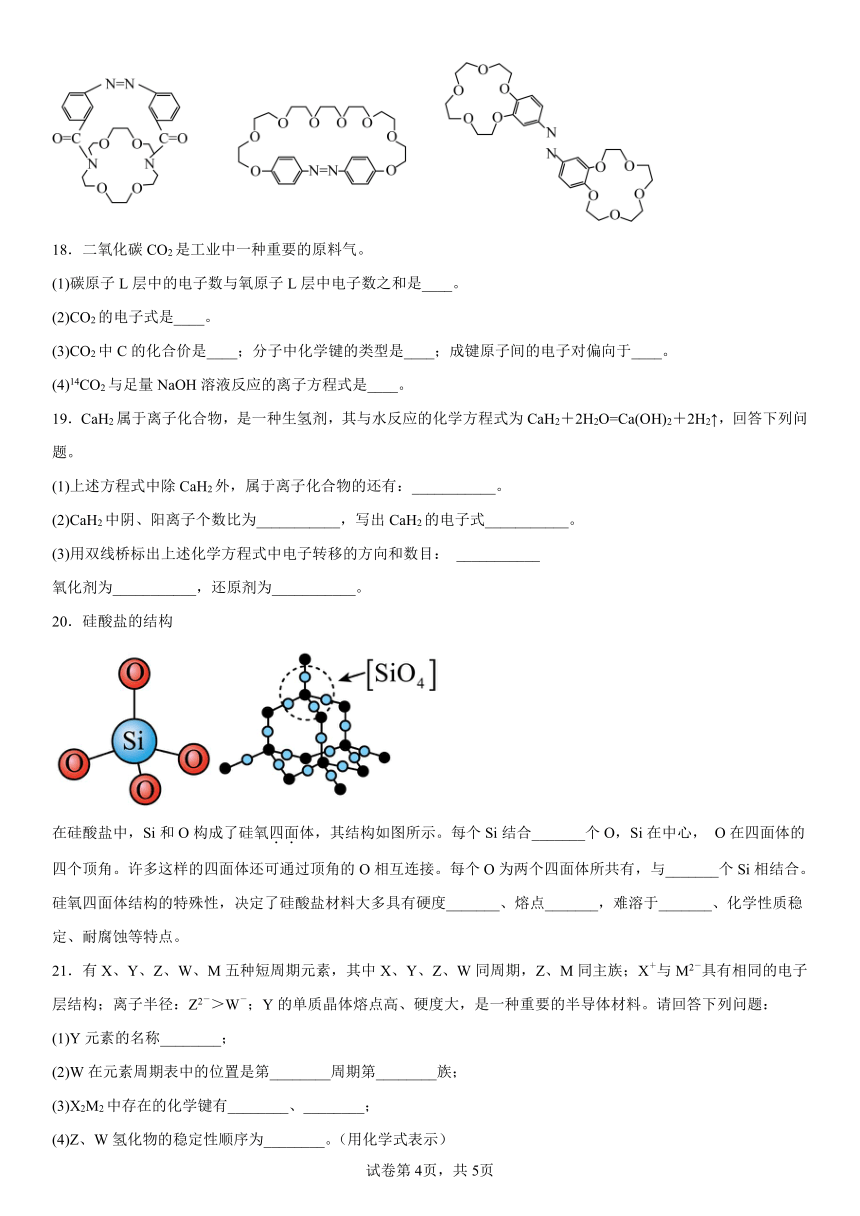
A.CBr4的熔点高于CCl4是因为C-Br键能大于C-Cl键能
B.石英是由硅原子和氧原子构成的共价晶体,加热熔化时需破坏共价键
C.金属键是金属阳离子和“自由电子”间的相互作用,金属键无饱和性和方向性
D.氧化镁的熔点比氧化钙高,原因是镁离子半径小于钙离子半径
3.下列物质中,含有共价键的离子化合物是
A. B. C. D.
4.下列各组物质各自形成的晶体,都属于分子晶体的化合物是
A.H2O、HD、C3H8 B.P2O5、CO2、H3PO4
C.SO2、SiO2、CS2 D.CCl4、(NH4)2S、H2O2
5.关于晶体,下列有关叙述不正确的是
A.利用超分子的分子识别特征,可以分离C60和C70
B.晶体内部离子在微观空间呈周期性有序排列,使晶体具有各向异性
C.可通过X-射线衍射实验区分晶体和非晶体
D.“硅-炭黑晶体管”为一种新型材料,硅、炭黑均属于晶体
6.下列化合物中有非极性共价键的是
A.KOH B.SiO2 C.CaCl2 D.Na2O2
7.下列有关说法正确的是
A.晶格能与离子晶体的物理性质无关
B.晶格能:
C.含有共价键的晶体不一定具有较高的熔、沸点及硬度
D.金属晶体的熔点高于共价晶体
8.二氯化二硫(S2Cl2)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H2O2相似,熔点为193K,沸点为411K,遇水反应,既产生能使品红褪色气体又产生淡黄色沉淀,S2Cl2可由干燥的氯气通入熔融的硫中制得。下列有关说法错误的是
A.S2Cl2晶体中不存在离子键
B.S2Cl2分子中各原子均达到8电子稳定结构
C.S2Cl2在液态下不能导电
D.S2Cl2与水反应后生成的气体通入石蕊试液中,现象是溶液先变红后褪色
9.下列说法正确的是
A.分子式为CCl4、NH3、SiO2的三种物质都是共价晶体
B.FeCl3熔点较低,易升华,易溶于水和乙醇,由此可推测其属于分子晶体
C.HCl分子间作用力强于HBr分子间作用力,因而HCl的热稳定性强于HBr
D.相对原子质量:Li<Na<K<Rb,因而熔点:Li<Na<K<Rb
10.在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是
A.、、的沸点依次升高
B.、、熔点依次升高
C.、、、的熔点依次降低
D.金刚石、碳化硅、晶体硅的熔点依次降低
11.某汽车安全气囊的气体发生剂主要为、、、。当汽车发生碰撞时,分解产生大量使气囊迅速膨胀,从而起到保护作用。下列说法错误的是
A.的电子式为:
B.中既含有离子键又含有共价键
C.基态Fe的核外价电子轨道表示式为
D.水溶液中存在
12.一种含铜氧化物的晶胞结构如图所示。下列说法错误的是
A.含铜氧化物的化学式为Cu2O
B.晶胞中铜原子组成的是正四面体
C.晶胞中4个Cu原子形成的正四面体的体积占晶胞体积的
D.O原子周围等距且最近的O原子数为8
13.下列晶体性质的比较正确的是
A.熔点:金刚石>晶体硅>晶体锗>硫
B.熔点:
C.沸点:
D.硬度:金刚石>白磷>冰>水晶
14.下列性质比较中不正确的是
A.还原性: B.熔点:
C.碱性: D.氧化性:
15.下列有关说法正确的是
A.晶格能与离子晶体的物理性质无关
B.金属晶体的熔点高于原子晶体
C.只含有共价键的晶体不一定具有较高的熔、沸点及硬度
D.晶格能:
二、填空题
16.列表总结液晶、纳米材料、超分子和等离子体的相关内容
聚集状态 宏观或微观特征及性质 举例和用途
液晶 ________ ________
纳米材料 ________ ________
超分子 ________ ________
等离子体 ________ ________
17.不同尺寸的冠醚可以装载不同大小的金属离子,偶氮苯在紫外光与可见光的作用下会发生顺式与反式结构的转变。如下分子的结构中都包含冠醚和偶氮苯片段,请你想象这些分子具有怎样的性质特点、可能会有怎样的应用________。
18.二氧化碳CO2是工业中一种重要的原料气。
(1)碳原子L层中的电子数与氧原子L层中电子数之和是____。
(2)CO2的电子式是____。
(3)CO2中C的化合价是____;分子中化学键的类型是____;成键原子间的电子对偏向于____。
(4)14CO2与足量NaOH溶液反应的离子方程式是____。
19.CaH2属于离子化合物,是一种生氢剂,其与水反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,回答下列问题。
(1)上述方程式中除CaH2外,属于离子化合物的还有:___________。
(2)CaH2中阴、阳离子个数比为___________,写出CaH2的电子式___________。
(3)用双线桥标出上述化学方程式中电子转移的方向和数目: ___________
氧化剂为___________,还原剂为___________。
20.硅酸盐的结构
在硅酸盐中,Si和O构成了硅氧四面体,其结构如图所示。每个Si结合_______个O,Si在中心, O在四面体的四个顶角。许多这样的四面体还可通过顶角的O相互连接。每个O为两个四面体所共有,与_______个Si相结合。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度_______、熔点_______,难溶于_______、化学性质稳定、耐腐蚀等特点。
21.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。请回答下列问题:
(1)Y元素的名称________;
(2)W在元素周期表中的位置是第________周期第________族;
(3)X2M2中存在的化学键有________、________;
(4)Z、W氢化物的稳定性顺序为________。(用化学式表示)
22.过氧化氢(H2O2)又叫双氧水,其水溶液可用于制备工业上的漂白剂、特殊环境里燃料燃烧的助燃剂、医疗上的消毒剂、实验室里的制氧剂等。过氧化钠(Na2O2)可用于制备工业上的漂白剂、实验室里的制氧剂、呼吸面具或潜水艇中的制氧剂等。过氧原子团“O2”由2个氧原子共用1对电子形成。
(1)分别写出H2O2、Na2O2的电子式:___________、___________。
(2)①Na2O、Na2O2中化学键的不同点是___________。
②H2O2的化合物类型是___________化合物(填“共价”或“离子”)。
(3)分别写出H2O2、Na2O2作供氧剂的化学方程式:
H2O2:___________。
Na2O2:___________。
(4)H2O2与Na2O2相比,化学键更稳定的是___________(写物质的名称),主要根据是___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.非金属性越强,其最高价氧化物对应水化物的酸性越强,Si、P、S属于同周期,非金属性逐渐增强,因此酸性强弱顺序是H2SiO3B.同主族,从上到下,电负性逐渐减弱,电负性大小顺序是IC.CsCl中Cl-的配位数为8,NaCl中Cl-的配位数为6,故C说法正确;
D.N、As、P属于同主族,氨气分子间存在氢键,沸点最高,AsH3、PH3属于分子晶体,且不存在分子间氢键,相对分子质量越大,沸点越高,沸点顺序是NH3>AsH3>PH3,故D说法正确;
答案为B。
2.A
【详解】A.CBr4的熔点高于CCl4是因为二者都属于分子晶体,分子间作用力随物质的相对分子质量的增大而增大。分子间作用力越大,克服分子间作用力使物质熔化需消耗的能量就越高,物质的熔沸点就越高,而与分子内的化学键的键能大小无关,A错误;
B.石英是由硅原子和氧原子构成的共价晶体,加热熔化时需破坏Si-O共价键,B正确;
C.金属键是金属阳离子和“自由电子”间的相互作用,自由电子在金属中自由移动,为整个金属所共有,因此金属键无饱和性和方向性,C正确;
D.氧化镁的熔点比氧化钙高,是由于二者都属于离子晶体,离子之间以离子键结合而成,镁离子半径小于钙离子半径,导致MgO中的离子键的键能比CaO更大,断裂消耗的能量更多,因此MgO的熔点更高,D正确;
故合理选项是A。
3.B
【详解】A.CO2属于共价化合物,只含有共价键,没有离子键,A错误;
B.NaOH是离子化合物,含有离子键、共价键,B正确;
C.只含有共价键,为单质,C错误;
D.属于离子化合物,只含有离子键,故D错误;
答案为:B。
4.B
【详解】A.HD是氢气分子,属于单质,不是化合物,故A错误;
B.P2O5、CO2、H3PO4均属于分子晶体,且属于化合物,故B 正确;
C.SO2、CS2均属于分子晶体,SiO2不属于分子晶体,属于共价晶体,故C错误;
D.CCl4、H2O2属于分子晶体,且是化合物,(NH4)2S是离子化合物,不是分子晶体,故D错误;
故选B。
5.D
【详解】A.将C60和C70的混合物,加入一种空腔大小适合C60的杯酚中,杯酚像个碗似的、把C60装起来,不能装下C70,加入甲苯溶剂,甲苯将未装入碗里的C70溶解了,过滤后分离C70,再向不容物中加入氯仿,氯仿溶解杯酚而将不溶解的C60释放出来并沉淀——利用超分子的分子识别特征,利用杯酚、可以分离C60和C70,A正确;
B. 晶体具有自范性,晶体内部离子在微观空间呈周期性有序排列,使晶体具有各向异性,B正确;
C. 可通过X-射线衍射实验区分晶体和非晶体,例如:石英玻璃为非晶体,水晶的粉末是晶体,用X射线衍射摄取石英玻璃和水晶的粉末得到的图谱是不同的,C正确;
D.炭黑属于非晶体,D不正确;
答案选D。
6.D
【分析】两个相同原子形成的共价键为非极性键。
【详解】A. KOH中含有H-O极性键,故A不选;
B. SiO2中含有Si-O极性键,故B不选;
C. CaCl2中不含共价键,故C不选;
D. Na2O2中含有O-O非极性键,故D选;
故选D。
7.C
【详解】A.晶格能影响离子晶体的熔、沸点,A错误:
B.离子半径:,离子晶体中离子半径越小,所带电荷数越多,晶格能越大,则晶格能大小顺序为,B错误:
C.含有共价键的晶体可能为分子晶体、离子晶体或共价晶体,若为分子晶体,则不具有较高的熔、沸点和硬度,C正确;
D.金属晶体的熔点不一定高于共价晶体,如的熔点远低于金刚石的熔点,D错误;
故选C。
8.D
【详解】A.S2Cl2晶体熔沸点较低,应为分子晶体,S与S,S与Cl之间以共价键结合,则一定不存在离子键,故A正确;
B.S2Cl2的电子式为 ,分子中各原子均达到8电子稳定结构,故B正确;
C.S2Cl2为分子晶体,在液态下不能电离出自由移动的离子,不能导电,故C正确;
D.与水发生2S2Cl2+2H2O=SO2↑+3S↓+4HCl,二氧化硫不能漂白指示剂,因此气体通入石蕊试液中,溶液变红不褪色,故D错误。
故选D。
9.B
【详解】A.CCl4、NH3为分子晶体,SiO2是共价晶体,SiO2不是分子式,A错误;
B.离子键远远强于分子间作用力,导致分子晶体熔沸点往往较低,离子晶体熔沸点往往较高,FeCl3熔点较低,易升华,易溶于水和乙醇,由此可推测其属于分子晶体,B正确;
C.HCl分子间作用力强于HBr分子间作用力,因而HCl的熔沸点比HBr高,HCl、HBr的稳定性与分子间作用力无关,与共价键强弱有关,C错误;
D.碱金属是金属晶体,金属晶体内存在金属正离子和自由电子之间强烈的相互作用,即金属键,阳离子所带电荷数越多,半径越小,金属键越强,熔沸点越高,故熔点:Li>Na>K>Rb,D错误;
答案选B。
10.A
【详解】A.新戊烷、异戊烷和正戊烷互为同分异构体,分子中支链数目越多,分子间作用力越小,沸点越低,则新戊烷、异戊烷和正戊烷的沸点依次升高与键能无关,故A符合题意;
B.金属晶体中金属键越强,熔点越高,钠、镁、铝都属于金属晶体,晶体中阳离子的离子半径依次减小、电荷数依次增大,金属键依次增强,熔点依次升高,则钠、镁、铝的熔点依次升高与键能有关,故B不符合题意;
C.离子晶体中离子键越强,熔点越高,氟化钠、氯化钠、碘化钠都是离子晶体,晶体中卤素离子的离子半径依次增大,离子键依次减弱,熔点依次降低,则氟化钠、氯化钠、碘化钠的熔点依次降低与键能有关,故C不符合题意;
D.原子晶体中共价键越强,熔点越高,金刚石、碳化硅、晶体硅都是原子晶体,晶体中C—C键、C—Si键、Si—Si键的键长依次增大、键能依次减小,共价键依次减弱,熔点依次降低,则金刚石、碳化硅、晶体硅的熔点依次降低与键能有关,故D不符合题意;
故选A。
11.D
【详解】A.氮气分子中的氮原子之间共用3对电子对,其电子对为:,A正确;
B.属于离子化合物,由钠离子与碳酸氢根离子构成,含有离子键,碳酸氢根原子团内部含共价键,B正确;
C.基态Fe的原子序数为26,根据核外电子排布规律可知,其价电子排布式为3d64s2,轨道表示式为:,C正确;
D.为强酸,所以为强酸强碱盐,在水溶液中不会发生水解,D错误;
故选D。
12.C
【详解】A.结合晶胞结构图,利用均摊法,可知晶胞中Cu的个数为4,而O位于体心和顶点,个数为,即化学式为, A正确,不符合题意;
B.观察晶胞图可看出4个铜分别位于4条体对角线一半的中点,组成正四面体, B正确,不符合题意;
C.晶胞中4个Cu原子形成的正四面体的体积小于晶胞体积的,C错误,符合题意;
D.根据晶胞图可看出1个氧原子在中心,距离最近的氧原子在顶点上,共8个, D正确,不符合题意;
故合理选项为C。
13.A
【详解】A.金刚石、晶体硅和晶体锗都是共价晶体,硫是分子晶体,原子半径:,共价键的键能:C—C>Si—Si>Ge—Ge,熔点:金刚石>晶体硅>晶体锗>硫,A项正确;
B.、、和是组成和结构相似的分子晶体,相对分子质量:,故熔点:,故B不正确;
C.、和分子间都存在氢键,分子之间的氢键作用最强,分子之间的氢键作用最弱,分子之间只存在范德华力,故沸点:,故C不正确;
D.白磷和冰是分子晶体,硬度小,金刚石和水晶是共价晶体,硬度大,D项不正确;
答案选A。
14.A
【详解】A.非金属性越强,对应离子的还原性越弱;因非金属性F>Cl>Br,则还原性F - <Cl - <Br - ,故A错误;
B.Al2O3是离子化合物熔点比较高,AlCl3和HCl都是分子晶体,AlCl3是固体,分子量大,范德华力大,熔沸点比HCl高,熔点:,故B正确;
C.金属性越强,最高价氧化物对应的水化物的碱性越强;因金属性K>Ca>Mg,则最高价氧化物对应的水化物的碱性KOH>Ca(OH)2 >Mg(OH)2 ,故C正确;
D.同种金属,价态越高氧化性越强,金属性越弱,离子的氧化性越强,所以氧化性为:,故D正确;
故答案为A。
15.C
【详解】A.晶格能可以衡量离子键的强弱,与离子晶体的物理性质如熔沸点有关,故A错误;
B.金属晶体的熔点有的很低有的很高,如汞常温下为液态,而原子晶体的熔点通常很高,故B错误;
C.只含有共价键的晶体可能为分子晶体,如二氧化碳晶体,不一定具有较高的熔、沸点及硬度,故C正确;
D.半径:Ba2+>Mg2+,则晶格能:,故D错误;
故选:C。
16. 像液体一样可以流动,又具有某些晶体结构特征,存在或撤去电场的两种不同条件下,材料的旋光性能发生变化 液晶显示屏,用作电子液晶表、电脑显示屏等 基本单元尺度范围为1~100nm,会出现奇异的性质,优点有:除味、杀菌、韧性强、延长老化时间等 纳米材料在力学、磁学、电学、热学、光学和生命科学都有广泛的应用 两个或者多个分子相互“组合”在一起形成具有特定结构和功能的聚集体,通过非共价键结合 合成“分子钳”,通过超分子 子实现分子识别和操作,应用生命科学领域 包含大量正负带电粒子、而又不出现净空间电荷的电离气体其中正负电荷密度相等,整体上呈现电中性 等离子体冶炼、等离子体喷涂、等离子体焊接等
【详解】液晶:像液体一样可以流动,又具有某些晶体结构特征,存在或撤去电场的两种不同条件下,材料的旋光性能发生变化; 液晶显示屏,用作电子液晶表、电脑显示屏等。
纳米材料:基本单元尺度范围为1~100nm,会出现奇异的性质,优点有:除味、杀菌、韧性强、延长老化时间等;用纳米材料制作的衣物自洁性好;纳米材料在力学、磁学、电学、热学、光学和生命科学都有广泛的应用;
超分子:两个或者多个分子相互“组合”在一起形成具有特定结构和功能的聚集体,通过非共价键结合;合成“分子钳”,通过超分子 子实现分子识别和操作,应用生命科学领域;
等离子体:包含大量正负带电粒子、而又不出现净空间电荷的电离气体其中正负电荷密度相等,整体上呈现电中性;等离子体冶炼,用于冶炼用普通方法难于冶炼的材料,例如高熔点的锆、钛、钽、铌、钒、钨等金属;等离子体喷涂:许多设备的部件应能耐磨耐腐蚀、抗高温,为此需要在其表面喷涂一层具有特殊性能的材料;等离子体焊接:可用以焊接钢、合金钢、铝。
17.冠醚与试剂中正离子络合,使该正离子可溶在有机溶剂中,而与它相对应的负离子也随同进入有机溶剂内,冠醚不与负离子络合,使游离或裸露的负离子反应活性很高,能迅速反应
【详解】冠醚最大的特点就是能与正离子,尤其是与碱金属离子络合,并且随环的大小不同而与不同的金属离子络合。冠醚的这种性质在合成上极为有用,使许多在传统条件下难以反应甚至不发生的反应能顺利地进行。冠醚与试剂中正离子络合,使该正离子可溶在有机溶剂中,而与它相对应的负离子也随同进入有机溶剂内,冠醚不与负离子络合,使游离或裸露的负离子反应活性很高,能迅速反应。在此过程中,冠醚把试剂带入有机溶剂中,称为相转移剂或相转移催化剂,这样发生的反应称为相转移催化反应。这类反应速率快、条件简单、操作方便、产率高。
18.(1)10
(2)
(3) +4 极性共价键 O
(4)14CO2+2OH-=14CO+H2O
【详解】(1)碳原子L层中的电子数是4,氧原子L层中电子数是6,碳原子L层中的电子数与氧原子L层中电子数之和是10;
(2)CO2是共价化合物,分子中含有2个碳氧双键,电子式是;
(3)CO2中O元素的化合价为-2,根据化合价代数和等于0,C的化合价是+4;分子中化学键的类型是极性共价键;O显负价,可知成键原子间的电子对偏向于O原子;
(4)14CO2与足量NaOH溶液反应生成碳酸钠和水,反应的离子方程式是14CO2+2OH-=14CO+H2O;
19.(1)Ca(OH)2
(2) 2∶1 [H:]-Ca2+[:H]-
(3) H2O CaH2
【解析】(1)
上述方程式中属于离子化合物的有CaH2和Ca(OH)2。
(2)
CaH2阴离子是氢负离子,阳离子是钙离子,故阴、阳离子个数比为2∶1,CaH2有一个钙离子和两个氢负离子组成的离子化合物,其电子式为[H:]-Ca2+[:H]-。
(3)
反应式CaH2+2H2O=Ca(OH)2+2H2↑为氧化还原反应,反应物CaH2中氢负离子失去电子生成氢气,充当还原剂;H2O中的+1价氢得电子变成氢气,做氧化剂,用双线桥表示为,氧化剂为H2O,还原剂是CaH2。
20. 4 2 高(大) 高 水
【分析】硅原子最外层只有4个电子,离8电子稳定结构还差4个,氧原子最外层有6个电子,离8电子稳定结构还差2个,则每个Si结合4个O,每个O与2个Si相结合,由图可知,硅酸盐中硅氧四面体形成了空间网状结构。
【详解】在硅酸盐中,Si和O构成了硅氧四面体,每个Si结合4个O,Si在中心, O在四面体的四个顶角。许多这样的四面体还可通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高(大)、熔点高,难溶于水、化学性质稳定、耐腐蚀等特点。
21. 硅 三 ⅦA 离子键 共价键 HCl>H2S
【分析】Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,则Y是Si元素,又因为X、Y、Z、W同周期,所以X、Y、Z、W属于第三周期,由离子半径:Z2->W-、X+与M2-具有相同的电子层结构,可知X、Z、W分别为Na、S、Cl元素,又因为Z、M同主族且X、Y、Z、W、M均为短周期元素,则M为第二周期的O元素。
【详解】(1)Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,则Y是Si元素,元素名称为:硅。
(2)W为Cl元素,在元素周期表中的位置为:第三周期第ⅦA。
(3)X为Na元素,M为O元素,所以X2M2为Na2O2,Na2O2中Na+与O22-之间存在离子键,O22-中两个O原子间存在共价键,故Na2O2中存在的化学键有离子键和共价键。
(4)Z为S,W为Cl,非金属性W(Cl)>Z(S),元素的非金属性越强,对应的氢化物越稳定,所以氢化物的稳定性顺序为:HCl>H2S。
【点睛】本题考查原子结构与元素周期律知识,侧重于学生分析能力的考查,首先运用元素周期表工具,结合同周期、同主族规律,位、构、性关系推断出X、Y、Z、W、M分别是什么元素,然后结合元素化合物知识进一步解答,注意本题分析的要点或关键词为:短周期元素、同周期、同主族、相同的电子层结构、离子半径大小、单质晶体熔点硬度、半导体材料等,找到突破口是解答本题的关键。
22.(1)
(2) Na2O中只含离子键,Na2O2中既含离子键又含共价键 共价
(3) 2H2O2=2H2O+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
(4) 过氧化钠 H2O2受热易分解
【分析】根据物质所含元素种类判断易形成的化学键,判断离子键和共价键,通过键的类型书写电子式;根据物质所含化学键的类型判断化合物类型,只含有共价键的物质属于共价化合物,含有离子键的物质称为离子化合物;对于物质的稳定性,利用加热条件下是否发生分解进行判断。
(1)
双氧水是共价化合物,根据最外层电子和8电子的稳定结构书写双氧水的电子式为:;过氧化钠属于离子化合物,根据得失电子及8电子的稳定情况书写电子式为:;
(2)
Na2O、Na2O2中化学键的不同点是Na2O中只含离子键,Na2O2中既含离子键又含共价键;H2O2的化合物类型是共价化合物物;
(3)
双氧水和过氧化钠中氧的化合价都为-1价,作氧化剂时化合价降低,常见的反应有:2H2O2=2H2O+O2↑、2Na2O2+2CO2=2Na2CO3+O2;
(4)
根据H2O2与Na2O2的热稳定性,即在自然条件下分解的性质,判断更稳定的是过氧化钠,其主要依据是H2O2受热易分解。
【点睛】化学键根据元素的类型及8电子的稳定情况判断成键特点,根据成键特点书写电子式,考查内容比较基础,对于稳定性利用加热条件下是否分解,及与空气中成分反应进行判断。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.根据相关递变规律,下列判断不正确的是
A.酸性:H2SiO3
C.阴离子配位数:CsCl>NaCl D.沸点:NH3>AsH3>PH3
2.下列说法不正确的是
A.CBr4的熔点高于CCl4是因为C-Br键能大于C-Cl键能
B.石英是由硅原子和氧原子构成的共价晶体,加热熔化时需破坏共价键
C.金属键是金属阳离子和“自由电子”间的相互作用,金属键无饱和性和方向性
D.氧化镁的熔点比氧化钙高,原因是镁离子半径小于钙离子半径
3.下列物质中,含有共价键的离子化合物是
A. B. C. D.
4.下列各组物质各自形成的晶体,都属于分子晶体的化合物是
A.H2O、HD、C3H8 B.P2O5、CO2、H3PO4
C.SO2、SiO2、CS2 D.CCl4、(NH4)2S、H2O2
5.关于晶体,下列有关叙述不正确的是
A.利用超分子的分子识别特征,可以分离C60和C70
B.晶体内部离子在微观空间呈周期性有序排列,使晶体具有各向异性
C.可通过X-射线衍射实验区分晶体和非晶体
D.“硅-炭黑晶体管”为一种新型材料,硅、炭黑均属于晶体
6.下列化合物中有非极性共价键的是
A.KOH B.SiO2 C.CaCl2 D.Na2O2
7.下列有关说法正确的是
A.晶格能与离子晶体的物理性质无关
B.晶格能:
C.含有共价键的晶体不一定具有较高的熔、沸点及硬度
D.金属晶体的熔点高于共价晶体
8.二氯化二硫(S2Cl2)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H2O2相似,熔点为193K,沸点为411K,遇水反应,既产生能使品红褪色气体又产生淡黄色沉淀,S2Cl2可由干燥的氯气通入熔融的硫中制得。下列有关说法错误的是
A.S2Cl2晶体中不存在离子键
B.S2Cl2分子中各原子均达到8电子稳定结构
C.S2Cl2在液态下不能导电
D.S2Cl2与水反应后生成的气体通入石蕊试液中,现象是溶液先变红后褪色
9.下列说法正确的是
A.分子式为CCl4、NH3、SiO2的三种物质都是共价晶体
B.FeCl3熔点较低,易升华,易溶于水和乙醇,由此可推测其属于分子晶体
C.HCl分子间作用力强于HBr分子间作用力,因而HCl的热稳定性强于HBr
D.相对原子质量:Li<Na<K<Rb,因而熔点:Li<Na<K<Rb
10.在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是
A.、、的沸点依次升高
B.、、熔点依次升高
C.、、、的熔点依次降低
D.金刚石、碳化硅、晶体硅的熔点依次降低
11.某汽车安全气囊的气体发生剂主要为、、、。当汽车发生碰撞时,分解产生大量使气囊迅速膨胀,从而起到保护作用。下列说法错误的是
A.的电子式为:
B.中既含有离子键又含有共价键
C.基态Fe的核外价电子轨道表示式为
D.水溶液中存在
12.一种含铜氧化物的晶胞结构如图所示。下列说法错误的是
A.含铜氧化物的化学式为Cu2O
B.晶胞中铜原子组成的是正四面体
C.晶胞中4个Cu原子形成的正四面体的体积占晶胞体积的
D.O原子周围等距且最近的O原子数为8
13.下列晶体性质的比较正确的是
A.熔点:金刚石>晶体硅>晶体锗>硫
B.熔点:
C.沸点:
D.硬度:金刚石>白磷>冰>水晶
14.下列性质比较中不正确的是
A.还原性: B.熔点:
C.碱性: D.氧化性:
15.下列有关说法正确的是
A.晶格能与离子晶体的物理性质无关
B.金属晶体的熔点高于原子晶体
C.只含有共价键的晶体不一定具有较高的熔、沸点及硬度
D.晶格能:
二、填空题
16.列表总结液晶、纳米材料、超分子和等离子体的相关内容
聚集状态 宏观或微观特征及性质 举例和用途
液晶 ________ ________
纳米材料 ________ ________
超分子 ________ ________
等离子体 ________ ________
17.不同尺寸的冠醚可以装载不同大小的金属离子,偶氮苯在紫外光与可见光的作用下会发生顺式与反式结构的转变。如下分子的结构中都包含冠醚和偶氮苯片段,请你想象这些分子具有怎样的性质特点、可能会有怎样的应用________。
18.二氧化碳CO2是工业中一种重要的原料气。
(1)碳原子L层中的电子数与氧原子L层中电子数之和是____。
(2)CO2的电子式是____。
(3)CO2中C的化合价是____;分子中化学键的类型是____;成键原子间的电子对偏向于____。
(4)14CO2与足量NaOH溶液反应的离子方程式是____。
19.CaH2属于离子化合物,是一种生氢剂,其与水反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,回答下列问题。
(1)上述方程式中除CaH2外,属于离子化合物的还有:___________。
(2)CaH2中阴、阳离子个数比为___________,写出CaH2的电子式___________。
(3)用双线桥标出上述化学方程式中电子转移的方向和数目: ___________
氧化剂为___________,还原剂为___________。
20.硅酸盐的结构
在硅酸盐中,Si和O构成了硅氧四面体,其结构如图所示。每个Si结合_______个O,Si在中心, O在四面体的四个顶角。许多这样的四面体还可通过顶角的O相互连接。每个O为两个四面体所共有,与_______个Si相结合。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度_______、熔点_______,难溶于_______、化学性质稳定、耐腐蚀等特点。
21.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。请回答下列问题:
(1)Y元素的名称________;
(2)W在元素周期表中的位置是第________周期第________族;
(3)X2M2中存在的化学键有________、________;
(4)Z、W氢化物的稳定性顺序为________。(用化学式表示)
22.过氧化氢(H2O2)又叫双氧水,其水溶液可用于制备工业上的漂白剂、特殊环境里燃料燃烧的助燃剂、医疗上的消毒剂、实验室里的制氧剂等。过氧化钠(Na2O2)可用于制备工业上的漂白剂、实验室里的制氧剂、呼吸面具或潜水艇中的制氧剂等。过氧原子团“O2”由2个氧原子共用1对电子形成。
(1)分别写出H2O2、Na2O2的电子式:___________、___________。
(2)①Na2O、Na2O2中化学键的不同点是___________。
②H2O2的化合物类型是___________化合物(填“共价”或“离子”)。
(3)分别写出H2O2、Na2O2作供氧剂的化学方程式:
H2O2:___________。
Na2O2:___________。
(4)H2O2与Na2O2相比,化学键更稳定的是___________(写物质的名称),主要根据是___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.非金属性越强,其最高价氧化物对应水化物的酸性越强,Si、P、S属于同周期,非金属性逐渐增强,因此酸性强弱顺序是H2SiO3
D.N、As、P属于同主族,氨气分子间存在氢键,沸点最高,AsH3、PH3属于分子晶体,且不存在分子间氢键,相对分子质量越大,沸点越高,沸点顺序是NH3>AsH3>PH3,故D说法正确;
答案为B。
2.A
【详解】A.CBr4的熔点高于CCl4是因为二者都属于分子晶体,分子间作用力随物质的相对分子质量的增大而增大。分子间作用力越大,克服分子间作用力使物质熔化需消耗的能量就越高,物质的熔沸点就越高,而与分子内的化学键的键能大小无关,A错误;
B.石英是由硅原子和氧原子构成的共价晶体,加热熔化时需破坏Si-O共价键,B正确;
C.金属键是金属阳离子和“自由电子”间的相互作用,自由电子在金属中自由移动,为整个金属所共有,因此金属键无饱和性和方向性,C正确;
D.氧化镁的熔点比氧化钙高,是由于二者都属于离子晶体,离子之间以离子键结合而成,镁离子半径小于钙离子半径,导致MgO中的离子键的键能比CaO更大,断裂消耗的能量更多,因此MgO的熔点更高,D正确;
故合理选项是A。
3.B
【详解】A.CO2属于共价化合物,只含有共价键,没有离子键,A错误;
B.NaOH是离子化合物,含有离子键、共价键,B正确;
C.只含有共价键,为单质,C错误;
D.属于离子化合物,只含有离子键,故D错误;
答案为:B。
4.B
【详解】A.HD是氢气分子,属于单质,不是化合物,故A错误;
B.P2O5、CO2、H3PO4均属于分子晶体,且属于化合物,故B 正确;
C.SO2、CS2均属于分子晶体,SiO2不属于分子晶体,属于共价晶体,故C错误;
D.CCl4、H2O2属于分子晶体,且是化合物,(NH4)2S是离子化合物,不是分子晶体,故D错误;
故选B。
5.D
【详解】A.将C60和C70的混合物,加入一种空腔大小适合C60的杯酚中,杯酚像个碗似的、把C60装起来,不能装下C70,加入甲苯溶剂,甲苯将未装入碗里的C70溶解了,过滤后分离C70,再向不容物中加入氯仿,氯仿溶解杯酚而将不溶解的C60释放出来并沉淀——利用超分子的分子识别特征,利用杯酚、可以分离C60和C70,A正确;
B. 晶体具有自范性,晶体内部离子在微观空间呈周期性有序排列,使晶体具有各向异性,B正确;
C. 可通过X-射线衍射实验区分晶体和非晶体,例如:石英玻璃为非晶体,水晶的粉末是晶体,用X射线衍射摄取石英玻璃和水晶的粉末得到的图谱是不同的,C正确;
D.炭黑属于非晶体,D不正确;
答案选D。
6.D
【分析】两个相同原子形成的共价键为非极性键。
【详解】A. KOH中含有H-O极性键,故A不选;
B. SiO2中含有Si-O极性键,故B不选;
C. CaCl2中不含共价键,故C不选;
D. Na2O2中含有O-O非极性键,故D选;
故选D。
7.C
【详解】A.晶格能影响离子晶体的熔、沸点,A错误:
B.离子半径:,离子晶体中离子半径越小,所带电荷数越多,晶格能越大,则晶格能大小顺序为,B错误:
C.含有共价键的晶体可能为分子晶体、离子晶体或共价晶体,若为分子晶体,则不具有较高的熔、沸点和硬度,C正确;
D.金属晶体的熔点不一定高于共价晶体,如的熔点远低于金刚石的熔点,D错误;
故选C。
8.D
【详解】A.S2Cl2晶体熔沸点较低,应为分子晶体,S与S,S与Cl之间以共价键结合,则一定不存在离子键,故A正确;
B.S2Cl2的电子式为 ,分子中各原子均达到8电子稳定结构,故B正确;
C.S2Cl2为分子晶体,在液态下不能电离出自由移动的离子,不能导电,故C正确;
D.与水发生2S2Cl2+2H2O=SO2↑+3S↓+4HCl,二氧化硫不能漂白指示剂,因此气体通入石蕊试液中,溶液变红不褪色,故D错误。
故选D。
9.B
【详解】A.CCl4、NH3为分子晶体,SiO2是共价晶体,SiO2不是分子式,A错误;
B.离子键远远强于分子间作用力,导致分子晶体熔沸点往往较低,离子晶体熔沸点往往较高,FeCl3熔点较低,易升华,易溶于水和乙醇,由此可推测其属于分子晶体,B正确;
C.HCl分子间作用力强于HBr分子间作用力,因而HCl的熔沸点比HBr高,HCl、HBr的稳定性与分子间作用力无关,与共价键强弱有关,C错误;
D.碱金属是金属晶体,金属晶体内存在金属正离子和自由电子之间强烈的相互作用,即金属键,阳离子所带电荷数越多,半径越小,金属键越强,熔沸点越高,故熔点:Li>Na>K>Rb,D错误;
答案选B。
10.A
【详解】A.新戊烷、异戊烷和正戊烷互为同分异构体,分子中支链数目越多,分子间作用力越小,沸点越低,则新戊烷、异戊烷和正戊烷的沸点依次升高与键能无关,故A符合题意;
B.金属晶体中金属键越强,熔点越高,钠、镁、铝都属于金属晶体,晶体中阳离子的离子半径依次减小、电荷数依次增大,金属键依次增强,熔点依次升高,则钠、镁、铝的熔点依次升高与键能有关,故B不符合题意;
C.离子晶体中离子键越强,熔点越高,氟化钠、氯化钠、碘化钠都是离子晶体,晶体中卤素离子的离子半径依次增大,离子键依次减弱,熔点依次降低,则氟化钠、氯化钠、碘化钠的熔点依次降低与键能有关,故C不符合题意;
D.原子晶体中共价键越强,熔点越高,金刚石、碳化硅、晶体硅都是原子晶体,晶体中C—C键、C—Si键、Si—Si键的键长依次增大、键能依次减小,共价键依次减弱,熔点依次降低,则金刚石、碳化硅、晶体硅的熔点依次降低与键能有关,故D不符合题意;
故选A。
11.D
【详解】A.氮气分子中的氮原子之间共用3对电子对,其电子对为:,A正确;
B.属于离子化合物,由钠离子与碳酸氢根离子构成,含有离子键,碳酸氢根原子团内部含共价键,B正确;
C.基态Fe的原子序数为26,根据核外电子排布规律可知,其价电子排布式为3d64s2,轨道表示式为:,C正确;
D.为强酸,所以为强酸强碱盐,在水溶液中不会发生水解,D错误;
故选D。
12.C
【详解】A.结合晶胞结构图,利用均摊法,可知晶胞中Cu的个数为4,而O位于体心和顶点,个数为,即化学式为, A正确,不符合题意;
B.观察晶胞图可看出4个铜分别位于4条体对角线一半的中点,组成正四面体, B正确,不符合题意;
C.晶胞中4个Cu原子形成的正四面体的体积小于晶胞体积的,C错误,符合题意;
D.根据晶胞图可看出1个氧原子在中心,距离最近的氧原子在顶点上,共8个, D正确,不符合题意;
故合理选项为C。
13.A
【详解】A.金刚石、晶体硅和晶体锗都是共价晶体,硫是分子晶体,原子半径:,共价键的键能:C—C>Si—Si>Ge—Ge,熔点:金刚石>晶体硅>晶体锗>硫,A项正确;
B.、、和是组成和结构相似的分子晶体,相对分子质量:,故熔点:,故B不正确;
C.、和分子间都存在氢键,分子之间的氢键作用最强,分子之间的氢键作用最弱,分子之间只存在范德华力,故沸点:,故C不正确;
D.白磷和冰是分子晶体,硬度小,金刚石和水晶是共价晶体,硬度大,D项不正确;
答案选A。
14.A
【详解】A.非金属性越强,对应离子的还原性越弱;因非金属性F>Cl>Br,则还原性F - <Cl - <Br - ,故A错误;
B.Al2O3是离子化合物熔点比较高,AlCl3和HCl都是分子晶体,AlCl3是固体,分子量大,范德华力大,熔沸点比HCl高,熔点:,故B正确;
C.金属性越强,最高价氧化物对应的水化物的碱性越强;因金属性K>Ca>Mg,则最高价氧化物对应的水化物的碱性KOH>Ca(OH)2 >Mg(OH)2 ,故C正确;
D.同种金属,价态越高氧化性越强,金属性越弱,离子的氧化性越强,所以氧化性为:,故D正确;
故答案为A。
15.C
【详解】A.晶格能可以衡量离子键的强弱,与离子晶体的物理性质如熔沸点有关,故A错误;
B.金属晶体的熔点有的很低有的很高,如汞常温下为液态,而原子晶体的熔点通常很高,故B错误;
C.只含有共价键的晶体可能为分子晶体,如二氧化碳晶体,不一定具有较高的熔、沸点及硬度,故C正确;
D.半径:Ba2+>Mg2+,则晶格能:,故D错误;
故选:C。
16. 像液体一样可以流动,又具有某些晶体结构特征,存在或撤去电场的两种不同条件下,材料的旋光性能发生变化 液晶显示屏,用作电子液晶表、电脑显示屏等 基本单元尺度范围为1~100nm,会出现奇异的性质,优点有:除味、杀菌、韧性强、延长老化时间等 纳米材料在力学、磁学、电学、热学、光学和生命科学都有广泛的应用 两个或者多个分子相互“组合”在一起形成具有特定结构和功能的聚集体,通过非共价键结合 合成“分子钳”,通过超分子 子实现分子识别和操作,应用生命科学领域 包含大量正负带电粒子、而又不出现净空间电荷的电离气体其中正负电荷密度相等,整体上呈现电中性 等离子体冶炼、等离子体喷涂、等离子体焊接等
【详解】液晶:像液体一样可以流动,又具有某些晶体结构特征,存在或撤去电场的两种不同条件下,材料的旋光性能发生变化; 液晶显示屏,用作电子液晶表、电脑显示屏等。
纳米材料:基本单元尺度范围为1~100nm,会出现奇异的性质,优点有:除味、杀菌、韧性强、延长老化时间等;用纳米材料制作的衣物自洁性好;纳米材料在力学、磁学、电学、热学、光学和生命科学都有广泛的应用;
超分子:两个或者多个分子相互“组合”在一起形成具有特定结构和功能的聚集体,通过非共价键结合;合成“分子钳”,通过超分子 子实现分子识别和操作,应用生命科学领域;
等离子体:包含大量正负带电粒子、而又不出现净空间电荷的电离气体其中正负电荷密度相等,整体上呈现电中性;等离子体冶炼,用于冶炼用普通方法难于冶炼的材料,例如高熔点的锆、钛、钽、铌、钒、钨等金属;等离子体喷涂:许多设备的部件应能耐磨耐腐蚀、抗高温,为此需要在其表面喷涂一层具有特殊性能的材料;等离子体焊接:可用以焊接钢、合金钢、铝。
17.冠醚与试剂中正离子络合,使该正离子可溶在有机溶剂中,而与它相对应的负离子也随同进入有机溶剂内,冠醚不与负离子络合,使游离或裸露的负离子反应活性很高,能迅速反应
【详解】冠醚最大的特点就是能与正离子,尤其是与碱金属离子络合,并且随环的大小不同而与不同的金属离子络合。冠醚的这种性质在合成上极为有用,使许多在传统条件下难以反应甚至不发生的反应能顺利地进行。冠醚与试剂中正离子络合,使该正离子可溶在有机溶剂中,而与它相对应的负离子也随同进入有机溶剂内,冠醚不与负离子络合,使游离或裸露的负离子反应活性很高,能迅速反应。在此过程中,冠醚把试剂带入有机溶剂中,称为相转移剂或相转移催化剂,这样发生的反应称为相转移催化反应。这类反应速率快、条件简单、操作方便、产率高。
18.(1)10
(2)
(3) +4 极性共价键 O
(4)14CO2+2OH-=14CO+H2O
【详解】(1)碳原子L层中的电子数是4,氧原子L层中电子数是6,碳原子L层中的电子数与氧原子L层中电子数之和是10;
(2)CO2是共价化合物,分子中含有2个碳氧双键,电子式是;
(3)CO2中O元素的化合价为-2,根据化合价代数和等于0,C的化合价是+4;分子中化学键的类型是极性共价键;O显负价,可知成键原子间的电子对偏向于O原子;
(4)14CO2与足量NaOH溶液反应生成碳酸钠和水,反应的离子方程式是14CO2+2OH-=14CO+H2O;
19.(1)Ca(OH)2
(2) 2∶1 [H:]-Ca2+[:H]-
(3) H2O CaH2
【解析】(1)
上述方程式中属于离子化合物的有CaH2和Ca(OH)2。
(2)
CaH2阴离子是氢负离子,阳离子是钙离子,故阴、阳离子个数比为2∶1,CaH2有一个钙离子和两个氢负离子组成的离子化合物,其电子式为[H:]-Ca2+[:H]-。
(3)
反应式CaH2+2H2O=Ca(OH)2+2H2↑为氧化还原反应,反应物CaH2中氢负离子失去电子生成氢气,充当还原剂;H2O中的+1价氢得电子变成氢气,做氧化剂,用双线桥表示为,氧化剂为H2O,还原剂是CaH2。
20. 4 2 高(大) 高 水
【分析】硅原子最外层只有4个电子,离8电子稳定结构还差4个,氧原子最外层有6个电子,离8电子稳定结构还差2个,则每个Si结合4个O,每个O与2个Si相结合,由图可知,硅酸盐中硅氧四面体形成了空间网状结构。
【详解】在硅酸盐中,Si和O构成了硅氧四面体,每个Si结合4个O,Si在中心, O在四面体的四个顶角。许多这样的四面体还可通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高(大)、熔点高,难溶于水、化学性质稳定、耐腐蚀等特点。
21. 硅 三 ⅦA 离子键 共价键 HCl>H2S
【分析】Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,则Y是Si元素,又因为X、Y、Z、W同周期,所以X、Y、Z、W属于第三周期,由离子半径:Z2->W-、X+与M2-具有相同的电子层结构,可知X、Z、W分别为Na、S、Cl元素,又因为Z、M同主族且X、Y、Z、W、M均为短周期元素,则M为第二周期的O元素。
【详解】(1)Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,则Y是Si元素,元素名称为:硅。
(2)W为Cl元素,在元素周期表中的位置为:第三周期第ⅦA。
(3)X为Na元素,M为O元素,所以X2M2为Na2O2,Na2O2中Na+与O22-之间存在离子键,O22-中两个O原子间存在共价键,故Na2O2中存在的化学键有离子键和共价键。
(4)Z为S,W为Cl,非金属性W(Cl)>Z(S),元素的非金属性越强,对应的氢化物越稳定,所以氢化物的稳定性顺序为:HCl>H2S。
【点睛】本题考查原子结构与元素周期律知识,侧重于学生分析能力的考查,首先运用元素周期表工具,结合同周期、同主族规律,位、构、性关系推断出X、Y、Z、W、M分别是什么元素,然后结合元素化合物知识进一步解答,注意本题分析的要点或关键词为:短周期元素、同周期、同主族、相同的电子层结构、离子半径大小、单质晶体熔点硬度、半导体材料等,找到突破口是解答本题的关键。
22.(1)
(2) Na2O中只含离子键,Na2O2中既含离子键又含共价键 共价
(3) 2H2O2=2H2O+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
(4) 过氧化钠 H2O2受热易分解
【分析】根据物质所含元素种类判断易形成的化学键,判断离子键和共价键,通过键的类型书写电子式;根据物质所含化学键的类型判断化合物类型,只含有共价键的物质属于共价化合物,含有离子键的物质称为离子化合物;对于物质的稳定性,利用加热条件下是否发生分解进行判断。
(1)
双氧水是共价化合物,根据最外层电子和8电子的稳定结构书写双氧水的电子式为:;过氧化钠属于离子化合物,根据得失电子及8电子的稳定情况书写电子式为:;
(2)
Na2O、Na2O2中化学键的不同点是Na2O中只含离子键,Na2O2中既含离子键又含共价键;H2O2的化合物类型是共价化合物物;
(3)
双氧水和过氧化钠中氧的化合价都为-1价,作氧化剂时化合价降低,常见的反应有:2H2O2=2H2O+O2↑、2Na2O2+2CO2=2Na2CO3+O2;
(4)
根据H2O2与Na2O2的热稳定性,即在自然条件下分解的性质,判断更稳定的是过氧化钠,其主要依据是H2O2受热易分解。
【点睛】化学键根据元素的类型及8电子的稳定情况判断成键特点,根据成键特点书写电子式,考查内容比较基础,对于稳定性利用加热条件下是否分解,及与空气中成分反应进行判断。
答案第1页,共2页
答案第1页,共2页
