专题7氮与社会可持续发展 强化基础练习题(含解析) 2022-2023学年下学期高一化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题7氮与社会可持续发展 强化基础练习题(含解析) 2022-2023学年下学期高一化学苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 611.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-23 18:06:19 | ||
图片预览




文档简介
专题7 氮与社会可持续发展 强化基础练习题
一、单选题
1.C、N、S是重要的非金属元素,下列说法正确的是
A.稀硫酸、稀硝酸与铁反应均属于置换反应
B.实验室用铜和浓硝酸反应制取NO
C.CO2、SO2、NO2都能与H2O反应,且原理相同
D.三种元素均可以和氧元素形成多种氧化物
2.下列化学反应中,与“ 雷雨发庄稼” 无关的是
A.N2+3H22NH3
B.N2+O22NO
C.2NO+O2=2NO2
D.3NO2+H2O=2HNO3+NO
3.由含[Cu(NH3)4]Cl2的蚀刻废液制取[Cu(NH3)4]CO3溶液的流程如图:
下列有关说法不正确的是
A.上述制取流程不涉及氧化还原反应
B.“沉铜”在加热条件下进行,发生反应的离子方程式为[Cu(NH3)4]+2OH-4NH3↑+CuO↓+H2O
C.“滤液”中大量存在的离子有Na+、、Cl-和OH-
D.“浸铜”时温度过高可能导致铜的浸出率下降
4.按照物质的树状分类法和交叉分类法,HNO3应属于
①酸;②氢化物;③氧化物;④含氧酸;⑤难挥发性酸;⑥强氧化性酸;⑦一元酸;⑧化合物;⑨混合物。
A.①②③④⑤⑥⑦⑧ B.①④⑥⑦⑧
C.①⑨ D.①④⑤⑥⑦
5.下列除杂试剂选用不正确的是
物质(括号内为杂质) 除杂试剂
A NO (NO2) H2O、无水CaCl2
B Cl2 (HCl) H2O、浓H2SO4
C NaCl溶液(MgCl2) 适量NaOH溶液、稀HCl,
D FeCl2溶液(FeCl3) Fe粉
A.A B.B C.C D.D
6.铁粉与稀硝酸反应的化学方程式为8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2O。下列有关说法正确的是
A.氧化性:HNO3<Fe3+
B.作氧化剂的HNO3是参与反应的HNO3的10%
C.若铁粉过量,则氧化剂与还原剂的物质的量之比为3∶8
D.在反应后的混合物中滴加少量氢氧化钠溶液,有气体逸出
7.将0.51mol铜与250mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。待产生的气体全部释放后,向溶液中加入300mL5mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀。则下列选项正确的是
A.反应中转移电子1.0mol
B.产生NO2气体0.26mol
C.原HNO3浓度为8.0mol/L
D.原HNO3浓度为6.0mol/L
8.某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g (已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是
A.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B.原混合酸中SO42-物质的量为0.6 mol
C.第二份溶液中最终溶质为FeSO4
D.取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
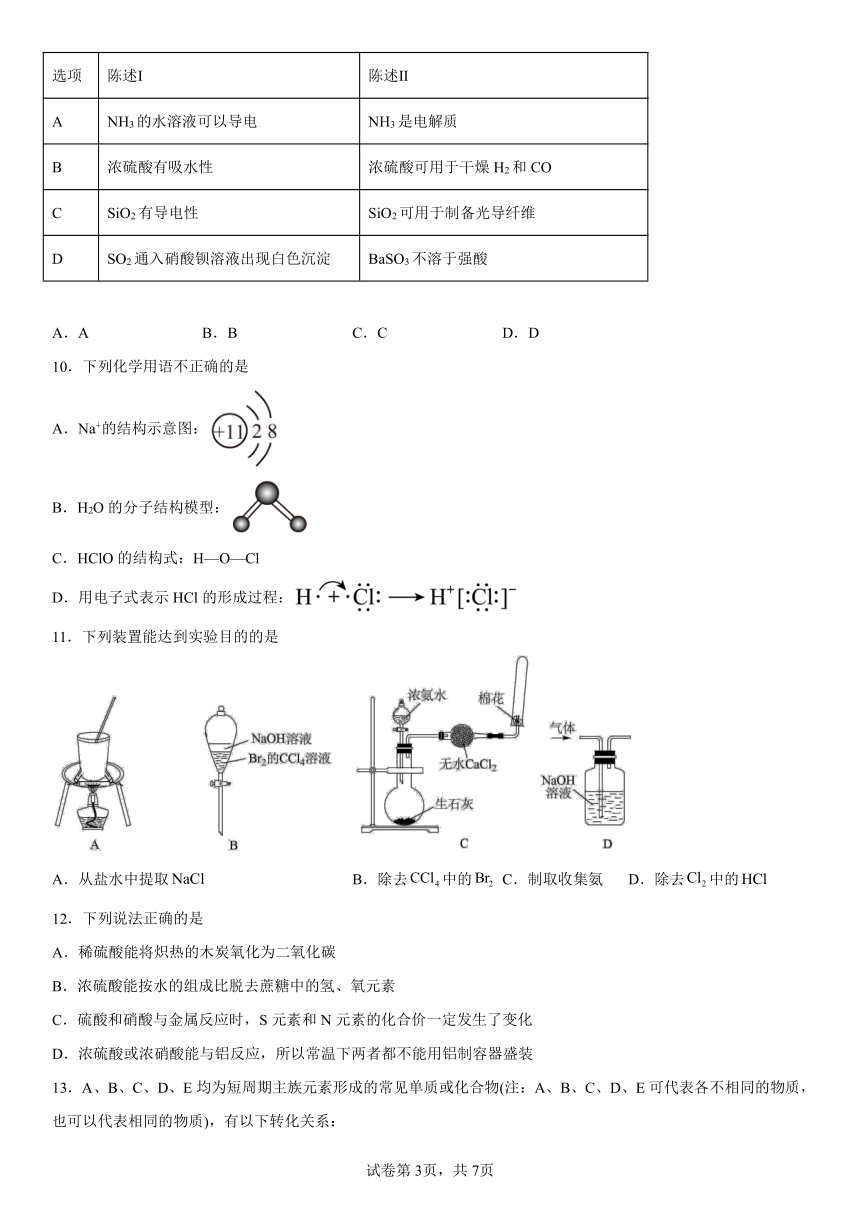
9.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A NH3的水溶液可以导电 NH3是电解质
B 浓硫酸有吸水性 浓硫酸可用于干燥H2和CO
C SiO2有导电性 SiO2可用于制备光导纤维
D SO2通入硝酸钡溶液出现白色沉淀 BaSO3不溶于强酸
A.A B.B C.C D.D
10.下列化学用语不正确的是
A.Na+的结构示意图:
B.H2O的分子结构模型:
C.HClO的结构式:H—O—Cl
D.用电子式表示HCl的形成过程:
11.下列装置能达到实验目的的是
A.从盐水中提取 B.除去中的 C.制取收集氨 D.除去中的
12.下列说法正确的是
A.稀硫酸能将炽热的木炭氧化为二氧化碳
B.浓硫酸能按水的组成比脱去蔗糖中的氢、氧元素
C.硫酸和硝酸与金属反应时,S元素和N元素的化合价一定发生了变化
D.浓硫酸或浓硝酸能与铝反应,所以常温下两者都不能用铝制容器盛装
13.A、B、C、D、E均为短周期主族元素形成的常见单质或化合物(注:A、B、C、D、E可代表各不相同的物质,也可以代表相同的物质),有以下转化关系:
下列说法不正确的是
A.①②③④步中均发生了氧化还原反应
B.A可为金属元素或非金属元素形成的单质
C.Al、Fe均可以在E的浓溶液中发生钝化
D.B、D、E均为共价化合物
14.下列说法不正确的是
A.液氨汽化时吸收大量的热,工业上可用液氨作制冷剂
B.在加压条件下,氯气转化为氯水,可储存于钢瓶中
C.二氧化硫有漂白性,可在食品中添加适量的二氧化硫用于漂白
D.在石膏资源丰富的地方,可用来制硫酸
15.下列关于氮及其化合物的说法不正确的是
A.铵态氮肥应保存在阴凉处,硝态氮肥(硝酸盐)则能够耐高温
B.“雷雨发庄稼”是由于放电条件有利于游离态的氮转化为化合态
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D.工业制硝酸过程中,氨催化氧化放出大量热,能预热新进入设备的氨气和空气,节约能源
二、填空题
16.工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。图中路线a、b、c是工业制备硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电固氮过程中生成硝酸的途径。
(1)写出N2的—种用途:__________。
(2)实验室制取NH3的化学方程式为______。
(3)写出工业制硝酸中c过程中反应的化学方程式:______。
(4)硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸溶液浓度的不同而有变化。浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
①请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____。该反应中发生氧化反应的物质是_____。
②64.0gCu与适量的浓HNO3反应,铜全部溶解后,共收集到1mol NO2和NO的混合气体,反应中消耗HNO3的物质的量是____(填标号)。
A.1.5mol B.2.0mol C.2.5mol D.3.0mol
③实际上HNO3不仅可被还原为NO2或NO,浓度更稀时HNO3还可以被还原为N2O、N2、NH4NO3等。请将3种物质:、和分别填入下面对应的横线上,组成一个未配平的化学方程式并配平其对应的离子方程式。
i.__________
ii._______________。
17.某无色溶液中,已知含有H+、Mg2+、、Al3+各1mol,向该溶液中逐滴加入氢氧化钠溶液,则消耗氢氧化钠溶液体积(x轴)和生成沉淀量(y轴)之间的函数关系用图象表示_______(用尺子作图,标出数量关系)。
18.请按要求书写下列离子方程式:
(1)向溶液中滴入溶液,至沉淀完全,写出反应的离子方程式:_______,在上述溶液中继续滴入溶液,此时离子方程式为_______。
(2)的溶液与的溶液等体积混合:_______。
(3)溶液与烧碱溶液反应,当时:_______。
(4)溶液与溶液反应,当时:_______。
(5)标准状况下,通入的溶液中:_______。
(6)的溶液中加入:_______。
(7)的溶液和的盐酸等体积均匀混合:_______。
19.氮气常用作焊接金属、填充灯泡、保存食品的保护气。(__)
20.NH3与NO2是常见的氮的化合物,研究它们的综合利用有重要意义
(1)NO2产生的环境问题有_______(填一种)
(2)热电厂通常用NH3消除燃煤烟气中NO2,写出该反应化学方程式_______
(3)氨气与氯化氢气体混合的现象是_______,该反应可用于_______
(4)若将少量氨气与过量氯气混合,则生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式_______,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式_______
21.A、B、C、D四种物质之间有下图所示的转化关系。已知A是气体单质,C是红棕色气体。
回答下列问题:
(1)A的电子式:_______ ,C的化学式:_______。
(2)在上图D→B的过程中,D表现出强_______(填“氧化性”或“还原性”)。
(3)写出C→D转化的化学方程式:_______。
22.选择装置,完成实验。
(1)配制100 mL 1.00 mol·L-1 NaCl溶液选用_______(填序号,下同)。
(2)除去水中的泥沙选用_______。
(3)用NH4Cl和Ca(OH)2制取NH3,选用_______。
(4)加热MnO2和浓盐酸的混合物制Cl2,选用_______。
23.如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
(1)写出N2的一种用途:___________。
(2)B物质的电子式为:___________。
(3)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为___________。
(4)实验室制取物质B的化学方程式为___________。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___________。
(6)从N元素化合价角度分析,上图中涉及的六种物质只有还原性的是___________(填化学式,下同),既有氧化性又有还原性的是___________。
24.某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容如下:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是______________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,若沉淀C物质的量大于0.07 mol,溶液X中还一定含有的离子是______;若而沉淀C物质的量小于0.07 mol,溶液X中还一定含有的离子是______。
25.硝酸工业尾气中氮氧化物(NO 和NO2)是主要的大气污染物之一,可用氨氧混合气体进行选择性还原处理。其主要反应原理如下:4NO+4NH3+O24N2+6H2O 6NO2+8NH37N2+12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
(1)尾气中氮氧化物的平均相对原子量为_____________;尾气中NO的含量为_____mg/m3。
(2)要处理5m3的尾气,需要氨氧混合气的体积为_______L。
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积25%NaOH溶液(密度1.28g/cm3)完全吸收。
(3)NaOH溶液的物质的量浓度为_____________mol/L,体积为_____mL。
(4)已知反应后溶液含有0.35molNaNO2。若将尾气NO 和NO2的平均组成用NOx表示,则x=______
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】试题分析:A.稀硫酸与铁反应属于置换反应,稀硝酸与铁反应生成硝酸铁、NO和H2O,不是置换反应,A错误;B.实验室用铜和稀硝酸反应制取NO,浓硝酸得到的是NO2,B错误;C.CO2、SO2、NO2都能与H2O反应,但原理不相同,前两者是非氧化还原反应,NO2与水反应生成硝酸和NO是氧化还原反应,C错误;D.三种元素均可以和氧元素形成多种氧化物,例如CO、CO2、SO2、SO3、NO、NO2等,D正确,答案选D。
考点:考查非金属元素及其化合物判断
2.A
【详解】“雷雨发庄稼”,空气中的N2在放电条件下与O2直接化合生成无色且不溶于水的一氧化氮气体,N2+O22NO;一氧化氮的密度比空气略大,不稳定,常温下就易与空气中的O2反应生成红棕色的二氧化氮气体,2NO+O2=2NO2;二氧化氮气体有毒,易与水反应生成硝酸(HN03)和一氧化氮,3NO2+H2O=2HNO3+NO;生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶于水的硝酸盐可作氮肥,植物生长得更好,不包括选项中氮气和氢气合成氨的反应,故选A。
3.C
【详解】A.沉铜时反应为[Cu(NH3)4]Cl2+2NaOH4NH3+CuO+2NaCl+H2O,浸铜时总反应为CuO+3NH3+NH4HCO3=[Cu(NH3)4]CO3+H2O,反应中没有元素化合价发生变化,没有发生氧化还原反应,A正确;
B.根据已知反应物和生成物,结合元素守恒可得离子方程式为[Cu(NH3)4]+2OH-4NH3↑+CuO↓+H2O,B正确;
C.和OH-不能大量共存,且根据B选项可知大部分氨气已逸出,C错误;
D.温度过高碳酸氢铵会分解,且氨气的溶解度降低,导致铜的浸出率下降,D正确;
综上所述答案为C。
4.B
【详解】①硝酸在水溶液中电离出的阳离子全部是氢离子,所以硝酸属于酸,①正确;
②氢化物是氢元素与其他元素形成的二元化合物,而硝酸的组成元素为3种,因此硝酸不属于氢化物,②错误;
③氧化物是氧元素与另外一种元素形成的二元化合物,而硝酸的组成元素为3种,因此硝酸不属于氧化物,③错误;
④硝酸属于酸,由于其组成元素中有氧元素,所以属于含氧酸,④正确;
⑤硝酸易挥发,属于挥发性酸,⑤错误;
⑥硝酸具有强氧化性,通常由硝酸根离子来表现强氧化性,为强氧化性酸,⑥正确;
⑦每个硝酸分子在水中能电离出一个氢离子,所以硝酸属于一元酸,⑦正确;
⑧硝酸为纯净物,其组成元素为三种,所以硝酸属于化合物,⑧正确;
⑨硝酸是仅有一种微粒构成的物质,属于纯净物,不属于混合物,⑨错误;
综上所述可知:上述说法正确的是①④⑥⑦⑧,故合理选项是B。
5.B
【详解】A.二氧化氮能与水反应生成硝酸和一氧化氮,无水氯化钙能干燥一氧化氮,则除去一氧化氮中混有的二氧化氮的除杂试剂选用正确,故A不符合题意;
B.氯气能溶于水,不溶于饱和食盐水,则用水除去氯气中氯化氢时,会吸收氯气,除杂试剂选用不正确,故B符合题意;
C.适量的氢氧化钠溶液能与氯化镁溶液反应生成氢氧化镁沉淀,适量的稀盐酸能与氢氧化钠反应生成氯化钠和水,则除去氯化钠溶液中混有的氯化镁的除杂试剂选用正确,故C不符合题意;
D.铁粉能与氯化铁溶液反应生成氯化亚铁,则除去氯化亚铁溶液中混有的氯化铁的除杂试剂选用正确,故D不符合题意;
故选B。
6.B
【分析】该反应中Fe元素化合价升高作还原剂被氧化,Fe3+为氧化产物,部分HNO3中N元素化合价降低作氧化剂被还原,NH为还原产物。
【详解】A.氧化还原反应中氧化剂的氧化性大于氧化产物,即氧化性:HNO3>Fe3+,A错误;
B.根据化学方程式可知,30molHNO3参与反应时生成3molNH4NO3,即有3molHNO3被还原,做氧化剂,所以作氧化剂的HNO3是参与反应的HNO3的×100%=10%,B正确;
C.若铁粉过量,则Fe元素最终生成Fe2+,化合价升高2价,做氧化剂的HNO3中N元素化合价降低8价,根据得失电子守恒可知氧化剂与还原剂的物质的量之比为2∶8,C错误;
D.在反应后的混合物中滴加少量氢氧化钠溶液,OH-会先结合Fe3+生成沉淀,不会有气体产生,D错误;
综上所述答案为B。
7.C
【详解】A.该反应中只有Cu失去电子,所以0.51molCu失去的电子即转移的电子,为1.02mol,故A错误;
B.NO和NO2的物质的量分别为x mol、ymol,则有x+y==0.5mol,根据电子守恒可知3x+y=1.02mol,联立解得x=0.26 y=0.24,即NO2气体0.24mol,故B错误;
C.向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH)=0.3L×5mol/L=1.5 mol,根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO)=1.5 mol+0.5mol=2mol,故原有硝酸的物质的量浓度为=8mol/L,故C正确;
D.根据C选项分析可知原HNO3浓度为8.0mol/L,故D错误;
综上所述答案为C。
8.B
【详解】分析:该混合溶液与铜粉反应的离子方程式为①3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,已知m(Cu)=19.2g,即n(Cu)=0.3mol,可求得参加反应的n(NO3-)=0.2mol,n(H+)=0.8mol;铁粉与混合溶液反应时,铁被氧化为Fe3+,而HNO3被还原为NO,即OA段的反应②为Fe+4H++NO3-=Fe3++NO↑+2H2O;随着铁粉的增加,AB段的反应③为2Fe3++Fe=3Fe2+,此时没有气体生成;当再增加铁粉时,又产生气体,即BC段的反应④为Fe+2H+=Fe2++H2↑,说明溶液中剩余的有H+;已知OA段消耗n( Fe) =0.2mol,由反应②可得参加反应的n(NO3-)=0.2mol,n(H+)=0.8mol,BC段消耗n( Fe) =0.1mol,则反应④消耗的n(H+)=0.2mol,综合分析可知,每一份混合溶液中n(HNO3)= 0.2mol,n(H2SO4)= 0.4mol。
详解:A、混合溶液开始与铁粉反应时,稀硝酸把铁氧化为Fe3+,而自身被还原为NO,即OA段,由于Fe3+也有较强的氧化性,被增加的铁粉还原为Fe2+,即AB段,由于溶液中剩余有H+,与加入的铁粉反应生成H2,即BC段,所以A正确;
B、由上述分析可知,原混合溶液中n(H2SO4)= n(SO42-)=2×0.4mol=0.8mol,所以B错误;
C、根据反应②③④可得,第二份溶液中的最终溶质只有FeSO4,所以C正确;
D、每一份混合溶液(100mL)中含有n(HNO3)= 0.2mol,n(H2SO4)= 0.4mol,则c(H+)=10 mol/L,取20mL加水稀释至1L时,根据溶质的物质的量不变,可得0.02L×10mol/L=1L×c(H+),c(H+)=0.2mol/L,所以D正确。本题答案为B。
点睛:本题一定要从金属与稀HNO3反应的离子方程式入手分析,同时认真思考铁与混合溶液反应时,图象中各段的含义,要明确硝酸的强氧化性一定先把铁氧化为Fe3+,最终铁与剩余的H+反应放出H2,这样才能得出HNO3和H2SO4物质的量的正确值。
9.B
【详解】A.溶于水的部分氨气与水反应生成一水合氨,一水合氨部分电离出氢氧根离子和铵根离子,氨水溶液可以导电,但是氨气本身不能电离出阴阳离子,不导电,属于非电解质,故A错误;
B.浓硫酸具有吸水性,且与氢气、一氧化碳气体不发生反应,可以作为H2和CO的干燥剂,故B正确;
C.二氧化硅具有良好的导光性,可以用于制备光导纤维,与其导电性无关,故C错误;
D.酸性环境下,硝酸根离子具有强氧化性,能够把二氧化硫氧化为硫酸根离子,最终产生不溶于硝酸的硫酸钡沉淀,而不是亚硫酸钡沉淀,故D错误;
故选B。
10.D
【详解】A.Na+的结构示意图为,A正确;
B.H2O为共价分子,分子结构模型:,B正确;
C.HClO中O原子分别与H原子和Cl原子形成共价键,结构式为H—O—Cl,C正确;
D.HCl是共价化合物,H原子与Cl原子间共用1对电子,形成过程表示为:,D错误;
故选D。
11.B
【详解】A.盐水中提取NaCl,用蒸发结晶的方法,需要用蒸发皿,坩埚是用于灼烧的,A错误;
B.Br2能与NaOH反应,且NaOH溶液与CCl4不互溶,所以可以用NaOH除去Br2后,再用分液的方法将NaOH溶液与CCl4分离,B正确;
C.浓氨水与生石灰混合,生石灰溶于水放热且生成氢氧化钙,使一水合氨的电离平衡往逆向移动,从而产生氨气,氨气会与氯化钙反应,不能用无水氯化钙干燥,C错误;
D.Cl2也可以与NaOH反应,用NaOH除去HCl,也会将Cl2除掉,D错误;
故选B。
12.B
【详解】A.浓硫酸能将炽热的木炭氧化为二氧化碳,稀硫酸没有强氧化性,不能将炽热的木炭氧化为二氧化碳,故A错误;
B.浓硫酸有脱水性,能按水的组成比脱去蔗糖中的氢、氧元素,故B正确;
C.稀硫酸与金属反应时,S元素的化合价不发生变化,C错误;
D.虽然浓硫酸或浓硝酸能与铝反应,但常温下反应生成了致密的氧化物薄膜,可以阻止反应的进行,所以在常温下可以用铝制容器盛装浓硫酸或浓硝酸,D错误;
答案选B。
13.B
【详解】A.通过转化关系可推出有如下组合,S→H2S→S→SO2→H2SO4,N2→NH3→NO→NO2→HNO3,据此分析 ①②③④步反应过程中均发生了氧化还原反应,故A正确;
B.A为S或N2,为非金属元素形成的单质,故B错误;
C.E是HNO3或H2SO4,在常温下,Al、Fe在HNO3或H2SO4浓溶液中发生钝化,故C正确;
D.通过A中的分析可以知道B、D、E均为共价化合物,故D正确;
故选B。
14.B
【详解】A.液氨汽化时吸收大量的热,导致周围温度降低,可作制冷剂,A正确;
B.在加压、降温条件下,氯气转化为液氯,氯水是氯气溶于水后形成的,B错误;
C.二氧化硫有漂白性,可在食品中添加适量的二氧化硫用于漂白,使食品变得漂亮诱人,但要符合国家规定,C正确;
D.在石膏中含有硫酸根离子,故可用来制硫酸,D正确;
故选B。
15.A
【详解】A.铵盐和硝酸盐都不稳定,不耐高温,因此两种氮肥都应保存在阴凉处,故A错误;
B.雷雨天,在闪电作用下能引发氮气与氧气发生反应生成NO,该过程中氮由游离态转化成化合态,故B正确;
C.“光化学烟雾”、“硝酸型酸雨”都是氮的氧化物在空气中发生反应引起的污染现象,故C正确;
D.氨催化氧化放出大量热,通过热交换器可以预热加入的氨气和空气,充分利用热量,节约能源,故D正确;
故选:A。
16. 做保护气(或制氨气等其他合理答案) Cu D 【、可互换位置】
【分析】氮气与氢气在高温高压催化剂作用下反应生成氨气,氨气与氧气在催化剂并在加热条件下反应生成一氧化氮,氮气与氧气在放电或高温条件下发硬生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水氧气反应生成硝酸。
【详解】(1)在日常生活中用途很广,可做保护气、制氨气等,故答案为:做保护气(或制氨气等其他合理答案);
(2)实验室常用氯化铵与氢氧化钙反应制取,化学方程式为
,故答案为:;
(3)工业制硝酸中c过程中的反应为转化为硝酸的反应,化学方程式为
,故答案为:;
(4)①用Cu与浓反应制取的化学方程式为
。反应中,Cu化合价升高被氧化,发生氧化反应,故答案为:;Cu;
②由题意可知,被还原的的物质的量为,参加反应的铜的物质的量为,则生成的的物质的量为,起酸性作用的的物质的量为,反应中消耗的的物质的量为,故答案选D;
③发生的反应为氧化还原反应,根据化合价的升降可知做氧化剂,硫酸亚铁做还原剂,发生的反应为。根据得失电子守恒、质量守恒和电荷守恒,可得,故答案为:;;;。
17.
【详解】假设纵坐标为生成沉淀的物质的量,NaOH溶液浓度为1mol/L,则NaOH溶液的体积和NaOH的物质的量相等。OH-先和H+反应生成水,此时没有沉淀生成,1molH+消耗1molOH-;然后OH-和Mg2+、Al3+反应生成沉淀,1molMg2+消耗2molNaOH生成1molMg(OH)2沉淀,1molAl3+消耗3molNaOH生成1molAl(OH)3沉淀,沉淀总量为2mol;接下来OH-和反应生成NH3 H2O,该过程消耗1molNaOH,此时沉淀量不变;最后OH-和生成的Al(OH)3反应,1molAl(OH)3消耗1molNaOH,沉淀剩余1mol,再加NaOH溶液,沉淀量也不再发生变化,图象如下: 。
18.(1)
(2)
(3)
(4)
(5)
(6)
(7)
【详解】(1)碳酸氢钡溶液与硫酸氢钠溶液反应至沉淀完全时生成碳酸氢钠、硫酸钡沉淀和水,向溶液中继续滴入硫酸氢钠溶液,碳酸氢钠溶液与硫酸氢钠溶液反应生成硫酸钠、二氧化碳和水,反应的离子方程式依次为、,故答案为:;;
(2)0.2mol/L的硫酸铝铵溶液与0.3mol/L氢氧化钡溶液等体积混合反应生成氢氧化铝沉淀和硫酸钡沉淀,反应的离子方程式为,故答案为:;
(3)当溶液中氢氧根离子和铝离子的物质的量比为7∶2时,氯化铝液与烧碱溶液反应生成氯化钠、等物质的量的氢氧化铝沉淀和偏铝酸钠、水,反应的离子方程式为,故答案为:;
(4)当氯化铜和硫氢化钠的物质的量比为1∶2时,氯化铜溶液和硫氢化钠溶液反应生成氯化钠、硫化铜沉淀和硫化氢气体,反应的离子方程式为,故答案为:;
(5)标准状况下,2.24L二氧化碳与250mL0.5mol/L氢氧化钠溶液反应得到物质的量比为1∶3的碳酸钠和碳酸氢钠的混合溶液,反应的离子方程式为,故答案为:;
(6)100mL0.1mol/L碳酸钠溶液与0.01mol醋酸反应生成醋酸钠和碳酸氢钠,反应的离子方程式为,故答案为:;
(7)4mol/L偏铝酸钠溶液和7mol/L盐酸等体积均匀混合反应生成氯化钠、物质的量比为3∶1的氢氧化铝沉淀和氯化铝,反应的离子方程式为,故答案为:。
19.正确
【解析】略
20.(1)产生光化学烟雾或形成酸雨
(2)8NH3+6NO2=7N2+12H2O
(3) 产生白烟 检验氨气或氯化氢是否泄漏
(4) NCl3+3H2O=NH3↑+3HClO
【详解】(1)氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,故NO2产生的环境问题为产生光化学烟雾或形成酸雨;
(2)氨气具有还原性,NO2具有强氧化性,二氧化氮氧化氨气生成氮气和水,反应的化学方程式为:8NH3+6NO2=7N2+12H2O;
(3)氨气与氯化氢气体混合反应生成白色固体氯化铵,反应为NH3+HCl=NH4Cl,反应现象为产生白烟,依据此现象可以检验氨气或氯化氢是否泄漏;
(4)将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,则生成的酸是HClO,A为NCl3,电子式为,三氯化氮和水反应生成次氯酸和氨气,反应方程式为NCl3+3H2O=NH3↑+3HClO。
【点睛】本题考查氨气和氯气性质,侧重考查学生分析推断能力,知道氨气的检验方法及现象,掌握物质性质是解题关键,题目难度不大。
21.(1) NO2
(2)氧化性
(3)3NO2+H2O=2HNO3+NO
【分析】C为红棕色气体,则C是NO2,NO2溶于水生成HNO3和NO,A是气体单质,且能和氧气反应,所以A是氮气,则B是NO,D能与Cu反应得到NO,故D为HNO3。
【详解】(1)A是氮气,电子式为;由分析可知C的化学式为NO2;
(2)D是HNO3,B是NO,D→B的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,HNO3中部分N元素化合价由+5价降低到+2价,表现出氧化性;
(3)C是NO2,D是HNO3,C→D转化的化学方程式为3NO2+H2O=2HNO3+NO。
22. ③ ④ ② ①
【详解】(1)配制100 mL 1.00 mol·L-1 NaCl溶液需要100mL容量瓶,即③;
(2)除去水中的泥沙需要过滤,应选用装置④;
(3)NH4Cl和Ca(OH)2均为固体,且该反应需要加热,应选用②;
(4)加热MnO2和浓盐酸的混合物制Cl2,浓盐酸为液体,该反应需要加热,所以选用①。
23.(1)做保护气(冷冻剂、制氨气)
(2)
(3)AgNO3
(4)
(5)
(6) NH3 N2、NO、NO2
【分析】(1)
氮气化学性质不活泼,可以用来做保护气,也可以用来保存粮食,也可做冷冻剂、制氨气等;
(2)
B为氨气,电子式为;
(3)
Cl-的检验方法是向待测溶液中加入硝酸酸化,再滴加AgNO3溶液,若产生不是沉淀,就证明溶液中含有Cl-。因此C为AgNO3;
(4)
在实验室中是用铵盐与碱共热来制取氨气的。制取物质氨气的化学方程式为;
(5)
浓硝酸有强氧化性,在加热条件下与木炭发生反应产生CO2、NO2、H2O。反应的化学方程式为;
(6)
化合价最低的NH3只有还原性,处于中间价态的N2、NO、NO2既有氧化性又有还原性。
24. Al3+、NH、Fe2+、SO 3Fe2++NO+4H+===3Fe3++NO↑+2H2O AlO+CO2+2H2O===Al(OH)3↓+HCO Fe3+ Cl-
【详解】(1)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,综上分析,溶液X中除H+外还肯定含有的离子有Al3+、NH4+、Fe2+、SO42-,故答案为Al3+、NH4+、Fe2+、SO42-;
(2)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
②H为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知Fe2+物质的量为0.03mol; 溶液中正电荷为:2n(Fe2+)+3n(Al3+)+n(NH4+)+n(H+)=2×0.03mol+3×0.01mol+0.01mol+0.04mol=0.14mol;沉淀C为硫酸钡,其物质的量大于0.07mol,n(SO42-)>0.07mol,硫酸根离子所带的负电荷>0.07mol×2=0.14mol,说明溶液中负电荷大于正电荷,所以Fe3+肯定存在,若物质的量小于0.07mol,n(SO42-)<0.07mol,硫酸根离子所带的负电荷<0.07mol×2=0.14mol,说明溶液中正电荷大于负电荷,就有Cl-存在,故答案为Fe3+; Cl-。
点睛:本题考查物质的检验与鉴别,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力。 本题解答时一定要紧扣反应现象,推断各离子存在的可能性。
25. 33.2 1800 10.64 8 62.5 1.8
【分析】(1)先根据尾气中二氧化氮和一氧化氮的关系计算二氧化氮、一氧化氮的物质的量,再根据方程式计算氨气和氧气的物质的量,最后根据M=计算其平均相对分子质量;根据m=nM计算出质量,再计算含量;
(2)根据V=nVm计算需要氨氧混合气体的体积;
(3)C=计算NaOH的浓度,根据方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O可知:氮氧化物的物质的量=NaOH的物质的量,由此计算;
(4)由氧化还原反应规律可写出NOx与NaOH反应的方程式为:2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3+H2O,据此计算。
【详解】(1)①设1m3尾气中NO2的物质的量为x,则NO的物质的量为4x,4xmol×30g/mol+46xg=2.49g,x=0.015mol,所以1m3尾气中NO2的物质的量为0.015mol,则NO的物质的量为0.06mol,
根据4NO+4NH3+O24N2+6H2O可知,0.06molNO需要0.06molNH3,0.015molO2,根据方程式6NO2+8NH37N2+12H2O,0.015molNO2需要0.02molNH3,所以氮氧化物混合气体的平均摩尔质量为=33.2g/mol,所以其相对分子质量为33.2,;1m3尾气中NO的物质的量为0.06mol,所以1m3尾气中NO的质量为m=nM=0.06mol×30g/mol=1800mg,则NO的含量为;故答案为:1800;33.2;
(2)处理1m3尾气需要氨氧混合物的体积=(0.06+0.02+0.015)mol×22.4L/mol=2.128L,则要处理5m3的尾气,需要氨氧混合气的体积为=2.128L×5=10.64L,故答案为:10.64;
(3)C=,根据方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O可知,氮氧化物的物质的量=氢氧化钠的物质的量=0.5mol,所以NaOH的体积V===0.0625L=62.5mL,故答案为:8;62.5;
(4)氮氧化物表示为NOx,则NOx与NaOH反应的化学方程式为:2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3+H2O,因为氮氧化物为0.5mol,NaNO2的物质的量为0.35mol,则计算如下:
2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3+H2O
2mol (5-2x)mol
0.5mol 0.35mol 计算得:x=1.8,故答案为:1.8。
【点睛】(4)NOx与NaOH反应生成NaNO2和NaNO3,根据氧化还原反应规律,可得出NOx与NaOH反应的化学方程式2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3,据此计算则手到擒来。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.C、N、S是重要的非金属元素,下列说法正确的是
A.稀硫酸、稀硝酸与铁反应均属于置换反应
B.实验室用铜和浓硝酸反应制取NO
C.CO2、SO2、NO2都能与H2O反应,且原理相同
D.三种元素均可以和氧元素形成多种氧化物
2.下列化学反应中,与“ 雷雨发庄稼” 无关的是
A.N2+3H22NH3
B.N2+O22NO
C.2NO+O2=2NO2
D.3NO2+H2O=2HNO3+NO
3.由含[Cu(NH3)4]Cl2的蚀刻废液制取[Cu(NH3)4]CO3溶液的流程如图:
下列有关说法不正确的是
A.上述制取流程不涉及氧化还原反应
B.“沉铜”在加热条件下进行,发生反应的离子方程式为[Cu(NH3)4]+2OH-4NH3↑+CuO↓+H2O
C.“滤液”中大量存在的离子有Na+、、Cl-和OH-
D.“浸铜”时温度过高可能导致铜的浸出率下降
4.按照物质的树状分类法和交叉分类法,HNO3应属于
①酸;②氢化物;③氧化物;④含氧酸;⑤难挥发性酸;⑥强氧化性酸;⑦一元酸;⑧化合物;⑨混合物。
A.①②③④⑤⑥⑦⑧ B.①④⑥⑦⑧
C.①⑨ D.①④⑤⑥⑦
5.下列除杂试剂选用不正确的是
物质(括号内为杂质) 除杂试剂
A NO (NO2) H2O、无水CaCl2
B Cl2 (HCl) H2O、浓H2SO4
C NaCl溶液(MgCl2) 适量NaOH溶液、稀HCl,
D FeCl2溶液(FeCl3) Fe粉
A.A B.B C.C D.D
6.铁粉与稀硝酸反应的化学方程式为8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2O。下列有关说法正确的是
A.氧化性:HNO3<Fe3+
B.作氧化剂的HNO3是参与反应的HNO3的10%
C.若铁粉过量,则氧化剂与还原剂的物质的量之比为3∶8
D.在反应后的混合物中滴加少量氢氧化钠溶液,有气体逸出
7.将0.51mol铜与250mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。待产生的气体全部释放后,向溶液中加入300mL5mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀。则下列选项正确的是
A.反应中转移电子1.0mol
B.产生NO2气体0.26mol
C.原HNO3浓度为8.0mol/L
D.原HNO3浓度为6.0mol/L
8.某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g (已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是
A.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B.原混合酸中SO42-物质的量为0.6 mol
C.第二份溶液中最终溶质为FeSO4
D.取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
9.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A NH3的水溶液可以导电 NH3是电解质
B 浓硫酸有吸水性 浓硫酸可用于干燥H2和CO
C SiO2有导电性 SiO2可用于制备光导纤维
D SO2通入硝酸钡溶液出现白色沉淀 BaSO3不溶于强酸
A.A B.B C.C D.D
10.下列化学用语不正确的是
A.Na+的结构示意图:
B.H2O的分子结构模型:
C.HClO的结构式:H—O—Cl
D.用电子式表示HCl的形成过程:
11.下列装置能达到实验目的的是
A.从盐水中提取 B.除去中的 C.制取收集氨 D.除去中的
12.下列说法正确的是
A.稀硫酸能将炽热的木炭氧化为二氧化碳
B.浓硫酸能按水的组成比脱去蔗糖中的氢、氧元素
C.硫酸和硝酸与金属反应时,S元素和N元素的化合价一定发生了变化
D.浓硫酸或浓硝酸能与铝反应,所以常温下两者都不能用铝制容器盛装
13.A、B、C、D、E均为短周期主族元素形成的常见单质或化合物(注:A、B、C、D、E可代表各不相同的物质,也可以代表相同的物质),有以下转化关系:
下列说法不正确的是
A.①②③④步中均发生了氧化还原反应
B.A可为金属元素或非金属元素形成的单质
C.Al、Fe均可以在E的浓溶液中发生钝化
D.B、D、E均为共价化合物
14.下列说法不正确的是
A.液氨汽化时吸收大量的热,工业上可用液氨作制冷剂
B.在加压条件下,氯气转化为氯水,可储存于钢瓶中
C.二氧化硫有漂白性,可在食品中添加适量的二氧化硫用于漂白
D.在石膏资源丰富的地方,可用来制硫酸
15.下列关于氮及其化合物的说法不正确的是
A.铵态氮肥应保存在阴凉处,硝态氮肥(硝酸盐)则能够耐高温
B.“雷雨发庄稼”是由于放电条件有利于游离态的氮转化为化合态
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D.工业制硝酸过程中,氨催化氧化放出大量热,能预热新进入设备的氨气和空气,节约能源
二、填空题
16.工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。图中路线a、b、c是工业制备硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电固氮过程中生成硝酸的途径。
(1)写出N2的—种用途:__________。
(2)实验室制取NH3的化学方程式为______。
(3)写出工业制硝酸中c过程中反应的化学方程式:______。
(4)硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸溶液浓度的不同而有变化。浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
①请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____。该反应中发生氧化反应的物质是_____。
②64.0gCu与适量的浓HNO3反应,铜全部溶解后,共收集到1mol NO2和NO的混合气体,反应中消耗HNO3的物质的量是____(填标号)。
A.1.5mol B.2.0mol C.2.5mol D.3.0mol
③实际上HNO3不仅可被还原为NO2或NO,浓度更稀时HNO3还可以被还原为N2O、N2、NH4NO3等。请将3种物质:、和分别填入下面对应的横线上,组成一个未配平的化学方程式并配平其对应的离子方程式。
i.__________
ii._______________。
17.某无色溶液中,已知含有H+、Mg2+、、Al3+各1mol,向该溶液中逐滴加入氢氧化钠溶液,则消耗氢氧化钠溶液体积(x轴)和生成沉淀量(y轴)之间的函数关系用图象表示_______(用尺子作图,标出数量关系)。
18.请按要求书写下列离子方程式:
(1)向溶液中滴入溶液,至沉淀完全,写出反应的离子方程式:_______,在上述溶液中继续滴入溶液,此时离子方程式为_______。
(2)的溶液与的溶液等体积混合:_______。
(3)溶液与烧碱溶液反应,当时:_______。
(4)溶液与溶液反应,当时:_______。
(5)标准状况下,通入的溶液中:_______。
(6)的溶液中加入:_______。
(7)的溶液和的盐酸等体积均匀混合:_______。
19.氮气常用作焊接金属、填充灯泡、保存食品的保护气。(__)
20.NH3与NO2是常见的氮的化合物,研究它们的综合利用有重要意义
(1)NO2产生的环境问题有_______(填一种)
(2)热电厂通常用NH3消除燃煤烟气中NO2,写出该反应化学方程式_______
(3)氨气与氯化氢气体混合的现象是_______,该反应可用于_______
(4)若将少量氨气与过量氯气混合,则生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式_______,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式_______
21.A、B、C、D四种物质之间有下图所示的转化关系。已知A是气体单质,C是红棕色气体。
回答下列问题:
(1)A的电子式:_______ ,C的化学式:_______。
(2)在上图D→B的过程中,D表现出强_______(填“氧化性”或“还原性”)。
(3)写出C→D转化的化学方程式:_______。
22.选择装置,完成实验。
(1)配制100 mL 1.00 mol·L-1 NaCl溶液选用_______(填序号,下同)。
(2)除去水中的泥沙选用_______。
(3)用NH4Cl和Ca(OH)2制取NH3,选用_______。
(4)加热MnO2和浓盐酸的混合物制Cl2,选用_______。
23.如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
(1)写出N2的一种用途:___________。
(2)B物质的电子式为:___________。
(3)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为___________。
(4)实验室制取物质B的化学方程式为___________。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___________。
(6)从N元素化合价角度分析,上图中涉及的六种物质只有还原性的是___________(填化学式,下同),既有氧化性又有还原性的是___________。
24.某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容如下:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是______________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,若沉淀C物质的量大于0.07 mol,溶液X中还一定含有的离子是______;若而沉淀C物质的量小于0.07 mol,溶液X中还一定含有的离子是______。
25.硝酸工业尾气中氮氧化物(NO 和NO2)是主要的大气污染物之一,可用氨氧混合气体进行选择性还原处理。其主要反应原理如下:4NO+4NH3+O24N2+6H2O 6NO2+8NH37N2+12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
(1)尾气中氮氧化物的平均相对原子量为_____________;尾气中NO的含量为_____mg/m3。
(2)要处理5m3的尾气,需要氨氧混合气的体积为_______L。
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积25%NaOH溶液(密度1.28g/cm3)完全吸收。
(3)NaOH溶液的物质的量浓度为_____________mol/L,体积为_____mL。
(4)已知反应后溶液含有0.35molNaNO2。若将尾气NO 和NO2的平均组成用NOx表示,则x=______
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】试题分析:A.稀硫酸与铁反应属于置换反应,稀硝酸与铁反应生成硝酸铁、NO和H2O,不是置换反应,A错误;B.实验室用铜和稀硝酸反应制取NO,浓硝酸得到的是NO2,B错误;C.CO2、SO2、NO2都能与H2O反应,但原理不相同,前两者是非氧化还原反应,NO2与水反应生成硝酸和NO是氧化还原反应,C错误;D.三种元素均可以和氧元素形成多种氧化物,例如CO、CO2、SO2、SO3、NO、NO2等,D正确,答案选D。
考点:考查非金属元素及其化合物判断
2.A
【详解】“雷雨发庄稼”,空气中的N2在放电条件下与O2直接化合生成无色且不溶于水的一氧化氮气体,N2+O22NO;一氧化氮的密度比空气略大,不稳定,常温下就易与空气中的O2反应生成红棕色的二氧化氮气体,2NO+O2=2NO2;二氧化氮气体有毒,易与水反应生成硝酸(HN03)和一氧化氮,3NO2+H2O=2HNO3+NO;生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶于水的硝酸盐可作氮肥,植物生长得更好,不包括选项中氮气和氢气合成氨的反应,故选A。
3.C
【详解】A.沉铜时反应为[Cu(NH3)4]Cl2+2NaOH4NH3+CuO+2NaCl+H2O,浸铜时总反应为CuO+3NH3+NH4HCO3=[Cu(NH3)4]CO3+H2O,反应中没有元素化合价发生变化,没有发生氧化还原反应,A正确;
B.根据已知反应物和生成物,结合元素守恒可得离子方程式为[Cu(NH3)4]+2OH-4NH3↑+CuO↓+H2O,B正确;
C.和OH-不能大量共存,且根据B选项可知大部分氨气已逸出,C错误;
D.温度过高碳酸氢铵会分解,且氨气的溶解度降低,导致铜的浸出率下降,D正确;
综上所述答案为C。
4.B
【详解】①硝酸在水溶液中电离出的阳离子全部是氢离子,所以硝酸属于酸,①正确;
②氢化物是氢元素与其他元素形成的二元化合物,而硝酸的组成元素为3种,因此硝酸不属于氢化物,②错误;
③氧化物是氧元素与另外一种元素形成的二元化合物,而硝酸的组成元素为3种,因此硝酸不属于氧化物,③错误;
④硝酸属于酸,由于其组成元素中有氧元素,所以属于含氧酸,④正确;
⑤硝酸易挥发,属于挥发性酸,⑤错误;
⑥硝酸具有强氧化性,通常由硝酸根离子来表现强氧化性,为强氧化性酸,⑥正确;
⑦每个硝酸分子在水中能电离出一个氢离子,所以硝酸属于一元酸,⑦正确;
⑧硝酸为纯净物,其组成元素为三种,所以硝酸属于化合物,⑧正确;
⑨硝酸是仅有一种微粒构成的物质,属于纯净物,不属于混合物,⑨错误;
综上所述可知:上述说法正确的是①④⑥⑦⑧,故合理选项是B。
5.B
【详解】A.二氧化氮能与水反应生成硝酸和一氧化氮,无水氯化钙能干燥一氧化氮,则除去一氧化氮中混有的二氧化氮的除杂试剂选用正确,故A不符合题意;
B.氯气能溶于水,不溶于饱和食盐水,则用水除去氯气中氯化氢时,会吸收氯气,除杂试剂选用不正确,故B符合题意;
C.适量的氢氧化钠溶液能与氯化镁溶液反应生成氢氧化镁沉淀,适量的稀盐酸能与氢氧化钠反应生成氯化钠和水,则除去氯化钠溶液中混有的氯化镁的除杂试剂选用正确,故C不符合题意;
D.铁粉能与氯化铁溶液反应生成氯化亚铁,则除去氯化亚铁溶液中混有的氯化铁的除杂试剂选用正确,故D不符合题意;
故选B。
6.B
【分析】该反应中Fe元素化合价升高作还原剂被氧化,Fe3+为氧化产物,部分HNO3中N元素化合价降低作氧化剂被还原,NH为还原产物。
【详解】A.氧化还原反应中氧化剂的氧化性大于氧化产物,即氧化性:HNO3>Fe3+,A错误;
B.根据化学方程式可知,30molHNO3参与反应时生成3molNH4NO3,即有3molHNO3被还原,做氧化剂,所以作氧化剂的HNO3是参与反应的HNO3的×100%=10%,B正确;
C.若铁粉过量,则Fe元素最终生成Fe2+,化合价升高2价,做氧化剂的HNO3中N元素化合价降低8价,根据得失电子守恒可知氧化剂与还原剂的物质的量之比为2∶8,C错误;
D.在反应后的混合物中滴加少量氢氧化钠溶液,OH-会先结合Fe3+生成沉淀,不会有气体产生,D错误;
综上所述答案为B。
7.C
【详解】A.该反应中只有Cu失去电子,所以0.51molCu失去的电子即转移的电子,为1.02mol,故A错误;
B.NO和NO2的物质的量分别为x mol、ymol,则有x+y==0.5mol,根据电子守恒可知3x+y=1.02mol,联立解得x=0.26 y=0.24,即NO2气体0.24mol,故B错误;
C.向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH)=0.3L×5mol/L=1.5 mol,根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO)=1.5 mol+0.5mol=2mol,故原有硝酸的物质的量浓度为=8mol/L,故C正确;
D.根据C选项分析可知原HNO3浓度为8.0mol/L,故D错误;
综上所述答案为C。
8.B
【详解】分析:该混合溶液与铜粉反应的离子方程式为①3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,已知m(Cu)=19.2g,即n(Cu)=0.3mol,可求得参加反应的n(NO3-)=0.2mol,n(H+)=0.8mol;铁粉与混合溶液反应时,铁被氧化为Fe3+,而HNO3被还原为NO,即OA段的反应②为Fe+4H++NO3-=Fe3++NO↑+2H2O;随着铁粉的增加,AB段的反应③为2Fe3++Fe=3Fe2+,此时没有气体生成;当再增加铁粉时,又产生气体,即BC段的反应④为Fe+2H+=Fe2++H2↑,说明溶液中剩余的有H+;已知OA段消耗n( Fe) =0.2mol,由反应②可得参加反应的n(NO3-)=0.2mol,n(H+)=0.8mol,BC段消耗n( Fe) =0.1mol,则反应④消耗的n(H+)=0.2mol,综合分析可知,每一份混合溶液中n(HNO3)= 0.2mol,n(H2SO4)= 0.4mol。
详解:A、混合溶液开始与铁粉反应时,稀硝酸把铁氧化为Fe3+,而自身被还原为NO,即OA段,由于Fe3+也有较强的氧化性,被增加的铁粉还原为Fe2+,即AB段,由于溶液中剩余有H+,与加入的铁粉反应生成H2,即BC段,所以A正确;
B、由上述分析可知,原混合溶液中n(H2SO4)= n(SO42-)=2×0.4mol=0.8mol,所以B错误;
C、根据反应②③④可得,第二份溶液中的最终溶质只有FeSO4,所以C正确;
D、每一份混合溶液(100mL)中含有n(HNO3)= 0.2mol,n(H2SO4)= 0.4mol,则c(H+)=10 mol/L,取20mL加水稀释至1L时,根据溶质的物质的量不变,可得0.02L×10mol/L=1L×c(H+),c(H+)=0.2mol/L,所以D正确。本题答案为B。
点睛:本题一定要从金属与稀HNO3反应的离子方程式入手分析,同时认真思考铁与混合溶液反应时,图象中各段的含义,要明确硝酸的强氧化性一定先把铁氧化为Fe3+,最终铁与剩余的H+反应放出H2,这样才能得出HNO3和H2SO4物质的量的正确值。
9.B
【详解】A.溶于水的部分氨气与水反应生成一水合氨,一水合氨部分电离出氢氧根离子和铵根离子,氨水溶液可以导电,但是氨气本身不能电离出阴阳离子,不导电,属于非电解质,故A错误;
B.浓硫酸具有吸水性,且与氢气、一氧化碳气体不发生反应,可以作为H2和CO的干燥剂,故B正确;
C.二氧化硅具有良好的导光性,可以用于制备光导纤维,与其导电性无关,故C错误;
D.酸性环境下,硝酸根离子具有强氧化性,能够把二氧化硫氧化为硫酸根离子,最终产生不溶于硝酸的硫酸钡沉淀,而不是亚硫酸钡沉淀,故D错误;
故选B。
10.D
【详解】A.Na+的结构示意图为,A正确;
B.H2O为共价分子,分子结构模型:,B正确;
C.HClO中O原子分别与H原子和Cl原子形成共价键,结构式为H—O—Cl,C正确;
D.HCl是共价化合物,H原子与Cl原子间共用1对电子,形成过程表示为:,D错误;
故选D。
11.B
【详解】A.盐水中提取NaCl,用蒸发结晶的方法,需要用蒸发皿,坩埚是用于灼烧的,A错误;
B.Br2能与NaOH反应,且NaOH溶液与CCl4不互溶,所以可以用NaOH除去Br2后,再用分液的方法将NaOH溶液与CCl4分离,B正确;
C.浓氨水与生石灰混合,生石灰溶于水放热且生成氢氧化钙,使一水合氨的电离平衡往逆向移动,从而产生氨气,氨气会与氯化钙反应,不能用无水氯化钙干燥,C错误;
D.Cl2也可以与NaOH反应,用NaOH除去HCl,也会将Cl2除掉,D错误;
故选B。
12.B
【详解】A.浓硫酸能将炽热的木炭氧化为二氧化碳,稀硫酸没有强氧化性,不能将炽热的木炭氧化为二氧化碳,故A错误;
B.浓硫酸有脱水性,能按水的组成比脱去蔗糖中的氢、氧元素,故B正确;
C.稀硫酸与金属反应时,S元素的化合价不发生变化,C错误;
D.虽然浓硫酸或浓硝酸能与铝反应,但常温下反应生成了致密的氧化物薄膜,可以阻止反应的进行,所以在常温下可以用铝制容器盛装浓硫酸或浓硝酸,D错误;
答案选B。
13.B
【详解】A.通过转化关系可推出有如下组合,S→H2S→S→SO2→H2SO4,N2→NH3→NO→NO2→HNO3,据此分析 ①②③④步反应过程中均发生了氧化还原反应,故A正确;
B.A为S或N2,为非金属元素形成的单质,故B错误;
C.E是HNO3或H2SO4,在常温下,Al、Fe在HNO3或H2SO4浓溶液中发生钝化,故C正确;
D.通过A中的分析可以知道B、D、E均为共价化合物,故D正确;
故选B。
14.B
【详解】A.液氨汽化时吸收大量的热,导致周围温度降低,可作制冷剂,A正确;
B.在加压、降温条件下,氯气转化为液氯,氯水是氯气溶于水后形成的,B错误;
C.二氧化硫有漂白性,可在食品中添加适量的二氧化硫用于漂白,使食品变得漂亮诱人,但要符合国家规定,C正确;
D.在石膏中含有硫酸根离子,故可用来制硫酸,D正确;
故选B。
15.A
【详解】A.铵盐和硝酸盐都不稳定,不耐高温,因此两种氮肥都应保存在阴凉处,故A错误;
B.雷雨天,在闪电作用下能引发氮气与氧气发生反应生成NO,该过程中氮由游离态转化成化合态,故B正确;
C.“光化学烟雾”、“硝酸型酸雨”都是氮的氧化物在空气中发生反应引起的污染现象,故C正确;
D.氨催化氧化放出大量热,通过热交换器可以预热加入的氨气和空气,充分利用热量,节约能源,故D正确;
故选:A。
16. 做保护气(或制氨气等其他合理答案) Cu D 【、可互换位置】
【分析】氮气与氢气在高温高压催化剂作用下反应生成氨气,氨气与氧气在催化剂并在加热条件下反应生成一氧化氮,氮气与氧气在放电或高温条件下发硬生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水氧气反应生成硝酸。
【详解】(1)在日常生活中用途很广,可做保护气、制氨气等,故答案为:做保护气(或制氨气等其他合理答案);
(2)实验室常用氯化铵与氢氧化钙反应制取,化学方程式为
,故答案为:;
(3)工业制硝酸中c过程中的反应为转化为硝酸的反应,化学方程式为
,故答案为:;
(4)①用Cu与浓反应制取的化学方程式为
。反应中,Cu化合价升高被氧化,发生氧化反应,故答案为:;Cu;
②由题意可知,被还原的的物质的量为,参加反应的铜的物质的量为,则生成的的物质的量为,起酸性作用的的物质的量为,反应中消耗的的物质的量为,故答案选D;
③发生的反应为氧化还原反应,根据化合价的升降可知做氧化剂,硫酸亚铁做还原剂,发生的反应为。根据得失电子守恒、质量守恒和电荷守恒,可得,故答案为:;;;。
17.
【详解】假设纵坐标为生成沉淀的物质的量,NaOH溶液浓度为1mol/L,则NaOH溶液的体积和NaOH的物质的量相等。OH-先和H+反应生成水,此时没有沉淀生成,1molH+消耗1molOH-;然后OH-和Mg2+、Al3+反应生成沉淀,1molMg2+消耗2molNaOH生成1molMg(OH)2沉淀,1molAl3+消耗3molNaOH生成1molAl(OH)3沉淀,沉淀总量为2mol;接下来OH-和反应生成NH3 H2O,该过程消耗1molNaOH,此时沉淀量不变;最后OH-和生成的Al(OH)3反应,1molAl(OH)3消耗1molNaOH,沉淀剩余1mol,再加NaOH溶液,沉淀量也不再发生变化,图象如下: 。
18.(1)
(2)
(3)
(4)
(5)
(6)
(7)
【详解】(1)碳酸氢钡溶液与硫酸氢钠溶液反应至沉淀完全时生成碳酸氢钠、硫酸钡沉淀和水,向溶液中继续滴入硫酸氢钠溶液,碳酸氢钠溶液与硫酸氢钠溶液反应生成硫酸钠、二氧化碳和水,反应的离子方程式依次为、,故答案为:;;
(2)0.2mol/L的硫酸铝铵溶液与0.3mol/L氢氧化钡溶液等体积混合反应生成氢氧化铝沉淀和硫酸钡沉淀,反应的离子方程式为,故答案为:;
(3)当溶液中氢氧根离子和铝离子的物质的量比为7∶2时,氯化铝液与烧碱溶液反应生成氯化钠、等物质的量的氢氧化铝沉淀和偏铝酸钠、水,反应的离子方程式为,故答案为:;
(4)当氯化铜和硫氢化钠的物质的量比为1∶2时,氯化铜溶液和硫氢化钠溶液反应生成氯化钠、硫化铜沉淀和硫化氢气体,反应的离子方程式为,故答案为:;
(5)标准状况下,2.24L二氧化碳与250mL0.5mol/L氢氧化钠溶液反应得到物质的量比为1∶3的碳酸钠和碳酸氢钠的混合溶液,反应的离子方程式为,故答案为:;
(6)100mL0.1mol/L碳酸钠溶液与0.01mol醋酸反应生成醋酸钠和碳酸氢钠,反应的离子方程式为,故答案为:;
(7)4mol/L偏铝酸钠溶液和7mol/L盐酸等体积均匀混合反应生成氯化钠、物质的量比为3∶1的氢氧化铝沉淀和氯化铝,反应的离子方程式为,故答案为:。
19.正确
【解析】略
20.(1)产生光化学烟雾或形成酸雨
(2)8NH3+6NO2=7N2+12H2O
(3) 产生白烟 检验氨气或氯化氢是否泄漏
(4) NCl3+3H2O=NH3↑+3HClO
【详解】(1)氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,故NO2产生的环境问题为产生光化学烟雾或形成酸雨;
(2)氨气具有还原性,NO2具有强氧化性,二氧化氮氧化氨气生成氮气和水,反应的化学方程式为:8NH3+6NO2=7N2+12H2O;
(3)氨气与氯化氢气体混合反应生成白色固体氯化铵,反应为NH3+HCl=NH4Cl,反应现象为产生白烟,依据此现象可以检验氨气或氯化氢是否泄漏;
(4)将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,则生成的酸是HClO,A为NCl3,电子式为,三氯化氮和水反应生成次氯酸和氨气,反应方程式为NCl3+3H2O=NH3↑+3HClO。
【点睛】本题考查氨气和氯气性质,侧重考查学生分析推断能力,知道氨气的检验方法及现象,掌握物质性质是解题关键,题目难度不大。
21.(1) NO2
(2)氧化性
(3)3NO2+H2O=2HNO3+NO
【分析】C为红棕色气体,则C是NO2,NO2溶于水生成HNO3和NO,A是气体单质,且能和氧气反应,所以A是氮气,则B是NO,D能与Cu反应得到NO,故D为HNO3。
【详解】(1)A是氮气,电子式为;由分析可知C的化学式为NO2;
(2)D是HNO3,B是NO,D→B的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,HNO3中部分N元素化合价由+5价降低到+2价,表现出氧化性;
(3)C是NO2,D是HNO3,C→D转化的化学方程式为3NO2+H2O=2HNO3+NO。
22. ③ ④ ② ①
【详解】(1)配制100 mL 1.00 mol·L-1 NaCl溶液需要100mL容量瓶,即③;
(2)除去水中的泥沙需要过滤,应选用装置④;
(3)NH4Cl和Ca(OH)2均为固体,且该反应需要加热,应选用②;
(4)加热MnO2和浓盐酸的混合物制Cl2,浓盐酸为液体,该反应需要加热,所以选用①。
23.(1)做保护气(冷冻剂、制氨气)
(2)
(3)AgNO3
(4)
(5)
(6) NH3 N2、NO、NO2
【分析】(1)
氮气化学性质不活泼,可以用来做保护气,也可以用来保存粮食,也可做冷冻剂、制氨气等;
(2)
B为氨气,电子式为;
(3)
Cl-的检验方法是向待测溶液中加入硝酸酸化,再滴加AgNO3溶液,若产生不是沉淀,就证明溶液中含有Cl-。因此C为AgNO3;
(4)
在实验室中是用铵盐与碱共热来制取氨气的。制取物质氨气的化学方程式为;
(5)
浓硝酸有强氧化性,在加热条件下与木炭发生反应产生CO2、NO2、H2O。反应的化学方程式为;
(6)
化合价最低的NH3只有还原性,处于中间价态的N2、NO、NO2既有氧化性又有还原性。
24. Al3+、NH、Fe2+、SO 3Fe2++NO+4H+===3Fe3++NO↑+2H2O AlO+CO2+2H2O===Al(OH)3↓+HCO Fe3+ Cl-
【详解】(1)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,综上分析,溶液X中除H+外还肯定含有的离子有Al3+、NH4+、Fe2+、SO42-,故答案为Al3+、NH4+、Fe2+、SO42-;
(2)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
②H为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知Fe2+物质的量为0.03mol; 溶液中正电荷为:2n(Fe2+)+3n(Al3+)+n(NH4+)+n(H+)=2×0.03mol+3×0.01mol+0.01mol+0.04mol=0.14mol;沉淀C为硫酸钡,其物质的量大于0.07mol,n(SO42-)>0.07mol,硫酸根离子所带的负电荷>0.07mol×2=0.14mol,说明溶液中负电荷大于正电荷,所以Fe3+肯定存在,若物质的量小于0.07mol,n(SO42-)<0.07mol,硫酸根离子所带的负电荷<0.07mol×2=0.14mol,说明溶液中正电荷大于负电荷,就有Cl-存在,故答案为Fe3+; Cl-。
点睛:本题考查物质的检验与鉴别,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力。 本题解答时一定要紧扣反应现象,推断各离子存在的可能性。
25. 33.2 1800 10.64 8 62.5 1.8
【分析】(1)先根据尾气中二氧化氮和一氧化氮的关系计算二氧化氮、一氧化氮的物质的量,再根据方程式计算氨气和氧气的物质的量,最后根据M=计算其平均相对分子质量;根据m=nM计算出质量,再计算含量;
(2)根据V=nVm计算需要氨氧混合气体的体积;
(3)C=计算NaOH的浓度,根据方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O可知:氮氧化物的物质的量=NaOH的物质的量,由此计算;
(4)由氧化还原反应规律可写出NOx与NaOH反应的方程式为:2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3+H2O,据此计算。
【详解】(1)①设1m3尾气中NO2的物质的量为x,则NO的物质的量为4x,4xmol×30g/mol+46xg=2.49g,x=0.015mol,所以1m3尾气中NO2的物质的量为0.015mol,则NO的物质的量为0.06mol,
根据4NO+4NH3+O24N2+6H2O可知,0.06molNO需要0.06molNH3,0.015molO2,根据方程式6NO2+8NH37N2+12H2O,0.015molNO2需要0.02molNH3,所以氮氧化物混合气体的平均摩尔质量为=33.2g/mol,所以其相对分子质量为33.2,;1m3尾气中NO的物质的量为0.06mol,所以1m3尾气中NO的质量为m=nM=0.06mol×30g/mol=1800mg,则NO的含量为;故答案为:1800;33.2;
(2)处理1m3尾气需要氨氧混合物的体积=(0.06+0.02+0.015)mol×22.4L/mol=2.128L,则要处理5m3的尾气,需要氨氧混合气的体积为=2.128L×5=10.64L,故答案为:10.64;
(3)C=,根据方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O可知,氮氧化物的物质的量=氢氧化钠的物质的量=0.5mol,所以NaOH的体积V===0.0625L=62.5mL,故答案为:8;62.5;
(4)氮氧化物表示为NOx,则NOx与NaOH反应的化学方程式为:2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3+H2O,因为氮氧化物为0.5mol,NaNO2的物质的量为0.35mol,则计算如下:
2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3+H2O
2mol (5-2x)mol
0.5mol 0.35mol 计算得:x=1.8,故答案为:1.8。
【点睛】(4)NOx与NaOH反应生成NaNO2和NaNO3,根据氧化还原反应规律,可得出NOx与NaOH反应的化学方程式2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3,据此计算则手到擒来。
答案第1页,共2页
答案第1页,共2页
