2.3.2配位键 课件(共27张PPT) 2022-2023学年鲁科版高中化学选择性必修2
文档属性
| 名称 | 2.3.2配位键 课件(共27张PPT) 2022-2023学年鲁科版高中化学选择性必修2 |  | |
| 格式 | zip | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 09:39:18 | ||
图片预览




文档简介
(共27张PPT)
配位键
百变魔法
蓝色溶液
无色液体
绿色溶液
深蓝色溶液
硫酸铜
粉末
盐酸
氨水
蒸馏水
配位键
课标要点
知道配位键的特点,认识简单配位化合物的成键特征
通过实验探究配位化合物的形成条件及配制
了解配位化合物的存在与应用
核心素养
发展宏观辨识与微观探析的核心化学素养
培养实验探究与创新意识的化学核心素养
培养科学精神与社会责任
学习之旅第一站—认识配位键
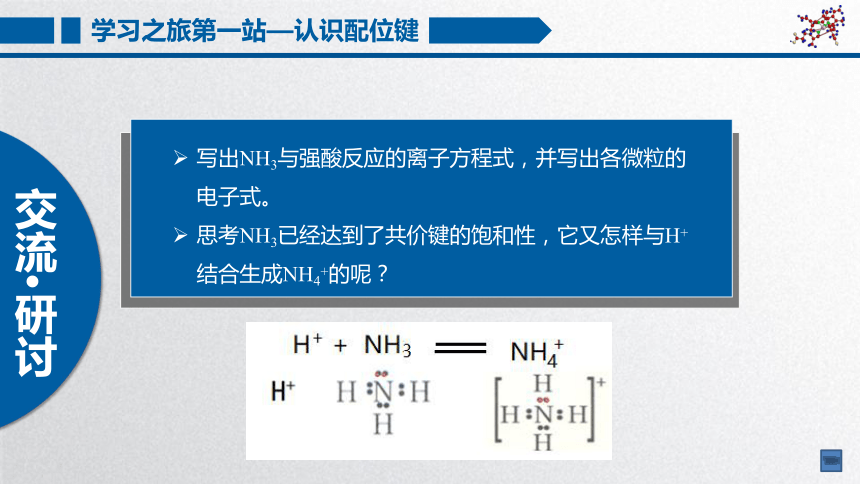
写出NH3与强酸反应的离子方程式,并写出各微粒的电子式。
思考NH3已经达到了共价键的饱和性,它又怎样与H+结合生成NH4+的呢?
交流·研讨
注意:
(1)配位键实质上是一种特殊的共价键
(2)两种原子间所形成的配位键与其余共价键的性质(键能,键角,键长)完全相同。
写出NH4+和H3O +中配位键的表示方法。
思考NH4+中的的配位键形成后与其他三个共价键的性质有区别吗?为什么?
学习之旅第一站:认识配位键
配位键的形成
(1)定义
一方提供空轨道,另一方提供孤电子对为双方所共用而形成的化学键就叫做配位键
(2)表示方法
常用符号A→B表示。A提供孤电子对,B提供空轨道
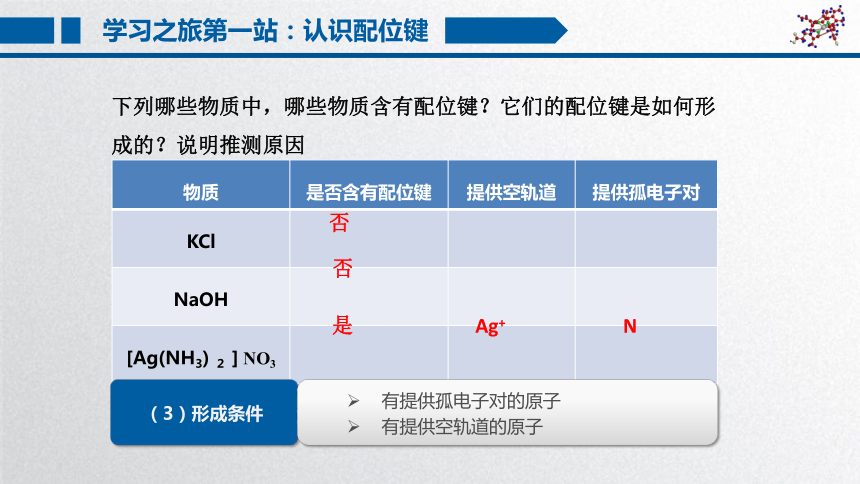
物质 是否含有配位键 提供空轨道 提供孤电子对
KCl
NaOH
[Ag(NH3) 2 ] NO3
下列哪些物质中,哪些物质含有配位键?它们的配位键是如何形成的?说明推测原因
否
否
是
Ag+
N
学习之旅第一站:认识配位键
(3)形成条件
有提供孤电子对的原子
有提供空轨道的原子
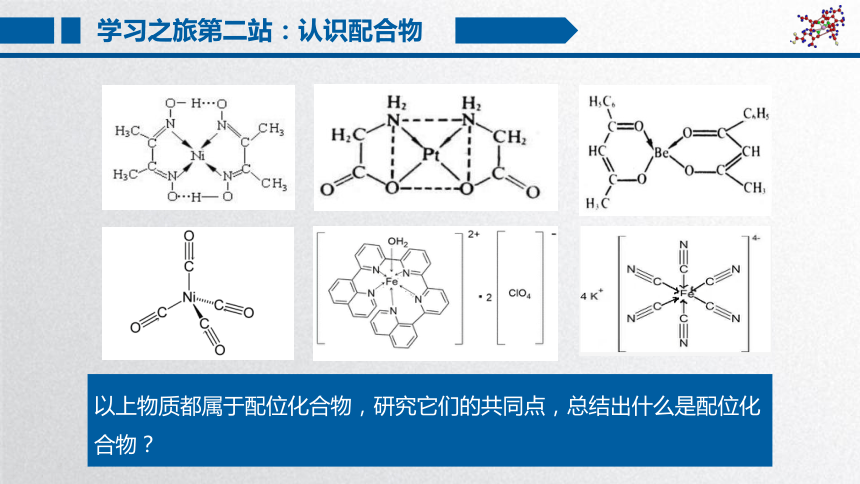
以上物质都属于配位化合物,研究它们的共同点,总结出什么是配位化合物?
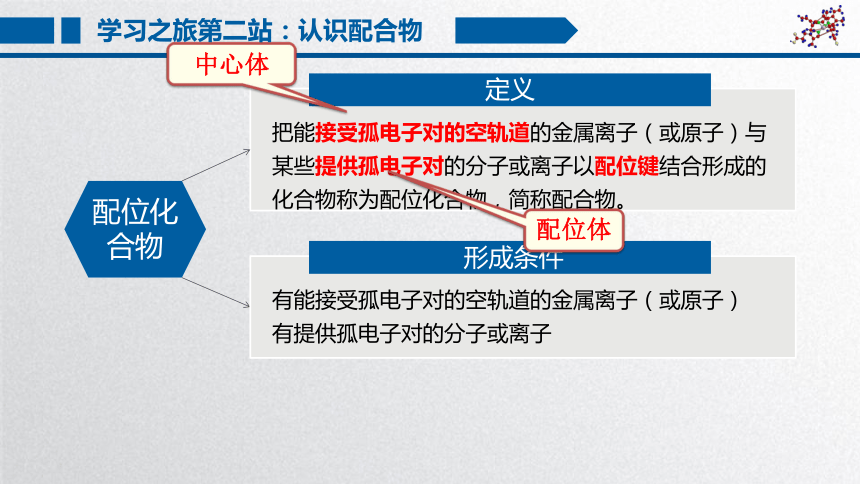
学习之旅第二站:认识配合物
定义
配位化合物
把能接受孤电子对的空轨道的金属离子(或原子)与某些提供孤电子对的分子或离子以配位键结合形成的化合物称为配位化合物,简称配合物。
形成条件
有能接受孤电子对的空轨道的金属离子(或原子)
有提供孤电子对的分子或离子
中心体
配位体
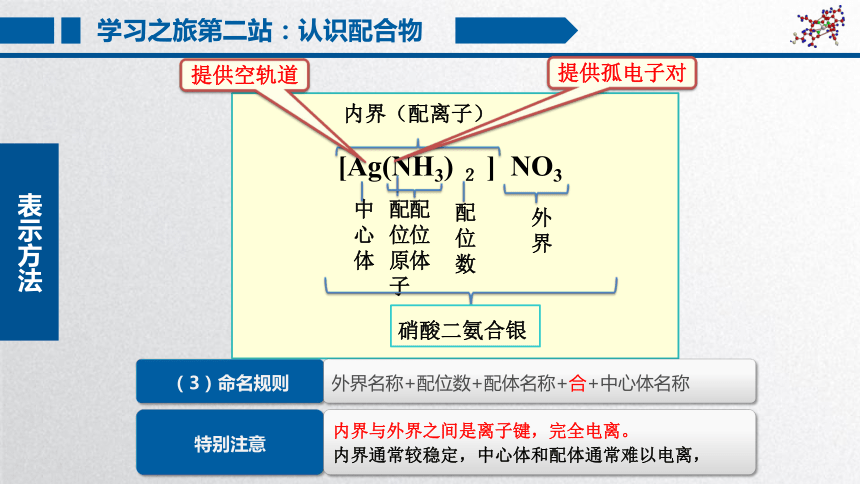
学习之旅第二站:认识配合物
[Ag(NH3) 2 ] NO3
内界(配离子)
外界
配位数
配位体
配位原子
中心体
配合物
提供孤电子对
提供空轨道
表示方法
学习之旅第二站:认识配合物
(3)命名规则
外界名称+配位数+配体名称+合+中心体名称
特别注意
内界与外界之间是离子键,完全电离。
内界通常较稳定,中心体和配体通常难以电离,
硝酸二氨合银
课堂练习
1、向下列配合物的水溶液中加入AgNO3溶液,不能生成 AgCl沉淀的是( )
A、[Co(NH3) 4Cl2] Cl
B、[Co(NH3) 3Cl3]
C、[Co(NH3) 6] Cl3
D、[Co(NH3) 5Cl] Cl2
B
中心体
配位原子
配体
配位数
提供能够接受电子对的空轨道的原子或离子,多为金属,常见的是过渡金属, 如Fe、Ni、Fe3+、Ag+、 Cu2+、Co3+、 Zn2+等。
含有孤电子对的原子、分子或离子。
原子:常为ⅤA、ⅥA、ⅦA族元素的原子;
分子:如H2O、NH3、CO等;
阴离子:如X-(Cl-、Br-、I-)、OH-、SCN-、CN-、RCOO- 等。
配体中直接与中心键合的原子,都具有孤电子对,如C、N、O、S、P、X
直接与中心键合的配位原子的数目。
配体中的原子如果都有孤电子对,如何判断谁是配位原子?
配位数与配体的个数一定相同吗?
学习之旅第二站:认识配合物
多齿配体(螯合物)
单齿配体
视野拓展
以配合物为研究对象的化学就叫做配位化学
课堂练习
叶绿素结构示意图
2、已知叶绿素是一种配合物,其结构如图所示。你能指出Mg和N形成的4个化学键中哪些是配位键吗?
走进高考
(2020山东卷17节选) 含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一Cd2+配合物的结构如图所示,1 mol该配合物中通过螯合作用形成的配位键有___mol。
6
蓝色溶液
无色液体
绿色溶液
深蓝色溶液
硫酸铜
粉末
盐酸
氨水
蒸馏水
魔法解密时刻
四水合铜离子
四氯合铜离子
四氨合铜离子
实验任务 操作与现象 结论
1.探究氯化铜固体在溶解并稀释过程中所发生的变化
2.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色原因
3.制备[Ag(NH3)2]+并用于与葡萄糖反应得到银镜
4.对比Cu2+与氨水和OH-反应的差异
实验用品: 0.1mol·L-1AgNO3溶液,0.1mol·L-1CuSO4溶液,1mol·L-1盐酸,1mol·L-1硝酸, 1mol·L-1NaCl溶液, 1mol·L-1NaOH溶液,浓氨水,10%葡萄糖溶液,氯化铜固体,氯化铁固体,硝酸铁固体,蒸馏水;试管,针筒,胶头滴管。
实验目的:制备简单的配合物,研究配合物的形成因素
实验方案设计与实施:
学习之旅第三站:实验探究
分组实验
1、2、3、4组做实验1和2
5、6、7、8组做实验3和4
小组人员分工合作
每个小组由主操作员和副操作员,记录员和观察员组成。
由组长根据每个人的特长分配任务!
注意实验中的药剂的使用剂量,尽量做到节约环保
实验任务 操作 现象 结论
1.探究氯化铜固体在溶解并稀释过程中所发生的变化
先将氯化铜固体加少量蒸馏水溶解,再加蒸馏水稀释
溶液由黄绿色到绿色,后逐渐变为蓝色
[CuCl4]2- +4H2O [Cu(H2O)4]2++4Cl-
黄绿色 蓝色
学习之旅第三站—实验探究
实验任务 操作 现象 结论
2.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色原因
1、将少量的氯化铁和硝酸铁固体溶解在水里。
均得到黄色溶液
氯化铁溶于水后,Fe 3+与Cl -形成了黄色 的[FeCl4]- ,硝酸铁溶于水后,水解形成了黄色的[Fe (H2O)6-n(OH)n]3-n
2、取1ml硝酸铁溶液,向其中加入2滴稀硝酸
黄色的硝酸铁溶液褪色
3、取2ml FeCl3溶液,向其中加入3滴稀硝酸,
黄色的氯化铁溶液不褪色
[Fe(H2O)6]3++nH2O [Fe (H2O)6-n(OH)n]3-n+nH3O+
无色 黄色
Fe3++4Cl- [FeCl4]-
黄色
4、将硝酸铁溶液分为2份,一份加入3滴的NaCl溶液,另一份中加入3滴的NaNO3溶液,
前者溶液变为黄色,溶液无明显变化。
[Fe(H2O)6]3++4Cl- [FeCl4(H2O)2]-+4H2O
无色 黄色
配体的浓度
溶液的酸碱性
学习之旅第三站—实验探究
配体的种类
实验任务 操作 现象 结论
3.制备[Ag(NH3)2]+并用于与葡萄糖反应得到银镜
1、在洁净的试管中加入1ml AgNO3溶液,然后一边振荡试管一边滴加2%氨水
先产生白色沉淀,继续滴加沉淀溶解。
2、再加入1ml 的葡萄糖溶液,振荡后,水浴加热。
AgNO3 + NH3.H2O = AgOH↓+NH4NO3
白色沉淀
AgOH + 2NH3.H2O =Ag(NH3)2 OH + 2H2O
无色溶液
试管底部出现光亮的银镜
[Ag(NH3)2]+ Ag++2NH3
CH2OH(CHOH)4CHO+ 2Ag(NH3)2OH
→CH2OH(CHOH)4COONH4
+2Ag↓+3NH3+H2O
学习之旅第三站:实验探究
实验任务 操作 现象 结论
4.对比Cu2+与氨水和OH-反应的差异
1、向盛有CuSO4溶液的试管里逐滴加入氨水
现象为先产生
蓝色沉淀,继续滴加氨水变为深蓝色溶液。
2、向盛有CuSO4溶液的试管里逐滴加入NaOH溶液
现象为先产生
蓝色沉淀,继续滴加并振荡,蓝色沉淀减少。
[Cu(H2O)4]2++ 2NH3.H2O=
蓝色 Cu(OH)2↓+2NH4++4 H2O
蓝色沉淀
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
蓝色沉淀 深蓝色
[Cu(H2O)4]2++ 2OH- = Cu(OH)2↓+4 H2O
蓝色 蓝色沉淀
Cu(OH)2+ 2OH- =[Cu(OH)4]2-
蓝色沉淀 蓝色
结论:配合物的形成与配体浓度、溶液的酸碱性及配体的种类有关
学习之旅第三站—实验探究
学习之旅第四站:解决问题
配合物的应用
软体动物中的血蓝蛋白
配合物与生物固氮
金属铂配合物抗肿瘤药
我们需要继续探索,未来世界的大门等着我们去开启!
学习之旅第四站:解决问题
为什么一氧化碳会是人中毒?你遇到这样的事情会怎么做呢?
配位键
配合物
配合物应用
宏观辩识与微观探析
科学探究与创新意识
科学精神与社会责任
学习之旅第五站—总结提升
配位键
学习之旅第六站:巩固提高
1.以下微粒含配位键的是( )
①[Al(OH)4]- ②CH4 ③OH- ④NH4+ ⑤[Cu(NH3)4]2+
⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①②④⑦⑧ B.③④⑤⑥⑦ C.①④⑤⑥⑦⑧ D.全部
2.关于[Cr(H2O)4Cl2]Cl的说法正确的是( )
A.中心原子的化合价为+2价
B.配体为水分子,外界为Cl-
C.配位数是6
D.在其水溶液中加入AgNO3溶液,不产生白色沉淀
C
C
学习之旅第六站—巩固提高
3.下列各种说法中错误的是( )
A.形成配位键的条件是一方有空轨道一方有孤对电子。
B.配位键是一种特殊的共价键。
C.配位化合物中的配体可以是分子也可以是阴离子。
D.共价键的形成条件是成键原子必须有未成对电子。
4.具有6个配体的Co3+的配合物CoClm·nNH3, 1mol配合物与AgNO3;溶液作用生成1mol AgCl沉淀,则m、n的值是( )
A. m=1、n=5 B. m=3、n=4 C. m=5、n=1 D. m=4、n=5
D
B
谢谢观赏 感谢聆听
配位键
百变魔法
蓝色溶液
无色液体
绿色溶液
深蓝色溶液
硫酸铜
粉末
盐酸
氨水
蒸馏水
配位键
课标要点
知道配位键的特点,认识简单配位化合物的成键特征
通过实验探究配位化合物的形成条件及配制
了解配位化合物的存在与应用
核心素养
发展宏观辨识与微观探析的核心化学素养
培养实验探究与创新意识的化学核心素养
培养科学精神与社会责任
学习之旅第一站—认识配位键
写出NH3与强酸反应的离子方程式,并写出各微粒的电子式。
思考NH3已经达到了共价键的饱和性,它又怎样与H+结合生成NH4+的呢?
交流·研讨
注意:
(1)配位键实质上是一种特殊的共价键
(2)两种原子间所形成的配位键与其余共价键的性质(键能,键角,键长)完全相同。
写出NH4+和H3O +中配位键的表示方法。
思考NH4+中的的配位键形成后与其他三个共价键的性质有区别吗?为什么?
学习之旅第一站:认识配位键
配位键的形成
(1)定义
一方提供空轨道,另一方提供孤电子对为双方所共用而形成的化学键就叫做配位键
(2)表示方法
常用符号A→B表示。A提供孤电子对,B提供空轨道
物质 是否含有配位键 提供空轨道 提供孤电子对
KCl
NaOH
[Ag(NH3) 2 ] NO3
下列哪些物质中,哪些物质含有配位键?它们的配位键是如何形成的?说明推测原因
否
否
是
Ag+
N
学习之旅第一站:认识配位键
(3)形成条件
有提供孤电子对的原子
有提供空轨道的原子
以上物质都属于配位化合物,研究它们的共同点,总结出什么是配位化合物?
学习之旅第二站:认识配合物
定义
配位化合物
把能接受孤电子对的空轨道的金属离子(或原子)与某些提供孤电子对的分子或离子以配位键结合形成的化合物称为配位化合物,简称配合物。
形成条件
有能接受孤电子对的空轨道的金属离子(或原子)
有提供孤电子对的分子或离子
中心体
配位体
学习之旅第二站:认识配合物
[Ag(NH3) 2 ] NO3
内界(配离子)
外界
配位数
配位体
配位原子
中心体
配合物
提供孤电子对
提供空轨道
表示方法
学习之旅第二站:认识配合物
(3)命名规则
外界名称+配位数+配体名称+合+中心体名称
特别注意
内界与外界之间是离子键,完全电离。
内界通常较稳定,中心体和配体通常难以电离,
硝酸二氨合银
课堂练习
1、向下列配合物的水溶液中加入AgNO3溶液,不能生成 AgCl沉淀的是( )
A、[Co(NH3) 4Cl2] Cl
B、[Co(NH3) 3Cl3]
C、[Co(NH3) 6] Cl3
D、[Co(NH3) 5Cl] Cl2
B
中心体
配位原子
配体
配位数
提供能够接受电子对的空轨道的原子或离子,多为金属,常见的是过渡金属, 如Fe、Ni、Fe3+、Ag+、 Cu2+、Co3+、 Zn2+等。
含有孤电子对的原子、分子或离子。
原子:常为ⅤA、ⅥA、ⅦA族元素的原子;
分子:如H2O、NH3、CO等;
阴离子:如X-(Cl-、Br-、I-)、OH-、SCN-、CN-、RCOO- 等。
配体中直接与中心键合的原子,都具有孤电子对,如C、N、O、S、P、X
直接与中心键合的配位原子的数目。
配体中的原子如果都有孤电子对,如何判断谁是配位原子?
配位数与配体的个数一定相同吗?
学习之旅第二站:认识配合物
多齿配体(螯合物)
单齿配体
视野拓展
以配合物为研究对象的化学就叫做配位化学
课堂练习
叶绿素结构示意图
2、已知叶绿素是一种配合物,其结构如图所示。你能指出Mg和N形成的4个化学键中哪些是配位键吗?
走进高考
(2020山东卷17节选) 含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一Cd2+配合物的结构如图所示,1 mol该配合物中通过螯合作用形成的配位键有___mol。
6
蓝色溶液
无色液体
绿色溶液
深蓝色溶液
硫酸铜
粉末
盐酸
氨水
蒸馏水
魔法解密时刻
四水合铜离子
四氯合铜离子
四氨合铜离子
实验任务 操作与现象 结论
1.探究氯化铜固体在溶解并稀释过程中所发生的变化
2.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色原因
3.制备[Ag(NH3)2]+并用于与葡萄糖反应得到银镜
4.对比Cu2+与氨水和OH-反应的差异
实验用品: 0.1mol·L-1AgNO3溶液,0.1mol·L-1CuSO4溶液,1mol·L-1盐酸,1mol·L-1硝酸, 1mol·L-1NaCl溶液, 1mol·L-1NaOH溶液,浓氨水,10%葡萄糖溶液,氯化铜固体,氯化铁固体,硝酸铁固体,蒸馏水;试管,针筒,胶头滴管。
实验目的:制备简单的配合物,研究配合物的形成因素
实验方案设计与实施:
学习之旅第三站:实验探究
分组实验
1、2、3、4组做实验1和2
5、6、7、8组做实验3和4
小组人员分工合作
每个小组由主操作员和副操作员,记录员和观察员组成。
由组长根据每个人的特长分配任务!
注意实验中的药剂的使用剂量,尽量做到节约环保
实验任务 操作 现象 结论
1.探究氯化铜固体在溶解并稀释过程中所发生的变化
先将氯化铜固体加少量蒸馏水溶解,再加蒸馏水稀释
溶液由黄绿色到绿色,后逐渐变为蓝色
[CuCl4]2- +4H2O [Cu(H2O)4]2++4Cl-
黄绿色 蓝色
学习之旅第三站—实验探究
实验任务 操作 现象 结论
2.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色原因
1、将少量的氯化铁和硝酸铁固体溶解在水里。
均得到黄色溶液
氯化铁溶于水后,Fe 3+与Cl -形成了黄色 的[FeCl4]- ,硝酸铁溶于水后,水解形成了黄色的[Fe (H2O)6-n(OH)n]3-n
2、取1ml硝酸铁溶液,向其中加入2滴稀硝酸
黄色的硝酸铁溶液褪色
3、取2ml FeCl3溶液,向其中加入3滴稀硝酸,
黄色的氯化铁溶液不褪色
[Fe(H2O)6]3++nH2O [Fe (H2O)6-n(OH)n]3-n+nH3O+
无色 黄色
Fe3++4Cl- [FeCl4]-
黄色
4、将硝酸铁溶液分为2份,一份加入3滴的NaCl溶液,另一份中加入3滴的NaNO3溶液,
前者溶液变为黄色,溶液无明显变化。
[Fe(H2O)6]3++4Cl- [FeCl4(H2O)2]-+4H2O
无色 黄色
配体的浓度
溶液的酸碱性
学习之旅第三站—实验探究
配体的种类
实验任务 操作 现象 结论
3.制备[Ag(NH3)2]+并用于与葡萄糖反应得到银镜
1、在洁净的试管中加入1ml AgNO3溶液,然后一边振荡试管一边滴加2%氨水
先产生白色沉淀,继续滴加沉淀溶解。
2、再加入1ml 的葡萄糖溶液,振荡后,水浴加热。
AgNO3 + NH3.H2O = AgOH↓+NH4NO3
白色沉淀
AgOH + 2NH3.H2O =Ag(NH3)2 OH + 2H2O
无色溶液
试管底部出现光亮的银镜
[Ag(NH3)2]+ Ag++2NH3
CH2OH(CHOH)4CHO+ 2Ag(NH3)2OH
→CH2OH(CHOH)4COONH4
+2Ag↓+3NH3+H2O
学习之旅第三站:实验探究
实验任务 操作 现象 结论
4.对比Cu2+与氨水和OH-反应的差异
1、向盛有CuSO4溶液的试管里逐滴加入氨水
现象为先产生
蓝色沉淀,继续滴加氨水变为深蓝色溶液。
2、向盛有CuSO4溶液的试管里逐滴加入NaOH溶液
现象为先产生
蓝色沉淀,继续滴加并振荡,蓝色沉淀减少。
[Cu(H2O)4]2++ 2NH3.H2O=
蓝色 Cu(OH)2↓+2NH4++4 H2O
蓝色沉淀
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
蓝色沉淀 深蓝色
[Cu(H2O)4]2++ 2OH- = Cu(OH)2↓+4 H2O
蓝色 蓝色沉淀
Cu(OH)2+ 2OH- =[Cu(OH)4]2-
蓝色沉淀 蓝色
结论:配合物的形成与配体浓度、溶液的酸碱性及配体的种类有关
学习之旅第三站—实验探究
学习之旅第四站:解决问题
配合物的应用
软体动物中的血蓝蛋白
配合物与生物固氮
金属铂配合物抗肿瘤药
我们需要继续探索,未来世界的大门等着我们去开启!
学习之旅第四站:解决问题
为什么一氧化碳会是人中毒?你遇到这样的事情会怎么做呢?
配位键
配合物
配合物应用
宏观辩识与微观探析
科学探究与创新意识
科学精神与社会责任
学习之旅第五站—总结提升
配位键
学习之旅第六站:巩固提高
1.以下微粒含配位键的是( )
①[Al(OH)4]- ②CH4 ③OH- ④NH4+ ⑤[Cu(NH3)4]2+
⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①②④⑦⑧ B.③④⑤⑥⑦ C.①④⑤⑥⑦⑧ D.全部
2.关于[Cr(H2O)4Cl2]Cl的说法正确的是( )
A.中心原子的化合价为+2价
B.配体为水分子,外界为Cl-
C.配位数是6
D.在其水溶液中加入AgNO3溶液,不产生白色沉淀
C
C
学习之旅第六站—巩固提高
3.下列各种说法中错误的是( )
A.形成配位键的条件是一方有空轨道一方有孤对电子。
B.配位键是一种特殊的共价键。
C.配位化合物中的配体可以是分子也可以是阴离子。
D.共价键的形成条件是成键原子必须有未成对电子。
4.具有6个配体的Co3+的配合物CoClm·nNH3, 1mol配合物与AgNO3;溶液作用生成1mol AgCl沉淀,则m、n的值是( )
A. m=1、n=5 B. m=3、n=4 C. m=5、n=1 D. m=4、n=5
D
B
谢谢观赏 感谢聆听
