2.3.1 《化学反应限度》 课件(共16张PPT) 2022-2023学年高中化学鲁科版(2019)必修2
文档属性
| 名称 | 2.3.1 《化学反应限度》 课件(共16张PPT) 2022-2023学年高中化学鲁科版(2019)必修2 |

|
|
| 格式 | zip | ||
| 文件大小 | 955.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 09:43:28 | ||
图片预览





文档简介
(共16张PPT)
第二章 第三节 化学反应限度
第1课时
N2(g)+ 3H2(g) 2NH3(g)
该反应在一定条件下是不可能进行完全的,即存在一定的限度,而反应的限度的大小对于生产和生活实际有着直接影响。因此仅研究化学反应的方向是不够的,还需要关注化学反应的限度问题。怎样 描述化学反应的限度呢?
定量
1.了解化学平衡常数的定义,能正确书写出反应的平衡常数表达式,并能进行相应的简单计算。
2. 理解化学平衡常数的意义,了解平衡常数的影响因素。
1
1、什么是可逆反应?
在同一条件下,既能向正反应方向又能向逆反应方向进行的反应称为可逆反应。
2
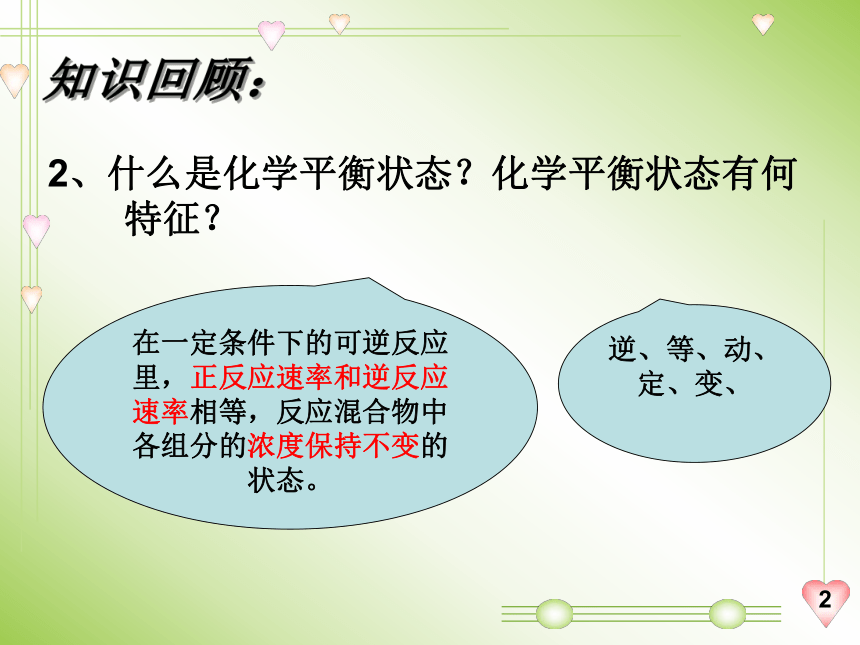
2、什么是化学平衡状态?化学平衡状态有何特征?
在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
逆、等、动、定、变、
2
[HI]2
温度
(K) 序
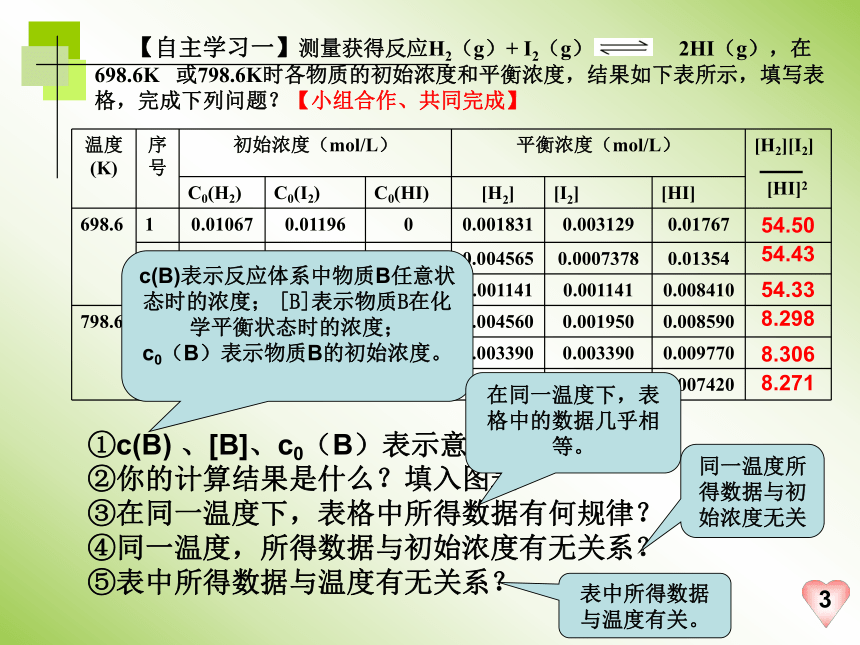
号 初始浓度(mol/L) 平衡浓度(mol/L) [H2][I2]
C0(H2) C0(I2) C0(HI) [H2] [I2] [HI]
698.6 1 0.01067 0.01196 0 0.001831 0.003129 0.01767
2 0.01134 0.007510 0 0.004565 0.0007378 0.01354
3 0 0 0.01069 0.001141 0.001141 0.008410
798.6 4 0.01135 0.009040 0 0.004560 0.001950 0.008590
5 0 0 0.01655 0.003390 0.003390 0.009770
6 0 0 0.01258 0.002580 0.002580 0.007420
①c(B) 、[B]、c0(B)表示意义有什么不同?
②你的计算结果是什么?填入图表 ③在同一温度下,表格中所得数据有何规律?
④同一温度,所得数据与初始浓度有无关系?
⑤表中所得数据与温度有无关系?
【自主学习一】测量获得反应H2(g)+ I2(g) 2HI(g),在698.6K 或798.6K时各物质的初始浓度和平衡浓度,结果如下表所示,填写表格,完成下列问题?【小组合作、共同完成】
3
54.33
54.43
54.50
8.298
8.306
8.271
c(B)表示反应体系中物质B任意状态时的浓度; [B]表示物质B在化学平衡状态时的浓度;
c0(B)表示物质B的初始浓度。
在同一温度下,表格中的数据几乎相等。
同一温度所得数据与初始浓度无关
表中所得数据与温度有关。
一、化学平衡常数
1、定义:在一定温度下,当一个可逆反应达到化学 平衡状态时,生成物浓度的系数次幂之积与反应物浓度的系数次幂之积的比值,用符号K表示。
2、 aA(g)+bB(g) cC(g)+dD(g)
表达式
[C]c[D]d
K= ——————
[A]a[B] b
3、影响因素:与外界温度有关
4
c(B) 、[B]、c0(B)?
【自主学习二】根据下面的【知识支持】完成表格。
1、平衡常数表达式中不包括固体和纯液体物质的浓度项(因为它们的浓度为常数),只包括气态物质和溶液中各溶质的浓度。
2、如果浓度的单位是mol/L,将浓度单位代入平衡常数表达式,可得到K的单位。
1/2N2(g)+3/2 H2(g)
N2(g)+ 3H2(g)
2NH3(g)
NH3·H2O(aq)
FeO(s) +CO(g)
AgCl(s)
反 应 K 单 位
1 NH3(g)
2 2NH3(g)
3 N2(g)+ 3H2(g)
4 NH4+(aq)+ OH—(aq)
5 Fe(s)+ CO2(g)
6 Ag+(aq) + Cl—(aq)
【思考】根据以上表格分析,回答下列问题。
①根据表中反应1、2分析,对于一个反应,其平衡常数的表达式是唯一的吗?平衡常数的表达式与什么有关?
②根据表中反应2、3分析,对于一个反应,其正反应和逆反应的平衡常数之间有什么关系?
③化学平衡常数有统一固定单位吗?它与什么有关?
5
1
mol·L-1
[NH3]
[N2]1/2 [H2]3/2
[ NH3]2
[N2 ] [H2]3
[N2 ] [H2]3
[ NH3]2
[NH4+] [OH-]
[NH3·H2O]
[CO2]
[CO]
[Ag+] [Cl-]
(mol·L-1)2
(mol·L-1)2
(mol·L-1)-2
(mol·L-1)-1
对于一个反应,平衡常数的表达式不是唯一的,与方程式的书写有关
对于一个反应,正逆反应的平衡常数互为倒数
平衡常数的单位与方程式的书写有关
4、化学平衡常数的注意事项:
6
(1)有纯固体或溶剂参加的反应,它们不列入平衡常数表达式。
(2)平衡常数的表达式及单位与方程式的书写形式有关。
(3)化学反应的正逆反应的平衡常数互为倒数。
在2000K时,反应CO(g)+1/2O2(g) CO2(g )的平衡常数为K1,则相同温度下反应2CO2(g) 2CO(g) + O2(g)的平衡常数K2为( )
A、 1/K1 B、 K12 C、 1/K12
7
C
8
大
【自主学习三】
【知识支持】一般说来,如果一个反应的平衡常数大于105,通常认为反应可以进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行。
5、化学平衡常数的意义:平衡常数的数值越 ,说明反应进行得越完全。
【自主学习四】阅读课本P43最后一自然段后小组讨论,并将结果展示到黑板上。
①对于反应aA(g)+bB(g) cC(g)+dD(g)的 的浓度商Q=
②如果浓度商和化学平衡常数相等,则说明反应达到 请解释原因?
③如果浓度商和化学平衡常数不一致,如何判断可逆反应进行的方向?并解释原因?
9
————
cC (C) cd (D)
ca(A) cb(B)
平衡状态
Q>K时,反应逆向进行;
Q任意状态
10
6、化学平衡常数的应用
判断反应是否达到化学平衡状态或反应进行的方向
Q = K时,反应已达平衡;
Q > K时,反应逆向进行;
Q < K时,反应正向进行;
已知CO(g)+H2O(g) CO2(g)+H2(g) ,8000C,K=1 ,试推导在下列浓度下反应进行的方向。
序号 CO/
mol.L-1 H2O /
mol.L-1 CO2 /
mol.L-1 H2 /
mol.L-1 反应进行方向
1 0.3 0.5 0.4 0.4
2 1.0 0.3 0.5 0.6
3 0.8 1.6 0.7 1.7
11
逆向移动
平衡状态
正向移动
12
化学平衡
常数
定义及
表达式
意义
应用
注意事项
影响因素
作业:课本53页:4
第二章 第三节 化学反应限度
第1课时
N2(g)+ 3H2(g) 2NH3(g)
该反应在一定条件下是不可能进行完全的,即存在一定的限度,而反应的限度的大小对于生产和生活实际有着直接影响。因此仅研究化学反应的方向是不够的,还需要关注化学反应的限度问题。怎样 描述化学反应的限度呢?
定量
1.了解化学平衡常数的定义,能正确书写出反应的平衡常数表达式,并能进行相应的简单计算。
2. 理解化学平衡常数的意义,了解平衡常数的影响因素。
1
1、什么是可逆反应?
在同一条件下,既能向正反应方向又能向逆反应方向进行的反应称为可逆反应。
2
2、什么是化学平衡状态?化学平衡状态有何特征?
在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
逆、等、动、定、变、
2
[HI]2
温度
(K) 序
号 初始浓度(mol/L) 平衡浓度(mol/L) [H2][I2]
C0(H2) C0(I2) C0(HI) [H2] [I2] [HI]
698.6 1 0.01067 0.01196 0 0.001831 0.003129 0.01767
2 0.01134 0.007510 0 0.004565 0.0007378 0.01354
3 0 0 0.01069 0.001141 0.001141 0.008410
798.6 4 0.01135 0.009040 0 0.004560 0.001950 0.008590
5 0 0 0.01655 0.003390 0.003390 0.009770
6 0 0 0.01258 0.002580 0.002580 0.007420
①c(B) 、[B]、c0(B)表示意义有什么不同?
②你的计算结果是什么?填入图表 ③在同一温度下,表格中所得数据有何规律?
④同一温度,所得数据与初始浓度有无关系?
⑤表中所得数据与温度有无关系?
【自主学习一】测量获得反应H2(g)+ I2(g) 2HI(g),在698.6K 或798.6K时各物质的初始浓度和平衡浓度,结果如下表所示,填写表格,完成下列问题?【小组合作、共同完成】
3
54.33
54.43
54.50
8.298
8.306
8.271
c(B)表示反应体系中物质B任意状态时的浓度; [B]表示物质B在化学平衡状态时的浓度;
c0(B)表示物质B的初始浓度。
在同一温度下,表格中的数据几乎相等。
同一温度所得数据与初始浓度无关
表中所得数据与温度有关。
一、化学平衡常数
1、定义:在一定温度下,当一个可逆反应达到化学 平衡状态时,生成物浓度的系数次幂之积与反应物浓度的系数次幂之积的比值,用符号K表示。
2、 aA(g)+bB(g) cC(g)+dD(g)
表达式
[C]c[D]d
K= ——————
[A]a[B] b
3、影响因素:与外界温度有关
4
c(B) 、[B]、c0(B)?
【自主学习二】根据下面的【知识支持】完成表格。
1、平衡常数表达式中不包括固体和纯液体物质的浓度项(因为它们的浓度为常数),只包括气态物质和溶液中各溶质的浓度。
2、如果浓度的单位是mol/L,将浓度单位代入平衡常数表达式,可得到K的单位。
1/2N2(g)+3/2 H2(g)
N2(g)+ 3H2(g)
2NH3(g)
NH3·H2O(aq)
FeO(s) +CO(g)
AgCl(s)
反 应 K 单 位
1 NH3(g)
2 2NH3(g)
3 N2(g)+ 3H2(g)
4 NH4+(aq)+ OH—(aq)
5 Fe(s)+ CO2(g)
6 Ag+(aq) + Cl—(aq)
【思考】根据以上表格分析,回答下列问题。
①根据表中反应1、2分析,对于一个反应,其平衡常数的表达式是唯一的吗?平衡常数的表达式与什么有关?
②根据表中反应2、3分析,对于一个反应,其正反应和逆反应的平衡常数之间有什么关系?
③化学平衡常数有统一固定单位吗?它与什么有关?
5
1
mol·L-1
[NH3]
[N2]1/2 [H2]3/2
[ NH3]2
[N2 ] [H2]3
[N2 ] [H2]3
[ NH3]2
[NH4+] [OH-]
[NH3·H2O]
[CO2]
[CO]
[Ag+] [Cl-]
(mol·L-1)2
(mol·L-1)2
(mol·L-1)-2
(mol·L-1)-1
对于一个反应,平衡常数的表达式不是唯一的,与方程式的书写有关
对于一个反应,正逆反应的平衡常数互为倒数
平衡常数的单位与方程式的书写有关
4、化学平衡常数的注意事项:
6
(1)有纯固体或溶剂参加的反应,它们不列入平衡常数表达式。
(2)平衡常数的表达式及单位与方程式的书写形式有关。
(3)化学反应的正逆反应的平衡常数互为倒数。
在2000K时,反应CO(g)+1/2O2(g) CO2(g )的平衡常数为K1,则相同温度下反应2CO2(g) 2CO(g) + O2(g)的平衡常数K2为( )
A、 1/K1 B、 K12 C、 1/K12
7
C
8
大
【自主学习三】
【知识支持】一般说来,如果一个反应的平衡常数大于105,通常认为反应可以进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行。
5、化学平衡常数的意义:平衡常数的数值越 ,说明反应进行得越完全。
【自主学习四】阅读课本P43最后一自然段后小组讨论,并将结果展示到黑板上。
①对于反应aA(g)+bB(g) cC(g)+dD(g)的 的浓度商Q=
②如果浓度商和化学平衡常数相等,则说明反应达到 请解释原因?
③如果浓度商和化学平衡常数不一致,如何判断可逆反应进行的方向?并解释原因?
9
————
cC (C) cd (D)
ca(A) cb(B)
平衡状态
Q>K时,反应逆向进行;
Q
10
6、化学平衡常数的应用
判断反应是否达到化学平衡状态或反应进行的方向
Q = K时,反应已达平衡;
Q > K时,反应逆向进行;
Q < K时,反应正向进行;
已知CO(g)+H2O(g) CO2(g)+H2(g) ,8000C,K=1 ,试推导在下列浓度下反应进行的方向。
序号 CO/
mol.L-1 H2O /
mol.L-1 CO2 /
mol.L-1 H2 /
mol.L-1 反应进行方向
1 0.3 0.5 0.4 0.4
2 1.0 0.3 0.5 0.6
3 0.8 1.6 0.7 1.7
11
逆向移动
平衡状态
正向移动
12
化学平衡
常数
定义及
表达式
意义
应用
注意事项
影响因素
作业:课本53页:4
