第九单元溶液检测题(含答案)---2022-2023学年九年级化学人教版下册
文档属性
| 名称 | 第九单元溶液检测题(含答案)---2022-2023学年九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 171.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-22 11:58:55 | ||
图片预览



文档简介
第九单元《溶液》检测题
一、单选题
1.下列有关溶液的说法正确的是
A.溶液都是无色透明的
B.稀溶液一定是不饱和溶液
C.溶液都是均一、稳定的混合物
D.长期放置后不会分层的液体一定是溶液
2.纳米铁粉在空气中不易自燃,但稍加热即可剧烈燃烧,如图是纳米铁粉在锥形瓶中燃烧的实验。下列说法不正确的是( )
A.纳米铁粉燃烧的化学方程式为3Fe+2O2Fe3O4
B.水可防止生成物溅落炸裂瓶底
C.激光手电照射使纳米铁粉的着火点降低
D.气球先膨胀后又变小
3.厨房中的下列物质与水混合后,不能形成溶液的是
A.食用纯碱
B.菜籽油
C.食盐
D.白糖
4.将下列物质加入足量的水中,能形成无色透明溶液的是( )
A.汽油 B.面粉 C.蔗糖 D.硫酸铜
5.如表是NaCl、KNO3 在不同温度时的溶解度:
温度/°C 10 20 30 40 50 60
溶解度/g NaCl 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 20.9 31.6 45.8 63.9 85.5 110
据此数据,下列说法正确的是( )
A.20℃时,将20gNaCl加入50g水中,得到70g 溶液
B.50℃时,KNO3溶液的溶质质量分数大于NaCl溶液的溶质质量分数
C.降温时,KNO3溶液析出的固体质量大于NaCl溶液析出的固体质量
D.NaCl和KNO3的溶解度曲线在20℃ ~30℃之间相交
6.如图是甲、乙两种物质的溶解度曲线。下列说法不正确的是
A.甲、乙两种物质的溶解度相等
B.甲的溶解度随温度的升高而增大
C.40℃时,将等质量的甲、乙分别配成饱和溶液,需要水的质量甲<乙
D.40℃时,向90g甲的饱和溶液中加水110g可以得到溶质质量分数为15%的溶液
7.海水中含有氯化钙,氯化钙的溶解度如下表。下列说法正确的是
温度/℃ 10 20 30 40
溶解度/g 65.0 74.5 100 116
A.氯化钙的溶解度随温度的升高而减小
B.10℃时,氯化钙的饱和溶液的溶质质量分数为65.0%
C.30℃时,向100g氯化钙固体中加入50g水,充分搅拌后能得到150g氯化钙溶液
D.将40℃的氯化钙的饱和溶液降温至20℃,有晶体析出
8.下列实验方法正确的是
A.用托盘天平称取6.35g食盐 B.用水区分NaOH和NH4NO3固体
C.用点燃的方法除去CO2中的CO D.用玻璃棒搅拌滤纸上的悬浊液,加快过滤速度
9.NaCl和KNO3在不同温度时的溶解度如下:
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
下列说法正确的是
A.某温度下,NaCl饱和溶液析出晶体后,溶液的溶质浓度一定减少
B.20℃时,50g水中最多溶解18.0gNaCl
C.将60℃的KNO3不饱和溶液降温至30℃,会变成饱和溶液
D.温度相同时,KNO3饱和溶液的浓度一定比NaCl溶液浓度大
10.下列物质不能与水形成溶液的是
A.植物油 B.蔗糖 C.高锰酸钾 D.硝酸钾
11.根据表中三种物质的溶解度数据,下列说法错误的是( )
温度/℃ 20 40 50 60
溶解度/g NaCl 36.0 36.6 37.0 37.3
NH4Cl 37.2 45.8 50.4 55.2
KNO3 31.6 63.9 85.5 110
A.20℃时,溶解度最大的物质是氯化铵
B.温度变化对硝酸钾的溶解度影响最大
C.氯化铵和硝酸钾的溶解度在某一温度时相同,该溶解度的数值在37.2﹣45.8之间
D.50℃时,用三种物质配制的溶液的溶质质量分数大小顺序是:KNO3>NH4Cl>NaCl
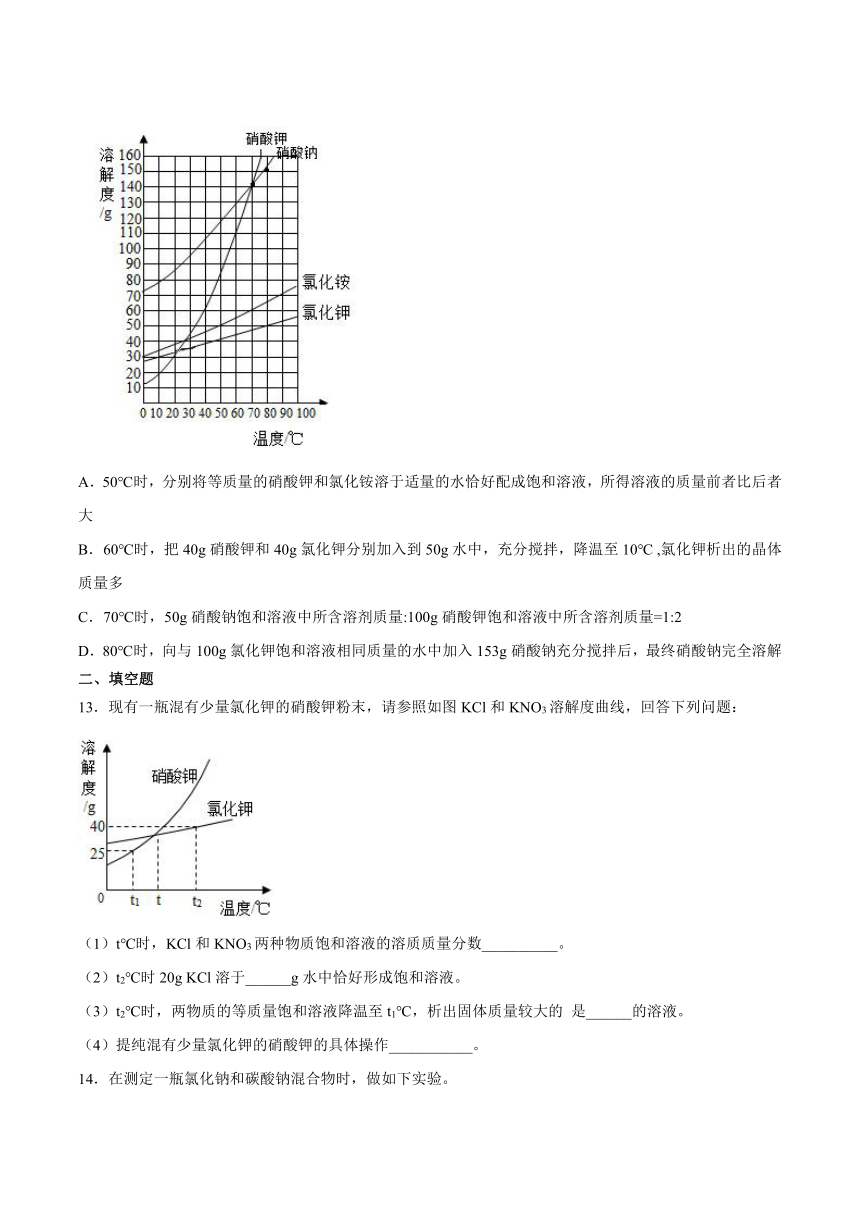
12.根据如图所示的溶解度曲线,判断下列说法正确的是
A.50℃时,分别将等质量的硝酸钾和氯化铵溶于适量的水恰好配成饱和溶液,所得溶液的质量前者比后者大
B.60℃时,把40g硝酸钾和40g氯化钾分别加入到50g水中,充分搅拌,降温至10℃ ,氯化钾析出的晶体质量多
C.70℃时,50g硝酸钠饱和溶液中所含溶剂质量:100g硝酸钾饱和溶液中所含溶剂质量=1:2
D.80℃时,向与100g氯化钾饱和溶液相同质量的水中加入153g硝酸钠充分搅拌后,最终硝酸钠完全溶解
二、填空题
13.现有一瓶混有少量氯化钾的硝酸钾粉末,请参照如图KCl和KNO3溶解度曲线,回答下列问题:
(1)t℃时,KCl和KNO3两种物质饱和溶液的溶质质量分数__________。
(2)t2℃时20g KCl溶于______g水中恰好形成饱和溶液。
(3)t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的 是______的溶液。
(4)提纯混有少量氯化钾的硝酸钾的具体操作___________。
14.在测定一瓶氯化钠和碳酸钠混合物时,做如下实验。
请回答下列问题:
(1)实验中发生反应的化学方程式是______________________________;
(2)求解混合物中发生反应的物质质量(X)的比例式是_________________________;
(3)混合物中氯化钠和碳酸钠质量的最简整数比是___________;
(4)实验时,若不考虑溶剂损失,将所得溶液蒸发15g水,发现无晶体析出。此时所得溶液中溶质的质量分数是_______________;
15.分别指出下列溶液中的溶质和溶剂,用相关物质的化学式填空:
(1)浓硫酸中的溶质是______;
(2)稀盐酸中的溶质是______;
(3)石灰水中的溶质是______;
(4)35%的酒精溶液中溶质是______,溶剂是______。
三、简答题
16.如图是甲、乙、丙三种固体物质的溶解度曲线,请根据溶解度曲线回答下列问题:
(1)t3℃时,将30g甲物质加入到 50g 水中,充分溶解后所得溶液的质量为______。
(2)若满足P点指标的氢氧化钙溶液中,加入少量的生石灰,则溶液中溶质的质量将_______(填“增加”、“减少”或“不变”) 。
(3)下列说法正确的是(填序号)____。
①t1℃时,甲、丙两溶液的溶质质量分数一定相等
②t3℃时,向100g20%甲的溶液中加100g水,充分搅拌,溶液的溶质质量分数为10%
③t2℃时,将甲和丙的混合溶液(两者均已达到饱和),降温至t1℃,析出的晶体含有甲和丙
④t3℃时,用等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙。
17.如图所示是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2℃时A、B、C三种物质中溶解度最大的是_____。P点所表示的含义是_____。
(2)t2℃时,将等质量的A、B、C三种物质溶解形成饱和溶液,所得溶液质量最大的是_____(填“A”或“B”或“C”)。
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的_________。
四、实验题
18.某科学兴趣小组的同学做粗盐(含有杂质,且杂质难溶于水)提纯实验,并用所得的精盐配制50克10%的氯化钠溶液。请回答下列有关问题:
实验一:下图是同学们做粗盐提纯实验的操作示意图。
(1)写出操作④中A仪器的名称____________________;
(2)实验操作⑤中的错误是____________________;
(3)粗盐提纯实验的操作顺序为(填操作序号)_____________;
实验二:用粗盐提纯后得到的精盐(氯化钠)配制了氯化钠溶液,经检测溶质质量分数偏小。
(4)其原因可能有_______________(填字母序号,多选)。
①氯化钠固体仍然不纯
②称量时砝码和氯化钠放错盘
③称量时只在天平左盘垫上滤纸
④用量筒量取水时俯视读数
⑤配制好的氯化钠溶液装瓶时,有少量溶液洒出
五、计算题
19.某发电厂用含硫元素1%的烟煤发电。为防止污染环境,用纯碱溶液吸收废气中的 ,化学反应方程式:
(1)燃烧3200t这种烟煤,产生二氧化硫的质量为_____t。(假设燃烧时硫元素全部转化为二氧化硫)
(2)上述二氧化硫全部被吸收,至少需要质量分数为15%的碳酸钠溶液的质量是多少?
(结果保留一位小数)
参考答案:
1.C 2.C 3.B 4.C 5.D 6.A 7.D 8.B 9.B 10.A 11.D
12.C
13. 相等 50 KNO3 先将混合物溶于水中形成热的浓溶液,然后降温结晶,再进行过滤,即可分离得到较为纯净的硝酸钾晶体
14. Na2CO3+CaCl2==CaCO3↓+2NaCl 106/100==X/10g 22:53 16.1%
15.(1)H2SO4
(2)HCl
(3)Ca(OH)2
(4) C2H5OH H2O
16. 75g 减少 ②④
17. A t1℃时B和C两物质的溶解度相等 C C
18.(1)蒸发皿
(2)未用玻璃棒引流
(3)①②③⑤④
(4)①③
19.(1)64
(2)解:设至少需要质量分数为15%的碳酸钠溶液的质量是y
答:至少需要质量分数为15%的碳酸钠溶液的质量是353.3t
一、单选题
1.下列有关溶液的说法正确的是
A.溶液都是无色透明的
B.稀溶液一定是不饱和溶液
C.溶液都是均一、稳定的混合物
D.长期放置后不会分层的液体一定是溶液
2.纳米铁粉在空气中不易自燃,但稍加热即可剧烈燃烧,如图是纳米铁粉在锥形瓶中燃烧的实验。下列说法不正确的是( )
A.纳米铁粉燃烧的化学方程式为3Fe+2O2Fe3O4
B.水可防止生成物溅落炸裂瓶底
C.激光手电照射使纳米铁粉的着火点降低
D.气球先膨胀后又变小
3.厨房中的下列物质与水混合后,不能形成溶液的是
A.食用纯碱
B.菜籽油
C.食盐
D.白糖
4.将下列物质加入足量的水中,能形成无色透明溶液的是( )
A.汽油 B.面粉 C.蔗糖 D.硫酸铜
5.如表是NaCl、KNO3 在不同温度时的溶解度:
温度/°C 10 20 30 40 50 60
溶解度/g NaCl 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 20.9 31.6 45.8 63.9 85.5 110
据此数据,下列说法正确的是( )
A.20℃时,将20gNaCl加入50g水中,得到70g 溶液
B.50℃时,KNO3溶液的溶质质量分数大于NaCl溶液的溶质质量分数
C.降温时,KNO3溶液析出的固体质量大于NaCl溶液析出的固体质量
D.NaCl和KNO3的溶解度曲线在20℃ ~30℃之间相交
6.如图是甲、乙两种物质的溶解度曲线。下列说法不正确的是
A.甲、乙两种物质的溶解度相等
B.甲的溶解度随温度的升高而增大
C.40℃时,将等质量的甲、乙分别配成饱和溶液,需要水的质量甲<乙
D.40℃时,向90g甲的饱和溶液中加水110g可以得到溶质质量分数为15%的溶液
7.海水中含有氯化钙,氯化钙的溶解度如下表。下列说法正确的是
温度/℃ 10 20 30 40
溶解度/g 65.0 74.5 100 116
A.氯化钙的溶解度随温度的升高而减小
B.10℃时,氯化钙的饱和溶液的溶质质量分数为65.0%
C.30℃时,向100g氯化钙固体中加入50g水,充分搅拌后能得到150g氯化钙溶液
D.将40℃的氯化钙的饱和溶液降温至20℃,有晶体析出
8.下列实验方法正确的是
A.用托盘天平称取6.35g食盐 B.用水区分NaOH和NH4NO3固体
C.用点燃的方法除去CO2中的CO D.用玻璃棒搅拌滤纸上的悬浊液,加快过滤速度
9.NaCl和KNO3在不同温度时的溶解度如下:
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
下列说法正确的是
A.某温度下,NaCl饱和溶液析出晶体后,溶液的溶质浓度一定减少
B.20℃时,50g水中最多溶解18.0gNaCl
C.将60℃的KNO3不饱和溶液降温至30℃,会变成饱和溶液
D.温度相同时,KNO3饱和溶液的浓度一定比NaCl溶液浓度大
10.下列物质不能与水形成溶液的是
A.植物油 B.蔗糖 C.高锰酸钾 D.硝酸钾
11.根据表中三种物质的溶解度数据,下列说法错误的是( )
温度/℃ 20 40 50 60
溶解度/g NaCl 36.0 36.6 37.0 37.3
NH4Cl 37.2 45.8 50.4 55.2
KNO3 31.6 63.9 85.5 110
A.20℃时,溶解度最大的物质是氯化铵
B.温度变化对硝酸钾的溶解度影响最大
C.氯化铵和硝酸钾的溶解度在某一温度时相同,该溶解度的数值在37.2﹣45.8之间
D.50℃时,用三种物质配制的溶液的溶质质量分数大小顺序是:KNO3>NH4Cl>NaCl
12.根据如图所示的溶解度曲线,判断下列说法正确的是
A.50℃时,分别将等质量的硝酸钾和氯化铵溶于适量的水恰好配成饱和溶液,所得溶液的质量前者比后者大
B.60℃时,把40g硝酸钾和40g氯化钾分别加入到50g水中,充分搅拌,降温至10℃ ,氯化钾析出的晶体质量多
C.70℃时,50g硝酸钠饱和溶液中所含溶剂质量:100g硝酸钾饱和溶液中所含溶剂质量=1:2
D.80℃时,向与100g氯化钾饱和溶液相同质量的水中加入153g硝酸钠充分搅拌后,最终硝酸钠完全溶解
二、填空题
13.现有一瓶混有少量氯化钾的硝酸钾粉末,请参照如图KCl和KNO3溶解度曲线,回答下列问题:
(1)t℃时,KCl和KNO3两种物质饱和溶液的溶质质量分数__________。
(2)t2℃时20g KCl溶于______g水中恰好形成饱和溶液。
(3)t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的 是______的溶液。
(4)提纯混有少量氯化钾的硝酸钾的具体操作___________。
14.在测定一瓶氯化钠和碳酸钠混合物时,做如下实验。
请回答下列问题:
(1)实验中发生反应的化学方程式是______________________________;
(2)求解混合物中发生反应的物质质量(X)的比例式是_________________________;
(3)混合物中氯化钠和碳酸钠质量的最简整数比是___________;
(4)实验时,若不考虑溶剂损失,将所得溶液蒸发15g水,发现无晶体析出。此时所得溶液中溶质的质量分数是_______________;
15.分别指出下列溶液中的溶质和溶剂,用相关物质的化学式填空:
(1)浓硫酸中的溶质是______;
(2)稀盐酸中的溶质是______;
(3)石灰水中的溶质是______;
(4)35%的酒精溶液中溶质是______,溶剂是______。
三、简答题
16.如图是甲、乙、丙三种固体物质的溶解度曲线,请根据溶解度曲线回答下列问题:
(1)t3℃时,将30g甲物质加入到 50g 水中,充分溶解后所得溶液的质量为______。
(2)若满足P点指标的氢氧化钙溶液中,加入少量的生石灰,则溶液中溶质的质量将_______(填“增加”、“减少”或“不变”) 。
(3)下列说法正确的是(填序号)____。
①t1℃时,甲、丙两溶液的溶质质量分数一定相等
②t3℃时,向100g20%甲的溶液中加100g水,充分搅拌,溶液的溶质质量分数为10%
③t2℃时,将甲和丙的混合溶液(两者均已达到饱和),降温至t1℃,析出的晶体含有甲和丙
④t3℃时,用等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙。
17.如图所示是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2℃时A、B、C三种物质中溶解度最大的是_____。P点所表示的含义是_____。
(2)t2℃时,将等质量的A、B、C三种物质溶解形成饱和溶液,所得溶液质量最大的是_____(填“A”或“B”或“C”)。
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的_________。
四、实验题
18.某科学兴趣小组的同学做粗盐(含有杂质,且杂质难溶于水)提纯实验,并用所得的精盐配制50克10%的氯化钠溶液。请回答下列有关问题:
实验一:下图是同学们做粗盐提纯实验的操作示意图。
(1)写出操作④中A仪器的名称____________________;
(2)实验操作⑤中的错误是____________________;
(3)粗盐提纯实验的操作顺序为(填操作序号)_____________;
实验二:用粗盐提纯后得到的精盐(氯化钠)配制了氯化钠溶液,经检测溶质质量分数偏小。
(4)其原因可能有_______________(填字母序号,多选)。
①氯化钠固体仍然不纯
②称量时砝码和氯化钠放错盘
③称量时只在天平左盘垫上滤纸
④用量筒量取水时俯视读数
⑤配制好的氯化钠溶液装瓶时,有少量溶液洒出
五、计算题
19.某发电厂用含硫元素1%的烟煤发电。为防止污染环境,用纯碱溶液吸收废气中的 ,化学反应方程式:
(1)燃烧3200t这种烟煤,产生二氧化硫的质量为_____t。(假设燃烧时硫元素全部转化为二氧化硫)
(2)上述二氧化硫全部被吸收,至少需要质量分数为15%的碳酸钠溶液的质量是多少?
(结果保留一位小数)
参考答案:
1.C 2.C 3.B 4.C 5.D 6.A 7.D 8.B 9.B 10.A 11.D
12.C
13. 相等 50 KNO3 先将混合物溶于水中形成热的浓溶液,然后降温结晶,再进行过滤,即可分离得到较为纯净的硝酸钾晶体
14. Na2CO3+CaCl2==CaCO3↓+2NaCl 106/100==X/10g 22:53 16.1%
15.(1)H2SO4
(2)HCl
(3)Ca(OH)2
(4) C2H5OH H2O
16. 75g 减少 ②④
17. A t1℃时B和C两物质的溶解度相等 C C
18.(1)蒸发皿
(2)未用玻璃棒引流
(3)①②③⑤④
(4)①③
19.(1)64
(2)解:设至少需要质量分数为15%的碳酸钠溶液的质量是y
答:至少需要质量分数为15%的碳酸钠溶液的质量是353.3t
同课章节目录
