实验活动6 化学能转化为电能 课时作业(含解析)
文档属性
| 名称 | 实验活动6 化学能转化为电能 课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 848.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 11:42:05 | ||
图片预览



文档简介
实验活动6 化学能转化为电能 课时作业
2022-2023学年下学期高一化学人教版(2019)必修第二册
一、单选题
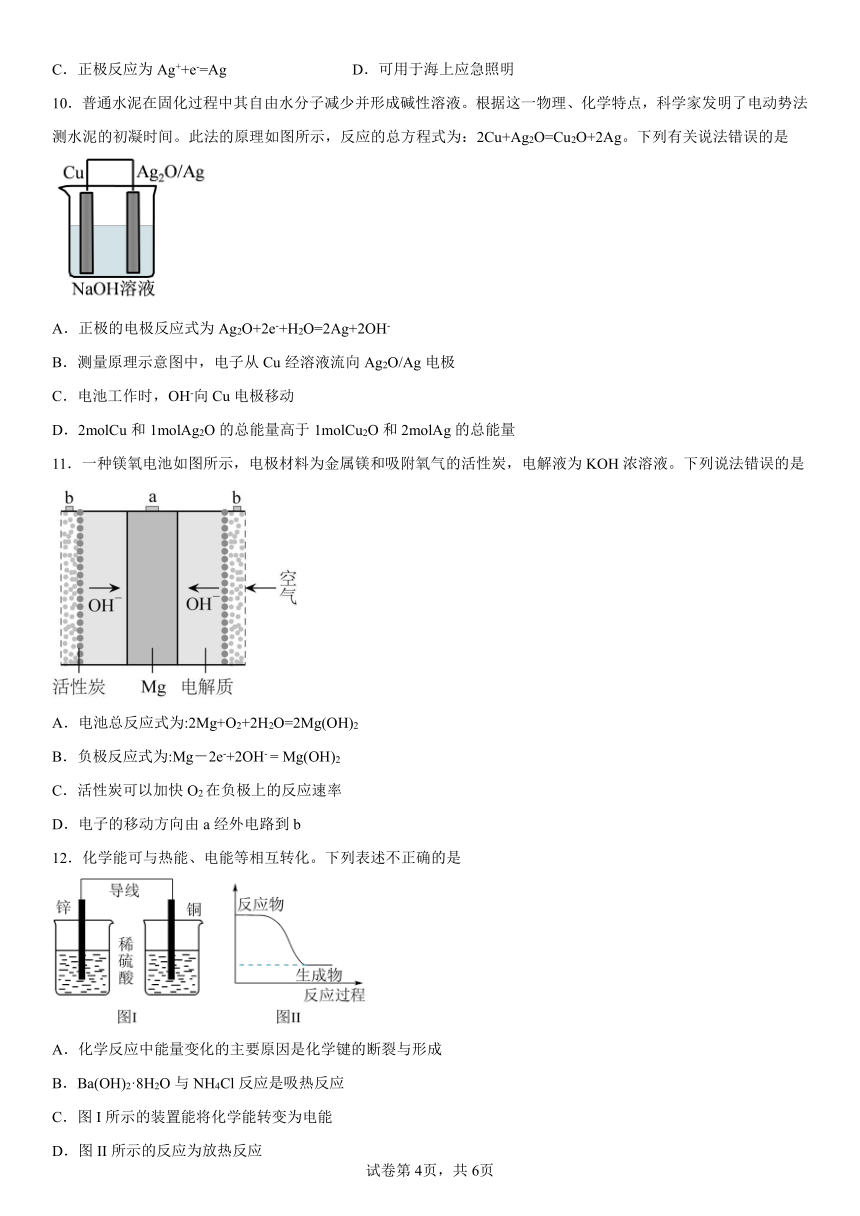
1.第二代钠离子电池是负极为镶嵌在硬碳中的钠、正极为锰基高锰普鲁士白的一种新型二次电池,其工作原理如图所示。下列说法错误的是
A.放电时,B极为负极,发生氧化反应
B.充电时,在从阳极脱嵌,在阴极嵌入
C.放电时,电解质溶液中的穿过离子交换膜向A极移动
D.充电时,A极反应为
2.氢燃料电池是目前最具发展前景的新能源方式,如能普及并应用在车辆及其他高污染之发电工具上,将能显著减轻空气污染及温室效应。下列有关氢燃料电池的说法正确的是
A.通入氢气的电极发生还原反应
B.电解液中阳离子向通入氢气的方向移动
C.正极的电极反应式为:O2+4H++4e-═2H2O
D.放电过程中电解液的浓度不断增大
3.某兴趣小组设计如图所示的装置进行原电池原理的探究。下列叙述错误的是
A.a和b不连接时,锌片上有气体生成,该装置不能形成原电池
B.a和b用导线连接时锌片为负极,发生的反应式为:Zn-2e-=Zn2+
C.a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
D.无论a和b是否连接,稀硫酸均参与反应
4.锌铜原电池装置如图所示,下列说法正确的是
A.铜片作负极
B.电流从锌片流向铜片
C.盐桥的作用是传递电子
D.锌电极的反应式:Zn 2e-=Zn2+
5.在如图所示的装置,a为活泼性顺序位于氢之前的金属,b为石墨棒,关于此装置的各种叙述正确的是
A.石墨棒上有气体放出,溶液酸性变弱
B.a是正极,b是负极
C.导线中有电子流动,电流方向是从a极到b极
D.b极附近的SO浓度逐渐增大
6.肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH=+108. 3 kJ/mol
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol
下列说法正确的是( )
A.反应①中反应物所具有的总能量大于生成物所具有的总能量
B.N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH=-642. 3 kJ/mol
C.铂作电极,硫酸溶液作电解质溶液,由反应②设计的燃料电池其负极反应式为:N2H4-4e-=N2↑+4H+
D.铂作电极,氢氧化钾溶液作电解质溶液,由反应②设计的燃料电池工作一段时间,氢氧化钾溶液的pH将增大
7.2020年3月29日,全球新能源汽车领导者比亚迪宣布正式推出“刀片电池”。“刀片电池”是将传统磷酸铁锂电池电芯加长,使单个电芯形状扁平、窄小,再通过多个“刀片”捆扎形成模组,通过少数几个大模组的组合成电池。“刀片电池”放电时结构如下,正极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4,下列说法错误的是
A.“刀片电池”和三元锂电池(镣钻锭酸锂电池)相比几乎没有污染
B.放电时,负极反应为LiC6-xe-=xLi++Li1-xC6
C.充电时,锂离子在阴极脱嵌;放电时,锂离子在正极脱嵌
D.该电池维持电流强度4.825A,工作10分钟,理论上正极增加重量0.21g(已知F=96500C/mol)
8.下列原电池在工作时,铜电极有电流流入的是
A. B.
C. D.
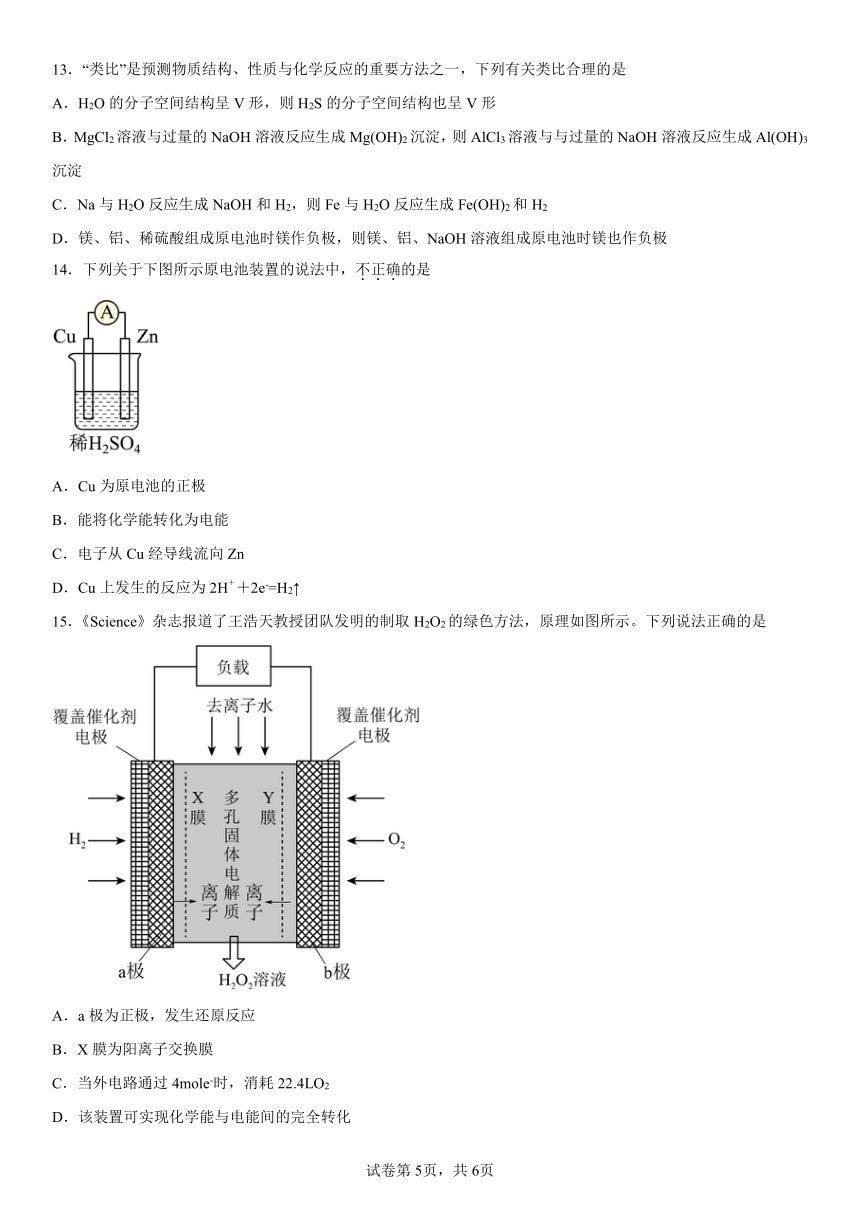
9.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg= Mg2++2Ag+2Cl-,有关该电池说法错误的是
A.镁为电池负极 B.有24g镁被氧化时,还原得到216g银
C.正极反应为Ag++e-=Ag D.可用于海上应急照明
10.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag。下列有关说法错误的是
A.正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
B.测量原理示意图中,电子从Cu经溶液流向Ag2O/Ag电极
C.电池工作时,OH-向Cu电极移动
D.2molCu和1molAg2O的总能量高于1molCu2O和2molAg的总能量
11.一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是
A.电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2
B.负极反应式为:Mg-2e-+2OH- = Mg(OH)2
C.活性炭可以加快O2在负极上的反应速率
D.电子的移动方向由a经外电路到b
12.化学能可与热能、电能等相互转化。下列表述不正确的是
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.Ba(OH)2·8H2O与NH4Cl反应是吸热反应
C.图I所示的装置能将化学能转变为电能
D.图II所示的反应为放热反应
13.“类比”是预测物质结构、性质与化学反应的重要方法之一,下列有关类比合理的是
A.H2O的分子空间结构呈V形,则H2S的分子空间结构也呈V形
B.MgCl2溶液与过量的NaOH溶液反应生成Mg(OH)2沉淀,则AlCl3溶液与与过量的NaOH溶液反应生成Al(OH)3沉淀
C.Na与H2O反应生成NaOH和H2,则Fe与H2O反应生成Fe(OH)2和H2
D.镁、铝、稀硫酸组成原电池时镁作负极,则镁、铝、NaOH溶液组成原电池时镁也作负极
14.下列关于下图所示原电池装置的说法中,不正确的是
A.Cu为原电池的正极
B.能将化学能转化为电能
C.电子从Cu经导线流向Zn
D.Cu上发生的反应为2H++2e-=H2↑
15.《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示。下列说法正确的是
A.a极为正极,发生还原反应
B.X膜为阳离子交换膜
C.当外电路通过4mole-时,消耗22.4LO2
D.该装置可实现化学能与电能间的完全转化
二、填空题
16.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的正极发生____反应(填“氧化”或“还原”),电极反应式为___________,电解质溶液是____;
(2)正极上出现的现象是________________________________________
(3)若导线上转移电子1 mol,则负极质量变化____克。
17.填空。
(1)写出漂白粉有效成分的化学式_______。
(2)写出的电子式_______。
(3)铅酸蓄电池是常见的二次电池,放电时发生反应为:。Pb为该电池的_______ (填“正极”或“负极”),该电极发生的反应方程式为_______。
三、实验题
18.铁是人们在日常生活和工农业生产中应用极为广泛的一种金属。请回答下列问题:
(1)某研究性学习小组为了证明铁的金属性比铜的强,设计了如下几种方案,其中合理的有___(填序号)。
A.铁片置于硫酸铜溶液中置换出铜
B.铁、铜与氯气反应分别生成FeCl3、CuCl2
C.铜片置于FeCl3溶液中,铜片逐渐溶解
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片上无气泡产生
E.常温下,将铁片和铜片分别置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属性比铜的强的实验。要求:该实验方案的原理不同于(1)中任何一个方案。
①画出实验装置图并注明所需药品___。
②写出实验过程中的主要现象:___。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.原电池中正极电势高于负极,放电时,B是负极,发生氧化反应,A项正确;
B.充电是放电的逆过程,充电时,钠离子从阳极脱嵌,在阴极嵌入,B项正确;
C.放电时,电解质溶液中的钠离子穿过离子交换膜向A极移动,C正确;
D.充电时,A是阳极,应该是失去电子发生氧化反应,D项错误;
答案选D。
2.C
【详解】A.通入氢气的电极是负极,发生氧化反应,A错误;
B.电解液中阳离子向正极移动,反应中通入氧气的一端为正极,即电解液中阳离子向通入氧气的方向移动,B错误;
C.正极上,氧气与氢离子结合生成水,电极反应式为:O2+4H++4e-═2H2O,C正确;
D.放电过程中不断的生成水,电解液的浓度减小,D错误;
故选C。
3.C
【详解】A.a和b不连接时,没有形成闭合回路,没有构成原电池,锌和氢离子反应生成氢气,故A正确;
B.导线连接后,构成原电池,锌比铜活泼,锌作负极,电极发生的反应为Zn-2e-=Zn2+,故B正确;
C.电子由负极即锌经导线流向正极即铜,但电子不能经过溶液,内电路是离子的定向移动,故C错误;
D.a和b不连接时,锌与稀硫酸反应生成氢气,而a和b连接时构成原电池,发生原电池反应,硫酸电离氢离子在正极发生还原反应,两种情况下的反应实质都是锌与稀硫酸反应Zn+H2SO4=ZnSO4+H2↑,故D正确;
故答案为:C。
4.D
【详解】
A.由于锌比铜活泼,故锌片作负极,故A错误;
B.电流是从正极流向负极,即从铜片流向锌片,故B错误;
C.盐桥不能传递电子,而是盐桥中的阴、阳离子定向移动而导电的,故C错误;
D.锌电极是负极,发生还原反应,故其电极反应式为Zn 2e-=Zn2+,故D正确;
答案为D。
5.A
【分析】原电池中活泼金属为负极,失去电子,则a为负极;溶液中的氢离子在正极得到电子而被还原为H2,则b为正极;电流方向与电子流向相反,应由正极(b)流经导线向负极(a),据此进行解答。
【详解】A.由分析可知,石墨棒为正极,有气体放出,溶液中的H+得到电子转化为H2,故溶液的酸性变弱,A正确;
B.由分析可知,a是负极,b是正极,B错误;
C.由分析可知,导线中有电子流动,电流方向是从b极经导线流到a极,C错误;
D.由分析可知,a为负极,原电池内部的溶液中阴离子流向负极,故a极附近的SO浓度逐渐增大,D错误;
故答案为:A。
6.C
【详解】A. 已知2H2O(g)+O2(g)=2H2O2(l) ΔH=+108. 3 kJ/mol,该反应为吸热反应,反应后物质能量升高,所以反应物所具有的总能量小于生成物所具有的总能量,A错误;
B. ①2H2O(g)+O2(g)=2H2O2(l) ΔH=+108. 3 kJ/mol,②N2H4(l)+O2(g)=N2(g)+2H2O(g),△H=-534 kJ/mol ,根据盖斯定律,将②-①整理可得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642. 3 kJ/mol,反应生成的水为液态时放热更多,反应热小于-642. 3 kJ/mol,B错误;
C. 铂作电极,硫酸溶液作电解质溶液,负极是N2H4失电子生成N2和H2O,则其电极反应式为:N2H4-4e-=N2+4H+,C正确;
D. 铂作电极,氢氧化钾溶液作电解质溶液,已知该电池反应的总方程为:N2H4+O2=N2+2H2O,尽管KOH未参加反应,,但反应生成水,使溶液的体积增大,因此氢氧化钾的浓度减小,溶液的pH减小,D错误;
故合理选项是C。
7.C
【分析】磷酸铁锂电池放电时,负极反应:LiC6-xe-=xLi++Li1-xC6,正极反应:Li1-xFePO4+xe-+xLi+=LiFePO4;充电时,阳极接正极,电极反应式:LiFePO4- xe-= Li1-xFePO4+xLi+,阴极接负极,电极反应式:Li1-xC6+ xLi++ xe-= LiC6。
【详解】A.“刀片电池”的总反应:LiC6+ Li1-xFePO4= Li1-xC6+LiFePO4,由锂离子的得失转移而发生反应,几乎无污染,A正确,不选;
B.放电时为原电池,负极发生氧化反应,电极反应式为:LiC6-xe-=xLi++Li1-xC6,B正确,不选;
C.脱嵌意思是锂从正极材料中出来的过程,充电时,阳极的电极材料产生锂离子,电极反应式为::LiFePO4- xe-= Li1-xFePO4+xLi+,放电时,负极材料产生锂离子,电极反应式为:LiC6-xe-=xLi++Li1-xC6,则充电时,锂离子在阳极脱嵌;放电时,锂离子在负极脱嵌,C错误,符合题意;
D.维持电流强度4.825A,工作10分钟,则电量为4.825A×600s=2895C,转移电子的物质的量为,则正极增加重量为:,D正确,不选;
答案选C。
8.B
【详解】原电池中电流是由正极经导线流向负极,据此进行解题。
A.由于锌比铜活泼,故锌是负极,铜是正极,故电流由铜电极经导线流向锌电极,A不合题意;
B.由于铜比银活泼,故铜是负极,银是正极,故电流由银电极经导线流向铜电极,B符合题意;
C.由于锌比铜活泼,故锌是负极,铜是正极,故电流由铜电极经导线流向锌电极,C不合题意;
D.由于镁比铜活泼,故镁是负极,铜是正极,故电流由铜电极经导线流向镁电极,D不合题意;
故答案为:B。
9.C
【详解】A.电极方程式中Mg失去电子,做原电池负极,A正确;
B.24g Mg被氧化时转移电子2mol,有2mol AgCl得到电子,生成216g Ag,B正确;
C.正极反应为AgCl+e-=Ag+Cl-,C错误;
D.该电池可被海水激活,故可用于海上应急照明,D正确;
故选C。
10.B
【详解】A.由总反应知Ag2O得电子变为Ag,则正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,A正确;
B.Cu失去电子,为负极,则Ag2O/Ag为正极,电子从Cu经外电路流向Ag2O/Ag电极,电子不能通过溶液,B错误;
C.阴离子向负极移动,故OH-向Cu电极移动,C正确;
D.此装置能量转化为化学能转化为电能,即反应物总能量高于生成物总能量,故2molCu和1molAg2O的总能量高于1molCu2O和2molAg的总能量,D正确;
故答案为B。
11.C
【分析】该镁氧电池的负极为金属镁,正极为吸附氧气的活性炭,在电解液为KOH浓溶液条件下,负极镁失去电子变成镁离子,即电极反应方程式为Mg-2e- =Mg2+,溶液中有大量氢氧根,所以镁离子会结合氢氧根生成氢氧化镁;正极为氧气的电子转化为氢氧根,电极反应方程式为:O2+4e-+2H2O=4OH-;总电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。
【详解】A.由分析可知,总电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,故A正确;
B.由分析可知,负极电极反应方程式为:Mg-2e-+2OH- = Mg(OH)2,故B正确;
C.氧气在正极反应,所以活性炭可以加快O2在正极上的反应速率,故C错误;
D.根据原电池原理,电子从负极流出,经外电路流向正极,即电子由a经外电路到b,故D正确;
综上所述,答案为C。
12.C
【详解】A.化学反应中能量变化的主要原因是化学键的断裂与形成,因为断裂旧键要吸收能量、形成新键要放出能量,断裂化学键吸收的总能量和形成化学键释放的总能量总是不相等,化学反应才有能量的变化,故A正确,不选;
B.Ba(OH)2·8H2O与NH4Cl反应是吸热反应,故B正确,不选;
C.图I所示的装置没有形成闭合回路,不是原电池,故不能将化学能转变为电能,故C错误,符合题意;
D.图II所示的反应中,反应物的总能量高于生成物的总能量,为放热反应,故D正确,不选;
答案选C。
13.A
【详解】A.O、S为同主族元素,最外层电子数相同,二者形成的简单氢化物中,的分子空间结构呈V形,的分子空间结构也呈V形,A正确;
B.MgCl2溶液与过量的NaOH溶液反应生成Mg(OH)2沉淀,AlCl3溶液与过量的NaOH溶液反应生成NaAlO2溶液,B错误;
C.Na与H2O反应生成NaOH和H2,铁与水蒸气反应生成Fe3O4而不生成Fe(OH)3,C错误;
D.镁、铝、稀硫酸组成原电池时,镁作负极,镁、铝、NaOH溶液组成原电池时,镁不能与NaOH溶液反应,铝能与NaOH溶液反应,铝作负极,D错误;
答案选A。
14.C
【分析】图示原电池装置中,Zn比Cu活泼,Zn作负极,Zn失去电子,发生的电极反应为,Cu作正极本身不反应,硫酸作电解质,溶液中氢离子在正极得电子,发生的电极反应为,
【详解】A.根据上述分析,Cu为原电池的正极,A正确;
B.该装置为原电池,能将化学能转化为电能,B正确;
C.Zn失去电子,经导线流向Cu,氢离子在铜电极得电子产生氢气,C错误;
D.Cu作正极,发生的电极反应为,D正确;
答案选C。
15.B
【分析】本题中通入H2的a极发生氧化反应,是原电池的负极,其电极反应式为:H2-2e-=2H+。通入O2的b极发生还原反应,是原电池的正极,考虑到最终产物为H2O2,故其电极反应式为:H2O+O2+2e-=HO+OH-。负极生成的H+通过阳离子交换膜进入到电解质中,正极生成的HO通过阴离子交换膜进入到电解质中,二者结合得到H2O2。据此可分析各个选项。
【详解】A.在该原电池中,a极通入氢气,发生氧化反应,是原电池的负极,A错误;
B.a极生成的H+需要穿过X膜进入到电解质中与HO结合,X膜是阳离子交换膜,B正确;
C.当外电路流过4mol e-时,根据b极的电极反应式可知需要消耗2mol O2,但本题中未指明是否为标准状况,不能确定O2体积一定为44.8L,C错误;
D.原电池不可能实现化学能与电能的完全转化,还有一部分化学能会转化为其他形式的能量,如内能,D错误;
答案选B。
16. 还原 Ag++e-=Ag AgNO3溶液 碳棒上出现银白色物质 32
【详解】根据总反应式Cu+2Ag+=2Ag+Cu2+,铜发生氧化反应,所以铜为负极,负极反应式为Cu-2e-=Cu2+;正极是Ag+发生还原反应生成银,硝酸银作电解质。
(1)根据以上分析可知:电池的正极发生还原反应,电极反应式为Ag++e-=Ag,电解质溶液是AgNO3溶液;
(2)正极反应为Ag++e-=Ag,正极上出现的现象是碳棒上出现银白色物质生成;
(3)负极反应式为Cu-2e-=Cu2+,导线上转移电子1 mol,消耗铜0.5 mol,则负极质量减少32克。
17.(1)Ca(ClO)2
(2)
(3) 负极
【解析】(1)
漂白粉有效成分是次氯酸钙,其化学式为Ca(ClO)2;故答案为:Ca(ClO)2。
(2)
是通过共用电子对形成的共价化合物,其电子式为;故答案为:。
(3)
根据方程式分析得到Pb化合价升高,失去电子,因此Pb为该电池的负极,该电极发生的反应方程式为;故答案为:负极;。
18. AD 铁棒溶解,铜棒变粗,溶液逐渐变为浅绿色
【详解】(1)A.铁与硫酸铜反应置换出铜,说明铁的金属性比铜的强,故A正确;
B.元素在化学反应中失电子数目的多少与其单质的金属性无关,所以不能通过铁、铜与氯气反应来判断Fe与Cu的金属性强弱,故B错误;
C.铜片置于FeCl3溶液中,铜片逐渐溶解,说明还原剂Cu的还原性比还原产物Fe2+的还原性强,但无法比较Fe与Cu的金属性强弱,故C错误;
D.铁能与稀硫酸反应置换出氢气,而铜不能,说明铁的金属性比铜的强,故D正确;
E.铁遇浓硝酸发生钝化,无法证明铁、铜金属性的强弱,故E错误;
综上所述,答案为AD。
(2)除了金属活动顺序表外,在原电池中,如果两电极材料都是金属,负极金属的活泼性一般是强于正极金属的活泼性的,所以要比较铁、铜金属性强弱可以设计成铁、铜与硫酸铜溶液组成原电池的装置,装置如图:,现象为:铁棒溶解,铜棒变粗,溶液逐渐变为浅绿色;
综上所述,答案为:①;②铁棒溶解,铜棒变粗,溶液逐渐变为浅绿色。
答案第1页,共2页
答案第1页,共2页
2022-2023学年下学期高一化学人教版(2019)必修第二册
一、单选题
1.第二代钠离子电池是负极为镶嵌在硬碳中的钠、正极为锰基高锰普鲁士白的一种新型二次电池,其工作原理如图所示。下列说法错误的是
A.放电时,B极为负极,发生氧化反应
B.充电时,在从阳极脱嵌,在阴极嵌入
C.放电时,电解质溶液中的穿过离子交换膜向A极移动
D.充电时,A极反应为
2.氢燃料电池是目前最具发展前景的新能源方式,如能普及并应用在车辆及其他高污染之发电工具上,将能显著减轻空气污染及温室效应。下列有关氢燃料电池的说法正确的是
A.通入氢气的电极发生还原反应
B.电解液中阳离子向通入氢气的方向移动
C.正极的电极反应式为:O2+4H++4e-═2H2O
D.放电过程中电解液的浓度不断增大
3.某兴趣小组设计如图所示的装置进行原电池原理的探究。下列叙述错误的是
A.a和b不连接时,锌片上有气体生成,该装置不能形成原电池
B.a和b用导线连接时锌片为负极,发生的反应式为:Zn-2e-=Zn2+
C.a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
D.无论a和b是否连接,稀硫酸均参与反应
4.锌铜原电池装置如图所示,下列说法正确的是
A.铜片作负极
B.电流从锌片流向铜片
C.盐桥的作用是传递电子
D.锌电极的反应式:Zn 2e-=Zn2+
5.在如图所示的装置,a为活泼性顺序位于氢之前的金属,b为石墨棒,关于此装置的各种叙述正确的是
A.石墨棒上有气体放出,溶液酸性变弱
B.a是正极,b是负极
C.导线中有电子流动,电流方向是从a极到b极
D.b极附近的SO浓度逐渐增大
6.肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH=+108. 3 kJ/mol
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol
下列说法正确的是( )
A.反应①中反应物所具有的总能量大于生成物所具有的总能量
B.N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH=-642. 3 kJ/mol
C.铂作电极,硫酸溶液作电解质溶液,由反应②设计的燃料电池其负极反应式为:N2H4-4e-=N2↑+4H+
D.铂作电极,氢氧化钾溶液作电解质溶液,由反应②设计的燃料电池工作一段时间,氢氧化钾溶液的pH将增大
7.2020年3月29日,全球新能源汽车领导者比亚迪宣布正式推出“刀片电池”。“刀片电池”是将传统磷酸铁锂电池电芯加长,使单个电芯形状扁平、窄小,再通过多个“刀片”捆扎形成模组,通过少数几个大模组的组合成电池。“刀片电池”放电时结构如下,正极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4,下列说法错误的是
A.“刀片电池”和三元锂电池(镣钻锭酸锂电池)相比几乎没有污染
B.放电时,负极反应为LiC6-xe-=xLi++Li1-xC6
C.充电时,锂离子在阴极脱嵌;放电时,锂离子在正极脱嵌
D.该电池维持电流强度4.825A,工作10分钟,理论上正极增加重量0.21g(已知F=96500C/mol)
8.下列原电池在工作时,铜电极有电流流入的是
A. B.
C. D.
9.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg= Mg2++2Ag+2Cl-,有关该电池说法错误的是
A.镁为电池负极 B.有24g镁被氧化时,还原得到216g银
C.正极反应为Ag++e-=Ag D.可用于海上应急照明
10.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag。下列有关说法错误的是
A.正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
B.测量原理示意图中,电子从Cu经溶液流向Ag2O/Ag电极
C.电池工作时,OH-向Cu电极移动
D.2molCu和1molAg2O的总能量高于1molCu2O和2molAg的总能量
11.一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是
A.电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2
B.负极反应式为:Mg-2e-+2OH- = Mg(OH)2
C.活性炭可以加快O2在负极上的反应速率
D.电子的移动方向由a经外电路到b
12.化学能可与热能、电能等相互转化。下列表述不正确的是
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.Ba(OH)2·8H2O与NH4Cl反应是吸热反应
C.图I所示的装置能将化学能转变为电能
D.图II所示的反应为放热反应
13.“类比”是预测物质结构、性质与化学反应的重要方法之一,下列有关类比合理的是
A.H2O的分子空间结构呈V形,则H2S的分子空间结构也呈V形
B.MgCl2溶液与过量的NaOH溶液反应生成Mg(OH)2沉淀,则AlCl3溶液与与过量的NaOH溶液反应生成Al(OH)3沉淀
C.Na与H2O反应生成NaOH和H2,则Fe与H2O反应生成Fe(OH)2和H2
D.镁、铝、稀硫酸组成原电池时镁作负极,则镁、铝、NaOH溶液组成原电池时镁也作负极
14.下列关于下图所示原电池装置的说法中,不正确的是
A.Cu为原电池的正极
B.能将化学能转化为电能
C.电子从Cu经导线流向Zn
D.Cu上发生的反应为2H++2e-=H2↑
15.《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示。下列说法正确的是
A.a极为正极,发生还原反应
B.X膜为阳离子交换膜
C.当外电路通过4mole-时,消耗22.4LO2
D.该装置可实现化学能与电能间的完全转化
二、填空题
16.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的正极发生____反应(填“氧化”或“还原”),电极反应式为___________,电解质溶液是____;
(2)正极上出现的现象是________________________________________
(3)若导线上转移电子1 mol,则负极质量变化____克。
17.填空。
(1)写出漂白粉有效成分的化学式_______。
(2)写出的电子式_______。
(3)铅酸蓄电池是常见的二次电池,放电时发生反应为:。Pb为该电池的_______ (填“正极”或“负极”),该电极发生的反应方程式为_______。
三、实验题
18.铁是人们在日常生活和工农业生产中应用极为广泛的一种金属。请回答下列问题:
(1)某研究性学习小组为了证明铁的金属性比铜的强,设计了如下几种方案,其中合理的有___(填序号)。
A.铁片置于硫酸铜溶液中置换出铜
B.铁、铜与氯气反应分别生成FeCl3、CuCl2
C.铜片置于FeCl3溶液中,铜片逐渐溶解
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片上无气泡产生
E.常温下,将铁片和铜片分别置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属性比铜的强的实验。要求:该实验方案的原理不同于(1)中任何一个方案。
①画出实验装置图并注明所需药品___。
②写出实验过程中的主要现象:___。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.原电池中正极电势高于负极,放电时,B是负极,发生氧化反应,A项正确;
B.充电是放电的逆过程,充电时,钠离子从阳极脱嵌,在阴极嵌入,B项正确;
C.放电时,电解质溶液中的钠离子穿过离子交换膜向A极移动,C正确;
D.充电时,A是阳极,应该是失去电子发生氧化反应,D项错误;
答案选D。
2.C
【详解】A.通入氢气的电极是负极,发生氧化反应,A错误;
B.电解液中阳离子向正极移动,反应中通入氧气的一端为正极,即电解液中阳离子向通入氧气的方向移动,B错误;
C.正极上,氧气与氢离子结合生成水,电极反应式为:O2+4H++4e-═2H2O,C正确;
D.放电过程中不断的生成水,电解液的浓度减小,D错误;
故选C。
3.C
【详解】A.a和b不连接时,没有形成闭合回路,没有构成原电池,锌和氢离子反应生成氢气,故A正确;
B.导线连接后,构成原电池,锌比铜活泼,锌作负极,电极发生的反应为Zn-2e-=Zn2+,故B正确;
C.电子由负极即锌经导线流向正极即铜,但电子不能经过溶液,内电路是离子的定向移动,故C错误;
D.a和b不连接时,锌与稀硫酸反应生成氢气,而a和b连接时构成原电池,发生原电池反应,硫酸电离氢离子在正极发生还原反应,两种情况下的反应实质都是锌与稀硫酸反应Zn+H2SO4=ZnSO4+H2↑,故D正确;
故答案为:C。
4.D
【详解】
A.由于锌比铜活泼,故锌片作负极,故A错误;
B.电流是从正极流向负极,即从铜片流向锌片,故B错误;
C.盐桥不能传递电子,而是盐桥中的阴、阳离子定向移动而导电的,故C错误;
D.锌电极是负极,发生还原反应,故其电极反应式为Zn 2e-=Zn2+,故D正确;
答案为D。
5.A
【分析】原电池中活泼金属为负极,失去电子,则a为负极;溶液中的氢离子在正极得到电子而被还原为H2,则b为正极;电流方向与电子流向相反,应由正极(b)流经导线向负极(a),据此进行解答。
【详解】A.由分析可知,石墨棒为正极,有气体放出,溶液中的H+得到电子转化为H2,故溶液的酸性变弱,A正确;
B.由分析可知,a是负极,b是正极,B错误;
C.由分析可知,导线中有电子流动,电流方向是从b极经导线流到a极,C错误;
D.由分析可知,a为负极,原电池内部的溶液中阴离子流向负极,故a极附近的SO浓度逐渐增大,D错误;
故答案为:A。
6.C
【详解】A. 已知2H2O(g)+O2(g)=2H2O2(l) ΔH=+108. 3 kJ/mol,该反应为吸热反应,反应后物质能量升高,所以反应物所具有的总能量小于生成物所具有的总能量,A错误;
B. ①2H2O(g)+O2(g)=2H2O2(l) ΔH=+108. 3 kJ/mol,②N2H4(l)+O2(g)=N2(g)+2H2O(g),△H=-534 kJ/mol ,根据盖斯定律,将②-①整理可得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642. 3 kJ/mol,反应生成的水为液态时放热更多,反应热小于-642. 3 kJ/mol,B错误;
C. 铂作电极,硫酸溶液作电解质溶液,负极是N2H4失电子生成N2和H2O,则其电极反应式为:N2H4-4e-=N2+4H+,C正确;
D. 铂作电极,氢氧化钾溶液作电解质溶液,已知该电池反应的总方程为:N2H4+O2=N2+2H2O,尽管KOH未参加反应,,但反应生成水,使溶液的体积增大,因此氢氧化钾的浓度减小,溶液的pH减小,D错误;
故合理选项是C。
7.C
【分析】磷酸铁锂电池放电时,负极反应:LiC6-xe-=xLi++Li1-xC6,正极反应:Li1-xFePO4+xe-+xLi+=LiFePO4;充电时,阳极接正极,电极反应式:LiFePO4- xe-= Li1-xFePO4+xLi+,阴极接负极,电极反应式:Li1-xC6+ xLi++ xe-= LiC6。
【详解】A.“刀片电池”的总反应:LiC6+ Li1-xFePO4= Li1-xC6+LiFePO4,由锂离子的得失转移而发生反应,几乎无污染,A正确,不选;
B.放电时为原电池,负极发生氧化反应,电极反应式为:LiC6-xe-=xLi++Li1-xC6,B正确,不选;
C.脱嵌意思是锂从正极材料中出来的过程,充电时,阳极的电极材料产生锂离子,电极反应式为::LiFePO4- xe-= Li1-xFePO4+xLi+,放电时,负极材料产生锂离子,电极反应式为:LiC6-xe-=xLi++Li1-xC6,则充电时,锂离子在阳极脱嵌;放电时,锂离子在负极脱嵌,C错误,符合题意;
D.维持电流强度4.825A,工作10分钟,则电量为4.825A×600s=2895C,转移电子的物质的量为,则正极增加重量为:,D正确,不选;
答案选C。
8.B
【详解】原电池中电流是由正极经导线流向负极,据此进行解题。
A.由于锌比铜活泼,故锌是负极,铜是正极,故电流由铜电极经导线流向锌电极,A不合题意;
B.由于铜比银活泼,故铜是负极,银是正极,故电流由银电极经导线流向铜电极,B符合题意;
C.由于锌比铜活泼,故锌是负极,铜是正极,故电流由铜电极经导线流向锌电极,C不合题意;
D.由于镁比铜活泼,故镁是负极,铜是正极,故电流由铜电极经导线流向镁电极,D不合题意;
故答案为:B。
9.C
【详解】A.电极方程式中Mg失去电子,做原电池负极,A正确;
B.24g Mg被氧化时转移电子2mol,有2mol AgCl得到电子,生成216g Ag,B正确;
C.正极反应为AgCl+e-=Ag+Cl-,C错误;
D.该电池可被海水激活,故可用于海上应急照明,D正确;
故选C。
10.B
【详解】A.由总反应知Ag2O得电子变为Ag,则正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,A正确;
B.Cu失去电子,为负极,则Ag2O/Ag为正极,电子从Cu经外电路流向Ag2O/Ag电极,电子不能通过溶液,B错误;
C.阴离子向负极移动,故OH-向Cu电极移动,C正确;
D.此装置能量转化为化学能转化为电能,即反应物总能量高于生成物总能量,故2molCu和1molAg2O的总能量高于1molCu2O和2molAg的总能量,D正确;
故答案为B。
11.C
【分析】该镁氧电池的负极为金属镁,正极为吸附氧气的活性炭,在电解液为KOH浓溶液条件下,负极镁失去电子变成镁离子,即电极反应方程式为Mg-2e- =Mg2+,溶液中有大量氢氧根,所以镁离子会结合氢氧根生成氢氧化镁;正极为氧气的电子转化为氢氧根,电极反应方程式为:O2+4e-+2H2O=4OH-;总电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。
【详解】A.由分析可知,总电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,故A正确;
B.由分析可知,负极电极反应方程式为:Mg-2e-+2OH- = Mg(OH)2,故B正确;
C.氧气在正极反应,所以活性炭可以加快O2在正极上的反应速率,故C错误;
D.根据原电池原理,电子从负极流出,经外电路流向正极,即电子由a经外电路到b,故D正确;
综上所述,答案为C。
12.C
【详解】A.化学反应中能量变化的主要原因是化学键的断裂与形成,因为断裂旧键要吸收能量、形成新键要放出能量,断裂化学键吸收的总能量和形成化学键释放的总能量总是不相等,化学反应才有能量的变化,故A正确,不选;
B.Ba(OH)2·8H2O与NH4Cl反应是吸热反应,故B正确,不选;
C.图I所示的装置没有形成闭合回路,不是原电池,故不能将化学能转变为电能,故C错误,符合题意;
D.图II所示的反应中,反应物的总能量高于生成物的总能量,为放热反应,故D正确,不选;
答案选C。
13.A
【详解】A.O、S为同主族元素,最外层电子数相同,二者形成的简单氢化物中,的分子空间结构呈V形,的分子空间结构也呈V形,A正确;
B.MgCl2溶液与过量的NaOH溶液反应生成Mg(OH)2沉淀,AlCl3溶液与过量的NaOH溶液反应生成NaAlO2溶液,B错误;
C.Na与H2O反应生成NaOH和H2,铁与水蒸气反应生成Fe3O4而不生成Fe(OH)3,C错误;
D.镁、铝、稀硫酸组成原电池时,镁作负极,镁、铝、NaOH溶液组成原电池时,镁不能与NaOH溶液反应,铝能与NaOH溶液反应,铝作负极,D错误;
答案选A。
14.C
【分析】图示原电池装置中,Zn比Cu活泼,Zn作负极,Zn失去电子,发生的电极反应为,Cu作正极本身不反应,硫酸作电解质,溶液中氢离子在正极得电子,发生的电极反应为,
【详解】A.根据上述分析,Cu为原电池的正极,A正确;
B.该装置为原电池,能将化学能转化为电能,B正确;
C.Zn失去电子,经导线流向Cu,氢离子在铜电极得电子产生氢气,C错误;
D.Cu作正极,发生的电极反应为,D正确;
答案选C。
15.B
【分析】本题中通入H2的a极发生氧化反应,是原电池的负极,其电极反应式为:H2-2e-=2H+。通入O2的b极发生还原反应,是原电池的正极,考虑到最终产物为H2O2,故其电极反应式为:H2O+O2+2e-=HO+OH-。负极生成的H+通过阳离子交换膜进入到电解质中,正极生成的HO通过阴离子交换膜进入到电解质中,二者结合得到H2O2。据此可分析各个选项。
【详解】A.在该原电池中,a极通入氢气,发生氧化反应,是原电池的负极,A错误;
B.a极生成的H+需要穿过X膜进入到电解质中与HO结合,X膜是阳离子交换膜,B正确;
C.当外电路流过4mol e-时,根据b极的电极反应式可知需要消耗2mol O2,但本题中未指明是否为标准状况,不能确定O2体积一定为44.8L,C错误;
D.原电池不可能实现化学能与电能的完全转化,还有一部分化学能会转化为其他形式的能量,如内能,D错误;
答案选B。
16. 还原 Ag++e-=Ag AgNO3溶液 碳棒上出现银白色物质 32
【详解】根据总反应式Cu+2Ag+=2Ag+Cu2+,铜发生氧化反应,所以铜为负极,负极反应式为Cu-2e-=Cu2+;正极是Ag+发生还原反应生成银,硝酸银作电解质。
(1)根据以上分析可知:电池的正极发生还原反应,电极反应式为Ag++e-=Ag,电解质溶液是AgNO3溶液;
(2)正极反应为Ag++e-=Ag,正极上出现的现象是碳棒上出现银白色物质生成;
(3)负极反应式为Cu-2e-=Cu2+,导线上转移电子1 mol,消耗铜0.5 mol,则负极质量减少32克。
17.(1)Ca(ClO)2
(2)
(3) 负极
【解析】(1)
漂白粉有效成分是次氯酸钙,其化学式为Ca(ClO)2;故答案为:Ca(ClO)2。
(2)
是通过共用电子对形成的共价化合物,其电子式为;故答案为:。
(3)
根据方程式分析得到Pb化合价升高,失去电子,因此Pb为该电池的负极,该电极发生的反应方程式为;故答案为:负极;。
18. AD 铁棒溶解,铜棒变粗,溶液逐渐变为浅绿色
【详解】(1)A.铁与硫酸铜反应置换出铜,说明铁的金属性比铜的强,故A正确;
B.元素在化学反应中失电子数目的多少与其单质的金属性无关,所以不能通过铁、铜与氯气反应来判断Fe与Cu的金属性强弱,故B错误;
C.铜片置于FeCl3溶液中,铜片逐渐溶解,说明还原剂Cu的还原性比还原产物Fe2+的还原性强,但无法比较Fe与Cu的金属性强弱,故C错误;
D.铁能与稀硫酸反应置换出氢气,而铜不能,说明铁的金属性比铜的强,故D正确;
E.铁遇浓硝酸发生钝化,无法证明铁、铜金属性的强弱,故E错误;
综上所述,答案为AD。
(2)除了金属活动顺序表外,在原电池中,如果两电极材料都是金属,负极金属的活泼性一般是强于正极金属的活泼性的,所以要比较铁、铜金属性强弱可以设计成铁、铜与硫酸铜溶液组成原电池的装置,装置如图:,现象为:铁棒溶解,铜棒变粗,溶液逐渐变为浅绿色;
综上所述,答案为:①;②铁棒溶解,铜棒变粗,溶液逐渐变为浅绿色。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
