2023届高考化学二轮复习专题课件(共26张PPT)★★“陌生情景下”方程式的书写
文档属性
| 名称 | 2023届高考化学二轮复习专题课件(共26张PPT)★★“陌生情景下”方程式的书写 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 12:21:35 | ||
图片预览






文档简介
(共26张PPT)
2023届高考化学二轮复习专题课件★★
“陌生情景下”方程式的书写
1.书写方法
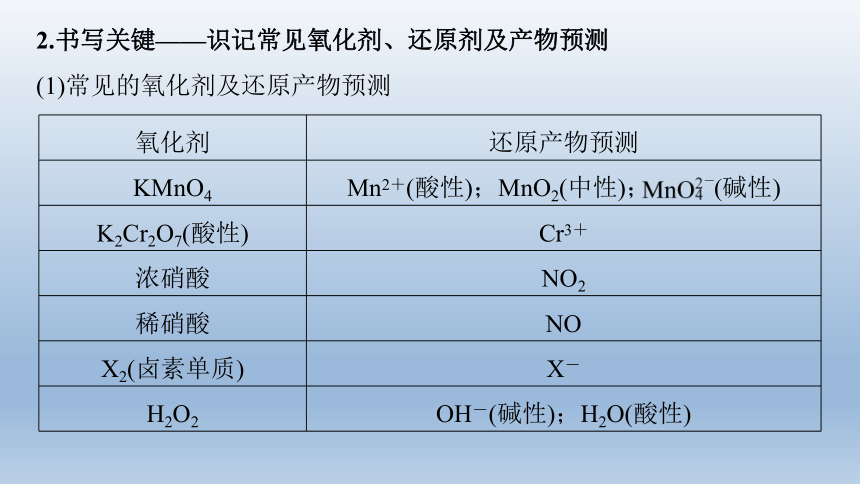
氧化剂 还原产物预测
KMnO4 Mn2+(酸性);MnO2(中性); (碱性)
K2Cr2O7(酸性) Cr3+
浓硝酸 NO2
稀硝酸 NO
X2(卤素单质) X-
H2O2 OH-(碱性);H2O(酸性)
2.书写关键——识记常见氧化剂、还原剂及产物预测
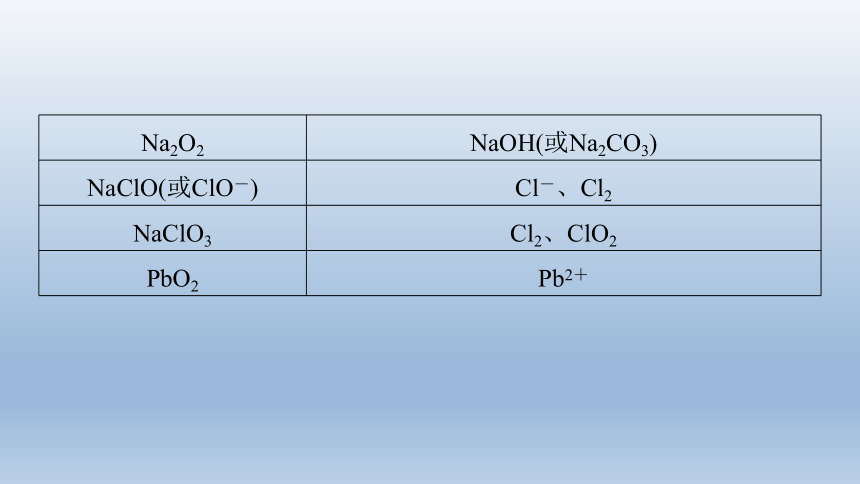
(1)常见的氧化剂及还原产物预测
Na2O2 NaOH(或Na2CO3)
NaClO(或ClO-) Cl-、Cl2
NaClO3 Cl2、ClO2
PbO2 Pb2+
还原剂 氧化产物预测
Fe2+ Fe3+(酸性);Fe(OH)3(碱性)
S2-(或H2S)
H2C2O4 CO2
H2O2 O2
I-(或HI)
CO CO2
金属单质(Zn、Fe、Cu等) Zn2+、Fe2+(与强氧化剂反应生成Fe3+)、Cu2+
(2)常见的还原剂及氧化产物预测
真题演练
1.[2021·全国甲卷,26(2)]碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为______________________________________。
2.[2021·全国乙卷,26(1)]磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
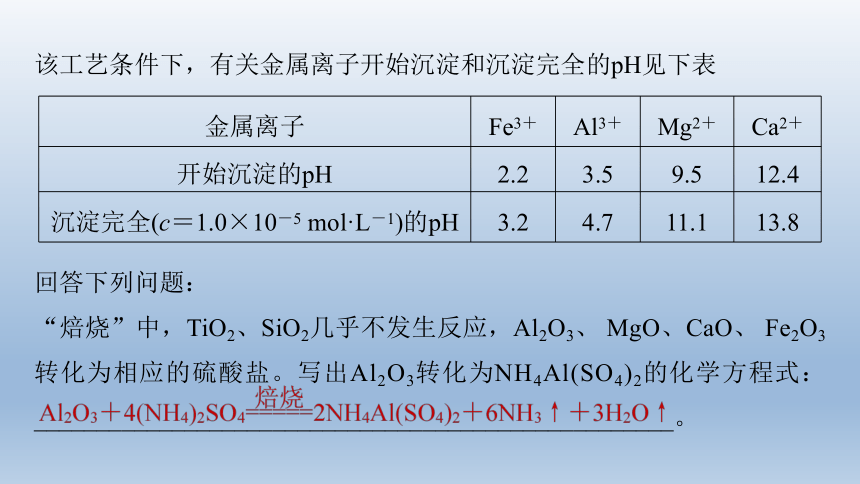
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
回答下列问题:
“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、 MgO、CaO、 Fe2O3转化为相应的硫酸盐。写出Al2O3转化为NH4Al(SO4)2的化学方程式:___________________________________________________。
金属离子 Fe3+ Al3+ Mg2+ Ca2+
开始沉淀的pH 2.2 3.5 9.5 12.4
沉淀完全(c=1.0×10-5 mol·L-1)的pH 3.2 4.7 11.1 13.8
氧化铝转化为硫酸铝铵发生的反应为氧化铝、硫酸铵在高温条件下反应生成硫酸铝铵、氨气和水,反应的化学方程式为Al2O3+4(NH4)2SO4 2NH4Al(SO4)2+6NH3↑+3H2O↑。
3.[2021·河北,15(4)(5)]绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠
和空气以外的其他原料,不产生
废弃物,实现了Cr—Fe—Al—Mg
的深度利用和Na+内循环。工艺
流程如图:
回答下列问题:
(4)工序③中发生反应的离子方程
式为_______________________________________________。
(5)物质Ⅴ可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为___________________________________________________
______________,可代替NaOH的化学试剂还有_________(填化学式)。
16CO2+8H2O
Na2CO3
碳酸氢钠代替高温连续氧化工序中
的氢氧化钠发生的主要反应为高温
下Fe(CrO2)2与氧气和碳酸氢钠反应
生成铬酸钠、氧化铁、二氧化碳和
水,反应的化学方程式为4Fe(CrO2)2
+7O2+16NaHCO3 8Na2CrO4
+2Fe2O3+16CO2+8H2O;若将碳酸氢钠换为碳酸钠也能发生类似的反应。
4.[2021·湖南,17(5)(6)节选]Ce2(CO3)3可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等物质。以独居石为原料制备Ce2(CO3)3·nH2O的工艺流程如下:
回答下列问题:
(5)“沉铈”过程中,生成Ce2(CO3)3·nH2O的离子方程式为_____________
_____________________________________。
+(n-3)H2O===Ce2(CO3)3·nH2O+3CO2↑
用碳酸氢铵“沉铈”,则结合原子守恒、电荷守恒可知,生成Ce2(CO3)3·nH2O的离子方程式为 +2Ce3++(n-3)H2O===
Ce2(CO3)3·nH2O+3CO2↑。
(6)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO和H2O,该反应的化学方程式为_______________________________________________________。
由在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO和H2O可知,该反应中Fe价态降低,C价态部分降低、部分升高,结合得失电子守恒、原子守恒可知该反应的化学方程式为6FePO4+3Li2CO3+C6H12O6 9CO↑+6H2O↑+6LiFePO4。
考向预测
1.高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺流程图如下:
“平炉”中发生反应的化学方程式为_______________________________
________。
+2H2O
根据流程图可知,在“平炉”中MnO2、KOH、O2在加热时会反应生成K2MnO4,根据原子守恒、得失电子守恒可得发生反应的化学方程式为2MnO2+O2+4KOH 2K2MnO4+2H2O。
2.在空气中加热Co(OH)2,使其转化为钴的氧化物。加热过程中,固体质量与温度的关系如下图所示。290~500 ℃,发生反应的化学方程式为______________________________。
从图中信息可知,加热前的反应物为Co(OH)2(0.930 g),其物质的量为0.01 mol,依据钴元素的质量不变可知:n(Co)=0.01 mol,m(Co)=0.590 g,温度升至290 ℃时,转化为0.830 g某种钴的氧化物,
则生成的氧化物为Co3O4;所以290~500 ℃过程中,Co2O3转化为Co3O4,反应过程中Co元素化合价降低,氧元素化合价升高并转化为O2,故反应的化学方程式为6Co2O3 4Co3O4+ O2↑。
3.根据“机理图”书写方程式。
(1)酸性环境中脱硫过程示意图如图:
过程i反应的离子方程式为_______________________________。
H2S+2Fe3+===2Fe2++S↓+2H+
1 3 Fe 8 3 1 2
H2O
(3)NaClO氧化可除去氨氮,反应机理如图所示(其中H2O和NaCl略去):
NaClO氧化NH3的总反应的化学方程式为___________________________
________。
2NH3 +3NaClO===N2+3H2O
+3NaCl
2023届高考化学二轮复习专题课件★★
“陌生情景下”方程式的书写
1.书写方法
氧化剂 还原产物预测
KMnO4 Mn2+(酸性);MnO2(中性); (碱性)
K2Cr2O7(酸性) Cr3+
浓硝酸 NO2
稀硝酸 NO
X2(卤素单质) X-
H2O2 OH-(碱性);H2O(酸性)
2.书写关键——识记常见氧化剂、还原剂及产物预测
(1)常见的氧化剂及还原产物预测
Na2O2 NaOH(或Na2CO3)
NaClO(或ClO-) Cl-、Cl2
NaClO3 Cl2、ClO2
PbO2 Pb2+
还原剂 氧化产物预测
Fe2+ Fe3+(酸性);Fe(OH)3(碱性)
S2-(或H2S)
H2C2O4 CO2
H2O2 O2
I-(或HI)
CO CO2
金属单质(Zn、Fe、Cu等) Zn2+、Fe2+(与强氧化剂反应生成Fe3+)、Cu2+
(2)常见的还原剂及氧化产物预测
真题演练
1.[2021·全国甲卷,26(2)]碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为______________________________________。
2.[2021·全国乙卷,26(1)]磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
回答下列问题:
“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、 MgO、CaO、 Fe2O3转化为相应的硫酸盐。写出Al2O3转化为NH4Al(SO4)2的化学方程式:___________________________________________________。
金属离子 Fe3+ Al3+ Mg2+ Ca2+
开始沉淀的pH 2.2 3.5 9.5 12.4
沉淀完全(c=1.0×10-5 mol·L-1)的pH 3.2 4.7 11.1 13.8
氧化铝转化为硫酸铝铵发生的反应为氧化铝、硫酸铵在高温条件下反应生成硫酸铝铵、氨气和水,反应的化学方程式为Al2O3+4(NH4)2SO4 2NH4Al(SO4)2+6NH3↑+3H2O↑。
3.[2021·河北,15(4)(5)]绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠
和空气以外的其他原料,不产生
废弃物,实现了Cr—Fe—Al—Mg
的深度利用和Na+内循环。工艺
流程如图:
回答下列问题:
(4)工序③中发生反应的离子方程
式为_______________________________________________。
(5)物质Ⅴ可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为___________________________________________________
______________,可代替NaOH的化学试剂还有_________(填化学式)。
16CO2+8H2O
Na2CO3
碳酸氢钠代替高温连续氧化工序中
的氢氧化钠发生的主要反应为高温
下Fe(CrO2)2与氧气和碳酸氢钠反应
生成铬酸钠、氧化铁、二氧化碳和
水,反应的化学方程式为4Fe(CrO2)2
+7O2+16NaHCO3 8Na2CrO4
+2Fe2O3+16CO2+8H2O;若将碳酸氢钠换为碳酸钠也能发生类似的反应。
4.[2021·湖南,17(5)(6)节选]Ce2(CO3)3可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等物质。以独居石为原料制备Ce2(CO3)3·nH2O的工艺流程如下:
回答下列问题:
(5)“沉铈”过程中,生成Ce2(CO3)3·nH2O的离子方程式为_____________
_____________________________________。
+(n-3)H2O===Ce2(CO3)3·nH2O+3CO2↑
用碳酸氢铵“沉铈”,则结合原子守恒、电荷守恒可知,生成Ce2(CO3)3·nH2O的离子方程式为 +2Ce3++(n-3)H2O===
Ce2(CO3)3·nH2O+3CO2↑。
(6)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO和H2O,该反应的化学方程式为_______________________________________________________。
由在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO和H2O可知,该反应中Fe价态降低,C价态部分降低、部分升高,结合得失电子守恒、原子守恒可知该反应的化学方程式为6FePO4+3Li2CO3+C6H12O6 9CO↑+6H2O↑+6LiFePO4。
考向预测
1.高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺流程图如下:
“平炉”中发生反应的化学方程式为_______________________________
________。
+2H2O
根据流程图可知,在“平炉”中MnO2、KOH、O2在加热时会反应生成K2MnO4,根据原子守恒、得失电子守恒可得发生反应的化学方程式为2MnO2+O2+4KOH 2K2MnO4+2H2O。
2.在空气中加热Co(OH)2,使其转化为钴的氧化物。加热过程中,固体质量与温度的关系如下图所示。290~500 ℃,发生反应的化学方程式为______________________________。
从图中信息可知,加热前的反应物为Co(OH)2(0.930 g),其物质的量为0.01 mol,依据钴元素的质量不变可知:n(Co)=0.01 mol,m(Co)=0.590 g,温度升至290 ℃时,转化为0.830 g某种钴的氧化物,
则生成的氧化物为Co3O4;所以290~500 ℃过程中,Co2O3转化为Co3O4,反应过程中Co元素化合价降低,氧元素化合价升高并转化为O2,故反应的化学方程式为6Co2O3 4Co3O4+ O2↑。
3.根据“机理图”书写方程式。
(1)酸性环境中脱硫过程示意图如图:
过程i反应的离子方程式为_______________________________。
H2S+2Fe3+===2Fe2++S↓+2H+
1 3 Fe 8 3 1 2
H2O
(3)NaClO氧化可除去氨氮,反应机理如图所示(其中H2O和NaCl略去):
NaClO氧化NH3的总反应的化学方程式为___________________________
________。
2NH3 +3NaClO===N2+3H2O
+3NaCl
同课章节目录
