2023届高考化学二轮复习专题课件(共20张PPT)★★电化学离子交换膜的分析与应用
文档属性
| 名称 | 2023届高考化学二轮复习专题课件(共20张PPT)★★电化学离子交换膜的分析与应用 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 12:22:14 | ||
图片预览





文档简介
(共20张PPT)
2023届高考化学二轮复习专题课件★★
电化学离子交换膜的分析与应用
演练
角度一 “单膜”电解池
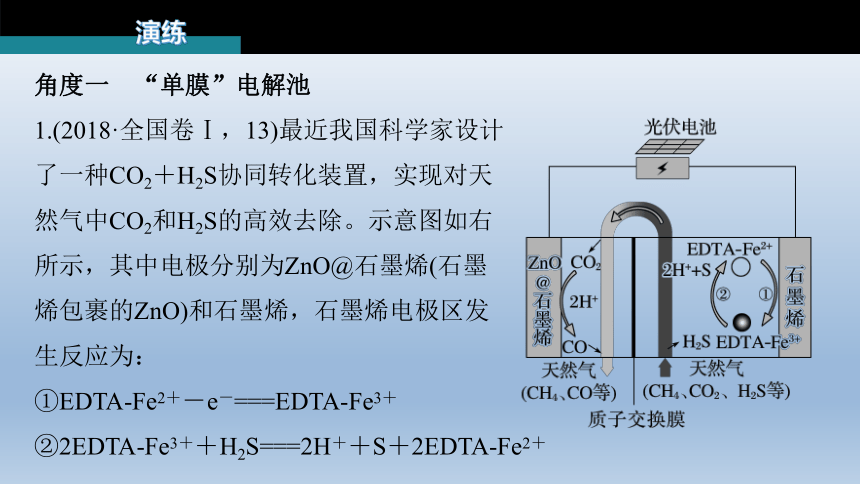
1.(2018·全国卷Ⅰ,13)最近我国科学家设计
了一种CO2+H2S协同转化装置,实现对天
然气中CO2和H2S的高效去除。示意图如右
所示,其中电极分别为ZnO@石墨烯(石墨
烯包裹的ZnO)和石墨烯,石墨烯电极区发
生反应为:
①EDTA-Fe2+-e-===EDTA-Fe3+
②2EDTA-Fe3++H2S===2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A.阴极的电极反应:CO2+2H++2e-===
CO+H2O
B.协同转化总反应:CO2+H2S===CO+
H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,
溶液需为酸性
√
由题中信息可知,石墨烯电极发生氧化反应,为电解池的阳极,则ZnO@石墨烯电极为阴极。阳极接电源正极,电势高,阴极接电源负极,电势低,故石墨烯上的电势比ZnO@石墨烯上的高,C项错误;
由题图可知,电解时阴极反应式为CO2+2H++2e-===CO+H2O,A项正确;
将阴、阳两极反应式合并可得总反应式为CO2+H2S===CO+H2O+S,B项正确;
Fe3+、Fe2+只能存在于酸性溶液中,D项正确。
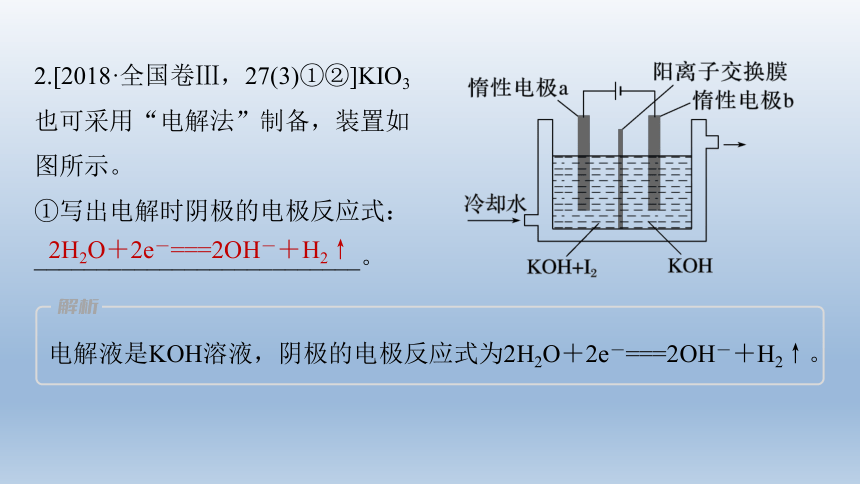
2.[2018·全国卷Ⅲ,27(3)①②]KIO3
也可采用“电解法”制备,装置如
图所示。
①写出电解时阴极的电极反应式:
__________________________。
2H2O+2e-===2OH-+H2↑
电解液是KOH溶液,阴极的电极反应式为2H2O+2e-===2OH-+H2↑。
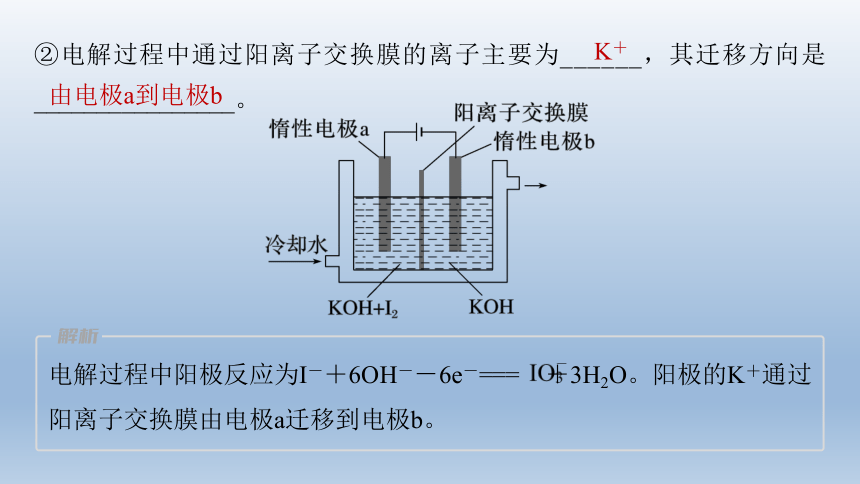
②电解过程中通过阳离子交换膜的离子主要为______,其迁移方向是________________。
K+
由电极a到电极b
电解过程中阳极反应为I-+6OH--6e-=== +3H2O。阳极的K+通过阳离子交换膜由电极a迁移到电极b。
√
根据图示的电池结构和题目所给信息可知,Ⅲ区Zn为电池的负极,电极反应为Zn-2e-+4OH-=== ,Ⅰ区MnO2为电池的正极,电极反应为MnO2+2e-+4H+===Mn2++2H2O,K+从Ⅲ区通过隔膜向Ⅱ区迁移,A错误;
Ⅰ区的 通过隔膜向Ⅱ区迁移,B正确;
MnO2电极的电极反应式为MnO2+2e-+
4H+===Mn2++2H2O,C正确;
电池的总反应为Zn+4OH-+MnO2+4H+
=== +Mn2++2H2O,D正确。
角度三 “多膜”电解池
4.[2014·全国卷Ⅰ,27(4)]H3PO2也可
用电渗析法制备。“四室电渗析法”
工作原理如图所示(阳膜和阴膜分别
只允许阳离子、阴离子通过):
①写出阳极的电极反应式:________
__________________。
2H2O-
4e-===O2↑+4H+
阳极发生氧化反应,水中的OH-失去电子,电极反应式为2H2O-4e-===O2↑+4H+。
②分析产品室可得到H3PO2的原因:_______________________________
___________________________________________________________。
阳极室的H+穿过阳膜扩散至产品
室,原料室的 穿过阴膜扩散至产品室,二者反应生成H3PO2
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有_______杂质。该杂质产生的原因是_____________________。
1.(2021·重庆1月适应性测试,10)双极膜在电渗析中应用广泛,它是由阳离子交换膜和阴离子交换膜复合而成。双极膜内层为水层,工作时水层中的H2O解离成H+和OH-,并分别通过离子交换膜向两侧发生迁移。下图为NaBr溶液的电渗析装置示意图。
下列说法正确的是
A.出口2的产物为HBr溶液
B.出口5的产物为硫酸溶液
C.Br-可从盐室最终进入阳极液中
D.阴极反应式为2H++2e-===H2↑
考向预测
√
电解时,双极膜中的氢氧根离子向阳极移动,进入交换室1,盐室中的Na+向阴极移动,进入交换
室1,则出口2的产物为NaOH
溶液,A错误;
钠离子不能通过双极膜,故出
口5不是硫酸,B错误;
Br-通过阴离子交换膜进入交换室2,但是不能通过双极膜,所以Br-不会从盐室最终进入阳极液中,C错误;
电解池阴极处,发生还原反应,水解离成H+和OH-,则在阴极发生的反应为2H++2e-===H2↑,D正确。
2.[2021·河北1月选考模拟,18(1)(2)(3)(4)(5)]我国科学家最近发明了一种Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
回答下列问题:
(1)电池中,Zn为______极,B区域的电
解质为_______(填“K2SO4”“H2SO4”
或“KOH”)。
负
K2SO4
根据图示可知,Zn电极失去电子生成Zn2+,与溶液中的OH-结合形成 ,所以Zn电极为负极;在A区域的电解质为KOH,在B区域的电解质为K2SO4,C区域电解质为H2SO4。
(2)电池反应的离子方程式为_________________________________________。
(3)阳离子交换膜为图中的______(填“a”或“b”)膜。
a
(4)此电池中,消耗6.5 g Zn,理论上可产生的容量(电量)为________毫安时(mAh)(1 mol电子的电量为1 F,1 F=96 500 C·mol-1,结果保留整数)。
5 361
(5)已知E为电池电动势[电池电动势即电池的理论电压,是两个电极电位之差,E=E(+)-E(-)],ΔG为电池反应的自由能变,则该电池与传统铅酸蓄电池相比较, ______ ; ________
(填“>”或“<”)。
>
<
由于Zn比Pb活动性强,正极材料都是PbO2,所以Zn-PbO2的电势差比Pb-PbO2的电势差大,则 > ;不同电池的电势差越大,电池反应的自由能变就越小,由于Zn-PbO2的电势差比Pb-PbO2的电势差大,所以 < 。
2023届高考化学二轮复习专题课件★★
电化学离子交换膜的分析与应用
演练
角度一 “单膜”电解池
1.(2018·全国卷Ⅰ,13)最近我国科学家设计
了一种CO2+H2S协同转化装置,实现对天
然气中CO2和H2S的高效去除。示意图如右
所示,其中电极分别为ZnO@石墨烯(石墨
烯包裹的ZnO)和石墨烯,石墨烯电极区发
生反应为:
①EDTA-Fe2+-e-===EDTA-Fe3+
②2EDTA-Fe3++H2S===2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A.阴极的电极反应:CO2+2H++2e-===
CO+H2O
B.协同转化总反应:CO2+H2S===CO+
H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,
溶液需为酸性
√
由题中信息可知,石墨烯电极发生氧化反应,为电解池的阳极,则ZnO@石墨烯电极为阴极。阳极接电源正极,电势高,阴极接电源负极,电势低,故石墨烯上的电势比ZnO@石墨烯上的高,C项错误;
由题图可知,电解时阴极反应式为CO2+2H++2e-===CO+H2O,A项正确;
将阴、阳两极反应式合并可得总反应式为CO2+H2S===CO+H2O+S,B项正确;
Fe3+、Fe2+只能存在于酸性溶液中,D项正确。
2.[2018·全国卷Ⅲ,27(3)①②]KIO3
也可采用“电解法”制备,装置如
图所示。
①写出电解时阴极的电极反应式:
__________________________。
2H2O+2e-===2OH-+H2↑
电解液是KOH溶液,阴极的电极反应式为2H2O+2e-===2OH-+H2↑。
②电解过程中通过阳离子交换膜的离子主要为______,其迁移方向是________________。
K+
由电极a到电极b
电解过程中阳极反应为I-+6OH--6e-=== +3H2O。阳极的K+通过阳离子交换膜由电极a迁移到电极b。
√
根据图示的电池结构和题目所给信息可知,Ⅲ区Zn为电池的负极,电极反应为Zn-2e-+4OH-=== ,Ⅰ区MnO2为电池的正极,电极反应为MnO2+2e-+4H+===Mn2++2H2O,K+从Ⅲ区通过隔膜向Ⅱ区迁移,A错误;
Ⅰ区的 通过隔膜向Ⅱ区迁移,B正确;
MnO2电极的电极反应式为MnO2+2e-+
4H+===Mn2++2H2O,C正确;
电池的总反应为Zn+4OH-+MnO2+4H+
=== +Mn2++2H2O,D正确。
角度三 “多膜”电解池
4.[2014·全国卷Ⅰ,27(4)]H3PO2也可
用电渗析法制备。“四室电渗析法”
工作原理如图所示(阳膜和阴膜分别
只允许阳离子、阴离子通过):
①写出阳极的电极反应式:________
__________________。
2H2O-
4e-===O2↑+4H+
阳极发生氧化反应,水中的OH-失去电子,电极反应式为2H2O-4e-===O2↑+4H+。
②分析产品室可得到H3PO2的原因:_______________________________
___________________________________________________________。
阳极室的H+穿过阳膜扩散至产品
室,原料室的 穿过阴膜扩散至产品室,二者反应生成H3PO2
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有_______杂质。该杂质产生的原因是_____________________。
1.(2021·重庆1月适应性测试,10)双极膜在电渗析中应用广泛,它是由阳离子交换膜和阴离子交换膜复合而成。双极膜内层为水层,工作时水层中的H2O解离成H+和OH-,并分别通过离子交换膜向两侧发生迁移。下图为NaBr溶液的电渗析装置示意图。
下列说法正确的是
A.出口2的产物为HBr溶液
B.出口5的产物为硫酸溶液
C.Br-可从盐室最终进入阳极液中
D.阴极反应式为2H++2e-===H2↑
考向预测
√
电解时,双极膜中的氢氧根离子向阳极移动,进入交换室1,盐室中的Na+向阴极移动,进入交换
室1,则出口2的产物为NaOH
溶液,A错误;
钠离子不能通过双极膜,故出
口5不是硫酸,B错误;
Br-通过阴离子交换膜进入交换室2,但是不能通过双极膜,所以Br-不会从盐室最终进入阳极液中,C错误;
电解池阴极处,发生还原反应,水解离成H+和OH-,则在阴极发生的反应为2H++2e-===H2↑,D正确。
2.[2021·河北1月选考模拟,18(1)(2)(3)(4)(5)]我国科学家最近发明了一种Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
回答下列问题:
(1)电池中,Zn为______极,B区域的电
解质为_______(填“K2SO4”“H2SO4”
或“KOH”)。
负
K2SO4
根据图示可知,Zn电极失去电子生成Zn2+,与溶液中的OH-结合形成 ,所以Zn电极为负极;在A区域的电解质为KOH,在B区域的电解质为K2SO4,C区域电解质为H2SO4。
(2)电池反应的离子方程式为_________________________________________。
(3)阳离子交换膜为图中的______(填“a”或“b”)膜。
a
(4)此电池中,消耗6.5 g Zn,理论上可产生的容量(电量)为________毫安时(mAh)(1 mol电子的电量为1 F,1 F=96 500 C·mol-1,结果保留整数)。
5 361
(5)已知E为电池电动势[电池电动势即电池的理论电压,是两个电极电位之差,E=E(+)-E(-)],ΔG为电池反应的自由能变,则该电池与传统铅酸蓄电池相比较, ______ ; ________
(填“>”或“<”)。
>
<
由于Zn比Pb活动性强,正极材料都是PbO2,所以Zn-PbO2的电势差比Pb-PbO2的电势差大,则 > ;不同电池的电势差越大,电池反应的自由能变就越小,由于Zn-PbO2的电势差比Pb-PbO2的电势差大,所以 < 。
同课章节目录
