河南省驻马店市2022-2023学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 河南省驻马店市2022-2023学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 14:50:26 | ||
图片预览



文档简介
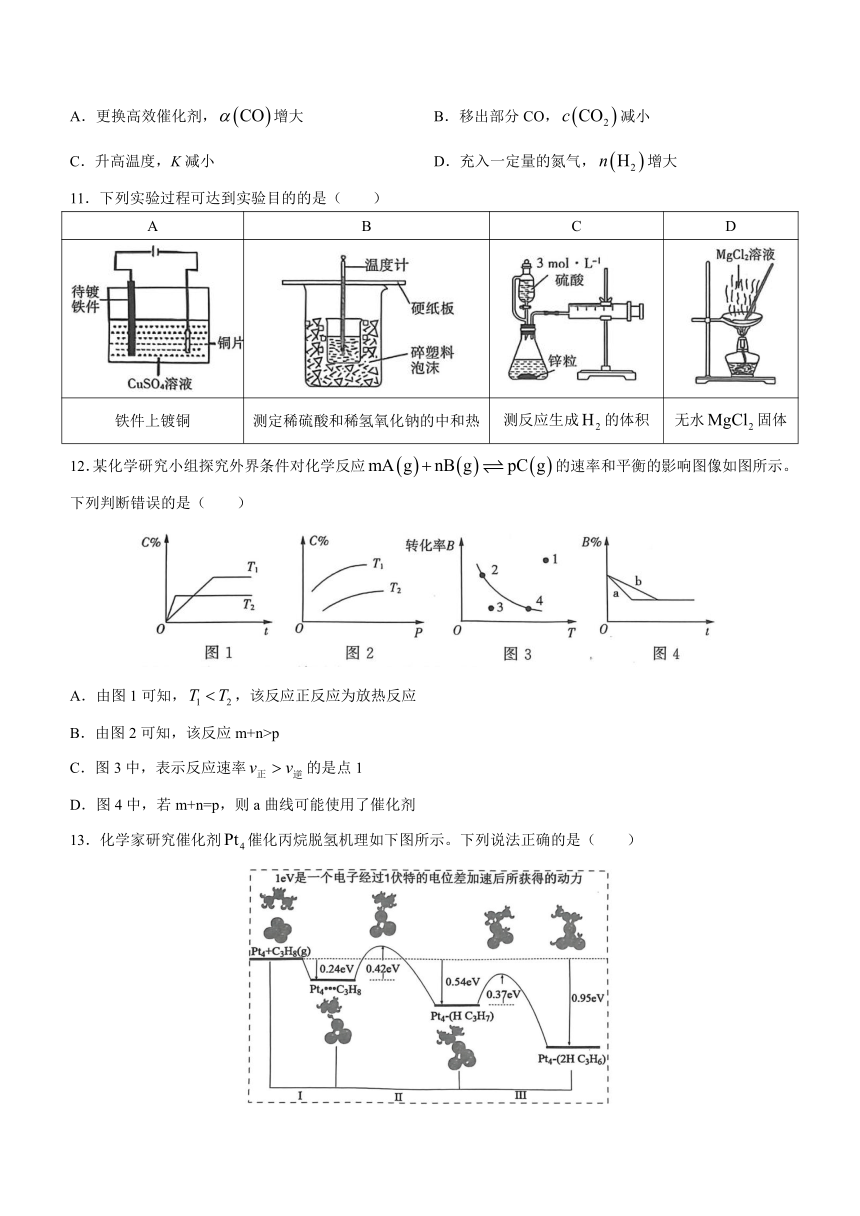
驻马店市2022-2023学年高二上学期期末考试
化学试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.2022年12月4日随着神舟十四号返回舱在东风着陆场成功着陆,载人飞行任务取得圆满成功。“天宫课堂”在中国空间站的开展,展示了我国科技发展的巨大成就。下列说法正确的是( )
A.A.“太空冰雪实验”中,乙酸钠过饱和溶液结晶形成温热“冰球”,该过程放出热量
B.“五环实验”中,向乙酸溶液中滴加甲基橙溶液后变成黄色
C.在太空失重状态下,“水油分离实验”中,能通过分液实现水和油的分离
D.由“泡腾片(主要成分为柠檬酸和碳酸氢钠)实验”可知,酸性:碳酸>柠檬酸
2.化学与社会、生活密切相关。下列说法不正确的是( )
打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释
B.纯铁比生铁易生锈
C.锅炉水垢中含有的,可先用溶液处理,后用盐酸除去
D.掩埋废旧电池会造成环境污染
3.设为阿伏伽德罗常数的值。下列说法正确的是( )
A.11.2 L(标准状况)完全溶于水后溶液中分子数为0.5
B.1 L 1 mol/L 溶液中与离子数之和大于
C.常温下0.1 mol/L 溶液中的数目为0.1
D.电解熔融,阴极增重2.4 g,外电路中通过的电子数为0.1
4.用标准NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,则原因可能是( )
A.用滴定管量取标准液时,先俯视后仰视
B.锥形瓶洗净后瓶内残留有少量蒸馏水
C.滴定到终点读数时,发现滴定管尖嘴处悬挂了一滴溶液
D.配制标准溶液的固体NaOH中混有杂质
5.通常情况下,原子核外p、d能级等原子轨道上电子排布为“全空”“半充满”“全充满”的时候更加稳定,称为洪特规则的特例。下列事实能作为这个规则的证据的是( )
①某种激发态碳原子的电子排布式是而不是
②基态He原子的电子排布式为,基态H原子的电子排布式为
③基态Cu原子的电子排布式是而不是
④容易失电子转变为,表现出较强的还原性
A.①②④ B.②③ C.③④ D.①②③
6.常温下,下列离子能在指定的溶液中一定能大量共存的是( )
A.使紫色石蕊试液变红的溶液中:、、、
B.pH=9的溶液中:、、、
C.由水电离的的溶液中:、、、
D.在溶质为溶液中:、、、
7.下列与原子核外电子排布规律相关的叙述中(N为能层序数),不正确的是( )
A.ns电子的能量一定高于电子的能量
B.根据构造原理,电子填入能级的顺序是
C.第三周期元素的基态原子中,未成对电子数最多的是磷
D.各能层含有的电子数均为
8.在容积不变的密闭容器中,A与B反应生成C,其化学反应速率分别用,,表示。已知:,,则此反应的化学方程式可表示为( )
A. B. C. D.
9.在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如右图所示。下列说法错误的是( )
A.加水前导电能力约为零的原因是冰醋酸中几乎没有自由移动的离子
B.a、b、c三点对应的溶液中,电离程度最大的是c
C.a、b、c三点对应的溶液中,由小到大的顺序是cD.在b点加入浓硫酸,可使溶液中增大、增大
10.已知反应 ,一定温度和压强下,在某密闭容器中反应达到平衡。下列叙述正确的是( )
A.更换高效催化剂,增大 B.移出部分CO,减小
C.升高温度,K减小 D.充入一定量的氮气,增大
11.下列实验过程可达到实验目的的是( )
A B C D
铁件上镀铜 测定稀硫酸和稀氢氧化钠的中和热 测反应生成的体积 无水固体
12.某化学研究小组探究外界条件对化学反应的速率和平衡的影响图像如图所示。下列判断错误的是( )
A.由图1可知,,该反应正反应为放热反应
B.由图2可知,该反应m+n>p
C.图3中,表示反应速率的是点1
D.图4中,若m+n=p,则a曲线可能使用了催化剂
13.化学家研究催化剂催化丙烷脱氢机理如下图所示。下列说法正确的是( )
A.由图可知催化大致经过阶段工(吸附)、反应Ⅱ(断裂第1个C-H键)、反应Ⅲ(断裂第2个C-H键)
B.反应Ⅱ活化能最大,不是催化丙烷脱氢的决速阶段
C.1 mol 在催化下反应生成1 mol 时,放出的热量为0.95eV
D.若该催化反应在绝热容器中按照先发生工,后发生Ⅱ,再发生Ⅲ,则完成反应Ⅱ后,需要再加热才能发生反应Ⅲ
14.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如右图所示。下列有关微生物电池的说法正确的是( )
A.燃料电池总反应和燃料燃烧方程式不相同
B.正极的电极反应式为
C.质子通过交换膜从正极区移向负极区
D.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池
15.由γ-烃基丁酸生成γ-丁内酯()的反应如下:。在25℃时,2L溶液中γ-烃基丁酸的初始浓度为0.180 mol/L,随着反应的进行,测得γ-丁内酯的浓度随时间的变化如下表所示。
t/min 21 50 80 100 120 160 220 ∞
c/() 0.024 0.050 0.071 0.081 0.090 0.104 0.116 0.132
下列说法中错误的是( )
A.适当控制反应温度可提高平衡时γ-烃基丁酸的转化率
B.在120min时,γ-烃基丁酸的转化率为50%
C.在80~100min内,以γ-丁内酯的浓度变化表示的反应速率为 mol/(L·min)
D.在25℃时,该反应的平衡常数为
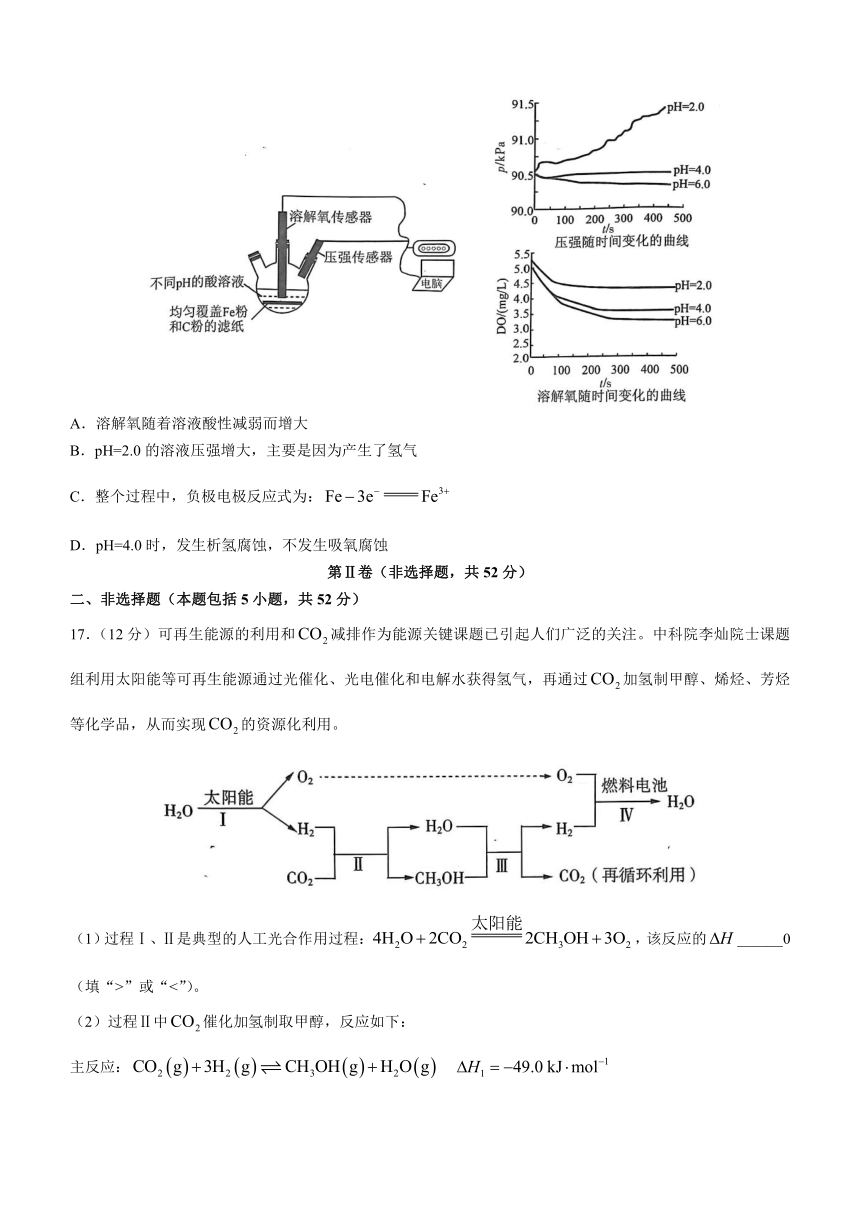
16.用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定三颈烧瓶中压强随时间变化关系以及溶解氧(DO)随时间变化关系的曲线如下。下列说法正确的是( )
A.溶解氧随着溶液酸性减弱而增大
B.pH=2.0的溶液压强增大,主要是因为产生了氢气
C.整个过程中,负极电极反应式为:
D.pH=4.0时,发生析氢腐蚀,不发生吸氧腐蚀
第Ⅱ卷(非选择题,共52分)
二、非选择题(本题包括5小题,共52分)
17.(12分)可再生能源的利用和减排作为能源关键课题已引起人们广泛的关注。中科院李灿院士课题组利用太阳能等可再生能源通过光催化、光电催化和电解水获得氢气,再通过加氢制甲醇、烯烃、芳烃等化学品,从而实现的资源化利用。
(1)过程Ⅰ、Ⅱ是典型的人工光合作用过程:,该反应的______0(填“>”或“<”)。
(2)过程Ⅱ中催化加氢制取甲醇,反应如下:
主反应:
副反应:
①CO、生成的热化学方程式是______。
②提高在平衡体系中的含量,可采取如下措施:______(写出两条即可)。
(3)过程Ⅲ制得的中混有CO,去除CO的反应如下:。在容积不变的密闭容器中,将0.1 mol CO、0.1 mol 混合加热到830℃发生上述反应,下列情况说明该反应一定达到化学平衡的是______(填标号)。
a.CO的物质的量不再发生变化
b.CO与的物质的量浓度相等
c.
d.
(4)已知催化还原的机理及能量变化关系如下图。为使能较快还原为,重点应研究催化加快图中______(填写下图中序号“①”“②”“③”…等)的反应速率。
(5)我国科学家研发了一种水系可逆电池,电极材料为金属锌和选择性催化材料,电池工作时,双极隔膜(由阴、阳膜复合而成)层间的解离成和,在外加电场中可透过相应的离子膜定向移动。电池工作原理如下图所示:
①充电时,电解质溶液1中阴离子向______(填“双极隔膜”或“金属锌”)移动。
②放电时,电池正极反应为______。
18.(10分)根据下表所列四种物质的溶液(均为0.1000mol/L)在25℃时的相关数据,按要求填空:
溶液编号 (Ⅰ) (Ⅱ) (Ⅲ) (Ⅳ)
溶质
pH 2.5 6 5.5 3
(1)用离子方程式表示(Ⅰ)溶液酸性最强的主要原因______。
(2)25℃时,(Ⅱ)溶液和(Ⅳ)溶液中由水电离出的之比是______。
(3)比较(Ⅰ)、(Ⅱ)、(Ⅲ)溶液中由大到小的顺序是______(填标号)。
(4)向10 mL的(Ⅳ)溶液中加入蒸馏水,将其稀释到1L后,下列说法正确的是______(填标号)。
A.的电离程度增大 B.减小
C.增大 D.的数目增多
(5)某温度下,用0.1000 mol/L NaOH溶液滴定20.00mL(Ⅳ)溶液所得到滴定曲线如下图:
①该温度下,的电离平衡常数______。
②当NaOH溶液的体积为10.00mL时,溶液中:______(填“>”、“<”或“=”)
③滴定时若选择酚酞做指示剂,判断滴定终点的方法是:______。
19.(10分)合成氨是人类科学技术上的~项重大突破,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的核外电子排布式为______,占据最高能级电子的电子云轮廓图为______形。
②分子中,与N原子相连的H显正电性。N、H电负性由大到小的顺序为______。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有、、CaO、MgO、等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是______。
②比较Mg、Ca的第一电离能:______(填“大于”或“小于”)
(3)我国科研人员研制出了“Fe-LiH”催化剂,温度、压强分别降到了350℃、1MPa。这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的价电子排布图为______,铁在元素周期表中的位置______。
②比较与的半径大小关系:______(填“>”或“<”)。
20.(10分)金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石()转化为,再进一步还原得到钛。回答下列问题:
(1)转化为有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
,
(ⅱ)碳氯化:
,
①对于直接氯化反应:增大压强,平衡______ 移动(填“向左”“向右”或“不”);温度升高,平衡转化率______(填“变大”“变小”或“不变”)。
②直接氯化的反应趋势远小于碳氯化,其原因是______。
(2)在,将、C、按物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如下图所示。
①反应的平衡常数______Pa()。
②图中显示,在200℃平衡时几乎完全转化为,但实际生产中反应温度却远高于此温度,其原因是______。
(3)直接氯化和碳氯化都属于“气—固”反应,工业生产中有利于“气—固”充分接触的措施是______。
21.(10分)2021年6月24日,《一种硫酸铜废液制备高纯氧化铜》获得第22届中国专利优秀奖,其工艺流程如下:
已知:①硫酸铜废液中的杂质离子仅含、、、等。
②25℃时的溶度积:,。
回答下列问题:
(1)双氧水能把氧化为,右图是双氧水的氧化效率随温度变化的曲线,请解释氧化效率变化的原因______。
(2)“除铁铝”时,为使和沉淀完全(溶液中剩余离子的浓度小于 mol/L),需加入CuO调节溶液pH至______()。
(3)“洗涤”目的是为了除去硫酸铜晶体表面沾附的少量杂质,洗涤所需要的玻璃仪器有______。
(4)“水热”时,将硫酸铜晶体和尿素都加人一定体积的蒸馏水中进行加热反应,写出发生水热反应的离子方程式______。
(5)利用微生物可实现含尿素[]废水的净化,装置如右图所示:
①下列说法正确的是______(填标号)。
A.温度越高,反应速率越快,装置的转化率越高
B.该电池工作时,每4mol 通过质子交换膜时,消耗标准状况下 22.4L
C.电解质溶液中电流的方向由b到a,电子的流向与之相反
②a极的电极反应式为______。
高二化学试题参考答案
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,共48分.每小题只有一个选项符合题意)
题号 1 2 3 4 5 6 7 8
答案 A B B D C A D C
题号 9 10 11 12 13 14 15 16
答案 D B C C A D C B
第Ⅱ卷(非选择题 共52分)
二、非选择题(本题包括5小题,共52分)
17.(12分)
(1)>(1分)
(2)① (2分,方程式及状态均正确1分,焓变1分)
②将水分离出体系、降低反应温度、增大压强(2分,写对1条1分)
(3)a、d(2分)
(4)⑤(2分)
(5)双极隔膜(1分);(2分)
18.(10分)
(1)(1分)
(2)(1分)
(3)(Ⅲ)>(Ⅰ)>(Ⅱ)(1分)
(4)ABD(2分)
(5)①(2分)
②>(1分)
③当滴入最后半滴氢氧化钠溶液时,溶液颜色从无色变成浅红色,且半分钟内不褪色(或不恢复原来的颜色)(2分)
19.(10分)
(1)①(2分) 哑铃或纺锤(1分)
②N>H(1分)
(2)①Al、O(2分)
②大于(1分)
(3)①(1分);第四周期第Ⅷ族(1分)
②>(1分)
20.(10分)
(1)①不(1分);变大(1分)
②直接氯化的体系是气体分子数不变、且是吸热过程,而碳氯化反应气体分子数增加,小于0,是熵增、放热过程,熵判据与焓判据均是自发过程.(2分)
(2)①850(2分)
②为了提高反应速率,在相同时间内得到更多的产品,提高效益(2分)
(3)将固体粉碎后加入反应容器,鼓入吹起固体反应物,使固体粉末“沸腾”(2分)
21.(10分)
(1)起始阶段随着温度升高化学反应速率加快,氧化效率升高;温度升高的分解速率也会加快,后段浓度降低使氧化速率变慢,氧化效率降低(2分)
(2)4.7(1分)
(3)漏斗、烧杯、玻璃棒(2分)
(4) (2分)
(5)①B(1分)
②(2分)
化学试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.2022年12月4日随着神舟十四号返回舱在东风着陆场成功着陆,载人飞行任务取得圆满成功。“天宫课堂”在中国空间站的开展,展示了我国科技发展的巨大成就。下列说法正确的是( )
A.A.“太空冰雪实验”中,乙酸钠过饱和溶液结晶形成温热“冰球”,该过程放出热量
B.“五环实验”中,向乙酸溶液中滴加甲基橙溶液后变成黄色
C.在太空失重状态下,“水油分离实验”中,能通过分液实现水和油的分离
D.由“泡腾片(主要成分为柠檬酸和碳酸氢钠)实验”可知,酸性:碳酸>柠檬酸
2.化学与社会、生活密切相关。下列说法不正确的是( )
打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释
B.纯铁比生铁易生锈
C.锅炉水垢中含有的,可先用溶液处理,后用盐酸除去
D.掩埋废旧电池会造成环境污染
3.设为阿伏伽德罗常数的值。下列说法正确的是( )
A.11.2 L(标准状况)完全溶于水后溶液中分子数为0.5
B.1 L 1 mol/L 溶液中与离子数之和大于
C.常温下0.1 mol/L 溶液中的数目为0.1
D.电解熔融,阴极增重2.4 g,外电路中通过的电子数为0.1
4.用标准NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,则原因可能是( )
A.用滴定管量取标准液时,先俯视后仰视
B.锥形瓶洗净后瓶内残留有少量蒸馏水
C.滴定到终点读数时,发现滴定管尖嘴处悬挂了一滴溶液
D.配制标准溶液的固体NaOH中混有杂质
5.通常情况下,原子核外p、d能级等原子轨道上电子排布为“全空”“半充满”“全充满”的时候更加稳定,称为洪特规则的特例。下列事实能作为这个规则的证据的是( )
①某种激发态碳原子的电子排布式是而不是
②基态He原子的电子排布式为,基态H原子的电子排布式为
③基态Cu原子的电子排布式是而不是
④容易失电子转变为,表现出较强的还原性
A.①②④ B.②③ C.③④ D.①②③
6.常温下,下列离子能在指定的溶液中一定能大量共存的是( )
A.使紫色石蕊试液变红的溶液中:、、、
B.pH=9的溶液中:、、、
C.由水电离的的溶液中:、、、
D.在溶质为溶液中:、、、
7.下列与原子核外电子排布规律相关的叙述中(N为能层序数),不正确的是( )
A.ns电子的能量一定高于电子的能量
B.根据构造原理,电子填入能级的顺序是
C.第三周期元素的基态原子中,未成对电子数最多的是磷
D.各能层含有的电子数均为
8.在容积不变的密闭容器中,A与B反应生成C,其化学反应速率分别用,,表示。已知:,,则此反应的化学方程式可表示为( )
A. B. C. D.
9.在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如右图所示。下列说法错误的是( )
A.加水前导电能力约为零的原因是冰醋酸中几乎没有自由移动的离子
B.a、b、c三点对应的溶液中,电离程度最大的是c
C.a、b、c三点对应的溶液中,由小到大的顺序是c
10.已知反应 ,一定温度和压强下,在某密闭容器中反应达到平衡。下列叙述正确的是( )
A.更换高效催化剂,增大 B.移出部分CO,减小
C.升高温度,K减小 D.充入一定量的氮气,增大
11.下列实验过程可达到实验目的的是( )
A B C D
铁件上镀铜 测定稀硫酸和稀氢氧化钠的中和热 测反应生成的体积 无水固体
12.某化学研究小组探究外界条件对化学反应的速率和平衡的影响图像如图所示。下列判断错误的是( )
A.由图1可知,,该反应正反应为放热反应
B.由图2可知,该反应m+n>p
C.图3中,表示反应速率的是点1
D.图4中,若m+n=p,则a曲线可能使用了催化剂
13.化学家研究催化剂催化丙烷脱氢机理如下图所示。下列说法正确的是( )
A.由图可知催化大致经过阶段工(吸附)、反应Ⅱ(断裂第1个C-H键)、反应Ⅲ(断裂第2个C-H键)
B.反应Ⅱ活化能最大,不是催化丙烷脱氢的决速阶段
C.1 mol 在催化下反应生成1 mol 时,放出的热量为0.95eV
D.若该催化反应在绝热容器中按照先发生工,后发生Ⅱ,再发生Ⅲ,则完成反应Ⅱ后,需要再加热才能发生反应Ⅲ
14.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如右图所示。下列有关微生物电池的说法正确的是( )
A.燃料电池总反应和燃料燃烧方程式不相同
B.正极的电极反应式为
C.质子通过交换膜从正极区移向负极区
D.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池
15.由γ-烃基丁酸生成γ-丁内酯()的反应如下:。在25℃时,2L溶液中γ-烃基丁酸的初始浓度为0.180 mol/L,随着反应的进行,测得γ-丁内酯的浓度随时间的变化如下表所示。
t/min 21 50 80 100 120 160 220 ∞
c/() 0.024 0.050 0.071 0.081 0.090 0.104 0.116 0.132
下列说法中错误的是( )
A.适当控制反应温度可提高平衡时γ-烃基丁酸的转化率
B.在120min时,γ-烃基丁酸的转化率为50%
C.在80~100min内,以γ-丁内酯的浓度变化表示的反应速率为 mol/(L·min)
D.在25℃时,该反应的平衡常数为
16.用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定三颈烧瓶中压强随时间变化关系以及溶解氧(DO)随时间变化关系的曲线如下。下列说法正确的是( )
A.溶解氧随着溶液酸性减弱而增大
B.pH=2.0的溶液压强增大,主要是因为产生了氢气
C.整个过程中,负极电极反应式为:
D.pH=4.0时,发生析氢腐蚀,不发生吸氧腐蚀
第Ⅱ卷(非选择题,共52分)
二、非选择题(本题包括5小题,共52分)
17.(12分)可再生能源的利用和减排作为能源关键课题已引起人们广泛的关注。中科院李灿院士课题组利用太阳能等可再生能源通过光催化、光电催化和电解水获得氢气,再通过加氢制甲醇、烯烃、芳烃等化学品,从而实现的资源化利用。
(1)过程Ⅰ、Ⅱ是典型的人工光合作用过程:,该反应的______0(填“>”或“<”)。
(2)过程Ⅱ中催化加氢制取甲醇,反应如下:
主反应:
副反应:
①CO、生成的热化学方程式是______。
②提高在平衡体系中的含量,可采取如下措施:______(写出两条即可)。
(3)过程Ⅲ制得的中混有CO,去除CO的反应如下:。在容积不变的密闭容器中,将0.1 mol CO、0.1 mol 混合加热到830℃发生上述反应,下列情况说明该反应一定达到化学平衡的是______(填标号)。
a.CO的物质的量不再发生变化
b.CO与的物质的量浓度相等
c.
d.
(4)已知催化还原的机理及能量变化关系如下图。为使能较快还原为,重点应研究催化加快图中______(填写下图中序号“①”“②”“③”…等)的反应速率。
(5)我国科学家研发了一种水系可逆电池,电极材料为金属锌和选择性催化材料,电池工作时,双极隔膜(由阴、阳膜复合而成)层间的解离成和,在外加电场中可透过相应的离子膜定向移动。电池工作原理如下图所示:
①充电时,电解质溶液1中阴离子向______(填“双极隔膜”或“金属锌”)移动。
②放电时,电池正极反应为______。
18.(10分)根据下表所列四种物质的溶液(均为0.1000mol/L)在25℃时的相关数据,按要求填空:
溶液编号 (Ⅰ) (Ⅱ) (Ⅲ) (Ⅳ)
溶质
pH 2.5 6 5.5 3
(1)用离子方程式表示(Ⅰ)溶液酸性最强的主要原因______。
(2)25℃时,(Ⅱ)溶液和(Ⅳ)溶液中由水电离出的之比是______。
(3)比较(Ⅰ)、(Ⅱ)、(Ⅲ)溶液中由大到小的顺序是______(填标号)。
(4)向10 mL的(Ⅳ)溶液中加入蒸馏水,将其稀释到1L后,下列说法正确的是______(填标号)。
A.的电离程度增大 B.减小
C.增大 D.的数目增多
(5)某温度下,用0.1000 mol/L NaOH溶液滴定20.00mL(Ⅳ)溶液所得到滴定曲线如下图:
①该温度下,的电离平衡常数______。
②当NaOH溶液的体积为10.00mL时,溶液中:______(填“>”、“<”或“=”)
③滴定时若选择酚酞做指示剂,判断滴定终点的方法是:______。
19.(10分)合成氨是人类科学技术上的~项重大突破,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的核外电子排布式为______,占据最高能级电子的电子云轮廓图为______形。
②分子中,与N原子相连的H显正电性。N、H电负性由大到小的顺序为______。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有、、CaO、MgO、等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是______。
②比较Mg、Ca的第一电离能:______(填“大于”或“小于”)
(3)我国科研人员研制出了“Fe-LiH”催化剂,温度、压强分别降到了350℃、1MPa。这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的价电子排布图为______,铁在元素周期表中的位置______。
②比较与的半径大小关系:______(填“>”或“<”)。
20.(10分)金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石()转化为,再进一步还原得到钛。回答下列问题:
(1)转化为有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
,
(ⅱ)碳氯化:
,
①对于直接氯化反应:增大压强,平衡______ 移动(填“向左”“向右”或“不”);温度升高,平衡转化率______(填“变大”“变小”或“不变”)。
②直接氯化的反应趋势远小于碳氯化,其原因是______。
(2)在,将、C、按物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如下图所示。
①反应的平衡常数______Pa()。
②图中显示,在200℃平衡时几乎完全转化为,但实际生产中反应温度却远高于此温度,其原因是______。
(3)直接氯化和碳氯化都属于“气—固”反应,工业生产中有利于“气—固”充分接触的措施是______。
21.(10分)2021年6月24日,《一种硫酸铜废液制备高纯氧化铜》获得第22届中国专利优秀奖,其工艺流程如下:
已知:①硫酸铜废液中的杂质离子仅含、、、等。
②25℃时的溶度积:,。
回答下列问题:
(1)双氧水能把氧化为,右图是双氧水的氧化效率随温度变化的曲线,请解释氧化效率变化的原因______。
(2)“除铁铝”时,为使和沉淀完全(溶液中剩余离子的浓度小于 mol/L),需加入CuO调节溶液pH至______()。
(3)“洗涤”目的是为了除去硫酸铜晶体表面沾附的少量杂质,洗涤所需要的玻璃仪器有______。
(4)“水热”时,将硫酸铜晶体和尿素都加人一定体积的蒸馏水中进行加热反应,写出发生水热反应的离子方程式______。
(5)利用微生物可实现含尿素[]废水的净化,装置如右图所示:
①下列说法正确的是______(填标号)。
A.温度越高,反应速率越快,装置的转化率越高
B.该电池工作时,每4mol 通过质子交换膜时,消耗标准状况下 22.4L
C.电解质溶液中电流的方向由b到a,电子的流向与之相反
②a极的电极反应式为______。
高二化学试题参考答案
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,共48分.每小题只有一个选项符合题意)
题号 1 2 3 4 5 6 7 8
答案 A B B D C A D C
题号 9 10 11 12 13 14 15 16
答案 D B C C A D C B
第Ⅱ卷(非选择题 共52分)
二、非选择题(本题包括5小题,共52分)
17.(12分)
(1)>(1分)
(2)① (2分,方程式及状态均正确1分,焓变1分)
②将水分离出体系、降低反应温度、增大压强(2分,写对1条1分)
(3)a、d(2分)
(4)⑤(2分)
(5)双极隔膜(1分);(2分)
18.(10分)
(1)(1分)
(2)(1分)
(3)(Ⅲ)>(Ⅰ)>(Ⅱ)(1分)
(4)ABD(2分)
(5)①(2分)
②>(1分)
③当滴入最后半滴氢氧化钠溶液时,溶液颜色从无色变成浅红色,且半分钟内不褪色(或不恢复原来的颜色)(2分)
19.(10分)
(1)①(2分) 哑铃或纺锤(1分)
②N>H(1分)
(2)①Al、O(2分)
②大于(1分)
(3)①(1分);第四周期第Ⅷ族(1分)
②>(1分)
20.(10分)
(1)①不(1分);变大(1分)
②直接氯化的体系是气体分子数不变、且是吸热过程,而碳氯化反应气体分子数增加,小于0,是熵增、放热过程,熵判据与焓判据均是自发过程.(2分)
(2)①850(2分)
②为了提高反应速率,在相同时间内得到更多的产品,提高效益(2分)
(3)将固体粉碎后加入反应容器,鼓入吹起固体反应物,使固体粉末“沸腾”(2分)
21.(10分)
(1)起始阶段随着温度升高化学反应速率加快,氧化效率升高;温度升高的分解速率也会加快,后段浓度降低使氧化速率变慢,氧化效率降低(2分)
(2)4.7(1分)
(3)漏斗、烧杯、玻璃棒(2分)
(4) (2分)
(5)①B(1分)
②(2分)
同课章节目录
