化学人教版(2019)必修第二册7.3.1乙醇(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇(共29张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 13.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 15:18:07 | ||
图片预览






文档简介
(共29张PPT)
第三节 乙醇与乙酸
第1课时 乙醇
第七章 有机化合物
1. 掌握乙醇的物理性质和用途。
2. 掌握乙醇的组成和结构以及化学性质。
3. 掌握“烃的衍生物”、“官能团”两个概念。
学习目标 1’
阅读课本P77-79页的内容,回答以下问题:
1. 请写出乙醇的分子式(化学式)、结构式、结构简式及所含官能团的名称。
2. 从微观的角度分析乙醇和金属钠反应时断裂哪个化学键?
问题导学 8’
【资料卡片】酒精度
酒类产品标签中的酒精度是指乙醇的体积分数,白酒一般在25%~ 68%,啤酒一般在3%~ 5%。
点拨精讲 21’
因为酒精能够吸收病毒蛋白的水分,使其脱水变性凝固,从而达到杀灭病毒的目的。
【资料卡片】酒精消毒原理
75%的酒精与病毒渗透压相近,在病毒表面蛋白未变性前不断渗入病毒体内,使所有蛋白脱水变性凝固,最终杀死病毒。
酒的主要成分是乙醇,少量饮酒对人体有益,但酗酒有害健康。科学研究表明酒量的大小与人体内某些酶有关。乙醇进入人体后,会在肝中通过酶的催化作用被氧化为乙醛和乙酸,最终被氧化为二氧化碳和水。过量饮酒会加重肝负担,血液中较高浓度的乙醇和乙醛也会对人体产生毒害作用。
【资料卡片】酗酒的危害
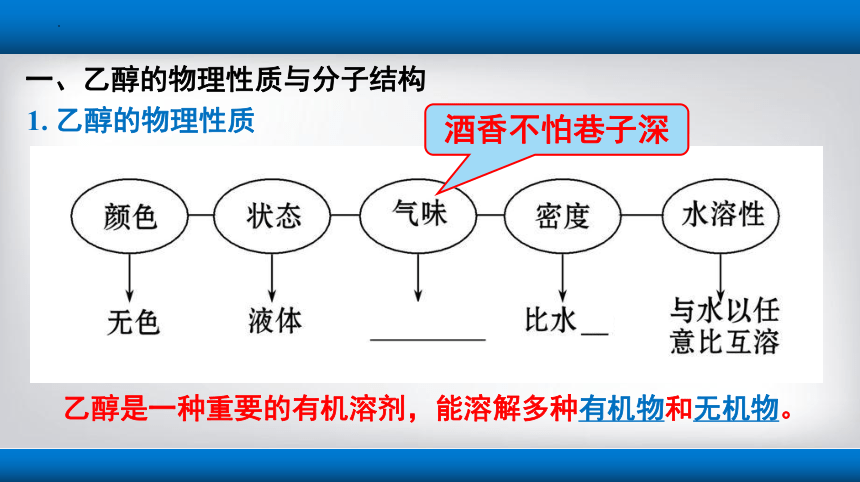
1. 乙醇的物理性质
乙醇是一种重要的有机溶剂,能溶解多种有机物和无机物。
酒香不怕巷子深
一、乙醇的物理性质与分子结构
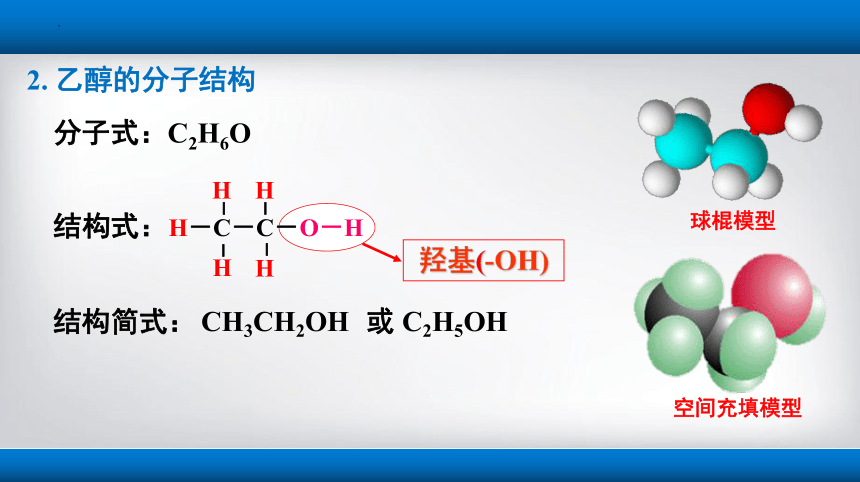
分子式:C2H6O
结构式:
结构简式:
CH3CH2OH
或 C2H5OH
羟基(-OH)
H-C-C-O-H
-
H
-
-
-
H
H
H
球棍模型
空间充填模型
2. 乙醇的分子结构
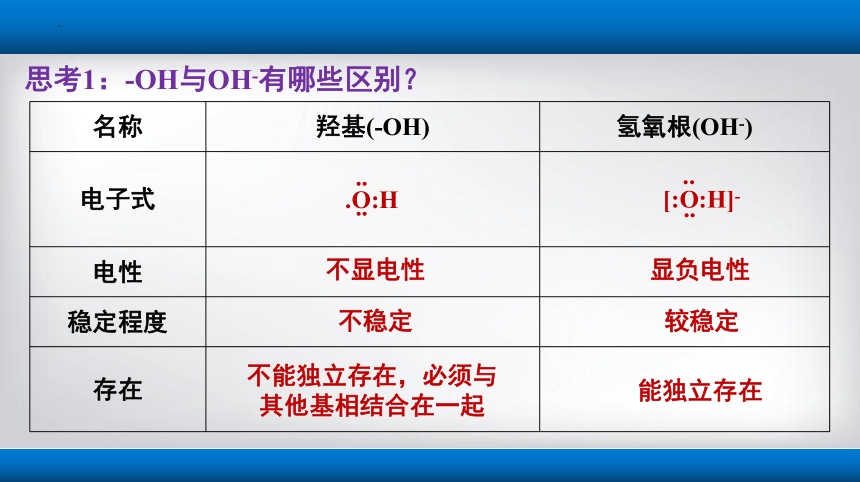
名称 羟基(-OH) 氢氧根(OH-)
电子式
电性
稳定程度
存在
.O:H
..
..
[:O:H]-
..
..
不显电性
不稳定
不能独立存在,必须与其他基相结合在一起
显负电性
较稳定
能独立存在
思考1:-OH与OH-有哪些区别?
CH3CH3
CH3CH2OH
烃的衍生物:烃分子中的H原子被其他原子或原子团所取代而生成的一系列化合物。
思考2:因取代基团的不同,预测乙醇与乙烷相比可能会有哪些不同的化学性质?
1. 乙醇与Na反应
二、乙醇的化学性质
实验操作
实验现象
实验结论
实验操作
实验现象 ①钠开始沉于试管底部,最终慢慢消失,产生___________气体;
②烧杯内壁有_____产生;③向烧杯中加入澄清石灰水_________
实验结论 乙醇与钠反应生成____,化学方程式为
___________________________________________
1. 乙醇与Na反应
无色可燃性
水珠
不变浑浊
H2
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
三、乙醇的化学性质
水与钠反应方程式?
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
取代/置换
H-C-C-O-H
-
H
-
-
-
H
H
H
2H2O + 2Na → 2NaOH + H2↑
1. 乙醇与Na反应( 反应)
三、乙醇的化学性质
乙醇羟基中的H不如水分子中的H活泼!
(2)如何检验乙醇中是否含有水?如何得到无水乙醇?
无水硫酸铜
加生石灰,再进行蒸馏
(1)根据Na和水反应与Na和乙醇反应的现象,比较乙醇羟基中的H与水分子中的H,哪个活泼性强?
思考3:
官能团:决定有机化合物特性的原子或原子团。
含有相同官能团的有机物在性质上具有相似性!
①燃烧:放出大量的热
C2H5OH + 3O2 2CO2+3H2O
点燃
乙醇汽油
2. 氧化反应:
固体酒精
【情景创设】工匠焊接银器、铜器时,表面会生成发黑的氧化膜,这时可以先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初。你知道为什么吗?
【实验7-5】向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇中,反复几次,注意观察反应现象,并小心闻试管中液体产生的气味。
红色铜丝
Δ
变黑
有刺激性气味
插入乙醇溶液中
又变红,
红色铜丝
变黑
又变红
产生
刺激性气味
②乙醇的催化氧化
2. 氧化反应:
如何断键(成键)?
官能团:醛基
(—CHO)
H—C—C—O—H
H H
H
H
①↓
②↓
↑④
↑⑤
←③
例:下列关于乙醇的说法中,不正确的是
A.与金属钠反应时,键①断裂
B.乙醇可以使酸性高锰酸钾溶液褪色
C.乙醇属于烃类物质
D.无水硫酸铜常用于检验乙醇中是否含有水
C
【知识拓展】醇的催化氧化反应规律
醇在有催化剂(铜或银)存在的条件下,可以发生催化氧化反应生成醛,但并不是所有的醇都能被氧化生成醛。
醇的结构 氧化情况及产物
(R代表烃基)
含有 结构
R—C—H
OH
H
R—C—H
O
都能被氧化成醛( )
【情景创设】据交警介绍,在机动车驾驶人的每100毫升血液中,酒精含量达到20毫克为饮酒驾车,大致相当于饮用一杯啤酒;每100毫升血液中酒精含量达到和超过80毫克可以认定为醉酒驾车,相当于饮用3两低度白酒或者两瓶啤酒。你知道酒精检测仪的工作原理吗?
交警用经硫酸酸化处理的三氧化铬(CrO3)(与重铬酸钾原理类似)硅胶检查司机呼出的气体,根据硅胶颜色的变化(硅胶中的+6价铬能被酒精蒸气还原为+3价铬,颜色发生变化,喝的越多颜色越深,橙黄变灰绿),可以判断司机是否酒后驾车。
乙醇
KMnO4(H+)溶液
乙醇
K2Cr2O7(H+)溶液
现象:
溶液紫色褪去
溶液由橙色变为绿色
K2Cr2O7
Cr2(SO4)3
(橙色)
(绿色)
乙醇
CH3CH2OH
KMnO4(H+) 或
K2Cr2O7 (H+)
CH3COOH(乙酸)
2. 氧化反应:
③乙醇与强氧化剂反应
三、乙醇的用途
二、乙醇的分子结构
一、乙醇的物理性质
三、乙醇的化学性质
2CH3CH2OH + 2Na → 2CH3CH2ONa+ H2↑(置换反应)
(乙醇钠)
C2H5OH + 3O2 2CO2 + 3H2O(燃烧反应)
点燃
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu或Ag
(催化氧化反应)
课堂小结 2’
1. 下列关于乙醇的说法中正确的是
A. 乙醇在水溶液中能电离出少量的H+,所以乙醇是电解质
B. 乙醇结构中有—OH,所以乙醇显碱性
C. 乙醇分子中只有烃基上的氢原子可被钠置换出来
D. 乙醇是一种很好的溶剂,能溶解许多无机化合物和有机化合物,人们用白酒浸泡中药制成药酒就是利用了这一性质
当堂检测 13’
2. 下列说法中正确的是
A. 醇的官能团是乙基
B. 羟基和氢氧根离子含有相同的化学式和结构式
C. 在氧气中燃烧只生成二氧化碳和水的有机物不一定是烃
D. 乙醇与钠反应生成氢气,此现象说明乙醇具有酸性
3. CH2=CHCH2OH可能发生的反应类型有
①加成反应 ②氧化反应 ③取代反应 ④中和反应
A. 只有①③ B. 只有①②③ C. 只有①③④ D. 只有①②
【答案】1—3 D C B
4. 通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是__________;
(2)X与空气中的氧气在铜或银催化作用下反应生成Y,Y的结构简式是__________,反应方程式为_________________________。
C2H6O
CH3CHO
第三节 乙醇与乙酸
第1课时 乙醇
第七章 有机化合物
1. 掌握乙醇的物理性质和用途。
2. 掌握乙醇的组成和结构以及化学性质。
3. 掌握“烃的衍生物”、“官能团”两个概念。
学习目标 1’
阅读课本P77-79页的内容,回答以下问题:
1. 请写出乙醇的分子式(化学式)、结构式、结构简式及所含官能团的名称。
2. 从微观的角度分析乙醇和金属钠反应时断裂哪个化学键?
问题导学 8’
【资料卡片】酒精度
酒类产品标签中的酒精度是指乙醇的体积分数,白酒一般在25%~ 68%,啤酒一般在3%~ 5%。
点拨精讲 21’
因为酒精能够吸收病毒蛋白的水分,使其脱水变性凝固,从而达到杀灭病毒的目的。
【资料卡片】酒精消毒原理
75%的酒精与病毒渗透压相近,在病毒表面蛋白未变性前不断渗入病毒体内,使所有蛋白脱水变性凝固,最终杀死病毒。
酒的主要成分是乙醇,少量饮酒对人体有益,但酗酒有害健康。科学研究表明酒量的大小与人体内某些酶有关。乙醇进入人体后,会在肝中通过酶的催化作用被氧化为乙醛和乙酸,最终被氧化为二氧化碳和水。过量饮酒会加重肝负担,血液中较高浓度的乙醇和乙醛也会对人体产生毒害作用。
【资料卡片】酗酒的危害
1. 乙醇的物理性质
乙醇是一种重要的有机溶剂,能溶解多种有机物和无机物。
酒香不怕巷子深
一、乙醇的物理性质与分子结构
分子式:C2H6O
结构式:
结构简式:
CH3CH2OH
或 C2H5OH
羟基(-OH)
H-C-C-O-H
-
H
-
-
-
H
H
H
球棍模型
空间充填模型
2. 乙醇的分子结构
名称 羟基(-OH) 氢氧根(OH-)
电子式
电性
稳定程度
存在
.O:H
..
..
[:O:H]-
..
..
不显电性
不稳定
不能独立存在,必须与其他基相结合在一起
显负电性
较稳定
能独立存在
思考1:-OH与OH-有哪些区别?
CH3CH3
CH3CH2OH
烃的衍生物:烃分子中的H原子被其他原子或原子团所取代而生成的一系列化合物。
思考2:因取代基团的不同,预测乙醇与乙烷相比可能会有哪些不同的化学性质?
1. 乙醇与Na反应
二、乙醇的化学性质
实验操作
实验现象
实验结论
实验操作
实验现象 ①钠开始沉于试管底部,最终慢慢消失,产生___________气体;
②烧杯内壁有_____产生;③向烧杯中加入澄清石灰水_________
实验结论 乙醇与钠反应生成____,化学方程式为
___________________________________________
1. 乙醇与Na反应
无色可燃性
水珠
不变浑浊
H2
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
三、乙醇的化学性质
水与钠反应方程式?
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
取代/置换
H-C-C-O-H
-
H
-
-
-
H
H
H
2H2O + 2Na → 2NaOH + H2↑
1. 乙醇与Na反应( 反应)
三、乙醇的化学性质
乙醇羟基中的H不如水分子中的H活泼!
(2)如何检验乙醇中是否含有水?如何得到无水乙醇?
无水硫酸铜
加生石灰,再进行蒸馏
(1)根据Na和水反应与Na和乙醇反应的现象,比较乙醇羟基中的H与水分子中的H,哪个活泼性强?
思考3:
官能团:决定有机化合物特性的原子或原子团。
含有相同官能团的有机物在性质上具有相似性!
①燃烧:放出大量的热
C2H5OH + 3O2 2CO2+3H2O
点燃
乙醇汽油
2. 氧化反应:
固体酒精
【情景创设】工匠焊接银器、铜器时,表面会生成发黑的氧化膜,这时可以先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初。你知道为什么吗?
【实验7-5】向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇中,反复几次,注意观察反应现象,并小心闻试管中液体产生的气味。
红色铜丝
Δ
变黑
有刺激性气味
插入乙醇溶液中
又变红,
红色铜丝
变黑
又变红
产生
刺激性气味
②乙醇的催化氧化
2. 氧化反应:
如何断键(成键)?
官能团:醛基
(—CHO)
H—C—C—O—H
H H
H
H
①↓
②↓
↑④
↑⑤
←③
例:下列关于乙醇的说法中,不正确的是
A.与金属钠反应时,键①断裂
B.乙醇可以使酸性高锰酸钾溶液褪色
C.乙醇属于烃类物质
D.无水硫酸铜常用于检验乙醇中是否含有水
C
【知识拓展】醇的催化氧化反应规律
醇在有催化剂(铜或银)存在的条件下,可以发生催化氧化反应生成醛,但并不是所有的醇都能被氧化生成醛。
醇的结构 氧化情况及产物
(R代表烃基)
含有 结构
R—C—H
OH
H
R—C—H
O
都能被氧化成醛( )
【情景创设】据交警介绍,在机动车驾驶人的每100毫升血液中,酒精含量达到20毫克为饮酒驾车,大致相当于饮用一杯啤酒;每100毫升血液中酒精含量达到和超过80毫克可以认定为醉酒驾车,相当于饮用3两低度白酒或者两瓶啤酒。你知道酒精检测仪的工作原理吗?
交警用经硫酸酸化处理的三氧化铬(CrO3)(与重铬酸钾原理类似)硅胶检查司机呼出的气体,根据硅胶颜色的变化(硅胶中的+6价铬能被酒精蒸气还原为+3价铬,颜色发生变化,喝的越多颜色越深,橙黄变灰绿),可以判断司机是否酒后驾车。
乙醇
KMnO4(H+)溶液
乙醇
K2Cr2O7(H+)溶液
现象:
溶液紫色褪去
溶液由橙色变为绿色
K2Cr2O7
Cr2(SO4)3
(橙色)
(绿色)
乙醇
CH3CH2OH
KMnO4(H+) 或
K2Cr2O7 (H+)
CH3COOH(乙酸)
2. 氧化反应:
③乙醇与强氧化剂反应
三、乙醇的用途
二、乙醇的分子结构
一、乙醇的物理性质
三、乙醇的化学性质
2CH3CH2OH + 2Na → 2CH3CH2ONa+ H2↑(置换反应)
(乙醇钠)
C2H5OH + 3O2 2CO2 + 3H2O(燃烧反应)
点燃
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu或Ag
(催化氧化反应)
课堂小结 2’
1. 下列关于乙醇的说法中正确的是
A. 乙醇在水溶液中能电离出少量的H+,所以乙醇是电解质
B. 乙醇结构中有—OH,所以乙醇显碱性
C. 乙醇分子中只有烃基上的氢原子可被钠置换出来
D. 乙醇是一种很好的溶剂,能溶解许多无机化合物和有机化合物,人们用白酒浸泡中药制成药酒就是利用了这一性质
当堂检测 13’
2. 下列说法中正确的是
A. 醇的官能团是乙基
B. 羟基和氢氧根离子含有相同的化学式和结构式
C. 在氧气中燃烧只生成二氧化碳和水的有机物不一定是烃
D. 乙醇与钠反应生成氢气,此现象说明乙醇具有酸性
3. CH2=CHCH2OH可能发生的反应类型有
①加成反应 ②氧化反应 ③取代反应 ④中和反应
A. 只有①③ B. 只有①②③ C. 只有①③④ D. 只有①②
【答案】1—3 D C B
4. 通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是__________;
(2)X与空气中的氧气在铜或银催化作用下反应生成Y,Y的结构简式是__________,反应方程式为_________________________。
C2H6O
CH3CHO
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
