江苏省南京市第二十七高级中学2022-2023学年高二下学期期中考试化学试卷(含解析)
文档属性
| 名称 | 江苏省南京市第二十七高级中学2022-2023学年高二下学期期中考试化学试卷(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 452.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-23 09:31:19 | ||
图片预览




文档简介
南京市第二十七高级中学2022-2023学年高二下学期期中考试
化学试卷
一.选择题(共14小题,每题3分,共42分
)
1.2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭,在酒泉卫星发射中心按照预定时间精准点火发射,这是中国空间站关键技术验证阶段第六次飞行。下列叙述错误的是( )
A.火箭箭体采用的高强度新型钛合金结构属于金属材料
B.航天员航天服上的橡胶属于有机高分子材料
C.二氧化硅是飞船搭载的太阳能电池板的核心材料
D.航天员手臂“延长器”——操纵棒中的碳纤维材料属于新型材料
2.下列说法错误的是( )
A.羊毛织品洗后易变形,与氢键有关
B.基态Fe原子中,两种自旋状态的电子数之比为11:15
C.键角:NO3﹣>NH4+>NH3>PH3>P4
D.46g二甲醚(CH3OCH3)中sp3杂化的原子数为2NA
3.下列说法正确的是( )
A.由分子组成的物质中一定存在共价键
B.共价化合物一定含共价键,也可能含离子键
C.由非金属元素组成的化合物一定是共价化合物
D.离子化合物一定含离子键,也可能含极性键或非极性键
4.7N、8O、11Na、17Cl是周期表中的短周期主族元素。下列有关说法不正确的是( )
A.离子半径:r(Na+)<r(O2﹣)<r(Cl﹣)
B.第一电离能:I1(Na)<I1(N)<I1(O)
C.氢化物对应的稳定性:NH3<H2O
D.最高价氧化物的水化物的酸性:HNO3<HClO4
5.X、Y、Z、Q、W原子序数依次增大。X的电子只有一种自旋取向,Y和Z的某同位素测定可用于分析古代人类的食物结构,Q单质可用于自来水消毒,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法一定正确的是( )
A.Z、Y的氢化物稳定性:Z<Y
B.Q与Y原子形成的分子空间结构为四面体型
C.Q单质可从Z的简单气态氢化物中置换出Z
D.[W(ZX3)4]2+中σ键数为12
6.某化合物X结构如图所示,下列说法不正确的是( )
A.X中含有4种含氧官能团
B.1molX最多能与5molNaOH反应
C.X水解后的产物都存在顺反异构体
D.X中含有1个手性碳原子
7.废旧锌锰电池处理后的废料[含MnO2、MnOOH、Zn(OH)2、Fe等]制备Zn和MnO2的一种工艺流程如图:
已知:Mn的金属活动性强于Fe,Mn2+在pH大于5.5时易被氧化。
下列说法不正确的是( )
A.“还原焙烧”时Mn元素被还原
B.“酸浸”过程中适当加热,主要目的是加快浸取速率
C.“净化”时MnCO3的作用是调节溶液的pH,使Fe3+形成Fe(OH)3沉淀而除去
D.“电解”时阳极反应式为Mn2+﹣2e﹣+4OH﹣═MnO2+2H2O
8.已知A、B、C、D、E是五种短周期主族元素,其原子半径与原子序数的关系如图1,且A、B、C、D可形成化合物X如图2,C与E同主族。下列说法错误的是( )
A.A、B、D均可与C形成常见的两种二元化合物
B.简单离子的半径:E>D>C
C.最高价氧化物对应水化物的酸性:E>B
D.化合物X在低温更加稳定
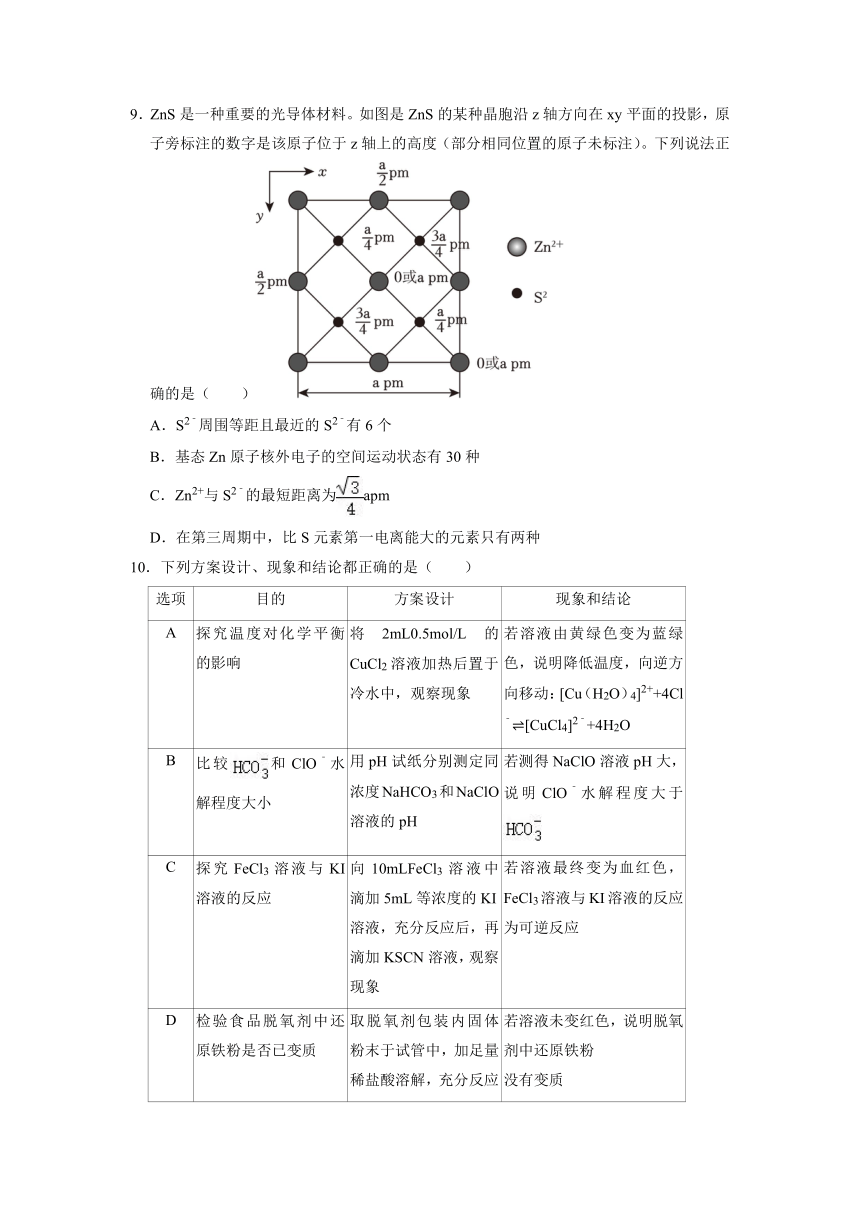
9.ZnS是一种重要的光导体材料。如图是ZnS的某种晶胞沿z轴方向在xy平面的投影,原子旁标注的数字是该原子位于z轴上的高度(部分相同位置的原子未标注)。下列说法正确的是( )
A.S2﹣周围等距且最近的S2﹣有6个
B.基态Zn原子核外电子的空间运动状态有30种
C.Zn2+与S2﹣的最短距离为apm
D.在第三周期中,比S元素第一电离能大的元素只有两种
10.下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
A 探究温度对化学平衡的影响 将2mL0.5mol/L的CuCl2溶液加热后置于冷水中,观察现象 若溶液由黄绿色变为蓝绿色,说明降低温度,向逆方向移动:[Cu(H2O)4]2++4Cl﹣ [CuCl4]2﹣+4H2O
B 比较和ClO﹣水解程度大小 用pH试纸分别测定同浓度NaHCO3和NaClO溶液的pH 若测得NaClO溶液pH大,说明ClO﹣水解程度大于
C 探究FeCl3溶液与KI溶液的反应 向10mLFeCl3溶液中滴加5mL等浓度的KI溶液,充分反应后,再滴加KSCN溶液,观察现象 若溶液最终变为血红色,FeCl3溶液与KI溶液的反应为可逆反应
D 检验食品脱氧剂中还原铁粉是否已变质 取脱氧剂包装内固体粉末于试管中,加足量稀盐酸溶解,充分反应后滴加KSCN溶液,振荡,观察溶液颜色变化 若溶液未变红色,说明脱氧剂中还原铁粉 没有变质
A.A B.B C.C D.D
11.氢气和二氧化碳在催化剂作用下合成甲醇的反应为放热反应,催化过程可解释为“吸附﹣活化﹣解离”的过程,催化反应机理如图所示。下列说法正确的是( )
A.反应过程中Ⅰ~Ⅴ步,C元素化合价不变
B.单位时间内生成的水越多,则甲醇的产率越大
C.增大催化剂的表面积,可以提高甲醇的平衡产率
D.氢气和二氧化碳在催化反应过程中有副产物CO生成
12.甲氧苄啶是一种广谱抗菌药,其合成路线中的一步过程如图,下列说法正确的是( )
A. X分子中含氧官能团有醚键、羟基 B.Y分子中含1个手性碳原子
C. X分子中所有碳原子可能共平面 D.用酸性高锰酸钾溶液可以鉴别有机物X、Y
13.常温下:常见弱酸的电离平衡常数如下:
H2S HClO H2CO3
Ka1═1.3×10﹣7 Ka2═7.1×10﹣15 Ka═4.7×10﹣8 Kal═4.2×10﹣7 Ka2═5.6×10﹣11
以下说法正确的是( )
A.少量CO2通入到NaClO溶液中生成Na2CO3
B.等浓度等体积的NaOH与H2S混合后,溶液中水的电离程度比纯水小
C.等浓度等体积的Na2S与NaHS混合,c(HS﹣)+3c(H2S)+2c(H+)═2c(OH﹣)+c(S2﹣)
D.NaOH溶液与H2S溶液混合,当溶液的pH═7时,离子浓度大小关系为:c(HS﹣)>c(Na+)>c(S2﹣)>c(H+)═c(OH﹣)
14.燃煤电厂锅炉尾气中含有氮氧化物(主要成分NO),可通过主反应4NH3(g)+4NO(g)+O2(g)═4N2(g)+6H2O(g)△H=﹣1627.7kJ mol﹣1除去。温度高于300℃时会发生副反应:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=﹣904.74kJ mol﹣1。在恒压、反应物起始物质的量之比一定的条件下,反应相同时间,NO的转化率在不同催化剂作用下随温度变化的曲线如图所示。下列有关说法一定正确的是( )
A.升高温度、增大压强均可提高主反应中NO的平衡转化率
B.N2(g)+O2(g)=2NO(g)△H=﹣180.74kJ mol﹣1
C.图中X点所示条件下,反应时间足够长,NO的转化率能达到Y点的值
D.图中Z点到W点NO的转化率降低的原因是主反应的平衡逆向移动
二.非选择题(共1小题)
15.(15分)氮及其化合物在工、农业生产中用途广泛。
(1)报道,美国科学家卡尔 克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
(2)①分子中的大π键可用符号Πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π66),已知N5﹣为平面结构且含有大π键,则N5﹣中的大π键应表示为 。
②图中虚线代表氢键,其表示式为(NH4+)N﹣H Cl、 、 。
(3)还原沉淀法:使用Na2SO3将Cr(Ⅵ)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(Ⅵ)具有很强的氧化能力,将Cr2还原为Cr3+的离子方程式为 。
②其他条件相同,用Na2SO3处理不同初始pH的含Cr(Ⅵ)废水相同时间,当pH<2时,Cr(Ⅵ)的去除率随
pH降低而降低的原因是 。
(4)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(VI)去除率随温度的变化如图1所示。55℃时,
Cr(Ⅵ)的去除率很低的原因是 。
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图2所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+, 。
16(12分)MnCO3常用于医药、电焊条辅料等,以软锰矿(主要成分为MnO2,还含有少量Fe2O3、Al2O3、SiO2、MgO、CaO等)为原料制备MnCO3的流程如图:
回答下列问题:
(1)废铁屑在使用前需要用热的纯碱溶液清洗表面油污,其清洗原理为 (结合离子方程式和必要的语言解释)。
(2)为了使废铁屑与软锰矿在“酸浸”中充分反应,可采取的措施为 ;“酸浸”时主要发生反应的离子方程式为 。
(3)“滤渣1”中含有的主要成分为 。
(4)“氧化”过程中加入H2O2的量远超理论量的原因为 。
(5)加入CaCO3能“除铁、铝”的原因为 。
(6)“沉锰”时发生反应的离子方程式为 。
(7)MnO2的正交(棱与棱之间的夹角均为90°)晶胞结构如图所示,晶胞参数分别为apm、bpm、cpm。其中Mn的配位数为 ;用NA表示阿伏加德罗常数的值,该晶体的密度为 g cm﹣3。
17.(15分)化合物H是制备药物洛索洛芬钠的关键中间体,其一种合成路线如图:
(1)A→B的反应类型为 。
(2)D分子中碳原子杂化轨道类型有 种。
(3)G的结构简式为 。
(4)F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
①分子中含有苯环;
②碱性条件下完全水解生成两种产物,酸化后分子中均含有4种不同化学环境的氢。
(5)设计以苯乙醇为原料制备的合成路线(无机试剂任用,合成路线示例见本题题干) 。
18.(15分)气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)用NH3催化还原NOx可以消除氮氧化物的污染。已知:
①4NH3 (g)+3O2 (g)═2N2 (g)+6H2O (g)ΔH=﹣akJ/mol
②N2(g)+O2 (g)═2NO (g)ΔH=﹣bkJ/mol
写出NH3还原NO至N2和水蒸气的热化学方程式 。
(2)尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如图:
①尿素[CO(NH2)2]中氮元素的化合价为 。
②写出“催化反应”过程中NH3还原NO2的化学方程式 。
③若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。试分析硫酸盐的产生过程 。
④“催化反应”过程中需控制温度在250℃~380℃之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和 。
(3)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k c(N2O) [c(I2)]0.5(k为速率常数)。下列表述正确的是
A.N2O分解反应中:k值与是否含碘蒸气有关
B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的催化剂
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体:2CO+2NO→N2+2CO2△H1。
①已知:反应N2(g)+O2(g) 2NO(g)△H2=+180.0kJ mol﹣1,若CO的燃烧热△H为﹣283.5kJ/mol,则△H1= 。
②若在恒容的密闭容器中,充入2mol CO和1mol NO,下列选项中不能说明该反应已经达到平衡状态的是 。
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.2v(N2)正=v(CO)逆
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+x(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ.NO(g)+□→NO(a)
Ⅱ.2NO(a)→2N(a)+O2(g)
Ⅲ.2N(a)→N2(g)+2□
Ⅳ.2NO(a)→N2(g)+2O(a)
Ⅴ.2O(a)→O2(g)+2□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是 。
(3)N2O4与NO2之间存在反应N2O4(g) 2NO(g)。将定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
①图中a点对应温度下。已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp= kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1= ,在图上标出的点中,能表示反应达到平衡状态的点为 (填字母代号)。
参考答案与试题解析
一.选择题(共13小题)
1.2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭,在酒泉卫星发射中心按照预定时间精准点火发射,这是中国空间站关键技术验证阶段第六次飞行。下列叙述错误的是( )
A.火箭箭体采用的高强度新型钛合金结构属于金属材料
B.航天员航天服上的橡胶属于有机高分子材料
C.二氧化硅是飞船搭载的太阳能电池板的核心材料
D.航天员手臂“延长器”——操纵棒中的碳纤维材料属于新型材料
【解答】解:A.钛合金强度大,适合用作火箭箭体材料,故A正确;
B.合成橡胶由各种单体经聚合反应而得,橡胶制品广泛应用于工业或生活,属于有机高分子材料,故B正确;
C.晶体硅为良好的半导体材料,是制造太阳能电池板的核心材料,二氧化硅不具有此性质,故C错误;
D.碳纤维是新型无机非金属材料,故D正确;
故选:C。
2.下列说法错误的是( )
A.羊毛织品洗后易变形,与氢键有关
B.基态Fe原子中,两种自旋状态的电子数之比为11:15
C.键角:NO3﹣>NH4+>NH3>PH3>P4
D.46g二甲醚(CH3OCH3)中sp3杂化的原子数为2NA
【解答】解:A.羊毛织品中主要成分为蛋白质,蛋白质中含有大量氢键,水洗时会破坏其中部分氢键,使得织品变形,DNA为双螺旋结构,其中碱基对以氢键相连,故A正确;
B.基态Fe原子核外电子排布式为:[Ar]3d64s2,3d能级上有4个自旋方向相同的单电子,所以基态Fe原子中,两种自旋状态的电子数之比为11:15,故B正确;
C.NO3﹣中N原子价层电子对个数=3+=3且不含孤电子对,NH4+中N原子价层电子对个数=4+=4且不含孤电子对,NH3中N原子价层电子对个数=3+=4且含有1个孤电子对,PH3中P原子价层电子对个数=3+=4且含有1个孤电子对,P4为正四面体结构,NO3﹣、NH4+、NH3、PH3、P4分别为平面三角形、正四面体形、三角锥形、三角锥形、正四面体形,N﹣H键长小于P﹣H键长,所以NH3的键角大于PH3,P4中键角为60°,所以键角NO3﹣>NH4+>NH3>PH3>P4,故C正确;
D.n(CH3OCH3)==1mol,每个二甲醚分子中含有3个采用sp3杂化的原子,46g二甲醚(CH3OCH3)中sp3杂化的原子数为3NA,故D错误;
故选:D。
3.下列说法正确的是( )
A.由分子组成的物质中一定存在共价键
B.共价化合物一定含共价键,也可能含离子键
C.由非金属元素组成的化合物一定是共价化合物
D.离子化合物一定含离子键,也可能含极性键或非极性键
【解答】解:A.稀有气体为单原子分子,分子中不存在共价键,所以由分子构成的物质中不一定存在共价键,故A错误;
B.共价化合物是指只含有共价键的化合物,故B错误;
C.非金属元素之间也能形成离子键,如氯化铵是由非金属元素构成的离子化合物,故C错误;
D.含有离子键的化合物为离子化合物,也可能含有极性键或非极性键,如氢氧化钠中含有离子键和极性键,过氧化钠中含有离子键和非极性共价键,故D正确;
故选:D。
4.7N、8O、11Na、17Cl是周期表中的短周期主族元素。下列有关说法不正确的是( )
A.离子半径:r(Na+)<r(O2﹣)<r(Cl﹣)
B.第一电离能:I1(Na)<I1(N)<I1(O)
C.氢化物对应的稳定性:NH3<H2O
D.最高价氧化物的水化物的酸性:HNO3<HClO4
【解答】解:A.Na+、O2﹣的电子层结构相同,离子的核电荷数越大,离子半径越小,所以离子半径:r(Na+)<r(O2﹣);对于电子层结构不同的离子,离子的核外电子层数越多,离子半径就越大;Na+、O2﹣只有2个电子层,Cl﹣核外有3个电子层,Cl﹣核外的电子层数最多,故Cl﹣半径最大,则离子半径:r(Na+)<r(O2﹣)<r(Cl﹣),故A正确;
B.一般情况下,元素的非金属性越强,其第一电离能就越大,但由于N原子核外电子排布处于半充满的稳定状态,失去电子消耗的能量大于同一周期相邻元素,所以I1(O)<I1(N),则三种元素的第一电离能大小关系为:I1(Na)<I1(O)<I1(N),故B错误;
C.元素的非金属性越强,其相应的简单氢化物的稳定性就越强,由于元素的非金属性:N<O,所以简单氢化物的稳定性:NH3<H2O,故C正确;
D.高氯酸为所有含氧酸中酸性最强的酸,所以最高价氧化物的水化物的酸性:HNO3<HClO4,故D正确;
故选:B。
5.X、Y、Z、Q、W原子序数依次增大。X的电子只有一种自旋取向,Y和Z的某同位素测定可用于分析古代人类的食物结构,Q单质可用于自来水消毒,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法一定正确的是( )
A.Z、Y的氢化物稳定性:Z<Y
B.Q与Y原子形成的分子空间结构为四面体型
C.Q单质可从Z的简单气态氢化物中置换出Z
D.[W(ZX3)4]2+中σ键数为12
【解答】解:A.由分析可知,Y、Z分别为C、N,C、N为同周期元素,C的非金属性比N弱,则 Z、Y的简单氢化物稳定性:NH3>CH4,故A错误;
B.Q与Y原子形成的分子可以为CCl4,也可以是C2Cl6,CCl4是正四面体结构,而C2Cl6不是四面体形结构,故B错误;
C.Q单质(Cl2)与Z的简单气态氢化物(NH3)反应为8NH3+3Cl2═6NH4Cl+N2,则Cl2可置换出NH3中的N,故C正确;
D.[W(ZX3)4]2+为[Zn(NH3)4]2+,每个NH3中含有3个σ键,另外还形成4个配位键,配位键也属于σ键,则σ键数为3×4+4═16,故D错误;
故选:C。
6.某化合物X结构如图所示,下列说法不正确的是( )
A.X中含有4种含氧官能团
B.1molX最多能与5molNaOH反应
C.X水解后的产物都存在顺反异构体
D.X中含有1个手性碳原子
【解答】解:A.含有酚羟基、碳碳双键、酯基、酰胺基、羧基,其中四种是含氧官能团,故A正确;
B.酚羟基、酯基水解生成的羧基和酚羟基、酰胺基水解生成的羧基、羧基都能和NaOH以1:1反应,1mol该物质最多消耗6molNaOH,故B错误;
C.水解产物HOOCCH=CHCOOH中碳碳双键两端的碳原子连接2个不同的原子或原子团,该物质中存在顺反异构,故C正确;
D.连接甲基和酰胺键中N原子的碳原子为手性碳原子,故D正确;
故选:B。
7.废旧锌锰电池处理后的废料[含MnO2、MnOOH、Zn(OH)2、Fe等]制备Zn和MnO2的一种工艺流程如图:
已知:Mn的金属活动性强于Fe,Mn2+在pH大于5.5时易被氧化。
下列说法不正确的是( )
A.“还原焙烧”时Mn元素被还原
B.“酸浸”过程中适当加热,主要目的是加快浸取速率
C.“净化”时MnCO3的作用是调节溶液的pH,使Fe3+形成Fe(OH)3沉淀而除去
D.“电解”时阳极反应式为Mn2+﹣2e﹣+4OH﹣═MnO2+2H2O
【解答】解:A.“还原焙烧”中MnO2、MnOOH分别与炭黑反应,2MnOOH+C2MnO+CO↑+H2↑、MnO2+CMnO+CO,反应中锰元素被还原为MnO,且有气体产物生成,故A正确;
B.加热和搅拌都可以加快酸浸时的反应速率,故B正确;
C.“净化”时通入氧气和加入碳酸锰,使铁元素变成Fe(OH)3沉淀而分离,故C正确;
D.电解时阳极电极方程式为:Mn2+﹣2e﹣+2H2O=MnO2+4H+,故D错误;
故选:D。
8.已知A、B、C、D、E是五种短周期主族元素,其原子半径与原子序数的关系如图1,且A、B、C、D可形成化合物X如图2,C与E同主族。下列说法错误的是( )
A.A、B、D均可与C形成常见的两种二元化合物
B.简单离子的半径:E>D>C
C.最高价氧化物对应水化物的酸性:E>B
D.化合物X在低温更加稳定
【解答】解:A.H与O能形成化合物H2O、H2O2,Na与O能形成化合物Na2O、Na2O2,C与O能形成化合物CO、CO2,故A正确;
B.电子层数越多半径越大,电子层数相同,质子数越多半径越小,简单离子的半径:S2﹣>O2﹣>Na+,故B错误;
C.非金属性越强对应的最高价氧化物的水化物酸性越强,非金属性S>C,最高价氧化物的水化物酸性H2SO4>H2CO3,故C正确;
D.X为Na2CO3 H2O2,H2O2受热易分解,Na2CO3易与酸反应,化合物X在低温的碱性溶液中更加稳定,故D正确;
故选:B。
9.ZnS是一种重要的光导体材料。如图是ZnS的某种晶胞沿z轴方向在xy平面的投影,原子旁标注的数字是该原子位于z轴上的高度(部分相同位置的原子未标注)。下列说法正确的是( )
A.S2﹣周围等距且最近的S2﹣有6个
B.基态Zn原子核外电子的空间运动状态有30种
C.Zn2+与S2﹣的最短距离为apm
D.在第三周期中,比S元素第一电离能大的元素只有两种
【解答】解:A.S2﹣处于晶胞内部,处于体对角线的四分之一处,S2﹣周围等距且最近的S2﹣有4个,故A错误;
B.锌元素的原子序数为30,基态原子的电子排布式为1s22s22p63s23p63d104s2,原子轨道的数目与核外电子的空间运动状态相等,s轨道、p轨道、d轨道的数目分别为1、3、5,所以锌原子核外电子共有15种空间运动状态,故B错误;
C.S2﹣处于体对角线的四分之一处,体对角线长度为apm,故Zn2+与S2﹣的最短距离为apm,故C正确;
D.同周期元素,非金属性越强,电离能越大,第ⅤA主族元素原子核外电子为半满状态,第一电离能大于相邻元素,且Cl、Ar元素电离能也大于S,有3种,故D错误;
故选:C。
10.下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
A 探究温度对化学平衡的影响 将2mL0.5mol/L的CuCl2溶液加热后置于冷水中,观察现象 若溶液由黄绿色变为蓝绿色,说明降低温度,向逆方向移动:[Cu(H2O)4]2++4Cl﹣ [CuCl4]2﹣+4H2O
B 比较和ClO﹣水解程度大小 用pH试纸分别测定同浓度NaHCO3和NaClO溶液的pH 若测得NaClO溶液pH大,说明ClO﹣水解程度大于
C 探究FeCl3溶液与KI溶液的反应 向10mLFeCl3溶液中滴加5mL等浓度的KI溶液,充分反应后,再滴加KSCN溶液,观察现象 若溶液最终变为血红色,FeCl3溶液与KI溶液的反应为可逆反应
D 检验食品脱氧剂中还原铁粉是否已变质 取脱氧剂包装内固体粉末于试管中,加足量稀盐酸溶解,充分反应后滴加KSCN溶液,振荡,观察溶液颜色变化 若溶液未变红色,说明脱氧剂中还原铁粉 没有变质
A.A B.B C.C D.D
【解答】解:A.降低温度,溶液由黄绿色变为蓝绿色,[CuCl4]2﹣的浓度减小,则降低温度使[Cu(H2O)4]2++4Cl [CuCl4]2﹣+4H2O逆向移动,故A正确;
B.NaClO溶液可使pH试纸褪色,应选pH计测定,故B错误;
C.FeCl3溶液过量,反应后有剩余,应控制氯化铁不足,反应后检验铁离子证明反应的可逆性,故C错误;
D.溶解时可能Fe与铁离子反应生成亚铁离子,由实验操作和现象不能证明铁粉是否变质,故D错误;
故选:A。
11.氢气和二氧化碳在催化剂作用下合成甲醇的反应为放热反应,催化过程可解释为“吸附﹣活化﹣解离”的过程,催化反应机理如图所示。下列说法正确的是( )
A.反应过程中Ⅰ~Ⅴ步,C元素化合价不变
B.单位时间内生成的水越多,则甲醇的产率越大
C.增大催化剂的表面积,可以提高甲醇的平衡产率
D.氢气和二氧化碳在催化反应过程中有副产物CO生成
【解答】解:A.反应过程中Ⅰ﹣Ⅴ步,C的成键个数不相同,化合价发生了变化,故A错误;
B.生成的水越多,有可能产生的CO越多,甲醇产率不一定大,故B错误;
C.增大催化剂的表面积,可以加快反应速率,但不影响平衡转化率,故C错误;
D.由图可得,氢气和二氧化碳在催化反应过程中有副产物CO生成,故D正确;
故选:D。
12.甲氧苄啶是一种广谱抗菌药,其合成路线中的一步过程如图,下列说法正确的是( )
A. X分子中含氧官能团有醚键、羟基 B.Y分子中含1个手性碳原子
C. X分子中所有碳原子可能共平面 D.用酸性高锰酸钾溶液可以鉴别有机物X、Y
【解答】【解答】解:A.X与足量氢气加成产物如图,含有2个手性碳原子,故A错误;
B.Y分子中饱和碳原子采用sp3杂化,酯基上的碳原子采用sp2杂化,﹣CN中碳原子采用sp杂化,C原子有3种杂化类型,故B错误;
C.碳碳双键两端的碳原子连接2个不同的原子或原子团,所以Z存在顺反异构,故C不正确;
D.Z中具有苯、醚、烯烃、酯和腈的性质,苯环和碳碳双键能发生加成反应,酯基能发生取代反应,碳碳双键能发生氧化反应,故D正确;
选D
12.常温下:常见弱酸的电离平衡常数如下:
H2S HClO H2CO3
Ka1═1.3×10﹣7 Ka2═7.1×10﹣15 Ka═4.7×10﹣8 Kal═4.2×10﹣7 Ka2═5.6×10﹣11
以下说法正确的是( )
A.少量CO2通入到NaClO溶液中生成Na2CO3
B.等浓度等体积的NaOH与H2S混合后,溶液中水的电离程度比纯水小
C.等浓度等体积的Na2S与NaHS混合,c(HS﹣)+3c(H2S)+2c(H+)═2c(OH﹣)+c(S2﹣)
D.NaOH溶液与H2S溶液混合,当溶液的pH═7时,离子浓度大小关系为:c(HS﹣)>c(Na+)>c(S2﹣)>c(H+)═c(OH﹣)
【解答】解:A.比较电离平衡常数可知,酸性强弱关系:H2CO3>HClO>HCO3﹣,CO2通入到NaClO溶液中发生反应:CO2+H2O+NaClO═HClO+NaHCO3,故A错误;
B.两者按物质的量1:1混合,发生反应:NaOH+H2S═NaHS+H2O,溶液呈碱性,HS﹣水解程度大于电离程度,使水的电离程度增大,故B错误;
C.混合后,两者浓度仍然相等,设为c,根据Na元素质量守恒得c(Na+)═3c,根据S元素质量守恒得c(S2﹣)+c(HS﹣)+c(H2S)═2c,溶液中物料守恒式为:2c(Na+)=3c(S2﹣)+3c(HS﹣)+3c(H2S),电荷守恒式为:c(Na+)+c(H+)═2c(S2﹣)+c(HS﹣)+c(OH﹣),用物料守恒式与电荷守恒式共同消除c(Na+)后得:c(HS﹣)+3c(H2S)+2c(H+)═2c(OH﹣)+c(S2﹣),故C正确;
D.溶液的pH=7时,溶质为NaHS和H2S,其中c(H+)═c(OH﹣)>c(S2﹣),根据电荷守恒式:c(Na+)+c(H+)═2c(S2﹣)+c(HS﹣)+c(OH﹣),得c(Na+)>c(HS﹣),故c(Na+)>c(HS﹣)>c(H+)═c(OH﹣)>c(S2﹣),故D错误;
故选:C。
13.燃煤电厂锅炉尾气中含有氮氧化物(主要成分NO),可通过主反应4NH3(g)+4NO(g)+O2(g)═4N2(g)+6H2O(g)△H=﹣1627.7kJ mol﹣1除去。温度高于300℃时会发生副反应:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=﹣904.74kJ mol﹣1。在恒压、反应物起始物质的量之比一定的条件下,反应相同时间,NO的转化率在不同催化剂作用下随温度变化的曲线如图所示。下列有关说法一定正确的是( )
A.升高温度、增大压强均可提高主反应中NO的平衡转化率
B.N2(g)+O2(g)=2NO(g)△H=﹣180.74kJ mol﹣1
C.图中X点所示条件下,反应时间足够长,NO的转化率能达到Y点的值
D.图中Z点到W点NO的转化率降低的原因是主反应的平衡逆向移动
【解答】解:A.由主反应可知,正反应为气体体积增大的放热反应,根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,增大压强,平衡向气体体积缩小的方向移动,则升高温度、增大压强均使平衡向逆反应方向移动,可降低主反应中NO的平衡转化率,故A错误;
B.已知:①4NH3(g)+4NO(g)+O2(g)═4N2(g)+6H2O(g)△H=﹣1627.7kJ mol﹣1
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=﹣904.74kJ mol﹣1
根据盖斯定律,可得N2(g)+O2(g)=2NO(g)△H=×[(﹣904.74kJ mol﹣1)﹣(﹣1627.7kJ mol﹣1)]=+180.74kJ mol﹣1,故B错误;
C.图中X点反应未达平衡,所以反应时间足够长,此温度和催化剂B存在的条件下,NO的转化率能达到Y点的值,故C正确;
D.由图中Z点到W点NO的转化率降低的原因可能是催化剂的催化活性降低,还有可能是温度超过300°C发生副反应造成的,故D错误;
故选:C。
二.非选择题(共1小题)
三.解答题(共7小题)
15.氮及其化合物在工、农业生产中用途广泛。
(1)据报道,美国科学家卡尔 克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 +1 。
(2)
①分子中的大π键可用符号Πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π66),已知N5﹣为平面结构且含有大π键,则N5﹣中的大π键应表示为 。
②图中虚线代表氢键,其表示式为(NH4+)N﹣H Cl、 (H3O+)O﹣H N 、 (NH4+)N﹣H N 。
(3)还原沉淀法:使用Na2SO3将Cr(Ⅵ)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(Ⅵ)具有很强的氧化能力,将Cr2还原为Cr3+的离子方程式为 8H++3+Cr2=2Cr3++3+4H2O 。
②其他条件相同,用Na2SO3处理不同初始pH的含Cr(Ⅵ)废水相同时间,当pH<2时,Cr(Ⅵ)的去除率随
pH降低而降低的原因是 部分与H+结合转化为SO2逸出,使得与Cr(Ⅵ)反应的的物质的量浓度减小,反应速率减慢 。
(4)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(VI)去除率随温度的变化如图1所示。55℃时,
Cr(Ⅵ)的去除率很低的原因是 温度过高,硫酸盐还原菌发生变性,失去活性 。
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图2所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+, 在SRB细胞膜的作用下被H原子还原生成S2﹣,生成的S2﹣与Fe2+反应生成FeS 。
【解答】解:(1)由5个N结合,都达到8电子结构,且含有两个N≡N三键,故N≡N只能在链端,其结构为,两个N﹣N为配位键,电子对由靠近三键的N提供,故中间的N原子需失去一个电子达到稳定结构,所以N5分子碎片所带电荷是+1,
故答案为:+1;
(2)①N5﹣中键总数为5个,有6个电子可以形成大π键,可用符号,
故答案为:;
②O和N非金属性都很强,都可以与H形成氢键,可以表示为:(H3O+)O﹣H N和(NH4+)N﹣H N,
故答案为:(H3O+)O﹣H N;(NH4+)N﹣H N;
(3)①酸性条件下将Cr2还原为Cr3+,被氧化为,离子方程式为8H++3+Cr2=2Cr3++3+4H2O,
故答案为:8H++3+Cr2=2Cr3++3+4H2O;
②酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低,是由于当溶液酸性较强时,部分与H+结合产生的H2SO3转化为SO2气体逸出,使得与Cr(Ⅵ)反应的的物质的量浓度减小,从而导致化学反应速率减慢,
故答案为:部分与H+结合转化为SO2逸出,使得与Cr(Ⅵ)反应的的物质的量浓度减小,反应速率减慢;
(4)①硫酸盐还原菌中含有具有生物活性的蛋白质,其催化活性具有一定的温度范围,若温度过高,硫酸盐还原菌的蛋白质发生变性,导致失去活性,因而Cr(Ⅵ)的去除率降低,
故答案为:温度过高,硫酸盐还原菌发生变性,失去活性;
②在SRB细胞膜的作用下被H原子还原生成S2﹣,生成的S2﹣与Fe失去电子生成的Fe2+反应生成FeS,
故答案为:在SRB细胞膜的作用下被H原子还原生成S2﹣,生成的S2﹣与Fe2+反应生成FeS;
16.MnCO3常用于医药、电焊条辅料等,以软锰矿(主要成分为MnO2,还含有少量Fe2O3、Al2O3、SiO2、MgO、CaO等)为原料制备MnCO3的流程如图:
回答下列问题:
(1)废铁屑在使用前需要用热的纯碱溶液清洗表面油污,其清洗原理为 CO32﹣+H2O HCO3﹣+OH﹣,温度升高水解程度增强,碱性增强使油污加速水解 (结合离子方程式和必要的语言解释)。
(2)为了使废铁屑与软锰矿在“酸浸”中充分反应,可采取的措施为 将铁屑与软锰矿破碎为粉末,充分搅拌混合 ;“酸浸”时主要发生反应的离子方程式为 Fe+MnO2+4H+=Mn2++Fe2++2H2O 。
(3)“滤渣1”中含有的主要成分为 SiO2和CaSO4 。
(4)“氧化”过程中加入H2O2的量远超理论量的原因为 生成的Fe3+可催化H2O2的分解 。
(5)加入CaCO3能“除铁、铝”的原因为 加入CaCO3消耗H+,c(OH﹣)增大,从而沉淀Fe3+和Al3+ 。
(6)“沉锰”时发生反应的离子方程式为 Mn2++2HCO3﹣=MnCO3↓+CO2↑+H2O 。
(7)MnO2的正交(棱与棱之间的夹角均为90°)晶胞结构如图所示,晶胞参数分别为apm、bpm、cpm。其中Mn的配位数为 6 ;用NA表示阿伏加德罗常数的值,该晶体的密度为 g cm﹣3。
【解答】解:(1)热的纯碱溶液清洗表面油污的原理为:CO32﹣+H2O HCO3﹣+OH﹣,温度升高水解程度增强,碱性增强使油污加速水解,
故答案为:CO32﹣+H2O HCO3﹣+OH﹣,温度升高水解程度增强,碱性增强使油污加速水解;
(2)为了使废铁屑与软锰矿在“酸浸”中充分反应,可采取的措施为将铁屑与软锰矿破碎为粉末,充分搅拌混合;“酸浸”时主要发生反应的离子方程式为:Fe+MnO2+4H+=Mn2++Fe2++2H2O,
故答案为:将铁屑与软锰矿破碎为粉末,充分搅拌混合;Fe+MnO2+4H+=Mn2++Fe2++2H2O;
(3)SiO2不溶于酸,氧化钙与硫酸反应生成CaSO4微溶于水,所以“滤渣1”中含有的成分为SiO2和CaSO4,
故答案为:SiO2和CaSO4;
(4)“氧化”过程中加入H2O2的量远超理论量的原因为生成的Fe3+可催化H2O2的分解,
故答案为:生成的Fe3+可催化H2O2的分解;
(5)加入CaCO3能调节溶液酸度,从而起到“除铁、铝”的目的,
故答案为:加入CaCO3消耗H+,c(OH﹣)增大,从而沉淀Fe3+和Al3+;
(6)“沉锰”时发生反应的离子方程式为Mn2++2HCO3﹣=MnCO3↓+CO2↑+H2O,
故答案为:Mn2++2HCO3﹣=MnCO3↓+CO2↑+H2O;
(7)由图可知MnO2晶胞中Mn的配位数为6,该晶体密度==g cm﹣3,
故答案为:6;。
17.化合物H是制备药物洛索洛芬钠的关键中间体,其一种合成路线如图:
(1)A→B的反应类型为 还原反应 。
(2)D分子中碳原子杂化轨道类型有 3 种。
(3)G的结构简式为 。
(4)F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 、或 。
①分子中含有苯环;
②碱性条件下完全水解生成两种产物,酸化后分子中均含有4种不同化学环境的氢。
(5)设计以苯乙醇为原料制备的合成路线(无机试剂任用,合成路线示例见本题题干) 。
【解答】解:(1)A→B的反应类型为还原反应,
故答案为:还原反应;
(2)D分子中饱和碳原子价层电子对数是4,采用sp3杂化,苯环上碳原子价层电子对数是3,采用sp2杂化,﹣CN中碳原子价层电子对数是2,采用sp杂化,所以碳原子杂化轨道类型有3种,
故答案为:3;
(3)G的结构简式为,
故答案为:;
(4)F的一种同分异构体同时满足下列条件:
①分子中含有苯环;
②碱性条件下完全水解生成两种产物,说明含有酯基,酸化后分子中均含有4种不同化学环境的氢,生成的两种有机物的结构简式为、HOCH2CH2COOH,所以该同分异构体的结构简式为、、,
故答案为:、或;
(5)以苯乙醇为原料制备,可由和苯乙醇发生酯化反应得到,可由发生水解反应得到,可由发生取代反应得到,可由和HCl发生加成反应得到,苯乙醇发生消去反应得到苯乙烯,合成路线为,
故答案为:。
18.气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)用NH3催化还原NOx可以消除氮氧化物的污染。已知:
①4NH3 (g)+3O2 (g)═2N2 (g)+6H2O (g)ΔH=﹣akJ/mol
②N2(g)+O2 (g)═2NO (g)ΔH=﹣bkJ/mol
写出NH3还原NO至N2和水蒸气的热化学方程式 4NH3(g)+6NO(g)=5N2(g)+6H2O(g)ΔH=(3b﹣a)kJ/mol 。
(2)尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如图:
①尿素[CO(NH2)2]中氮元素的化合价为 ﹣3 。
②写出“催化反应”过程中NH3还原NO2的化学方程式 8NH3+6NO2=N2+12H2O 。
③若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。试分析硫酸盐的产生过程 SO2与O2、H2O反应生成H2SO4,H2SO4与NH3反应生成(NH4)2SO4或者NH4HSO4 。
④“催化反应”过程中需控制温度在250℃~380℃之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和 温度升高,NH3催化氧化生成NO 。
以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k c(N2O) [c(I2)]0.5(k为速率常数)。下列表述正确的是 A
A.N2O分解反应中:k值与是否含碘蒸气有关
B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的催化剂
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体:2CO+2NO→N2+2CO2△H1。
①已知:反应N2(g)+O2(g) 2NO(g)△H2=+180.0kJ mol﹣1,若CO的燃烧热△H为﹣283.5kJ/mol,则△H1= ﹣747.0kJ/mol 。
②若在恒容的密闭容器中,充入2mol CO和1mol NO,下列选项中不能说明该反应已经达到平衡状态的是 B 。
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.2v(N2)正=v(CO)逆
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+x(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ.NO(g)+□→NO(a)
Ⅱ.2NO(a)→2N(a)+O2(g)
Ⅲ.2N(a)→N2(g)+2□
Ⅳ.2NO(a)→N2(g)+2O(a)
Ⅴ.2O(a)→O2(g)+2□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是 还原后催化剂中金属原子的个数不变,价态降低,氧缺位增多,反应速率加快 。
(3)N2O4与NO2之间存在反应N2O4(g) 2NO(g)。将定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
①图中a点对应温度下。已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp= 115.2 kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1= K2Kp ,在图上标出的点中,能表示反应达到平衡状态的点为 B、D (填字母代号)。
【解答】解:(1)①4NH3 (g)+3O2 (g)═2N2 (g)+6H2O (g)ΔH=﹣akJ/mol
②N2(g)+O2 (g)═2NO (g)ΔH=﹣bkJ/mol
根据盖斯定律:①﹣3×②得4NH3 (g)+6NO (g)=5N2(g)+6H2O (g)ΔH=(3b﹣a)kJ/mol,
故答案为:4NH3 (g)+6NO (g)=5N2(g)+6H2O (g)ΔH=(3b﹣a)kJ/mol;
(2)①尿素[CO(NH2)2]中C元素为+4价,O元素为﹣2价,H元素为+1价,根据化合价代数和为0,则尿素氮元素的化合价为﹣3价;
故答案为:﹣3;
②由图可知,“催化反应”过程中NH3还原NO2的化学方程式为:8NH3+6NO2=N2+12H2O,
故答案为:8NH3+6NO2=N2+12H2O;
③若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。则硫酸盐的产生过程为:SO2与O2、H2O反应生成H2SO4,H2SO4与NH3反应生成(NH4)2SO4或者NH4HSO4,
故答案为:SO2与O2、H2O反应生成H2SO4,H2SO4与NH3反应生成(NH4)2SO4或者NH4HSO4;
④“催化反应”过程中需控制温度在250℃~380℃之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和温度升高,NH3催化氧化生成NO,
故答案为:温度升高,NH3催化氧化生成NO。
(3)A.单质碘在N2O分解的反应中起到催化剂的作用,因此能够使K 值增大,故A正确;
B.第二步反应为慢反应,对总反应的速率起到决定性作用,故B错误;
C.活化能越大,反应速率越慢,故C错误;
D.IO在第二步反应中生成,在第三步反应又消失,为中间产物,不是催化剂,故D错误,
故答案为:A;
(2)根据所给的反应①2CO+2NO→N2+2CO2△H1和反应②N2(g)+O2(g) 2NO(g)△H2=+180.0kJ mol﹣1,可得到一氧化碳燃烧的热化学方程式CO(g)+O2 (g)=CO2(g)△H为﹣283.5kJ/mol,则△H1=2△H﹣△H2=(﹣283.5×2)kJ mol﹣1﹣180.0kJ mol﹣1=﹣747.0kJ mol﹣1,
故答案为:﹣747.0kJ mol﹣1;
②A.投入的CO和NO的物质的量之比为2:1,CO与NO的反应的物质的量之比为1:1,则在反应过程中,CO与NO的反应的物质的量之比为为变量,若比值不变,则表明达到平衡,不符合题意;
B.反应前后均为气体,气体的质量不变,恒容的密闭容器容积不变,混合气体的密度在反应过程中均保持不变,不能够标志反应已经达到平衡,符合题意;
C.反应前后气体的分子数不相等,则在反应过程中气体压强在不断变化,因此混合气体的压强不变时,说明反应已经达到平衡,不符合题意;
D.反应未达到平衡前正反应速率逐渐减小,逆反应速率逐渐增大,二者相等则反应达到平衡,2v(N2)正=v(CO)逆,不符合题意,
故答案为:B;
③还原前后催化剂中金属原子的个数不变,则还原后低价的金属离子越多,催化剂表面的氧缺位越多,氧缺位越多,反应速率越快,
故答案为:还原后催化剂中金属原子的个数不变,价态降低,氧缺位增多,反应速率加快;
(3)①设起始时N2O4的物质的量为1mol,a点时N2O4与的转化率为40%,列三段式可得:
N2O4(g) 2NO2(g)
起始(mol) 1 0
变化(mol) 0.4 0.8
平衡(mol) 0.6 0.8
则平衡时气体的总物质的量为0.6mol+0.8mol=1.4mol,压强之比等于气体的物质的量之比,平衡时气体的总压强为108kPa×1.4=151.2kPa,则平衡常数,
故答案为:115.2Kpa;
②v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),达到平衡时,有2v正( N2O4)=v逆(NO2),即2k1p(N2O4)=k2p2(NO2),平衡常数,K1=K2Kp,
故答案为:K2Kp;
③达到平衡时,2v正( N2O4)=v逆(NO2),由图可知B、D两点的速率符合2v正( N2O4)=v逆(NO2),故B点与D点为平衡点,
故答案为:B、D。
化学试卷
一.选择题(共14小题,每题3分,共42分
)
1.2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭,在酒泉卫星发射中心按照预定时间精准点火发射,这是中国空间站关键技术验证阶段第六次飞行。下列叙述错误的是( )
A.火箭箭体采用的高强度新型钛合金结构属于金属材料
B.航天员航天服上的橡胶属于有机高分子材料
C.二氧化硅是飞船搭载的太阳能电池板的核心材料
D.航天员手臂“延长器”——操纵棒中的碳纤维材料属于新型材料
2.下列说法错误的是( )
A.羊毛织品洗后易变形,与氢键有关
B.基态Fe原子中,两种自旋状态的电子数之比为11:15
C.键角:NO3﹣>NH4+>NH3>PH3>P4
D.46g二甲醚(CH3OCH3)中sp3杂化的原子数为2NA
3.下列说法正确的是( )
A.由分子组成的物质中一定存在共价键
B.共价化合物一定含共价键,也可能含离子键
C.由非金属元素组成的化合物一定是共价化合物
D.离子化合物一定含离子键,也可能含极性键或非极性键
4.7N、8O、11Na、17Cl是周期表中的短周期主族元素。下列有关说法不正确的是( )
A.离子半径:r(Na+)<r(O2﹣)<r(Cl﹣)
B.第一电离能:I1(Na)<I1(N)<I1(O)
C.氢化物对应的稳定性:NH3<H2O
D.最高价氧化物的水化物的酸性:HNO3<HClO4
5.X、Y、Z、Q、W原子序数依次增大。X的电子只有一种自旋取向,Y和Z的某同位素测定可用于分析古代人类的食物结构,Q单质可用于自来水消毒,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法一定正确的是( )
A.Z、Y的氢化物稳定性:Z<Y
B.Q与Y原子形成的分子空间结构为四面体型
C.Q单质可从Z的简单气态氢化物中置换出Z
D.[W(ZX3)4]2+中σ键数为12
6.某化合物X结构如图所示,下列说法不正确的是( )
A.X中含有4种含氧官能团
B.1molX最多能与5molNaOH反应
C.X水解后的产物都存在顺反异构体
D.X中含有1个手性碳原子
7.废旧锌锰电池处理后的废料[含MnO2、MnOOH、Zn(OH)2、Fe等]制备Zn和MnO2的一种工艺流程如图:
已知:Mn的金属活动性强于Fe,Mn2+在pH大于5.5时易被氧化。
下列说法不正确的是( )
A.“还原焙烧”时Mn元素被还原
B.“酸浸”过程中适当加热,主要目的是加快浸取速率
C.“净化”时MnCO3的作用是调节溶液的pH,使Fe3+形成Fe(OH)3沉淀而除去
D.“电解”时阳极反应式为Mn2+﹣2e﹣+4OH﹣═MnO2+2H2O
8.已知A、B、C、D、E是五种短周期主族元素,其原子半径与原子序数的关系如图1,且A、B、C、D可形成化合物X如图2,C与E同主族。下列说法错误的是( )
A.A、B、D均可与C形成常见的两种二元化合物
B.简单离子的半径:E>D>C
C.最高价氧化物对应水化物的酸性:E>B
D.化合物X在低温更加稳定
9.ZnS是一种重要的光导体材料。如图是ZnS的某种晶胞沿z轴方向在xy平面的投影,原子旁标注的数字是该原子位于z轴上的高度(部分相同位置的原子未标注)。下列说法正确的是( )
A.S2﹣周围等距且最近的S2﹣有6个
B.基态Zn原子核外电子的空间运动状态有30种
C.Zn2+与S2﹣的最短距离为apm
D.在第三周期中,比S元素第一电离能大的元素只有两种
10.下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
A 探究温度对化学平衡的影响 将2mL0.5mol/L的CuCl2溶液加热后置于冷水中,观察现象 若溶液由黄绿色变为蓝绿色,说明降低温度,向逆方向移动:[Cu(H2O)4]2++4Cl﹣ [CuCl4]2﹣+4H2O
B 比较和ClO﹣水解程度大小 用pH试纸分别测定同浓度NaHCO3和NaClO溶液的pH 若测得NaClO溶液pH大,说明ClO﹣水解程度大于
C 探究FeCl3溶液与KI溶液的反应 向10mLFeCl3溶液中滴加5mL等浓度的KI溶液,充分反应后,再滴加KSCN溶液,观察现象 若溶液最终变为血红色,FeCl3溶液与KI溶液的反应为可逆反应
D 检验食品脱氧剂中还原铁粉是否已变质 取脱氧剂包装内固体粉末于试管中,加足量稀盐酸溶解,充分反应后滴加KSCN溶液,振荡,观察溶液颜色变化 若溶液未变红色,说明脱氧剂中还原铁粉 没有变质
A.A B.B C.C D.D
11.氢气和二氧化碳在催化剂作用下合成甲醇的反应为放热反应,催化过程可解释为“吸附﹣活化﹣解离”的过程,催化反应机理如图所示。下列说法正确的是( )
A.反应过程中Ⅰ~Ⅴ步,C元素化合价不变
B.单位时间内生成的水越多,则甲醇的产率越大
C.增大催化剂的表面积,可以提高甲醇的平衡产率
D.氢气和二氧化碳在催化反应过程中有副产物CO生成
12.甲氧苄啶是一种广谱抗菌药,其合成路线中的一步过程如图,下列说法正确的是( )
A. X分子中含氧官能团有醚键、羟基 B.Y分子中含1个手性碳原子
C. X分子中所有碳原子可能共平面 D.用酸性高锰酸钾溶液可以鉴别有机物X、Y
13.常温下:常见弱酸的电离平衡常数如下:
H2S HClO H2CO3
Ka1═1.3×10﹣7 Ka2═7.1×10﹣15 Ka═4.7×10﹣8 Kal═4.2×10﹣7 Ka2═5.6×10﹣11
以下说法正确的是( )
A.少量CO2通入到NaClO溶液中生成Na2CO3
B.等浓度等体积的NaOH与H2S混合后,溶液中水的电离程度比纯水小
C.等浓度等体积的Na2S与NaHS混合,c(HS﹣)+3c(H2S)+2c(H+)═2c(OH﹣)+c(S2﹣)
D.NaOH溶液与H2S溶液混合,当溶液的pH═7时,离子浓度大小关系为:c(HS﹣)>c(Na+)>c(S2﹣)>c(H+)═c(OH﹣)
14.燃煤电厂锅炉尾气中含有氮氧化物(主要成分NO),可通过主反应4NH3(g)+4NO(g)+O2(g)═4N2(g)+6H2O(g)△H=﹣1627.7kJ mol﹣1除去。温度高于300℃时会发生副反应:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=﹣904.74kJ mol﹣1。在恒压、反应物起始物质的量之比一定的条件下,反应相同时间,NO的转化率在不同催化剂作用下随温度变化的曲线如图所示。下列有关说法一定正确的是( )
A.升高温度、增大压强均可提高主反应中NO的平衡转化率
B.N2(g)+O2(g)=2NO(g)△H=﹣180.74kJ mol﹣1
C.图中X点所示条件下,反应时间足够长,NO的转化率能达到Y点的值
D.图中Z点到W点NO的转化率降低的原因是主反应的平衡逆向移动
二.非选择题(共1小题)
15.(15分)氮及其化合物在工、农业生产中用途广泛。
(1)报道,美国科学家卡尔 克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
(2)①分子中的大π键可用符号Πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π66),已知N5﹣为平面结构且含有大π键,则N5﹣中的大π键应表示为 。
②图中虚线代表氢键,其表示式为(NH4+)N﹣H Cl、 、 。
(3)还原沉淀法:使用Na2SO3将Cr(Ⅵ)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(Ⅵ)具有很强的氧化能力,将Cr2还原为Cr3+的离子方程式为 。
②其他条件相同,用Na2SO3处理不同初始pH的含Cr(Ⅵ)废水相同时间,当pH<2时,Cr(Ⅵ)的去除率随
pH降低而降低的原因是 。
(4)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(VI)去除率随温度的变化如图1所示。55℃时,
Cr(Ⅵ)的去除率很低的原因是 。
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图2所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+, 。
16(12分)MnCO3常用于医药、电焊条辅料等,以软锰矿(主要成分为MnO2,还含有少量Fe2O3、Al2O3、SiO2、MgO、CaO等)为原料制备MnCO3的流程如图:
回答下列问题:
(1)废铁屑在使用前需要用热的纯碱溶液清洗表面油污,其清洗原理为 (结合离子方程式和必要的语言解释)。
(2)为了使废铁屑与软锰矿在“酸浸”中充分反应,可采取的措施为 ;“酸浸”时主要发生反应的离子方程式为 。
(3)“滤渣1”中含有的主要成分为 。
(4)“氧化”过程中加入H2O2的量远超理论量的原因为 。
(5)加入CaCO3能“除铁、铝”的原因为 。
(6)“沉锰”时发生反应的离子方程式为 。
(7)MnO2的正交(棱与棱之间的夹角均为90°)晶胞结构如图所示,晶胞参数分别为apm、bpm、cpm。其中Mn的配位数为 ;用NA表示阿伏加德罗常数的值,该晶体的密度为 g cm﹣3。
17.(15分)化合物H是制备药物洛索洛芬钠的关键中间体,其一种合成路线如图:
(1)A→B的反应类型为 。
(2)D分子中碳原子杂化轨道类型有 种。
(3)G的结构简式为 。
(4)F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
①分子中含有苯环;
②碱性条件下完全水解生成两种产物,酸化后分子中均含有4种不同化学环境的氢。
(5)设计以苯乙醇为原料制备的合成路线(无机试剂任用,合成路线示例见本题题干) 。
18.(15分)气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)用NH3催化还原NOx可以消除氮氧化物的污染。已知:
①4NH3 (g)+3O2 (g)═2N2 (g)+6H2O (g)ΔH=﹣akJ/mol
②N2(g)+O2 (g)═2NO (g)ΔH=﹣bkJ/mol
写出NH3还原NO至N2和水蒸气的热化学方程式 。
(2)尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如图:
①尿素[CO(NH2)2]中氮元素的化合价为 。
②写出“催化反应”过程中NH3还原NO2的化学方程式 。
③若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。试分析硫酸盐的产生过程 。
④“催化反应”过程中需控制温度在250℃~380℃之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和 。
(3)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k c(N2O) [c(I2)]0.5(k为速率常数)。下列表述正确的是
A.N2O分解反应中:k值与是否含碘蒸气有关
B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的催化剂
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体:2CO+2NO→N2+2CO2△H1。
①已知:反应N2(g)+O2(g) 2NO(g)△H2=+180.0kJ mol﹣1,若CO的燃烧热△H为﹣283.5kJ/mol,则△H1= 。
②若在恒容的密闭容器中,充入2mol CO和1mol NO,下列选项中不能说明该反应已经达到平衡状态的是 。
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.2v(N2)正=v(CO)逆
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+x(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ.NO(g)+□→NO(a)
Ⅱ.2NO(a)→2N(a)+O2(g)
Ⅲ.2N(a)→N2(g)+2□
Ⅳ.2NO(a)→N2(g)+2O(a)
Ⅴ.2O(a)→O2(g)+2□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是 。
(3)N2O4与NO2之间存在反应N2O4(g) 2NO(g)。将定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
①图中a点对应温度下。已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp= kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1= ,在图上标出的点中,能表示反应达到平衡状态的点为 (填字母代号)。
参考答案与试题解析
一.选择题(共13小题)
1.2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭,在酒泉卫星发射中心按照预定时间精准点火发射,这是中国空间站关键技术验证阶段第六次飞行。下列叙述错误的是( )
A.火箭箭体采用的高强度新型钛合金结构属于金属材料
B.航天员航天服上的橡胶属于有机高分子材料
C.二氧化硅是飞船搭载的太阳能电池板的核心材料
D.航天员手臂“延长器”——操纵棒中的碳纤维材料属于新型材料
【解答】解:A.钛合金强度大,适合用作火箭箭体材料,故A正确;
B.合成橡胶由各种单体经聚合反应而得,橡胶制品广泛应用于工业或生活,属于有机高分子材料,故B正确;
C.晶体硅为良好的半导体材料,是制造太阳能电池板的核心材料,二氧化硅不具有此性质,故C错误;
D.碳纤维是新型无机非金属材料,故D正确;
故选:C。
2.下列说法错误的是( )
A.羊毛织品洗后易变形,与氢键有关
B.基态Fe原子中,两种自旋状态的电子数之比为11:15
C.键角:NO3﹣>NH4+>NH3>PH3>P4
D.46g二甲醚(CH3OCH3)中sp3杂化的原子数为2NA
【解答】解:A.羊毛织品中主要成分为蛋白质,蛋白质中含有大量氢键,水洗时会破坏其中部分氢键,使得织品变形,DNA为双螺旋结构,其中碱基对以氢键相连,故A正确;
B.基态Fe原子核外电子排布式为:[Ar]3d64s2,3d能级上有4个自旋方向相同的单电子,所以基态Fe原子中,两种自旋状态的电子数之比为11:15,故B正确;
C.NO3﹣中N原子价层电子对个数=3+=3且不含孤电子对,NH4+中N原子价层电子对个数=4+=4且不含孤电子对,NH3中N原子价层电子对个数=3+=4且含有1个孤电子对,PH3中P原子价层电子对个数=3+=4且含有1个孤电子对,P4为正四面体结构,NO3﹣、NH4+、NH3、PH3、P4分别为平面三角形、正四面体形、三角锥形、三角锥形、正四面体形,N﹣H键长小于P﹣H键长,所以NH3的键角大于PH3,P4中键角为60°,所以键角NO3﹣>NH4+>NH3>PH3>P4,故C正确;
D.n(CH3OCH3)==1mol,每个二甲醚分子中含有3个采用sp3杂化的原子,46g二甲醚(CH3OCH3)中sp3杂化的原子数为3NA,故D错误;
故选:D。
3.下列说法正确的是( )
A.由分子组成的物质中一定存在共价键
B.共价化合物一定含共价键,也可能含离子键
C.由非金属元素组成的化合物一定是共价化合物
D.离子化合物一定含离子键,也可能含极性键或非极性键
【解答】解:A.稀有气体为单原子分子,分子中不存在共价键,所以由分子构成的物质中不一定存在共价键,故A错误;
B.共价化合物是指只含有共价键的化合物,故B错误;
C.非金属元素之间也能形成离子键,如氯化铵是由非金属元素构成的离子化合物,故C错误;
D.含有离子键的化合物为离子化合物,也可能含有极性键或非极性键,如氢氧化钠中含有离子键和极性键,过氧化钠中含有离子键和非极性共价键,故D正确;
故选:D。
4.7N、8O、11Na、17Cl是周期表中的短周期主族元素。下列有关说法不正确的是( )
A.离子半径:r(Na+)<r(O2﹣)<r(Cl﹣)
B.第一电离能:I1(Na)<I1(N)<I1(O)
C.氢化物对应的稳定性:NH3<H2O
D.最高价氧化物的水化物的酸性:HNO3<HClO4
【解答】解:A.Na+、O2﹣的电子层结构相同,离子的核电荷数越大,离子半径越小,所以离子半径:r(Na+)<r(O2﹣);对于电子层结构不同的离子,离子的核外电子层数越多,离子半径就越大;Na+、O2﹣只有2个电子层,Cl﹣核外有3个电子层,Cl﹣核外的电子层数最多,故Cl﹣半径最大,则离子半径:r(Na+)<r(O2﹣)<r(Cl﹣),故A正确;
B.一般情况下,元素的非金属性越强,其第一电离能就越大,但由于N原子核外电子排布处于半充满的稳定状态,失去电子消耗的能量大于同一周期相邻元素,所以I1(O)<I1(N),则三种元素的第一电离能大小关系为:I1(Na)<I1(O)<I1(N),故B错误;
C.元素的非金属性越强,其相应的简单氢化物的稳定性就越强,由于元素的非金属性:N<O,所以简单氢化物的稳定性:NH3<H2O,故C正确;
D.高氯酸为所有含氧酸中酸性最强的酸,所以最高价氧化物的水化物的酸性:HNO3<HClO4,故D正确;
故选:B。
5.X、Y、Z、Q、W原子序数依次增大。X的电子只有一种自旋取向,Y和Z的某同位素测定可用于分析古代人类的食物结构,Q单质可用于自来水消毒,W为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法一定正确的是( )
A.Z、Y的氢化物稳定性:Z<Y
B.Q与Y原子形成的分子空间结构为四面体型
C.Q单质可从Z的简单气态氢化物中置换出Z
D.[W(ZX3)4]2+中σ键数为12
【解答】解:A.由分析可知,Y、Z分别为C、N,C、N为同周期元素,C的非金属性比N弱,则 Z、Y的简单氢化物稳定性:NH3>CH4,故A错误;
B.Q与Y原子形成的分子可以为CCl4,也可以是C2Cl6,CCl4是正四面体结构,而C2Cl6不是四面体形结构,故B错误;
C.Q单质(Cl2)与Z的简单气态氢化物(NH3)反应为8NH3+3Cl2═6NH4Cl+N2,则Cl2可置换出NH3中的N,故C正确;
D.[W(ZX3)4]2+为[Zn(NH3)4]2+,每个NH3中含有3个σ键,另外还形成4个配位键,配位键也属于σ键,则σ键数为3×4+4═16,故D错误;
故选:C。
6.某化合物X结构如图所示,下列说法不正确的是( )
A.X中含有4种含氧官能团
B.1molX最多能与5molNaOH反应
C.X水解后的产物都存在顺反异构体
D.X中含有1个手性碳原子
【解答】解:A.含有酚羟基、碳碳双键、酯基、酰胺基、羧基,其中四种是含氧官能团,故A正确;
B.酚羟基、酯基水解生成的羧基和酚羟基、酰胺基水解生成的羧基、羧基都能和NaOH以1:1反应,1mol该物质最多消耗6molNaOH,故B错误;
C.水解产物HOOCCH=CHCOOH中碳碳双键两端的碳原子连接2个不同的原子或原子团,该物质中存在顺反异构,故C正确;
D.连接甲基和酰胺键中N原子的碳原子为手性碳原子,故D正确;
故选:B。
7.废旧锌锰电池处理后的废料[含MnO2、MnOOH、Zn(OH)2、Fe等]制备Zn和MnO2的一种工艺流程如图:
已知:Mn的金属活动性强于Fe,Mn2+在pH大于5.5时易被氧化。
下列说法不正确的是( )
A.“还原焙烧”时Mn元素被还原
B.“酸浸”过程中适当加热,主要目的是加快浸取速率
C.“净化”时MnCO3的作用是调节溶液的pH,使Fe3+形成Fe(OH)3沉淀而除去
D.“电解”时阳极反应式为Mn2+﹣2e﹣+4OH﹣═MnO2+2H2O
【解答】解:A.“还原焙烧”中MnO2、MnOOH分别与炭黑反应,2MnOOH+C2MnO+CO↑+H2↑、MnO2+CMnO+CO,反应中锰元素被还原为MnO,且有气体产物生成,故A正确;
B.加热和搅拌都可以加快酸浸时的反应速率,故B正确;
C.“净化”时通入氧气和加入碳酸锰,使铁元素变成Fe(OH)3沉淀而分离,故C正确;
D.电解时阳极电极方程式为:Mn2+﹣2e﹣+2H2O=MnO2+4H+,故D错误;
故选:D。
8.已知A、B、C、D、E是五种短周期主族元素,其原子半径与原子序数的关系如图1,且A、B、C、D可形成化合物X如图2,C与E同主族。下列说法错误的是( )
A.A、B、D均可与C形成常见的两种二元化合物
B.简单离子的半径:E>D>C
C.最高价氧化物对应水化物的酸性:E>B
D.化合物X在低温更加稳定
【解答】解:A.H与O能形成化合物H2O、H2O2,Na与O能形成化合物Na2O、Na2O2,C与O能形成化合物CO、CO2,故A正确;
B.电子层数越多半径越大,电子层数相同,质子数越多半径越小,简单离子的半径:S2﹣>O2﹣>Na+,故B错误;
C.非金属性越强对应的最高价氧化物的水化物酸性越强,非金属性S>C,最高价氧化物的水化物酸性H2SO4>H2CO3,故C正确;
D.X为Na2CO3 H2O2,H2O2受热易分解,Na2CO3易与酸反应,化合物X在低温的碱性溶液中更加稳定,故D正确;
故选:B。
9.ZnS是一种重要的光导体材料。如图是ZnS的某种晶胞沿z轴方向在xy平面的投影,原子旁标注的数字是该原子位于z轴上的高度(部分相同位置的原子未标注)。下列说法正确的是( )
A.S2﹣周围等距且最近的S2﹣有6个
B.基态Zn原子核外电子的空间运动状态有30种
C.Zn2+与S2﹣的最短距离为apm
D.在第三周期中,比S元素第一电离能大的元素只有两种
【解答】解:A.S2﹣处于晶胞内部,处于体对角线的四分之一处,S2﹣周围等距且最近的S2﹣有4个,故A错误;
B.锌元素的原子序数为30,基态原子的电子排布式为1s22s22p63s23p63d104s2,原子轨道的数目与核外电子的空间运动状态相等,s轨道、p轨道、d轨道的数目分别为1、3、5,所以锌原子核外电子共有15种空间运动状态,故B错误;
C.S2﹣处于体对角线的四分之一处,体对角线长度为apm,故Zn2+与S2﹣的最短距离为apm,故C正确;
D.同周期元素,非金属性越强,电离能越大,第ⅤA主族元素原子核外电子为半满状态,第一电离能大于相邻元素,且Cl、Ar元素电离能也大于S,有3种,故D错误;
故选:C。
10.下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
A 探究温度对化学平衡的影响 将2mL0.5mol/L的CuCl2溶液加热后置于冷水中,观察现象 若溶液由黄绿色变为蓝绿色,说明降低温度,向逆方向移动:[Cu(H2O)4]2++4Cl﹣ [CuCl4]2﹣+4H2O
B 比较和ClO﹣水解程度大小 用pH试纸分别测定同浓度NaHCO3和NaClO溶液的pH 若测得NaClO溶液pH大,说明ClO﹣水解程度大于
C 探究FeCl3溶液与KI溶液的反应 向10mLFeCl3溶液中滴加5mL等浓度的KI溶液,充分反应后,再滴加KSCN溶液,观察现象 若溶液最终变为血红色,FeCl3溶液与KI溶液的反应为可逆反应
D 检验食品脱氧剂中还原铁粉是否已变质 取脱氧剂包装内固体粉末于试管中,加足量稀盐酸溶解,充分反应后滴加KSCN溶液,振荡,观察溶液颜色变化 若溶液未变红色,说明脱氧剂中还原铁粉 没有变质
A.A B.B C.C D.D
【解答】解:A.降低温度,溶液由黄绿色变为蓝绿色,[CuCl4]2﹣的浓度减小,则降低温度使[Cu(H2O)4]2++4Cl [CuCl4]2﹣+4H2O逆向移动,故A正确;
B.NaClO溶液可使pH试纸褪色,应选pH计测定,故B错误;
C.FeCl3溶液过量,反应后有剩余,应控制氯化铁不足,反应后检验铁离子证明反应的可逆性,故C错误;
D.溶解时可能Fe与铁离子反应生成亚铁离子,由实验操作和现象不能证明铁粉是否变质,故D错误;
故选:A。
11.氢气和二氧化碳在催化剂作用下合成甲醇的反应为放热反应,催化过程可解释为“吸附﹣活化﹣解离”的过程,催化反应机理如图所示。下列说法正确的是( )
A.反应过程中Ⅰ~Ⅴ步,C元素化合价不变
B.单位时间内生成的水越多,则甲醇的产率越大
C.增大催化剂的表面积,可以提高甲醇的平衡产率
D.氢气和二氧化碳在催化反应过程中有副产物CO生成
【解答】解:A.反应过程中Ⅰ﹣Ⅴ步,C的成键个数不相同,化合价发生了变化,故A错误;
B.生成的水越多,有可能产生的CO越多,甲醇产率不一定大,故B错误;
C.增大催化剂的表面积,可以加快反应速率,但不影响平衡转化率,故C错误;
D.由图可得,氢气和二氧化碳在催化反应过程中有副产物CO生成,故D正确;
故选:D。
12.甲氧苄啶是一种广谱抗菌药,其合成路线中的一步过程如图,下列说法正确的是( )
A. X分子中含氧官能团有醚键、羟基 B.Y分子中含1个手性碳原子
C. X分子中所有碳原子可能共平面 D.用酸性高锰酸钾溶液可以鉴别有机物X、Y
【解答】【解答】解:A.X与足量氢气加成产物如图,含有2个手性碳原子,故A错误;
B.Y分子中饱和碳原子采用sp3杂化,酯基上的碳原子采用sp2杂化,﹣CN中碳原子采用sp杂化,C原子有3种杂化类型,故B错误;
C.碳碳双键两端的碳原子连接2个不同的原子或原子团,所以Z存在顺反异构,故C不正确;
D.Z中具有苯、醚、烯烃、酯和腈的性质,苯环和碳碳双键能发生加成反应,酯基能发生取代反应,碳碳双键能发生氧化反应,故D正确;
选D
12.常温下:常见弱酸的电离平衡常数如下:
H2S HClO H2CO3
Ka1═1.3×10﹣7 Ka2═7.1×10﹣15 Ka═4.7×10﹣8 Kal═4.2×10﹣7 Ka2═5.6×10﹣11
以下说法正确的是( )
A.少量CO2通入到NaClO溶液中生成Na2CO3
B.等浓度等体积的NaOH与H2S混合后,溶液中水的电离程度比纯水小
C.等浓度等体积的Na2S与NaHS混合,c(HS﹣)+3c(H2S)+2c(H+)═2c(OH﹣)+c(S2﹣)
D.NaOH溶液与H2S溶液混合,当溶液的pH═7时,离子浓度大小关系为:c(HS﹣)>c(Na+)>c(S2﹣)>c(H+)═c(OH﹣)
【解答】解:A.比较电离平衡常数可知,酸性强弱关系:H2CO3>HClO>HCO3﹣,CO2通入到NaClO溶液中发生反应:CO2+H2O+NaClO═HClO+NaHCO3,故A错误;
B.两者按物质的量1:1混合,发生反应:NaOH+H2S═NaHS+H2O,溶液呈碱性,HS﹣水解程度大于电离程度,使水的电离程度增大,故B错误;
C.混合后,两者浓度仍然相等,设为c,根据Na元素质量守恒得c(Na+)═3c,根据S元素质量守恒得c(S2﹣)+c(HS﹣)+c(H2S)═2c,溶液中物料守恒式为:2c(Na+)=3c(S2﹣)+3c(HS﹣)+3c(H2S),电荷守恒式为:c(Na+)+c(H+)═2c(S2﹣)+c(HS﹣)+c(OH﹣),用物料守恒式与电荷守恒式共同消除c(Na+)后得:c(HS﹣)+3c(H2S)+2c(H+)═2c(OH﹣)+c(S2﹣),故C正确;
D.溶液的pH=7时,溶质为NaHS和H2S,其中c(H+)═c(OH﹣)>c(S2﹣),根据电荷守恒式:c(Na+)+c(H+)═2c(S2﹣)+c(HS﹣)+c(OH﹣),得c(Na+)>c(HS﹣),故c(Na+)>c(HS﹣)>c(H+)═c(OH﹣)>c(S2﹣),故D错误;
故选:C。
13.燃煤电厂锅炉尾气中含有氮氧化物(主要成分NO),可通过主反应4NH3(g)+4NO(g)+O2(g)═4N2(g)+6H2O(g)△H=﹣1627.7kJ mol﹣1除去。温度高于300℃时会发生副反应:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=﹣904.74kJ mol﹣1。在恒压、反应物起始物质的量之比一定的条件下,反应相同时间,NO的转化率在不同催化剂作用下随温度变化的曲线如图所示。下列有关说法一定正确的是( )
A.升高温度、增大压强均可提高主反应中NO的平衡转化率
B.N2(g)+O2(g)=2NO(g)△H=﹣180.74kJ mol﹣1
C.图中X点所示条件下,反应时间足够长,NO的转化率能达到Y点的值
D.图中Z点到W点NO的转化率降低的原因是主反应的平衡逆向移动
【解答】解:A.由主反应可知,正反应为气体体积增大的放热反应,根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,增大压强,平衡向气体体积缩小的方向移动,则升高温度、增大压强均使平衡向逆反应方向移动,可降低主反应中NO的平衡转化率,故A错误;
B.已知:①4NH3(g)+4NO(g)+O2(g)═4N2(g)+6H2O(g)△H=﹣1627.7kJ mol﹣1
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=﹣904.74kJ mol﹣1
根据盖斯定律,可得N2(g)+O2(g)=2NO(g)△H=×[(﹣904.74kJ mol﹣1)﹣(﹣1627.7kJ mol﹣1)]=+180.74kJ mol﹣1,故B错误;
C.图中X点反应未达平衡,所以反应时间足够长,此温度和催化剂B存在的条件下,NO的转化率能达到Y点的值,故C正确;
D.由图中Z点到W点NO的转化率降低的原因可能是催化剂的催化活性降低,还有可能是温度超过300°C发生副反应造成的,故D错误;
故选:C。
二.非选择题(共1小题)
三.解答题(共7小题)
15.氮及其化合物在工、农业生产中用途广泛。
(1)据报道,美国科学家卡尔 克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 +1 。
(2)
①分子中的大π键可用符号Πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π66),已知N5﹣为平面结构且含有大π键,则N5﹣中的大π键应表示为 。
②图中虚线代表氢键,其表示式为(NH4+)N﹣H Cl、 (H3O+)O﹣H N 、 (NH4+)N﹣H N 。
(3)还原沉淀法:使用Na2SO3将Cr(Ⅵ)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(Ⅵ)具有很强的氧化能力,将Cr2还原为Cr3+的离子方程式为 8H++3+Cr2=2Cr3++3+4H2O 。
②其他条件相同,用Na2SO3处理不同初始pH的含Cr(Ⅵ)废水相同时间,当pH<2时,Cr(Ⅵ)的去除率随
pH降低而降低的原因是 部分与H+结合转化为SO2逸出,使得与Cr(Ⅵ)反应的的物质的量浓度减小,反应速率减慢 。
(4)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(VI)去除率随温度的变化如图1所示。55℃时,
Cr(Ⅵ)的去除率很低的原因是 温度过高,硫酸盐还原菌发生变性,失去活性 。
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图2所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+, 在SRB细胞膜的作用下被H原子还原生成S2﹣,生成的S2﹣与Fe2+反应生成FeS 。
【解答】解:(1)由5个N结合,都达到8电子结构,且含有两个N≡N三键,故N≡N只能在链端,其结构为,两个N﹣N为配位键,电子对由靠近三键的N提供,故中间的N原子需失去一个电子达到稳定结构,所以N5分子碎片所带电荷是+1,
故答案为:+1;
(2)①N5﹣中键总数为5个,有6个电子可以形成大π键,可用符号,
故答案为:;
②O和N非金属性都很强,都可以与H形成氢键,可以表示为:(H3O+)O﹣H N和(NH4+)N﹣H N,
故答案为:(H3O+)O﹣H N;(NH4+)N﹣H N;
(3)①酸性条件下将Cr2还原为Cr3+,被氧化为,离子方程式为8H++3+Cr2=2Cr3++3+4H2O,
故答案为:8H++3+Cr2=2Cr3++3+4H2O;
②酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低,是由于当溶液酸性较强时,部分与H+结合产生的H2SO3转化为SO2气体逸出,使得与Cr(Ⅵ)反应的的物质的量浓度减小,从而导致化学反应速率减慢,
故答案为:部分与H+结合转化为SO2逸出,使得与Cr(Ⅵ)反应的的物质的量浓度减小,反应速率减慢;
(4)①硫酸盐还原菌中含有具有生物活性的蛋白质,其催化活性具有一定的温度范围,若温度过高,硫酸盐还原菌的蛋白质发生变性,导致失去活性,因而Cr(Ⅵ)的去除率降低,
故答案为:温度过高,硫酸盐还原菌发生变性,失去活性;
②在SRB细胞膜的作用下被H原子还原生成S2﹣,生成的S2﹣与Fe失去电子生成的Fe2+反应生成FeS,
故答案为:在SRB细胞膜的作用下被H原子还原生成S2﹣,生成的S2﹣与Fe2+反应生成FeS;
16.MnCO3常用于医药、电焊条辅料等,以软锰矿(主要成分为MnO2,还含有少量Fe2O3、Al2O3、SiO2、MgO、CaO等)为原料制备MnCO3的流程如图:
回答下列问题:
(1)废铁屑在使用前需要用热的纯碱溶液清洗表面油污,其清洗原理为 CO32﹣+H2O HCO3﹣+OH﹣,温度升高水解程度增强,碱性增强使油污加速水解 (结合离子方程式和必要的语言解释)。
(2)为了使废铁屑与软锰矿在“酸浸”中充分反应,可采取的措施为 将铁屑与软锰矿破碎为粉末,充分搅拌混合 ;“酸浸”时主要发生反应的离子方程式为 Fe+MnO2+4H+=Mn2++Fe2++2H2O 。
(3)“滤渣1”中含有的主要成分为 SiO2和CaSO4 。
(4)“氧化”过程中加入H2O2的量远超理论量的原因为 生成的Fe3+可催化H2O2的分解 。
(5)加入CaCO3能“除铁、铝”的原因为 加入CaCO3消耗H+,c(OH﹣)增大,从而沉淀Fe3+和Al3+ 。
(6)“沉锰”时发生反应的离子方程式为 Mn2++2HCO3﹣=MnCO3↓+CO2↑+H2O 。
(7)MnO2的正交(棱与棱之间的夹角均为90°)晶胞结构如图所示,晶胞参数分别为apm、bpm、cpm。其中Mn的配位数为 6 ;用NA表示阿伏加德罗常数的值,该晶体的密度为 g cm﹣3。
【解答】解:(1)热的纯碱溶液清洗表面油污的原理为:CO32﹣+H2O HCO3﹣+OH﹣,温度升高水解程度增强,碱性增强使油污加速水解,
故答案为:CO32﹣+H2O HCO3﹣+OH﹣,温度升高水解程度增强,碱性增强使油污加速水解;
(2)为了使废铁屑与软锰矿在“酸浸”中充分反应,可采取的措施为将铁屑与软锰矿破碎为粉末,充分搅拌混合;“酸浸”时主要发生反应的离子方程式为:Fe+MnO2+4H+=Mn2++Fe2++2H2O,
故答案为:将铁屑与软锰矿破碎为粉末,充分搅拌混合;Fe+MnO2+4H+=Mn2++Fe2++2H2O;
(3)SiO2不溶于酸,氧化钙与硫酸反应生成CaSO4微溶于水,所以“滤渣1”中含有的成分为SiO2和CaSO4,
故答案为:SiO2和CaSO4;
(4)“氧化”过程中加入H2O2的量远超理论量的原因为生成的Fe3+可催化H2O2的分解,
故答案为:生成的Fe3+可催化H2O2的分解;
(5)加入CaCO3能调节溶液酸度,从而起到“除铁、铝”的目的,
故答案为:加入CaCO3消耗H+,c(OH﹣)增大,从而沉淀Fe3+和Al3+;
(6)“沉锰”时发生反应的离子方程式为Mn2++2HCO3﹣=MnCO3↓+CO2↑+H2O,
故答案为:Mn2++2HCO3﹣=MnCO3↓+CO2↑+H2O;
(7)由图可知MnO2晶胞中Mn的配位数为6,该晶体密度==g cm﹣3,
故答案为:6;。
17.化合物H是制备药物洛索洛芬钠的关键中间体,其一种合成路线如图:
(1)A→B的反应类型为 还原反应 。
(2)D分子中碳原子杂化轨道类型有 3 种。
(3)G的结构简式为 。
(4)F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 、或 。
①分子中含有苯环;
②碱性条件下完全水解生成两种产物,酸化后分子中均含有4种不同化学环境的氢。
(5)设计以苯乙醇为原料制备的合成路线(无机试剂任用,合成路线示例见本题题干) 。
【解答】解:(1)A→B的反应类型为还原反应,
故答案为:还原反应;
(2)D分子中饱和碳原子价层电子对数是4,采用sp3杂化,苯环上碳原子价层电子对数是3,采用sp2杂化,﹣CN中碳原子价层电子对数是2,采用sp杂化,所以碳原子杂化轨道类型有3种,
故答案为:3;
(3)G的结构简式为,
故答案为:;
(4)F的一种同分异构体同时满足下列条件:
①分子中含有苯环;
②碱性条件下完全水解生成两种产物,说明含有酯基,酸化后分子中均含有4种不同化学环境的氢,生成的两种有机物的结构简式为、HOCH2CH2COOH,所以该同分异构体的结构简式为、、,
故答案为:、或;
(5)以苯乙醇为原料制备,可由和苯乙醇发生酯化反应得到,可由发生水解反应得到,可由发生取代反应得到,可由和HCl发生加成反应得到,苯乙醇发生消去反应得到苯乙烯,合成路线为,
故答案为:。
18.气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)用NH3催化还原NOx可以消除氮氧化物的污染。已知:
①4NH3 (g)+3O2 (g)═2N2 (g)+6H2O (g)ΔH=﹣akJ/mol
②N2(g)+O2 (g)═2NO (g)ΔH=﹣bkJ/mol
写出NH3还原NO至N2和水蒸气的热化学方程式 4NH3(g)+6NO(g)=5N2(g)+6H2O(g)ΔH=(3b﹣a)kJ/mol 。
(2)尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如图:
①尿素[CO(NH2)2]中氮元素的化合价为 ﹣3 。
②写出“催化反应”过程中NH3还原NO2的化学方程式 8NH3+6NO2=N2+12H2O 。
③若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。试分析硫酸盐的产生过程 SO2与O2、H2O反应生成H2SO4,H2SO4与NH3反应生成(NH4)2SO4或者NH4HSO4 。
④“催化反应”过程中需控制温度在250℃~380℃之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和 温度升高,NH3催化氧化生成NO 。
以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k c(N2O) [c(I2)]0.5(k为速率常数)。下列表述正确的是 A
A.N2O分解反应中:k值与是否含碘蒸气有关
B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的催化剂
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体:2CO+2NO→N2+2CO2△H1。
①已知:反应N2(g)+O2(g) 2NO(g)△H2=+180.0kJ mol﹣1,若CO的燃烧热△H为﹣283.5kJ/mol,则△H1= ﹣747.0kJ/mol 。
②若在恒容的密闭容器中,充入2mol CO和1mol NO,下列选项中不能说明该反应已经达到平衡状态的是 B 。
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.2v(N2)正=v(CO)逆
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+x(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ.NO(g)+□→NO(a)
Ⅱ.2NO(a)→2N(a)+O2(g)
Ⅲ.2N(a)→N2(g)+2□
Ⅳ.2NO(a)→N2(g)+2O(a)
Ⅴ.2O(a)→O2(g)+2□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是 还原后催化剂中金属原子的个数不变,价态降低,氧缺位增多,反应速率加快 。
(3)N2O4与NO2之间存在反应N2O4(g) 2NO(g)。将定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
①图中a点对应温度下。已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp= 115.2 kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1= K2Kp ,在图上标出的点中,能表示反应达到平衡状态的点为 B、D (填字母代号)。
【解答】解:(1)①4NH3 (g)+3O2 (g)═2N2 (g)+6H2O (g)ΔH=﹣akJ/mol
②N2(g)+O2 (g)═2NO (g)ΔH=﹣bkJ/mol
根据盖斯定律:①﹣3×②得4NH3 (g)+6NO (g)=5N2(g)+6H2O (g)ΔH=(3b﹣a)kJ/mol,
故答案为:4NH3 (g)+6NO (g)=5N2(g)+6H2O (g)ΔH=(3b﹣a)kJ/mol;
(2)①尿素[CO(NH2)2]中C元素为+4价,O元素为﹣2价,H元素为+1价,根据化合价代数和为0,则尿素氮元素的化合价为﹣3价;
故答案为:﹣3;
②由图可知,“催化反应”过程中NH3还原NO2的化学方程式为:8NH3+6NO2=N2+12H2O,
故答案为:8NH3+6NO2=N2+12H2O;
③若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。则硫酸盐的产生过程为:SO2与O2、H2O反应生成H2SO4,H2SO4与NH3反应生成(NH4)2SO4或者NH4HSO4,
故答案为:SO2与O2、H2O反应生成H2SO4,H2SO4与NH3反应生成(NH4)2SO4或者NH4HSO4;
④“催化反应”过程中需控制温度在250℃~380℃之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和温度升高,NH3催化氧化生成NO,
故答案为:温度升高,NH3催化氧化生成NO。
(3)A.单质碘在N2O分解的反应中起到催化剂的作用,因此能够使K 值增大,故A正确;
B.第二步反应为慢反应,对总反应的速率起到决定性作用,故B错误;
C.活化能越大,反应速率越慢,故C错误;
D.IO在第二步反应中生成,在第三步反应又消失,为中间产物,不是催化剂,故D错误,
故答案为:A;
(2)根据所给的反应①2CO+2NO→N2+2CO2△H1和反应②N2(g)+O2(g) 2NO(g)△H2=+180.0kJ mol﹣1,可得到一氧化碳燃烧的热化学方程式CO(g)+O2 (g)=CO2(g)△H为﹣283.5kJ/mol,则△H1=2△H﹣△H2=(﹣283.5×2)kJ mol﹣1﹣180.0kJ mol﹣1=﹣747.0kJ mol﹣1,
故答案为:﹣747.0kJ mol﹣1;
②A.投入的CO和NO的物质的量之比为2:1,CO与NO的反应的物质的量之比为1:1,则在反应过程中,CO与NO的反应的物质的量之比为为变量,若比值不变,则表明达到平衡,不符合题意;
B.反应前后均为气体,气体的质量不变,恒容的密闭容器容积不变,混合气体的密度在反应过程中均保持不变,不能够标志反应已经达到平衡,符合题意;
C.反应前后气体的分子数不相等,则在反应过程中气体压强在不断变化,因此混合气体的压强不变时,说明反应已经达到平衡,不符合题意;
D.反应未达到平衡前正反应速率逐渐减小,逆反应速率逐渐增大,二者相等则反应达到平衡,2v(N2)正=v(CO)逆,不符合题意,
故答案为:B;
③还原前后催化剂中金属原子的个数不变,则还原后低价的金属离子越多,催化剂表面的氧缺位越多,氧缺位越多,反应速率越快,
故答案为:还原后催化剂中金属原子的个数不变,价态降低,氧缺位增多,反应速率加快;
(3)①设起始时N2O4的物质的量为1mol,a点时N2O4与的转化率为40%,列三段式可得:
N2O4(g) 2NO2(g)
起始(mol) 1 0
变化(mol) 0.4 0.8
平衡(mol) 0.6 0.8
则平衡时气体的总物质的量为0.6mol+0.8mol=1.4mol,压强之比等于气体的物质的量之比,平衡时气体的总压强为108kPa×1.4=151.2kPa,则平衡常数,
故答案为:115.2Kpa;
②v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),达到平衡时,有2v正( N2O4)=v逆(NO2),即2k1p(N2O4)=k2p2(NO2),平衡常数,K1=K2Kp,
故答案为:K2Kp;
③达到平衡时,2v正( N2O4)=v逆(NO2),由图可知B、D两点的速率符合2v正( N2O4)=v逆(NO2),故B点与D点为平衡点,
故答案为:B、D。
同课章节目录
