人教版(2019)高中化学必修第一册 《活泼的金属单质——钠》精品课件(30张)
文档属性
| 名称 | 人教版(2019)高中化学必修第一册 《活泼的金属单质——钠》精品课件(30张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 00:00:00 | ||
图片预览










文档简介
(共30张PPT)
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物(第一课时)
掌握钠的化学性质
2
课程学习目标
学习钠的物理性质
1
了解钠的制取和用途
3
导入
海洋是一个巨大的化学资源宝库,含有80多种元素。
钠是其中含量较高的元素,也是典型的金属元素。
导入
钠元素在自然界中都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等,钠的单质可以通过化学反应式制得。
NaCl
Na2CO3
Na2SO4
钠有哪些性质呢?
实验室中,通常把钠保存在石蜡油或煤油中,以隔绝空气。
思考·讨论
这是为什么呢?
思考·讨论
钠的化学性质非常活泼表现出很强的还原性
从钠的原子结构来看,它的原子的最外层电子层上只有一个电子,该电子很容易在化学反应中丢失。
+11
2
8
1
Na
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
思考·讨论
不要用手直接接触钠,而
要用镊子夹取。
① 质软,能用刀切割
② 具有银白色金属光泽
③ 熔点:97.8℃
④ 沸点:883℃
⑤ 密度:0.971g/cm3
新课讲解
钠的物理性质
用新切开的钠的光亮的表面很快变暗了,这是因为钠与氧气发生反应,在钠的表面生成了一薄层氧化物,这种氧化物是氧化钠。
4Na + O2 —— 2Na2O
钠
氧气
氧化钠
0
0
+1
-2
新课讲解
钠的化学性质:钠和氧气反应
裸露在空气中的钠就能直接和氧气反应,钠的化学性质十分活泼。
思考·讨论
如果将钠加热,又会
发生什么变化呢?
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。
思考·讨论
继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
注:不要近距离俯视坩埚
思考·讨论
钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体。这种淡黄色固体是过氧化钠(Na2O2)。
2Na + O2 —— Na2O2
钠
氧气
过氧化钠
0
0
+1
-1
新课讲解
钠的化学性质:钠和氧气反应
钠的化学反应:钠与其他非金属反应
(1)在氯气中燃烧:现象:燃烧、产生白色的烟
(2)与硫反应:现象:火星四射、发生爆炸
思维启迪
2Na + Cl2 —— 2NaCl
2Na + S —— 2Na2S
点燃
研磨
钠除了能与氧气、氯气等非金属单质直接化合,还能与水发生反应。
思考·讨论
钠和水发生会生成什
么呢?
从物质组成及氧化还原反应的角度,预测钠与水反应的生成物。
预测
会不会是钠夺走氧变
成氧化物?
思考·讨论
在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。
实验
思考·讨论
从钠在水中的位置、钠的形状的变化、溶液颜色的变化等方面观察和描述实验现象。
结论
项目 实验现象 产生原因
水中的位置 在水面浮动 密度小
形状变化 变小 反应放热、熔点低
水中的状态 快速移动 反应剧烈,有气体产生
溶液颜色 变红 生成物呈碱性
思考·讨论
钠的性质非常活泼,能与水发生剧烈反应;反应时放出热量;反应后得到的溶液显碱性。
钠与水反应的化学方程式为:
2Na + 2H2O —— 2NaOH + H2
新课讲解
钠的化学性质:钠和水反应
① 金属钠会和酸溶液发生反应吗?
思考·讨论
会!
钠与酸的反应比和水反应更剧烈。
钠和水反应,实质上是跟水电离的H+反应。而酸中的H+浓度更大。
例如: 2Na + H2SO4 —— H2 + Na2SO4
② 金属钠会和盐溶液发生反应吗?
思考·讨论
会!
当将一小块金属钠投入硫酸铜溶液时,金属钠会在水面上下浮动,极速游动变小,最终会有蓝色絮状物产生。
反应式: 2Na + CuSO4 —— Cu + Na2SO4
钠的制取
2NaCl(熔融)—— 2Na + Cl2
电解
工业上制取金属钠主要是用电解熔融的氯化钠的方法
熔融态的氯化钠通电后,生成的氯气在此条件下密度较小,就飘在熔炉的上层而生成的钠也是以气体的形式存在,但密度较大,所以飘在下层。
两种气体相邻的位置一接触就会反应,生成氯化钠的小液滴,小液滴越来越多,最后就把两种气体完全隔开了。
再将两种气体分别抽出,再净化、冷却,就可以得到较纯金属钠了。
思维启迪
钠的用途
(1) 制备高压钠灯
(2)制备钠的化合物
(3)制备某些金属(锆等)
(4)Na-K液态合金做原子反应堆的导热剂
思维启迪
1、填写下列钠的物理性质
金属钠:颜色________ 形态__________
密度________ 熔沸点__________
导电、传热性__________
课堂达标
解析 金属钠是银白色固体,密度小、熔点熔点低、导电、传热性好。
银白色
固体
小
低
良好
2.下列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰 B.钠燃烧时产生氧化钠
C.钠具有很强的还原性 D.钠原子的最外电子层上只有1个电子
课堂达标
解析 钠的焰色反应为黄色,故A正确;钠燃烧生成过氧化钠,故B错误;钠易失去最外层电子,具有很强的还原性,故C正确;钠位于周期比第Ⅰ主族,最外层有1个电子,故D正确。
B
3.下列关于描述中,不正确的是( )
A. 钠和水反应的方程式:2Na + 2H2O —— 2NaOH + H2
B. 钠在空气中加热的方程式:4Na + O2 —— 2Na2O
C.钠和盐酸反应的方程式: 2Na + 2HCl —— 2NaCl + H2
D.钠和硫酸铜反应的方程式:2Na + CuSO4 —— Cu + Na2SO4
课堂达标
解析 钠在空气中燃烧时会生成过氧化钠,正确的反应方程式是:2Na + O2 —— Na2O2,故选B。
B
4.下面关于金属钠的描述正确的是( )
A.钠的化学性质很活泼,在自然界里能以游离态存在
B.钠离子和钠原子都具有较强的还原性
C.钠能把钛锆等金属从它们的盐溶液中还原出来
D.保存在煤油中的钠是银白色的固体
课堂达标
解析 钠的化学性质很活泼,钠元素在自然界中以化合态存在,没有游离态,故A错误;钠原子容易失去电子,而钠离子只能得到电子,所以钠原子都具有较强的还原性,而钠离子没有,故B错误;C、钠和钛锆等金属盐溶液的反应是先和其中的水反应置换出氢气,不会置换出金属,故C错误;D、保存在煤油中的钠是银白色的固体,故D正确。
D
金属钠的性质
质软可切割,硬度比较小,银白色,具有金属光泽固体
电和热的良导体,密度比水小0.97g/cm3
熔点低97.81℃,沸点882.9℃纳保存在煤油中
课堂小结
物理性质
与非金属的反应
化学性质
与氧气反应 4Na + O2 —— 2Na2O
2Na + O2 —— Na2O2
与氯气反应 2Na + Cl2 —— 2NaCl
与硫反应 2Na + S —— Na2S
点燃
与水的反应
2Na + 2H2O —— 2NaOH + H2
与酸、盐反应
金属钠的性质
2NaCl(熔融)—— 2Na + Cl
课堂小结
钠的制取
制取Na2O2
钠钾合金导热剂
把金属从卤化物中还原出来
高压钠灯
电解
钠的用途
纳的存在形式
只有化合态:NaCl,Na2SO4,Na2CO3,NaNO3
作业布置
记忆钠的物理性质、化学性质
默写钠和水、氧气、酸、盐的反应方程式
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物(第一课时)
掌握钠的化学性质
2
课程学习目标
学习钠的物理性质
1
了解钠的制取和用途
3
导入
海洋是一个巨大的化学资源宝库,含有80多种元素。
钠是其中含量较高的元素,也是典型的金属元素。
导入
钠元素在自然界中都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等,钠的单质可以通过化学反应式制得。
NaCl
Na2CO3
Na2SO4
钠有哪些性质呢?
实验室中,通常把钠保存在石蜡油或煤油中,以隔绝空气。
思考·讨论
这是为什么呢?
思考·讨论
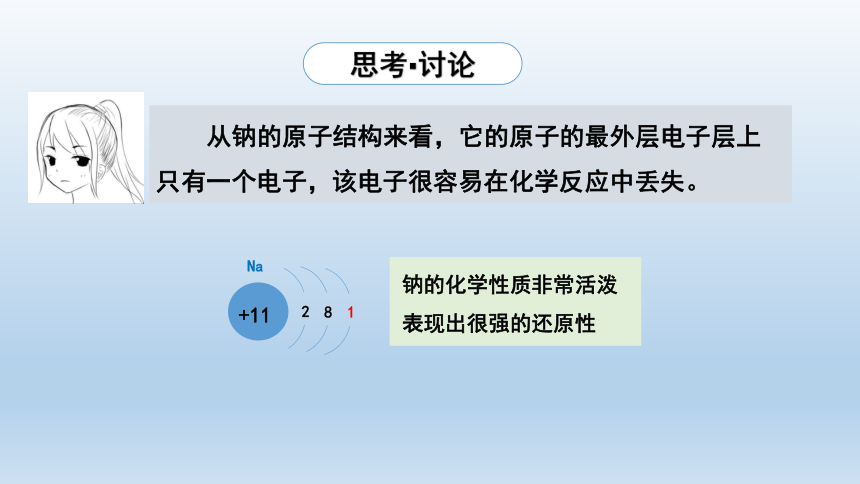
钠的化学性质非常活泼表现出很强的还原性
从钠的原子结构来看,它的原子的最外层电子层上只有一个电子,该电子很容易在化学反应中丢失。
+11
2
8
1
Na
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
思考·讨论
不要用手直接接触钠,而
要用镊子夹取。
① 质软,能用刀切割
② 具有银白色金属光泽
③ 熔点:97.8℃
④ 沸点:883℃
⑤ 密度:0.971g/cm3
新课讲解
钠的物理性质
用新切开的钠的光亮的表面很快变暗了,这是因为钠与氧气发生反应,在钠的表面生成了一薄层氧化物,这种氧化物是氧化钠。
4Na + O2 —— 2Na2O
钠
氧气
氧化钠
0
0
+1
-2
新课讲解
钠的化学性质:钠和氧气反应
裸露在空气中的钠就能直接和氧气反应,钠的化学性质十分活泼。
思考·讨论
如果将钠加热,又会
发生什么变化呢?
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。
思考·讨论
继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
注:不要近距离俯视坩埚
思考·讨论
钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体。这种淡黄色固体是过氧化钠(Na2O2)。
2Na + O2 —— Na2O2
钠
氧气
过氧化钠
0
0
+1
-1
新课讲解
钠的化学性质:钠和氧气反应
钠的化学反应:钠与其他非金属反应
(1)在氯气中燃烧:现象:燃烧、产生白色的烟
(2)与硫反应:现象:火星四射、发生爆炸
思维启迪
2Na + Cl2 —— 2NaCl
2Na + S —— 2Na2S
点燃
研磨
钠除了能与氧气、氯气等非金属单质直接化合,还能与水发生反应。
思考·讨论
钠和水发生会生成什
么呢?
从物质组成及氧化还原反应的角度,预测钠与水反应的生成物。
预测
会不会是钠夺走氧变
成氧化物?
思考·讨论
在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。
实验
思考·讨论
从钠在水中的位置、钠的形状的变化、溶液颜色的变化等方面观察和描述实验现象。
结论
项目 实验现象 产生原因
水中的位置 在水面浮动 密度小
形状变化 变小 反应放热、熔点低
水中的状态 快速移动 反应剧烈,有气体产生
溶液颜色 变红 生成物呈碱性
思考·讨论
钠的性质非常活泼,能与水发生剧烈反应;反应时放出热量;反应后得到的溶液显碱性。
钠与水反应的化学方程式为:
2Na + 2H2O —— 2NaOH + H2
新课讲解
钠的化学性质:钠和水反应
① 金属钠会和酸溶液发生反应吗?
思考·讨论
会!
钠与酸的反应比和水反应更剧烈。
钠和水反应,实质上是跟水电离的H+反应。而酸中的H+浓度更大。
例如: 2Na + H2SO4 —— H2 + Na2SO4
② 金属钠会和盐溶液发生反应吗?
思考·讨论
会!
当将一小块金属钠投入硫酸铜溶液时,金属钠会在水面上下浮动,极速游动变小,最终会有蓝色絮状物产生。
反应式: 2Na + CuSO4 —— Cu + Na2SO4
钠的制取
2NaCl(熔融)—— 2Na + Cl2
电解
工业上制取金属钠主要是用电解熔融的氯化钠的方法
熔融态的氯化钠通电后,生成的氯气在此条件下密度较小,就飘在熔炉的上层而生成的钠也是以气体的形式存在,但密度较大,所以飘在下层。
两种气体相邻的位置一接触就会反应,生成氯化钠的小液滴,小液滴越来越多,最后就把两种气体完全隔开了。
再将两种气体分别抽出,再净化、冷却,就可以得到较纯金属钠了。
思维启迪
钠的用途
(1) 制备高压钠灯
(2)制备钠的化合物
(3)制备某些金属(锆等)
(4)Na-K液态合金做原子反应堆的导热剂
思维启迪
1、填写下列钠的物理性质
金属钠:颜色________ 形态__________
密度________ 熔沸点__________
导电、传热性__________
课堂达标
解析 金属钠是银白色固体,密度小、熔点熔点低、导电、传热性好。
银白色
固体
小
低
良好
2.下列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰 B.钠燃烧时产生氧化钠
C.钠具有很强的还原性 D.钠原子的最外电子层上只有1个电子
课堂达标
解析 钠的焰色反应为黄色,故A正确;钠燃烧生成过氧化钠,故B错误;钠易失去最外层电子,具有很强的还原性,故C正确;钠位于周期比第Ⅰ主族,最外层有1个电子,故D正确。
B
3.下列关于描述中,不正确的是( )
A. 钠和水反应的方程式:2Na + 2H2O —— 2NaOH + H2
B. 钠在空气中加热的方程式:4Na + O2 —— 2Na2O
C.钠和盐酸反应的方程式: 2Na + 2HCl —— 2NaCl + H2
D.钠和硫酸铜反应的方程式:2Na + CuSO4 —— Cu + Na2SO4
课堂达标
解析 钠在空气中燃烧时会生成过氧化钠,正确的反应方程式是:2Na + O2 —— Na2O2,故选B。
B
4.下面关于金属钠的描述正确的是( )
A.钠的化学性质很活泼,在自然界里能以游离态存在
B.钠离子和钠原子都具有较强的还原性
C.钠能把钛锆等金属从它们的盐溶液中还原出来
D.保存在煤油中的钠是银白色的固体
课堂达标
解析 钠的化学性质很活泼,钠元素在自然界中以化合态存在,没有游离态,故A错误;钠原子容易失去电子,而钠离子只能得到电子,所以钠原子都具有较强的还原性,而钠离子没有,故B错误;C、钠和钛锆等金属盐溶液的反应是先和其中的水反应置换出氢气,不会置换出金属,故C错误;D、保存在煤油中的钠是银白色的固体,故D正确。
D
金属钠的性质
质软可切割,硬度比较小,银白色,具有金属光泽固体
电和热的良导体,密度比水小0.97g/cm3
熔点低97.81℃,沸点882.9℃纳保存在煤油中
课堂小结
物理性质
与非金属的反应
化学性质
与氧气反应 4Na + O2 —— 2Na2O
2Na + O2 —— Na2O2
与氯气反应 2Na + Cl2 —— 2NaCl
与硫反应 2Na + S —— Na2S
点燃
与水的反应
2Na + 2H2O —— 2NaOH + H2
与酸、盐反应
金属钠的性质
2NaCl(熔融)—— 2Na + Cl
课堂小结
钠的制取
制取Na2O2
钠钾合金导热剂
把金属从卤化物中还原出来
高压钠灯
电解
钠的用途
纳的存在形式
只有化合态:NaCl,Na2SO4,Na2CO3,NaNO3
作业布置
记忆钠的物理性质、化学性质
默写钠和水、氧气、酸、盐的反应方程式
