专题1《化学反应与能量变化》练习题2022-2023学年上学期高二苏教版(2019)高中化学选择性必修1(含解析)
文档属性
| 名称 | 专题1《化学反应与能量变化》练习题2022-2023学年上学期高二苏教版(2019)高中化学选择性必修1(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 939.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 20:21:14 | ||
图片预览



文档简介
专题1《化学反应与能量变化》练习题
一、单选题
1.节能减排、低碳出行对构建智慧能源系统有重要意义,下列措施不能减少二氧化碳排放的是
A.利用太阳能制氢 B.推广使用煤液化技术
C.举行“地球一小时"堪灯活动 D.关停小火电企业
2.电解甲、乙两个电解池一段时间后,下列说法正确的是
A.若利用甲池精炼铜,a电极为精铜
B.若甲池中a、b均为惰性电极,加盐酸可恢复甲池内溶液
C.若乙池中c、d均为惰性电极,一段时间后溶液pH变小
D.向乙池中d电极附近滴加酚酞试剂,则附近溶液显红色
3.下列关于能量转换的认识中不正确的是
A.煤燃烧时化学能主要转变成热能
B.白炽灯工作时,电能全部转变成光能
C.电解水生成氢气和氧气时,电能转化成化学能
D.绿色植物光合作用过程中太阳能转变成化学能
4.通过以下反应均可获取,下列有关说法正确的是
①太阳光催化分解水制氢:
②焦炭与水反应制氢:
③甲烷与水反应制氢:
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应的
D.由上述可知的燃烧热为
5.质子交换膜燃料电池将氢气和氧气反应放出的能量转化为电能,被视为电动汽车最具潜力的能量来源之一,该电池工作过程中,下列说法不正确的是
A.负极发生的反应是 B.正极上发生还原反应
C.仅产生,对环境友好 D.向正极移动
6.下列反应属于吸热反应的是
A.氢气在氯气中燃烧 B.石灰石在高温下分解
C.稀硫酸与NaOH溶液反应 D.铝和氧化铁在高温下反应
7.在相同温度下,下列两个反应放出的热量分别用Q1和Q2表示:
H2(g)+1/2O2(g)=H2O(g) ΔH= -Q1kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH = -Q2kJ/mol 关系正确的是
A.Q1=Q2 B.1/2Q1=Q2
C.Q1<1/2Q2 D.Q1=1/2Q2
8.环戊二烯的键线式为:,其广泛用于农药、橡胶、塑料等工业合成,是一种重要的有机化工原料。其相关键能和能量循环图如下所示,下列说法不正确的是
共价键 键能
436
299
151
A.在相同条件下,反应: H,则 H
B.
C.表中键能可知将1mol气态解离成气态碘原子需要吸收151kJ能量
D.(g)转化为(g)的过程属于氧化反应
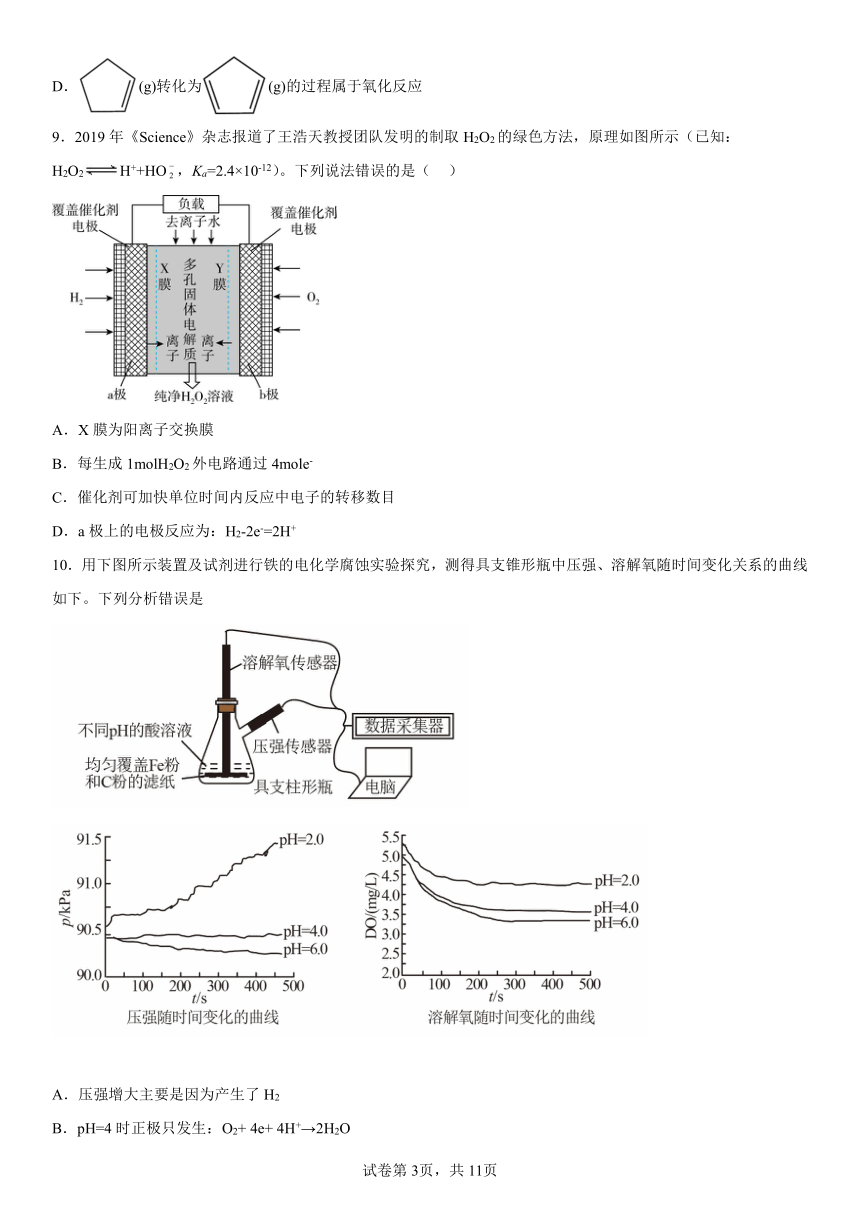
9.2019年《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2H++HO,Ka=2.4×10-12)。下列说法错误的是( )
A.X膜为阳离子交换膜
B.每生成1molH2O2外电路通过4mole-
C.催化剂可加快单位时间内反应中电子的转移数目
D.a极上的电极反应为:H2-2e-=2H+
10.用下图所示装置及试剂进行铁的电化学腐蚀实验探究,测得具支锥形瓶中压强、溶解氧随时间变化关系的曲线如下。下列分析错误是
A.压强增大主要是因为产生了H2
B.pH=4时正极只发生:O2+ 4e+ 4H+→2H2O
C.负极的反应都为:Fe-2e-→ Fe2+
D.都发生了吸氧腐蚀
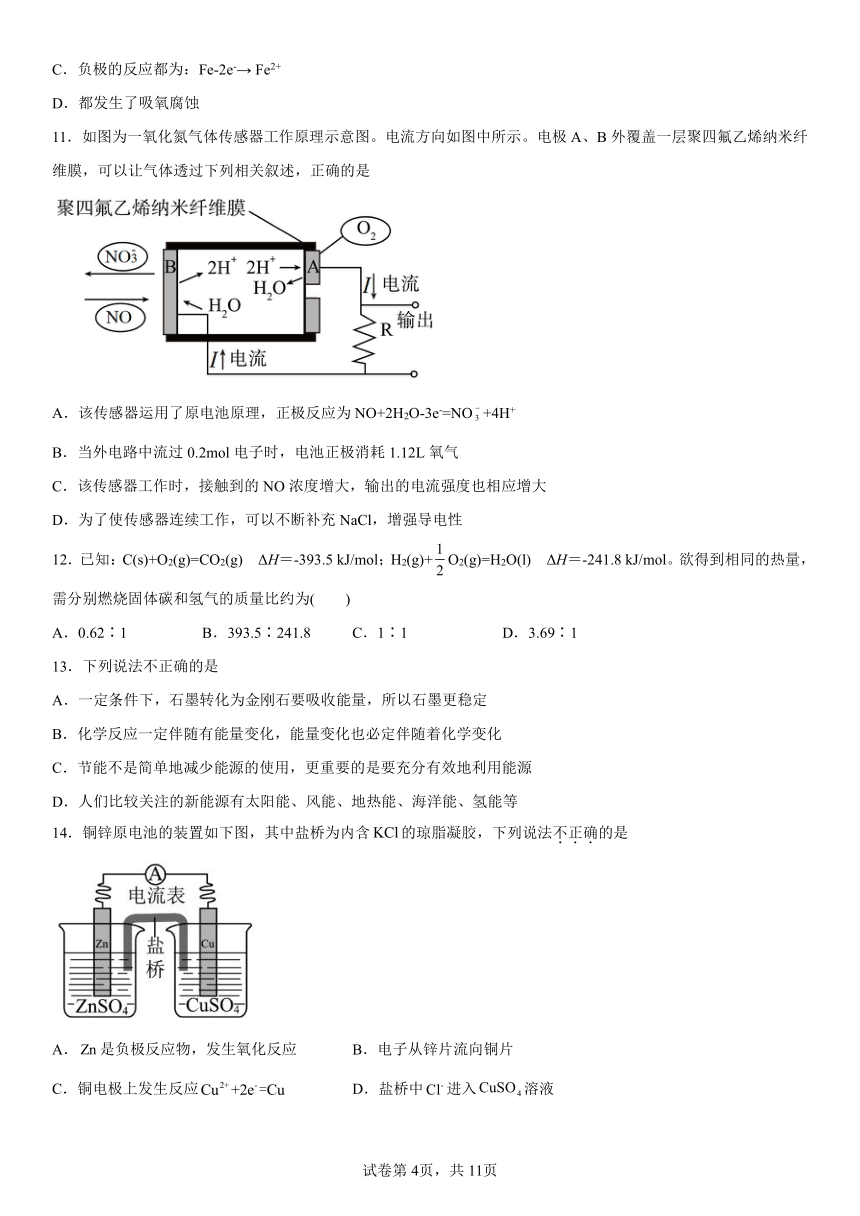
11.如图为一氧化氮气体传感器工作原理示意图。电流方向如图中所示。电极A、B外覆盖一层聚四氟乙烯纳米纤维膜,可以让气体透过下列相关叙述,正确的是
A.该传感器运用了原电池原理,正极反应为NO+2H2O-3e-=NO+4H+
B.当外电路中流过0.2mol电子时,电池正极消耗1.12L氧气
C.该传感器工作时,接触到的NO浓度增大,输出的电流强度也相应增大
D.为了使传感器连续工作,可以不断补充NaCl,增强导电性
12.已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol;H2(g)+O2(g)=H2O(l) ΔH=-241.8 kJ/mol。欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为( )
A.0.62∶1 B.393.5∶241.8 C.1∶1 D.3.69∶1
13.下列说法不正确的是
A.一定条件下,石墨转化为金刚石要吸收能量,所以石墨更稳定
B.化学反应一定伴随有能量变化,能量变化也必定伴随着化学变化
C.节能不是简单地减少能源的使用,更重要的是要充分有效地利用能源
D.人们比较关注的新能源有太阳能、风能、地热能、海洋能、氢能等
14.铜锌原电池的装置如下图,其中盐桥为内含的琼脂凝胶,下列说法不正确的是
A.是负极反应物,发生氧化反应 B.电子从锌片流向铜片
C.铜电极上发生反应 D.盐桥中进入溶液
二、填空题
15.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池能量转化的主要形式是___________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为___________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②金属锂吸收的氢气与放出的氢气的物质的量之比为________。
16.二氧化氯是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂。回答下列问题:
(1)二氧化氯可溶于水,但常温下难以与水反应,加热时会发生反应生成等物质的量的次氯酸和氯气,同时放出氧气,该反应的化学方程式为_______________________,产物之一次氯酸的电子式为_____________。二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠和另一种氯的含氧酸盐,同时生成水,该反应的离子方程式为______________________。
(2)工业上可利用电解法制备二氧化氯,如图为以石墨作电极制备二氧化氯的过程,写出产生二氧化氯气体的电极反应式:____________________。可利用滴定法测定电解过程中产生的二氧化氯,其过程如下:在锥形瓶中加入足量用硫酸酸化的碘化钾溶液,将生成的二氧化氯通入锥形瓶中至完全吸收,再向锥形瓶中滴加几滴淀粉溶液,用0.1 mol·L1硫代硫酸钠标准液进行滴定(I2+2S2O32-==2I-+S4O62-),共用去100.00 mL标准液。则电解过程中产生的气体折算为标准状况下的体积为________mL
17.氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 N2(g)→2N(g) O2(g)→2O(g) N(g)+O(g)→NO(g)
反应热 ΔH 1 ΔH 2 ΔH 3
热量值kJ·mol-1 945 498 630
①ΔH 1___________0,ΔH 3___________0.(填“>”或“<”)
②N2(g)+O2(g) = 2NO(g) ΔH=___________kJ·mol-1
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是___________(填字母)。
A.
B.
C 。
(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=___________,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为___________kJ。
18.氢气是一种理想的绿色能源,有科学家预言,氢能将成为人类的主要能源。已知以水为原料通过下列途径均可制得氢气。
ⅰ)太阳光催化分解水:
ⅱ)焦炭与水反应:
ⅲ)甲烷与水反应:
(1)反应ⅰ中主要的能量转化为___________;你认为通过此途径进行H2工业化生产的最突出优点是___________。
(2)相同温度压强下,若分别以ⅰ、ⅱ反应生成1mol H2,反应ⅱ比ⅰ要少吸收___________热量;你认为ⅱ反应需要吸热较小的原因可能是___________。
(3)①写出反应ⅲ的化学平衡常数的表达式:___________;
②一定温度下,ⅲ反应中使用催化剂后,下列物理量能保持不变的有___________。
a.焓变 b.反应活化能Ea c.活化分子百分比 d.平衡常数K3
(4)①利用上述热化学方程式,推测反应___________;
②以为燃料、KOH溶液为电解液的燃料电池,负极的电极反应式为___________。
19.如图是一个电化学原理的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O;填写下列空白:
(1)请写出甲、乙两池的名称。甲电池是_______,乙池是_______。
(2)甲池中通入O2的电极名称是_______,电极反应方程式为:_______。
(3)电解过程中,乙池溶液pH的变化为(“升高”、“降低”或“不变” )_______。
20.Cl2、漂白液(有效成分为 NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解 NaCl 溶液生成Cl2的化学方程式是________________。
(2)Cl2溶于H2O、NaOH 溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是_____。
②25℃,Cl2与H2O、NaOH 的反应如下:
反应Ⅰ Cl2+H2OCl-+H++HClO K1=4.510-4
反应Ⅱ Cl2+2OH- Cl-+ClO-+H2O K2=7.51015
解释不直接使用氯水而使用漂白液做消毒剂的原因_____。(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO-发生的电极反应式为____________。
(4)研究漂白液的稳定性对其生产和保存有实际意义。30℃时,pH=11 的漂白液中NaClO 的质量百分含量随时间变化如下:
比较分解速率 v(I)、 v(II)的大小关系_____,原因是_____。
21.如图是一个化学过程的示意图。
(1)图中甲池是______装置(填“电解池”或“原电池”),其中OH-移向______极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:_______。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的反应式_______。
(4)乙池中总反应的离子方程式_________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40g时,乙池的pH是_______(若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.KOH
22.理解化学变化与能量转化有着重要的学习意义。
(1)一种利用蓝绿藻制氢贮氢及氢气应用的图示如下。
①图中能量的转化方式有_______种;
②其循环转化中有_______种过程是释放能量的。
(2)用50 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。据此实验回答下列问题:
①要准确测定一个中和反应的反应热,温度计至少要使用_______次。
②将NaOH溶液与盐酸混合后,应读取的是溶液的_______温度。
③实验中改用55 mL 0.50 mol·L-1盐酸与55 mL 0.50 mol·L-1NaOH溶液进行反应,与上述实验相比,有一种观点认为所测中和热相等,理由是:_______。
(3)研究表明,在101kPa和298K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。据此回答:
①稳定性为HCN_______HNC(选填“>”、“<”、“=”);
②逆反应的活化能为_______kJ/mol;
③该反应的热化学方程式为_______。
(4)已知在298K、101 kPa时,CO(g)和CH3OH(l)的燃烧热ΔH分别为-283.0kJ·mol-1和-726.5kJ·mol-1。则CH3OH(l)不完全燃烧生成CO和液态水反应的ΔH=_______kJ·mol-1。
23.完成下列化学用语:
(1)书写电离方程式: NaClO:__________,一水合氨:__________。
(2)某金属氯化物MCl240.5g含有0.6mlCl-,MCl2的摩尔质量__________。
(3)工业上用电解饱和食盐水制Cl2,写出该反应的化学方程式:__________
(4)小块钠投入到水中,写出该反应的化学方程式:__________
(5)工厂里常用浓氨水来检验氯气管道是否泄漏,其原理为:8NH3+3Cl2=6NH4Cl+N2,请指出此反应中还原剂为__________(化学式)。
(6)相同温度和体积的A和B两容器,A容器中充满O2,B容器中充满O3,若密度相同,则氧气和臭氧的物质的量之比为:__________
24.铅蓄电池是典型的可充电电池,电池总反应式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O。回答下列问题:
(1)放电时,负极为_______电极,试写出该电极的电极反应式是___________。电解液中H2SO4的浓度将变____________。(填“升高”、 “降低” 或“不变”)
(2)电池放电时,当外电路通过0.1 mol电子时,理论上负极板的质量增加________g,电池中消耗的硫酸物质的量为_______mol。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A. 利用太阳能制氢可以减少化石燃料的燃烧,减少二氧化碳的排放;
B. 推广使用煤液化技术并不能减少二氧化碳的排放;
C. 举行“地球一小时”熄灯活动可以减少二氧化碳的排放;
D. 关停小火电企业减少煤炭等化石燃料的燃烧,可以减少二氧化碳的排放;
故选:B。
2.D
【详解】A.a与电源的正极相连作阳极,若利用甲池精炼铜,a电极为粗铜,故A错误;
B.若甲池中a、b均为惰性电极,电解氯化铜生成铜单质和氯气,加氯化铜可恢复甲池内溶液,故B错误;
C.若乙池中c、d均为惰性电极,电解硫酸钠溶液,相当于电解水,一段时间后溶液pH不变,故C错误;
D.乙池中d与电源负极相连做阴极,电极反应式是 ,则向乙池中d电极附近滴加酚酞试剂,附近溶液显红色,故D正确;
故选:D。
3.B
【详解】A.煤燃烧时化学能主要转变成热能,故A正确;
B.白炽灯工作时,电能转变成光能和热能,故B错误;
C.电解水生成氢气和氧气时,电能转化成化学能,故C正确;
D.绿色植物光合作用过程中太阳能转变成化学能,故D正确;
故选B。
4.C
【详解】A.反应①中是太阳能转化为化学能,故A错误;
B.反应②中,为吸热反应,故B错误;
C.根据盖斯定律,目标反应可由反应③-②获得,,故C正确;
D.燃烧热是指1mol纯物质完全燃烧生成稳定氧化物所放出的热量,由反应①可得,的燃烧热为,即,故D错误;
答案选C。
5.B
【详解】A.质子交换膜氢氧燃料电池燃料在负极反应,负极发生的反应是,故A正确;
B.O2在正极上反应,O2被还原,故B错误;
C.质子交换膜氢氧燃料电池将氢气和氧气最终生成水,绿色无污染对环境友好,故C正确;
D.原电池中阳离子移向正极,故D正确;
故答案为B。
6.B
【详解】A.氢气在氯气中燃烧属于放热反应,故A错误;
B.石灰石在高温下分解属于吸热反应,故B正确;
C.稀硫酸与NaOH溶液反应为酸碱中和反应,属于放热反应,故C错误;
D.铝和氧化铁在高温下反应属于放热反应,故D错误;
故选B。
7.C
【详解】已知H2O(g)变为H2O(l)放热,即H2O(g)= H2O(l) ΔH= -Q3kJ/mol<0,结合H2(g)+1/2O2(g)=H2O(g) ΔH=-Q1kJ/mol,根据盖斯定律,两个式子可整理得到2H2(g)+O2(g)=2H2O(l) ΔH = -Q2kJ/mol=-2Q1kJ/mol+(-Q3kJ/mol)<-2Q1kJ/mol,故Q1<1/2Q2,故答案为C。
8.B
【详解】A.氢气和卤素单质生成卤化氢的反应为放热反应,氯原子半径小于碘,得电子能力更强,形成的化学键键能大于碘形成的化学键,放出热量更多,焓变更负,故 H,A正确;
B.由盖斯定律可知,,则,由键能数据可知,,则,B错误;
C.断键需要吸收能量,表中键能可知将1mol气态解离成气态碘原子需要吸收151kJ能量,C正确;
D.(g)转化为(g)的过程中减少了氢原子,属于氧化反应,D正确;
故选B。
9.B
【分析】由示意图可知左边a电极氢气为负极,被氧化生成H+,电极方程式为H2 -2e-═2H+,H+经过X膜进入多孔固体电解质中,则X膜为选择性阳离子交换膜,右边b电极氧气为正极,被还原生成HO2-,反应为O2 +2e-+H2O═HO2-+OH-,HO2-和OH-经过Y膜进入多孔固体电解质中,则Y膜为选择性阴离子交换膜,总反应为H2 +O2 ═H2O2,以此解答该题。
【详解】A.由示意图可知X膜可透过H+,则为选择性阳离子交换膜,故A正确;
B.由分析可知,总反应为:H2 +O2 ═H2O2,反应中转移2e-,则每生成1mol H2O2电极上流过2mol e-,故B错误;
C.催化剂可加快反应速率,则可促进反应中电子的转移,故C正确;
D.a极为负极,发生的电极反应为H2-2e-=2H+,故D正确;
故答案为B。
10.B
【详解】A.pH=2.0的溶液,酸性较强,因此锥形瓶中的Fe粉能发生析氢腐蚀,析氢腐蚀产生氢气,因此会导致锥形瓶内压强增大,A正确;
B.若pH=4.0时只发生吸氧腐蚀,那么锥形瓶内的压强会有下降;而图中pH=4.0时,锥形瓶内的压强几乎不变,说明除了吸氧腐蚀,Fe粉还发生了析氢腐蚀,消耗氧气的同时也产生了氢气,因此锥形瓶内压强几乎不变,B错误;
C.锥形瓶中的Fe粉和C粉构成了原电池,Fe粉作为原电池的负极,发生的电极反应式为:Fe-2e-═Fe2+,C正确;
D.由题干溶解氧随时间变化曲线图可知,三种pH环境下溶解氧的浓度都有减小,则都发生了吸氧腐蚀,D正确;
故答案为:B。
11.C
【详解】A.由图中信息可知,电流从电极经外电路流向电极,则为正极、为负极。该传感器运用了原电池原理,在正极上发生还原反应,电极反应式为,A项错误;
B.由选项A分析可知,当外电路中流过电子时,电池正极消耗氧气,标准状况下体积为,B项错误;
C.该传感器工作时,接触到的浓度增大,则化学反应速率加快,单位时间内化学能转化的电能增多,输出的电流强度也相应增大,C项正确;
D.若补充氯化钠,也会失去电子生成氯气,影响的测定,且造成污染,D项错误;
答案选C。
12.D
【详解】根据C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol;H2(g)+O2(g)=H2O(l) ΔH=-241.8 kJ/mol。燃烧1mol固体碳和1mol氢气分别放出393.5 kJ和241.8 kJ的热量,欲得到相同的热量,固体碳和氢气的物质的量之比为,则固体碳和氢气的质量比为≈3.69,故选D。
13.B
【详解】A.物质的能量越低,稳定性越强,石墨转化为金刚石要吸收能量,则石墨的能量比金刚石低,所以石墨更稳定,A正确;
B.化学反应过程中发生化学键的断裂与形成,一定伴随有能量变化,物理变化中也伴随着能量变化,所以能量变化不一定伴随着化学变化,B不正确;
C.在生产、生活正常运行的前提下谈节能,所以节能是要充分有效地利用能源,而不是简单地减少能源的使用,C正确;
D.新能源一般是指在新技术基础上加以开发利用的可再生能源,包括太阳能、生物质能、水能、风能、地热能、波浪能、潮汐能、氢能等,D正确;
故选B。
14.D
【分析】由图可知,锌为原电池的负极,锌失去电子发生氧化反应生成锌离子,铜为正极,铜离子在正极得到电子发生还原反应生成铜。
【详解】A.由分析可知,锌为原电池的负极,锌失去电子发生氧化反应生成锌离子,故A正确;
B.由分析可知,锌为原电池的负极,铜为正极,则电池工作时,电子从锌片流向铜片,故B正确;
C.由分析可知,铜为正极,铜离子在正极得到电子发生还原反应生成铜,电极反应式为,故C正确;
D.由分析可知,锌为原电池的负极,铜为正极,则电池工作时,盐桥中的氯离子进入硫酸锌溶液,故D错误;
故选D。
15. 化学能转化为电能 由a流向b H2-2e-+2OH-===2H2O 锂(Li) 水(H2O) 1∶2
【详解】分析:(1)氢氧燃料电池主要是把化学能转化为电能;原电池中,电子都是由负极经过导线流向正极。
(2)氢氧燃料电池中,氢气失电子,发生氧化反应,做负极。
(3)①根据反应方程式可以判断出反应Ⅰ中的还原剂,反应Ⅱ中的氧化剂。
②根据反应Ⅰ:2Li--H2;根据反应Ⅱ:2Li--2LiH-- 2H2,就能判断金属锂吸收的氢气与放出的氢气的物质的量之比。
详解:(1)氢氧燃料电池的能量转化形式主要是把化学能转化为电能;氢气在负极被氧化,氧气被还原发生在正极,因此导线中电子流动方向是由a到b;正确答案:化学能转化为电能;由a流向b。
(2)负极上氢气被氧化,反应式为:H2-2e-+2OH-===2H2O ;正确答案:H2-2e-+2OH-===2H2O。
(3)①反应Ⅰ中Li转化为Li+,化合价升高,说明Li为还原剂;反应Ⅱ中水中氢的化合价降低,说明水是氧化剂;正确答案:锂(Li) ;水(H2O)。
②根据方程式Ⅰ.2Li+H2===2LiH可知,有2mol Li反应,吸收1mol氢气,同时生成2 molLiH,根据方程式Ⅱ.LiH+H2O===LiOH+H2↑可知,有1molLiH反应,放出1mol氢气,则2 molLiH反应放出氢气2mol,所以金属锂吸收的氢气与放出的氢气的物质的量之比为1∶2;正确答案:1:2。
点睛:针对于原料电池,可燃物在负极发生氧化反应,氧气在正极发生还原反应;原电池工作时溶液中阴离子移向负极,阳离子移向正极,电子由负极经外电路流向正极,电子不能从电解质中通过。
16. 12ClO2+2H2O4HClO+4Cl2+11O2 2ClO2+2OH-=ClO+ClO+H2O Cl-+2H2O–5e-=ClO2↑+4H+ 156.8
【分析】(1)二氧化氯可溶于水,但常温下难以与水反应,加热时会发生反应生成等物质的量的次氯酸和氨气,同时放出氧气,依据电子守恒和原子守恒配平书写化学方程式,次氯酸是共价化合物,氧原子和氢原子、氯原子分别形成一个共用电子对;二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠和另一种氯的含氧酸盐,同时生成水,依据氧化还原反应+4价变化为+5价和低于+4价的含氯含氧酸盐为+3价含氧酸盐为NaClO2;
(2)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,I2+2S2O═2I-+S4O,根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),V=22.4n,计算标准状况下气体体积。
【详解】(1)二氧化氯可溶于水,加热时会发生反应生成等物质的量的次氯酸和氯气,同时放出氧气,依据电子守恒,氯元素化合价+4价变化为+1价和0价,氧元素化合价-2价变化为0价,电子转移总数为44e-,则Cl2和NaClO前系数分别为4,ClO2前系数为12,结合原子守恒配平书写化学方程式为:12ClO2+2H2O4HClO+4Cl2+11O2,次氯酸是共价化合物,氧原子和氢原子、氯原子分别形成一个共用电子对,电子式为:,二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠和另一种氯的含氧酸盐,同时生成水,依据氧化还原反应+4价变化为+5价和低于+4价的含氯含氧酸盐为+3价含氧酸盐为NaClO2,反应的离子方程式为:2ClO2+2OH-=ClO+ClO+H2O,
故答案为:12ClO2+2H2O4HClO+4Cl2+11O2;;2ClO2+2OH-=ClO+ClO+H2O;
(2)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O,生成的碘单质用0.1mo1 L-1硫代硫酸钠标准液进行滴定(I2+2S2O═2I-+S4O),共用去100.00mL标准液,则:
根据关系式:
n(ClO2)=0.002mol。
阴极生成的是氢气,结合电子守恒电子转移总数为0.01mol,计算2H++2e-=H2↑,生成氢气0.005mol,电解过程中产生的气体折算为标准状况下的体积=(0.002mol+0.005mol)×22.4L/mol=0.1568L=156.8ml,故答案为:Cl-+2H2O-5e-=ClO2↑+4H+;156.8。
17.(1) > < 183
(2)C
(3) -867 kJ·mol-1 95.5
【解析】(1)
①氮气分子分解为氮原子,为断裂化学键吸收能量过程,则ΔH 1>0;氮原子和氧原子形成化学键放出能量过程,ΔH 3<0。
② Ⅰ:N2(g)→2N(g) ΔH 1=945 kJ·mol-1
Ⅱ:O2(g)→2O(g) ΔH 2=498 kJ·mol-1
Ⅲ:N(g)+O(g)→NO(g) ΔH 3=-630 kJ·mol-1
由盖斯定律可知,Ⅰ+Ⅱ+2×Ⅲ得到,N2(g)+O2(g) = 2NO(g) 故ΔH=183kJ·mol-1。
(2)
4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,反应为放热反应,反应物能量高于生成物,反应焓变为负值,故C。
(3)
①CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
由盖斯定律可知,(①+②)得到CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ,故ΔH=-867 kJ·mol-1;
由盖斯定律可知,(①+②)- ③×2得到CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(l) ,故ΔH=-955 kJ·mol-1;1.6 g CH4的物质的量为,故还原NO2 生成N2和液态水时放出的热量为955 kJ·mol-1×0.1mol=95.5 kJ。
18.(1) 太阳能(或光能)转化为化学能 太阳能是取之不尽的能源
(2) 154.5kJ ⅱ反应过程,C被氧化成CO放出了热量
(3) a、d
(4)
【解析】(1)
反应ⅰ是太阳光催化分解水制备氢气,即将太阳能转化为化学能;利用此途径进行H2工业化生产,优点是太阳能是取之不尽的清洁能源;
(2)
相同温度压强下,若分别以ⅰ、ⅱ反应生成1mol H2,反应ⅱ比ⅰ要少吸收;反应ii水蒸气本身具有较高能量,ⅱ反应过程,C被氧化成CO放出了热量,所以ii吸收能力较小;
(3)
①反应ⅲ的化学平衡常数的表达式为;
②ⅲ反应中使用催化剂不改变反应的反应热,催化剂可以降低反应活化能,提高活化分子百分数加快反应速率,催化剂之改变速率,不影响平衡,平衡常数不变,故答案为:ad;
(4)
①根据盖斯定律iii-ii得;
②以为燃料、KOH溶液为电解液的燃料电池,为燃料失去电子得碳酸钾,充入甲烷的一极为负极,负极的电极反应式为:;
19.(1) 原电池 电解池
(2) 正极 3O2 + 12e-+ 6H2O= 12OH-
(3)降低
【解析】(1)
根据甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,乙醇作还原剂,是原电池负极,氧气作氧化剂,是原电池正极,因此甲电池是原电池,乙池是电解池;故答案为:原电池;电解池。
(2)
根据前面分析甲池中氧气化合价降低,得到电子,因此通入O2的电极名称是正极,电极反应方程式为:3O2 + 12e-+ 6H2O= 12OH-;故答案为:正极;3O2 + 12e-+ 6H2O= 12OH-。。
(3)
电解过程中,乙池中阴极是银离子得到电子变为银单质,阳极是水中氢氧根失去电子变为氧气和水,剩余氢离子,因此溶液pH的变化为降低;故答案为:降低。
20. 2NaCl+2H2OH2↑+Cl2↑+2NaOH HClO K2>K1,反应Ⅱ的有效成分比反应Ⅰ的有效成分大,氯气转化为NaClO更充分,且NaClO比HClO更稳定 ClO-+2e-+H2O=Cl-+2OH- > 在相同条件下,次氯酸钠的浓度越大,其分解速率越大
【分析】
电解NaCl溶液的方程式为:2NaCl+2H2O H2↑+Cl2↑+2NaOH;氯水具有漂白性,原因是氯水中含有具有强氧化性的次氯酸;漂白液的有效成分为次氯酸钠,使用时,其与空气中的二氧化碳结合生成次氯酸从而起到漂白的作用;次氯酸不稳定易分解,不便于运输,而把次氯酸转化为次氯酸钠,次氯酸钠稳定,便于运输;根据图象的趋势和数据可知,在相同条件下,次氯酸钠的浓度越大,其分解速率越大。
【详解】
(1)电解NaCl溶液可生成氢气、氯气和氢氧化钠,方程式为:2NaCl+2H2O H2↑+Cl2↑+2NaOH;
(2)①氯水中含有盐酸和次氯酸,氯气和盐酸都不具有漂白性,具有漂白性的是次氯酸(HClO);
②氯水和漂白液的有效成分分别为HClO、NaClO,根据平衡常数K2>K1,确定漂白液的有效成分更多,并且NaClO比HClO更稳定,所以不直接使用氯水而使用漂白液做消毒剂;
(3)Fe-2e-=Fe2+应为负极反应,则正极反应中ClO-得电子被还原,方程式为:ClO-+2e-+H2O=Cl-+2OH-;
(4)根据漂白液中NaClO 的质量百分含量随时间变化图可知Ⅰ的次氯酸钠的含量大于Ⅱ的,浓度越大反应速率越大,则v(Ⅰ)>v(Ⅱ)。
21. 原电池 CH3OH CH3OH-6e-+8OH-=CO32-+6H2O A 4H2O-4e-=O2↑+4H+ 4Ag++2H2O=4Ag+O2↑+4H+ 1 B
【分析】(1)燃料电池属于原电池,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;
(2)燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
(3)乙池有外接电源是电解池,阳极上水得电子生成氧气和氢离子,阴极上银离子放电,酸性溶液使紫色石蕊试液变红,根据电极附近溶液的酸碱性变化确定溶液变红的电极;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,据此写出离子方程式;
(5)根据银和氢离子关系式计算氢离子浓度,从而确定溶液的pH,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素。
【详解】(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,即向投放甲醇的电极移动,故答案为:原电池;CH3OH;
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上水得电子生成氧气和氢离子,电极反应式为4H2O-4e-=O2↑+4H+,溶液呈酸性,滴加紫色石蕊试液呈红色, 故答案为:A;4H2O-4e-=O2↑+4H+;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O=4Ag+O2↑+4H+,故答案为:4Ag++2H2O=4Ag+O2↑+4H+;
(5)当乙池中B(Ag)极的质量增加5.40g时,设氢离子浓度为xmol/L,
有:=,解得:x=0.1,则溶液的pH=1,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,B中析出5.40g时转移电子是0.05mol。A、硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故错误;B、电解硫酸铜溶液时,阴极上析出1.60g铜需要转移电子0.05mol,故正确;C、氯化钠中钠元素处于氢元素前,所以阴极上不析出金属单质,故错误;D、电解氢氧化钾溶液相当于电解水,不能析出金属单质,故错误;故选B;故答案为:1;B。
【点睛】本题的易错点为(5),要注意丙中析出金属元素需要的电子等于或小于乙池中转移电子数。
22.(1) 2 2
(2) 9次 最高 中和热是指酸与碱发生中和反应生成1molH2O所放出的热量,与酸和碱的用量无关
(3) > 127.2 HCN(g)HNC(g) ΔH=+59.3kJ/mol
(4)△H=-443.5
【详解】(1)①太阳光和蓝藻使水分解成氢气和氧气,氢气作为汽车燃料电池的燃料,能量转化形式有光能转化为化学能,化学能转化为电能,故能量转化方式有2种;
②其循环转化中有氢气的液化释放能量,氢气在燃料电池中被氧化释放能量,故有2个过程释放能量;
(2)①要准确测定一个中和反应的反应热,需要重复3次,每次都要测酸、碱和中和反应的温度,每次实验要测3次,温度计至少要使用9次;
②将NaOH溶液与盐酸混合后,中和反应完全时释放热量最多,温度最高,应读取的是溶液的最高温度;
③中和热是指酸与碱发生中和反应生成1molH2O所放出的热量,与酸和碱的用量无关;
(3)①如图所示HCN(g)HNC(g)是吸热反应,HNC(g)能量高,能量越高越不稳定,故稳定性为HCN>HNC;
②逆反应的活化能为186.5-59.3=127.2 kJ/mol;
③该反应的热化学方程式为HCN(g)HNC(g) ΔH=+59.3kJ/mol;
(4)①
②
则CH3OH(l)不完全燃烧生成CO和液态水的方程式为根据盖斯定律可知②-①得该反应,;
23. NaClO =Na++ClO- NH3·H2ONH4++HO- 135g/mol 2Na+2H2O=2NaOH+H2↑ 2NaCl+2H2OC12↑+H2↑+2NaOH NH3 3:2
【分析】根据电解质的电离书写电离方程式;根据物质的性质书写相关反应方程式;根据反应中元素化合价变化分析解答。
【详解】(1)NaClO为强电解质,水溶液中完全电离,电离方程式为:NaClO =Na++ClO-;NH4·H2O是弱电解质,水溶液中不完全电离,用可逆符号,电离方程式为:NH3·H2ONH4++HO-,故答案为:NaClO =Na++ClO-;NH3·H2ONH4++HO-;
(2)金属氯化物MCl2,40.5g中含有0.6molCl-,则40.5gMCl2的物质的量为:0.6mol× =0.3mol,则MCl2的摩尔质量为:,故答案为:135g/mol;
(3)电解饱和食盐水,Cl 在阳极放电生成氯气,水电离出的H+在阴极放电生成氢气,电解反应的总化学方程式:2NaCl+2H2OC12↑+H2↑+2NaOH,故答案为:2NaCl+2H2OC12↑+H2↑+2NaOH;
(4)钠与水反应生成氢氧化钠和氢气,化学方程式为::2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(5)化学反应8NH3+3Cl2=6NH4Cl+N2中,Cl元素化合价由0价→ 1价,N元素化合价由 3价→0价,则还原剂为NH3,故答案为:NH3;
(6)相同温度和体积的A和B两容器,A容器中充满O2,B容器中充满O3,m=ρ·V,若密度相同,则质量相同,则氧气和臭氧的物质的量之比= ,故答案为:3:2。
【点睛】在写电离方程式时,强电解质完全电离,用等号表示,弱电解质部分电离,用可逆符号表示,此处为易错点。
24. Pb Pb-2e-+SO42-=PbSO4 降低 4.8 0.1
【分析】(1)从总反应Pb+PbO2+2H2SO42PbSO4+2H2O看,Pb化合价从0价升高到+2价,其为负极材料;在反应中,Pb最终转化为PbSO4,负极反应式为Pb-2e-+SO42-=PbSO4;正极PbO2也将转化为PbSO4,正极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,两电极都消耗H2SO4。
(2)电池放电时,可建立如下关系式:Pb——2e-——2H2SO4,由外电路通过0.1 mol电子,可求出负极板的质量增加和电池中消耗的硫酸物质的量。
【详解】(1)放电时,Pb化合价从0价升高到+2价,其为负极材料,该电极的电极反应式是Pb-2e-+SO42-=PbSO4。两电极都消耗H2SO4,所以电解液中H2SO4的浓度将降低。答案为:Pb;Pb-2e-+SO42-=PbSO4;降低;
(2)电池放电时,可建立如下关系式:Pb——2e-——2H2SO4,当外电路通过0.1 mol电子时,理论上负极板由Pb转化为PbSO4,质量增加=4.8g,电池中消耗的硫酸物质的量为0.1mol。答案为:4.8;0.1。
【点睛】一般来说,电池放电时,负极质量减轻,正极质量可能增加。但铅蓄电池放电时,正、负两个电极都消耗电解质,两电极的质量都增加,这是很少见的。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.节能减排、低碳出行对构建智慧能源系统有重要意义,下列措施不能减少二氧化碳排放的是
A.利用太阳能制氢 B.推广使用煤液化技术
C.举行“地球一小时"堪灯活动 D.关停小火电企业
2.电解甲、乙两个电解池一段时间后,下列说法正确的是
A.若利用甲池精炼铜,a电极为精铜
B.若甲池中a、b均为惰性电极,加盐酸可恢复甲池内溶液
C.若乙池中c、d均为惰性电极,一段时间后溶液pH变小
D.向乙池中d电极附近滴加酚酞试剂,则附近溶液显红色
3.下列关于能量转换的认识中不正确的是
A.煤燃烧时化学能主要转变成热能
B.白炽灯工作时,电能全部转变成光能
C.电解水生成氢气和氧气时,电能转化成化学能
D.绿色植物光合作用过程中太阳能转变成化学能
4.通过以下反应均可获取,下列有关说法正确的是
①太阳光催化分解水制氢:
②焦炭与水反应制氢:
③甲烷与水反应制氢:
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应的
D.由上述可知的燃烧热为
5.质子交换膜燃料电池将氢气和氧气反应放出的能量转化为电能,被视为电动汽车最具潜力的能量来源之一,该电池工作过程中,下列说法不正确的是
A.负极发生的反应是 B.正极上发生还原反应
C.仅产生,对环境友好 D.向正极移动
6.下列反应属于吸热反应的是
A.氢气在氯气中燃烧 B.石灰石在高温下分解
C.稀硫酸与NaOH溶液反应 D.铝和氧化铁在高温下反应
7.在相同温度下,下列两个反应放出的热量分别用Q1和Q2表示:
H2(g)+1/2O2(g)=H2O(g) ΔH= -Q1kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH = -Q2kJ/mol 关系正确的是
A.Q1=Q2 B.1/2Q1=Q2
C.Q1<1/2Q2 D.Q1=1/2Q2
8.环戊二烯的键线式为:,其广泛用于农药、橡胶、塑料等工业合成,是一种重要的有机化工原料。其相关键能和能量循环图如下所示,下列说法不正确的是
共价键 键能
436
299
151
A.在相同条件下,反应: H,则 H
B.
C.表中键能可知将1mol气态解离成气态碘原子需要吸收151kJ能量
D.(g)转化为(g)的过程属于氧化反应
9.2019年《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2H++HO,Ka=2.4×10-12)。下列说法错误的是( )
A.X膜为阳离子交换膜
B.每生成1molH2O2外电路通过4mole-
C.催化剂可加快单位时间内反应中电子的转移数目
D.a极上的电极反应为:H2-2e-=2H+
10.用下图所示装置及试剂进行铁的电化学腐蚀实验探究,测得具支锥形瓶中压强、溶解氧随时间变化关系的曲线如下。下列分析错误是
A.压强增大主要是因为产生了H2
B.pH=4时正极只发生:O2+ 4e+ 4H+→2H2O
C.负极的反应都为:Fe-2e-→ Fe2+
D.都发生了吸氧腐蚀
11.如图为一氧化氮气体传感器工作原理示意图。电流方向如图中所示。电极A、B外覆盖一层聚四氟乙烯纳米纤维膜,可以让气体透过下列相关叙述,正确的是
A.该传感器运用了原电池原理,正极反应为NO+2H2O-3e-=NO+4H+
B.当外电路中流过0.2mol电子时,电池正极消耗1.12L氧气
C.该传感器工作时,接触到的NO浓度增大,输出的电流强度也相应增大
D.为了使传感器连续工作,可以不断补充NaCl,增强导电性
12.已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol;H2(g)+O2(g)=H2O(l) ΔH=-241.8 kJ/mol。欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为( )
A.0.62∶1 B.393.5∶241.8 C.1∶1 D.3.69∶1
13.下列说法不正确的是
A.一定条件下,石墨转化为金刚石要吸收能量,所以石墨更稳定
B.化学反应一定伴随有能量变化,能量变化也必定伴随着化学变化
C.节能不是简单地减少能源的使用,更重要的是要充分有效地利用能源
D.人们比较关注的新能源有太阳能、风能、地热能、海洋能、氢能等
14.铜锌原电池的装置如下图,其中盐桥为内含的琼脂凝胶,下列说法不正确的是
A.是负极反应物,发生氧化反应 B.电子从锌片流向铜片
C.铜电极上发生反应 D.盐桥中进入溶液
二、填空题
15.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池能量转化的主要形式是___________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为___________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②金属锂吸收的氢气与放出的氢气的物质的量之比为________。
16.二氧化氯是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂。回答下列问题:
(1)二氧化氯可溶于水,但常温下难以与水反应,加热时会发生反应生成等物质的量的次氯酸和氯气,同时放出氧气,该反应的化学方程式为_______________________,产物之一次氯酸的电子式为_____________。二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠和另一种氯的含氧酸盐,同时生成水,该反应的离子方程式为______________________。
(2)工业上可利用电解法制备二氧化氯,如图为以石墨作电极制备二氧化氯的过程,写出产生二氧化氯气体的电极反应式:____________________。可利用滴定法测定电解过程中产生的二氧化氯,其过程如下:在锥形瓶中加入足量用硫酸酸化的碘化钾溶液,将生成的二氧化氯通入锥形瓶中至完全吸收,再向锥形瓶中滴加几滴淀粉溶液,用0.1 mol·L1硫代硫酸钠标准液进行滴定(I2+2S2O32-==2I-+S4O62-),共用去100.00 mL标准液。则电解过程中产生的气体折算为标准状况下的体积为________mL
17.氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 N2(g)→2N(g) O2(g)→2O(g) N(g)+O(g)→NO(g)
反应热 ΔH 1 ΔH 2 ΔH 3
热量值kJ·mol-1 945 498 630
①ΔH 1___________0,ΔH 3___________0.(填“>”或“<”)
②N2(g)+O2(g) = 2NO(g) ΔH=___________kJ·mol-1
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是___________(填字母)。
A.
B.
C 。
(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=___________,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为___________kJ。
18.氢气是一种理想的绿色能源,有科学家预言,氢能将成为人类的主要能源。已知以水为原料通过下列途径均可制得氢气。
ⅰ)太阳光催化分解水:
ⅱ)焦炭与水反应:
ⅲ)甲烷与水反应:
(1)反应ⅰ中主要的能量转化为___________;你认为通过此途径进行H2工业化生产的最突出优点是___________。
(2)相同温度压强下,若分别以ⅰ、ⅱ反应生成1mol H2,反应ⅱ比ⅰ要少吸收___________热量;你认为ⅱ反应需要吸热较小的原因可能是___________。
(3)①写出反应ⅲ的化学平衡常数的表达式:___________;
②一定温度下,ⅲ反应中使用催化剂后,下列物理量能保持不变的有___________。
a.焓变 b.反应活化能Ea c.活化分子百分比 d.平衡常数K3
(4)①利用上述热化学方程式,推测反应___________;
②以为燃料、KOH溶液为电解液的燃料电池,负极的电极反应式为___________。
19.如图是一个电化学原理的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O;填写下列空白:
(1)请写出甲、乙两池的名称。甲电池是_______,乙池是_______。
(2)甲池中通入O2的电极名称是_______,电极反应方程式为:_______。
(3)电解过程中,乙池溶液pH的变化为(“升高”、“降低”或“不变” )_______。
20.Cl2、漂白液(有效成分为 NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解 NaCl 溶液生成Cl2的化学方程式是________________。
(2)Cl2溶于H2O、NaOH 溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是_____。
②25℃,Cl2与H2O、NaOH 的反应如下:
反应Ⅰ Cl2+H2OCl-+H++HClO K1=4.510-4
反应Ⅱ Cl2+2OH- Cl-+ClO-+H2O K2=7.51015
解释不直接使用氯水而使用漂白液做消毒剂的原因_____。(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO-发生的电极反应式为____________。
(4)研究漂白液的稳定性对其生产和保存有实际意义。30℃时,pH=11 的漂白液中NaClO 的质量百分含量随时间变化如下:
比较分解速率 v(I)、 v(II)的大小关系_____,原因是_____。
21.如图是一个化学过程的示意图。
(1)图中甲池是______装置(填“电解池”或“原电池”),其中OH-移向______极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:_______。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的反应式_______。
(4)乙池中总反应的离子方程式_________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40g时,乙池的pH是_______(若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.KOH
22.理解化学变化与能量转化有着重要的学习意义。
(1)一种利用蓝绿藻制氢贮氢及氢气应用的图示如下。
①图中能量的转化方式有_______种;
②其循环转化中有_______种过程是释放能量的。
(2)用50 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。据此实验回答下列问题:
①要准确测定一个中和反应的反应热,温度计至少要使用_______次。
②将NaOH溶液与盐酸混合后,应读取的是溶液的_______温度。
③实验中改用55 mL 0.50 mol·L-1盐酸与55 mL 0.50 mol·L-1NaOH溶液进行反应,与上述实验相比,有一种观点认为所测中和热相等,理由是:_______。
(3)研究表明,在101kPa和298K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。据此回答:
①稳定性为HCN_______HNC(选填“>”、“<”、“=”);
②逆反应的活化能为_______kJ/mol;
③该反应的热化学方程式为_______。
(4)已知在298K、101 kPa时,CO(g)和CH3OH(l)的燃烧热ΔH分别为-283.0kJ·mol-1和-726.5kJ·mol-1。则CH3OH(l)不完全燃烧生成CO和液态水反应的ΔH=_______kJ·mol-1。
23.完成下列化学用语:
(1)书写电离方程式: NaClO:__________,一水合氨:__________。
(2)某金属氯化物MCl240.5g含有0.6mlCl-,MCl2的摩尔质量__________。
(3)工业上用电解饱和食盐水制Cl2,写出该反应的化学方程式:__________
(4)小块钠投入到水中,写出该反应的化学方程式:__________
(5)工厂里常用浓氨水来检验氯气管道是否泄漏,其原理为:8NH3+3Cl2=6NH4Cl+N2,请指出此反应中还原剂为__________(化学式)。
(6)相同温度和体积的A和B两容器,A容器中充满O2,B容器中充满O3,若密度相同,则氧气和臭氧的物质的量之比为:__________
24.铅蓄电池是典型的可充电电池,电池总反应式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O。回答下列问题:
(1)放电时,负极为_______电极,试写出该电极的电极反应式是___________。电解液中H2SO4的浓度将变____________。(填“升高”、 “降低” 或“不变”)
(2)电池放电时,当外电路通过0.1 mol电子时,理论上负极板的质量增加________g,电池中消耗的硫酸物质的量为_______mol。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A. 利用太阳能制氢可以减少化石燃料的燃烧,减少二氧化碳的排放;
B. 推广使用煤液化技术并不能减少二氧化碳的排放;
C. 举行“地球一小时”熄灯活动可以减少二氧化碳的排放;
D. 关停小火电企业减少煤炭等化石燃料的燃烧,可以减少二氧化碳的排放;
故选:B。
2.D
【详解】A.a与电源的正极相连作阳极,若利用甲池精炼铜,a电极为粗铜,故A错误;
B.若甲池中a、b均为惰性电极,电解氯化铜生成铜单质和氯气,加氯化铜可恢复甲池内溶液,故B错误;
C.若乙池中c、d均为惰性电极,电解硫酸钠溶液,相当于电解水,一段时间后溶液pH不变,故C错误;
D.乙池中d与电源负极相连做阴极,电极反应式是 ,则向乙池中d电极附近滴加酚酞试剂,附近溶液显红色,故D正确;
故选:D。
3.B
【详解】A.煤燃烧时化学能主要转变成热能,故A正确;
B.白炽灯工作时,电能转变成光能和热能,故B错误;
C.电解水生成氢气和氧气时,电能转化成化学能,故C正确;
D.绿色植物光合作用过程中太阳能转变成化学能,故D正确;
故选B。
4.C
【详解】A.反应①中是太阳能转化为化学能,故A错误;
B.反应②中,为吸热反应,故B错误;
C.根据盖斯定律,目标反应可由反应③-②获得,,故C正确;
D.燃烧热是指1mol纯物质完全燃烧生成稳定氧化物所放出的热量,由反应①可得,的燃烧热为,即,故D错误;
答案选C。
5.B
【详解】A.质子交换膜氢氧燃料电池燃料在负极反应,负极发生的反应是,故A正确;
B.O2在正极上反应,O2被还原,故B错误;
C.质子交换膜氢氧燃料电池将氢气和氧气最终生成水,绿色无污染对环境友好,故C正确;
D.原电池中阳离子移向正极,故D正确;
故答案为B。
6.B
【详解】A.氢气在氯气中燃烧属于放热反应,故A错误;
B.石灰石在高温下分解属于吸热反应,故B正确;
C.稀硫酸与NaOH溶液反应为酸碱中和反应,属于放热反应,故C错误;
D.铝和氧化铁在高温下反应属于放热反应,故D错误;
故选B。
7.C
【详解】已知H2O(g)变为H2O(l)放热,即H2O(g)= H2O(l) ΔH= -Q3kJ/mol<0,结合H2(g)+1/2O2(g)=H2O(g) ΔH=-Q1kJ/mol,根据盖斯定律,两个式子可整理得到2H2(g)+O2(g)=2H2O(l) ΔH = -Q2kJ/mol=-2Q1kJ/mol+(-Q3kJ/mol)<-2Q1kJ/mol,故Q1<1/2Q2,故答案为C。
8.B
【详解】A.氢气和卤素单质生成卤化氢的反应为放热反应,氯原子半径小于碘,得电子能力更强,形成的化学键键能大于碘形成的化学键,放出热量更多,焓变更负,故 H,A正确;
B.由盖斯定律可知,,则,由键能数据可知,,则,B错误;
C.断键需要吸收能量,表中键能可知将1mol气态解离成气态碘原子需要吸收151kJ能量,C正确;
D.(g)转化为(g)的过程中减少了氢原子,属于氧化反应,D正确;
故选B。
9.B
【分析】由示意图可知左边a电极氢气为负极,被氧化生成H+,电极方程式为H2 -2e-═2H+,H+经过X膜进入多孔固体电解质中,则X膜为选择性阳离子交换膜,右边b电极氧气为正极,被还原生成HO2-,反应为O2 +2e-+H2O═HO2-+OH-,HO2-和OH-经过Y膜进入多孔固体电解质中,则Y膜为选择性阴离子交换膜,总反应为H2 +O2 ═H2O2,以此解答该题。
【详解】A.由示意图可知X膜可透过H+,则为选择性阳离子交换膜,故A正确;
B.由分析可知,总反应为:H2 +O2 ═H2O2,反应中转移2e-,则每生成1mol H2O2电极上流过2mol e-,故B错误;
C.催化剂可加快反应速率,则可促进反应中电子的转移,故C正确;
D.a极为负极,发生的电极反应为H2-2e-=2H+,故D正确;
故答案为B。
10.B
【详解】A.pH=2.0的溶液,酸性较强,因此锥形瓶中的Fe粉能发生析氢腐蚀,析氢腐蚀产生氢气,因此会导致锥形瓶内压强增大,A正确;
B.若pH=4.0时只发生吸氧腐蚀,那么锥形瓶内的压强会有下降;而图中pH=4.0时,锥形瓶内的压强几乎不变,说明除了吸氧腐蚀,Fe粉还发生了析氢腐蚀,消耗氧气的同时也产生了氢气,因此锥形瓶内压强几乎不变,B错误;
C.锥形瓶中的Fe粉和C粉构成了原电池,Fe粉作为原电池的负极,发生的电极反应式为:Fe-2e-═Fe2+,C正确;
D.由题干溶解氧随时间变化曲线图可知,三种pH环境下溶解氧的浓度都有减小,则都发生了吸氧腐蚀,D正确;
故答案为:B。
11.C
【详解】A.由图中信息可知,电流从电极经外电路流向电极,则为正极、为负极。该传感器运用了原电池原理,在正极上发生还原反应,电极反应式为,A项错误;
B.由选项A分析可知,当外电路中流过电子时,电池正极消耗氧气,标准状况下体积为,B项错误;
C.该传感器工作时,接触到的浓度增大,则化学反应速率加快,单位时间内化学能转化的电能增多,输出的电流强度也相应增大,C项正确;
D.若补充氯化钠,也会失去电子生成氯气,影响的测定,且造成污染,D项错误;
答案选C。
12.D
【详解】根据C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol;H2(g)+O2(g)=H2O(l) ΔH=-241.8 kJ/mol。燃烧1mol固体碳和1mol氢气分别放出393.5 kJ和241.8 kJ的热量,欲得到相同的热量,固体碳和氢气的物质的量之比为,则固体碳和氢气的质量比为≈3.69,故选D。
13.B
【详解】A.物质的能量越低,稳定性越强,石墨转化为金刚石要吸收能量,则石墨的能量比金刚石低,所以石墨更稳定,A正确;
B.化学反应过程中发生化学键的断裂与形成,一定伴随有能量变化,物理变化中也伴随着能量变化,所以能量变化不一定伴随着化学变化,B不正确;
C.在生产、生活正常运行的前提下谈节能,所以节能是要充分有效地利用能源,而不是简单地减少能源的使用,C正确;
D.新能源一般是指在新技术基础上加以开发利用的可再生能源,包括太阳能、生物质能、水能、风能、地热能、波浪能、潮汐能、氢能等,D正确;
故选B。
14.D
【分析】由图可知,锌为原电池的负极,锌失去电子发生氧化反应生成锌离子,铜为正极,铜离子在正极得到电子发生还原反应生成铜。
【详解】A.由分析可知,锌为原电池的负极,锌失去电子发生氧化反应生成锌离子,故A正确;
B.由分析可知,锌为原电池的负极,铜为正极,则电池工作时,电子从锌片流向铜片,故B正确;
C.由分析可知,铜为正极,铜离子在正极得到电子发生还原反应生成铜,电极反应式为,故C正确;
D.由分析可知,锌为原电池的负极,铜为正极,则电池工作时,盐桥中的氯离子进入硫酸锌溶液,故D错误;
故选D。
15. 化学能转化为电能 由a流向b H2-2e-+2OH-===2H2O 锂(Li) 水(H2O) 1∶2
【详解】分析:(1)氢氧燃料电池主要是把化学能转化为电能;原电池中,电子都是由负极经过导线流向正极。
(2)氢氧燃料电池中,氢气失电子,发生氧化反应,做负极。
(3)①根据反应方程式可以判断出反应Ⅰ中的还原剂,反应Ⅱ中的氧化剂。
②根据反应Ⅰ:2Li--H2;根据反应Ⅱ:2Li--2LiH-- 2H2,就能判断金属锂吸收的氢气与放出的氢气的物质的量之比。
详解:(1)氢氧燃料电池的能量转化形式主要是把化学能转化为电能;氢气在负极被氧化,氧气被还原发生在正极,因此导线中电子流动方向是由a到b;正确答案:化学能转化为电能;由a流向b。
(2)负极上氢气被氧化,反应式为:H2-2e-+2OH-===2H2O ;正确答案:H2-2e-+2OH-===2H2O。
(3)①反应Ⅰ中Li转化为Li+,化合价升高,说明Li为还原剂;反应Ⅱ中水中氢的化合价降低,说明水是氧化剂;正确答案:锂(Li) ;水(H2O)。
②根据方程式Ⅰ.2Li+H2===2LiH可知,有2mol Li反应,吸收1mol氢气,同时生成2 molLiH,根据方程式Ⅱ.LiH+H2O===LiOH+H2↑可知,有1molLiH反应,放出1mol氢气,则2 molLiH反应放出氢气2mol,所以金属锂吸收的氢气与放出的氢气的物质的量之比为1∶2;正确答案:1:2。
点睛:针对于原料电池,可燃物在负极发生氧化反应,氧气在正极发生还原反应;原电池工作时溶液中阴离子移向负极,阳离子移向正极,电子由负极经外电路流向正极,电子不能从电解质中通过。
16. 12ClO2+2H2O4HClO+4Cl2+11O2 2ClO2+2OH-=ClO+ClO+H2O Cl-+2H2O–5e-=ClO2↑+4H+ 156.8
【分析】(1)二氧化氯可溶于水,但常温下难以与水反应,加热时会发生反应生成等物质的量的次氯酸和氨气,同时放出氧气,依据电子守恒和原子守恒配平书写化学方程式,次氯酸是共价化合物,氧原子和氢原子、氯原子分别形成一个共用电子对;二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠和另一种氯的含氧酸盐,同时生成水,依据氧化还原反应+4价变化为+5价和低于+4价的含氯含氧酸盐为+3价含氧酸盐为NaClO2;
(2)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,I2+2S2O═2I-+S4O,根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),V=22.4n,计算标准状况下气体体积。
【详解】(1)二氧化氯可溶于水,加热时会发生反应生成等物质的量的次氯酸和氯气,同时放出氧气,依据电子守恒,氯元素化合价+4价变化为+1价和0价,氧元素化合价-2价变化为0价,电子转移总数为44e-,则Cl2和NaClO前系数分别为4,ClO2前系数为12,结合原子守恒配平书写化学方程式为:12ClO2+2H2O4HClO+4Cl2+11O2,次氯酸是共价化合物,氧原子和氢原子、氯原子分别形成一个共用电子对,电子式为:,二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠和另一种氯的含氧酸盐,同时生成水,依据氧化还原反应+4价变化为+5价和低于+4价的含氯含氧酸盐为+3价含氧酸盐为NaClO2,反应的离子方程式为:2ClO2+2OH-=ClO+ClO+H2O,
故答案为:12ClO2+2H2O4HClO+4Cl2+11O2;;2ClO2+2OH-=ClO+ClO+H2O;
(2)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O,生成的碘单质用0.1mo1 L-1硫代硫酸钠标准液进行滴定(I2+2S2O═2I-+S4O),共用去100.00mL标准液,则:
根据关系式:
n(ClO2)=0.002mol。
阴极生成的是氢气,结合电子守恒电子转移总数为0.01mol,计算2H++2e-=H2↑,生成氢气0.005mol,电解过程中产生的气体折算为标准状况下的体积=(0.002mol+0.005mol)×22.4L/mol=0.1568L=156.8ml,故答案为:Cl-+2H2O-5e-=ClO2↑+4H+;156.8。
17.(1) > < 183
(2)C
(3) -867 kJ·mol-1 95.5
【解析】(1)
①氮气分子分解为氮原子,为断裂化学键吸收能量过程,则ΔH 1>0;氮原子和氧原子形成化学键放出能量过程,ΔH 3<0。
② Ⅰ:N2(g)→2N(g) ΔH 1=945 kJ·mol-1
Ⅱ:O2(g)→2O(g) ΔH 2=498 kJ·mol-1
Ⅲ:N(g)+O(g)→NO(g) ΔH 3=-630 kJ·mol-1
由盖斯定律可知,Ⅰ+Ⅱ+2×Ⅲ得到,N2(g)+O2(g) = 2NO(g) 故ΔH=183kJ·mol-1。
(2)
4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,反应为放热反应,反应物能量高于生成物,反应焓变为负值,故C。
(3)
①CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
由盖斯定律可知,(①+②)得到CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ,故ΔH=-867 kJ·mol-1;
由盖斯定律可知,(①+②)- ③×2得到CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(l) ,故ΔH=-955 kJ·mol-1;1.6 g CH4的物质的量为,故还原NO2 生成N2和液态水时放出的热量为955 kJ·mol-1×0.1mol=95.5 kJ。
18.(1) 太阳能(或光能)转化为化学能 太阳能是取之不尽的能源
(2) 154.5kJ ⅱ反应过程,C被氧化成CO放出了热量
(3) a、d
(4)
【解析】(1)
反应ⅰ是太阳光催化分解水制备氢气,即将太阳能转化为化学能;利用此途径进行H2工业化生产,优点是太阳能是取之不尽的清洁能源;
(2)
相同温度压强下,若分别以ⅰ、ⅱ反应生成1mol H2,反应ⅱ比ⅰ要少吸收;反应ii水蒸气本身具有较高能量,ⅱ反应过程,C被氧化成CO放出了热量,所以ii吸收能力较小;
(3)
①反应ⅲ的化学平衡常数的表达式为;
②ⅲ反应中使用催化剂不改变反应的反应热,催化剂可以降低反应活化能,提高活化分子百分数加快反应速率,催化剂之改变速率,不影响平衡,平衡常数不变,故答案为:ad;
(4)
①根据盖斯定律iii-ii得;
②以为燃料、KOH溶液为电解液的燃料电池,为燃料失去电子得碳酸钾,充入甲烷的一极为负极,负极的电极反应式为:;
19.(1) 原电池 电解池
(2) 正极 3O2 + 12e-+ 6H2O= 12OH-
(3)降低
【解析】(1)
根据甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,乙醇作还原剂,是原电池负极,氧气作氧化剂,是原电池正极,因此甲电池是原电池,乙池是电解池;故答案为:原电池;电解池。
(2)
根据前面分析甲池中氧气化合价降低,得到电子,因此通入O2的电极名称是正极,电极反应方程式为:3O2 + 12e-+ 6H2O= 12OH-;故答案为:正极;3O2 + 12e-+ 6H2O= 12OH-。。
(3)
电解过程中,乙池中阴极是银离子得到电子变为银单质,阳极是水中氢氧根失去电子变为氧气和水,剩余氢离子,因此溶液pH的变化为降低;故答案为:降低。
20. 2NaCl+2H2OH2↑+Cl2↑+2NaOH HClO K2>K1,反应Ⅱ的有效成分比反应Ⅰ的有效成分大,氯气转化为NaClO更充分,且NaClO比HClO更稳定 ClO-+2e-+H2O=Cl-+2OH- > 在相同条件下,次氯酸钠的浓度越大,其分解速率越大
【分析】
电解NaCl溶液的方程式为:2NaCl+2H2O H2↑+Cl2↑+2NaOH;氯水具有漂白性,原因是氯水中含有具有强氧化性的次氯酸;漂白液的有效成分为次氯酸钠,使用时,其与空气中的二氧化碳结合生成次氯酸从而起到漂白的作用;次氯酸不稳定易分解,不便于运输,而把次氯酸转化为次氯酸钠,次氯酸钠稳定,便于运输;根据图象的趋势和数据可知,在相同条件下,次氯酸钠的浓度越大,其分解速率越大。
【详解】
(1)电解NaCl溶液可生成氢气、氯气和氢氧化钠,方程式为:2NaCl+2H2O H2↑+Cl2↑+2NaOH;
(2)①氯水中含有盐酸和次氯酸,氯气和盐酸都不具有漂白性,具有漂白性的是次氯酸(HClO);
②氯水和漂白液的有效成分分别为HClO、NaClO,根据平衡常数K2>K1,确定漂白液的有效成分更多,并且NaClO比HClO更稳定,所以不直接使用氯水而使用漂白液做消毒剂;
(3)Fe-2e-=Fe2+应为负极反应,则正极反应中ClO-得电子被还原,方程式为:ClO-+2e-+H2O=Cl-+2OH-;
(4)根据漂白液中NaClO 的质量百分含量随时间变化图可知Ⅰ的次氯酸钠的含量大于Ⅱ的,浓度越大反应速率越大,则v(Ⅰ)>v(Ⅱ)。
21. 原电池 CH3OH CH3OH-6e-+8OH-=CO32-+6H2O A 4H2O-4e-=O2↑+4H+ 4Ag++2H2O=4Ag+O2↑+4H+ 1 B
【分析】(1)燃料电池属于原电池,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;
(2)燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
(3)乙池有外接电源是电解池,阳极上水得电子生成氧气和氢离子,阴极上银离子放电,酸性溶液使紫色石蕊试液变红,根据电极附近溶液的酸碱性变化确定溶液变红的电极;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,据此写出离子方程式;
(5)根据银和氢离子关系式计算氢离子浓度,从而确定溶液的pH,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素。
【详解】(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,即向投放甲醇的电极移动,故答案为:原电池;CH3OH;
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上水得电子生成氧气和氢离子,电极反应式为4H2O-4e-=O2↑+4H+,溶液呈酸性,滴加紫色石蕊试液呈红色, 故答案为:A;4H2O-4e-=O2↑+4H+;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O=4Ag+O2↑+4H+,故答案为:4Ag++2H2O=4Ag+O2↑+4H+;
(5)当乙池中B(Ag)极的质量增加5.40g时,设氢离子浓度为xmol/L,
有:=,解得:x=0.1,则溶液的pH=1,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,B中析出5.40g时转移电子是0.05mol。A、硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故错误;B、电解硫酸铜溶液时,阴极上析出1.60g铜需要转移电子0.05mol,故正确;C、氯化钠中钠元素处于氢元素前,所以阴极上不析出金属单质,故错误;D、电解氢氧化钾溶液相当于电解水,不能析出金属单质,故错误;故选B;故答案为:1;B。
【点睛】本题的易错点为(5),要注意丙中析出金属元素需要的电子等于或小于乙池中转移电子数。
22.(1) 2 2
(2) 9次 最高 中和热是指酸与碱发生中和反应生成1molH2O所放出的热量,与酸和碱的用量无关
(3) > 127.2 HCN(g)HNC(g) ΔH=+59.3kJ/mol
(4)△H=-443.5
【详解】(1)①太阳光和蓝藻使水分解成氢气和氧气,氢气作为汽车燃料电池的燃料,能量转化形式有光能转化为化学能,化学能转化为电能,故能量转化方式有2种;
②其循环转化中有氢气的液化释放能量,氢气在燃料电池中被氧化释放能量,故有2个过程释放能量;
(2)①要准确测定一个中和反应的反应热,需要重复3次,每次都要测酸、碱和中和反应的温度,每次实验要测3次,温度计至少要使用9次;
②将NaOH溶液与盐酸混合后,中和反应完全时释放热量最多,温度最高,应读取的是溶液的最高温度;
③中和热是指酸与碱发生中和反应生成1molH2O所放出的热量,与酸和碱的用量无关;
(3)①如图所示HCN(g)HNC(g)是吸热反应,HNC(g)能量高,能量越高越不稳定,故稳定性为HCN>HNC;
②逆反应的活化能为186.5-59.3=127.2 kJ/mol;
③该反应的热化学方程式为HCN(g)HNC(g) ΔH=+59.3kJ/mol;
(4)①
②
则CH3OH(l)不完全燃烧生成CO和液态水的方程式为根据盖斯定律可知②-①得该反应,;
23. NaClO =Na++ClO- NH3·H2ONH4++HO- 135g/mol 2Na+2H2O=2NaOH+H2↑ 2NaCl+2H2OC12↑+H2↑+2NaOH NH3 3:2
【分析】根据电解质的电离书写电离方程式;根据物质的性质书写相关反应方程式;根据反应中元素化合价变化分析解答。
【详解】(1)NaClO为强电解质,水溶液中完全电离,电离方程式为:NaClO =Na++ClO-;NH4·H2O是弱电解质,水溶液中不完全电离,用可逆符号,电离方程式为:NH3·H2ONH4++HO-,故答案为:NaClO =Na++ClO-;NH3·H2ONH4++HO-;
(2)金属氯化物MCl2,40.5g中含有0.6molCl-,则40.5gMCl2的物质的量为:0.6mol× =0.3mol,则MCl2的摩尔质量为:,故答案为:135g/mol;
(3)电解饱和食盐水,Cl 在阳极放电生成氯气,水电离出的H+在阴极放电生成氢气,电解反应的总化学方程式:2NaCl+2H2OC12↑+H2↑+2NaOH,故答案为:2NaCl+2H2OC12↑+H2↑+2NaOH;
(4)钠与水反应生成氢氧化钠和氢气,化学方程式为::2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(5)化学反应8NH3+3Cl2=6NH4Cl+N2中,Cl元素化合价由0价→ 1价,N元素化合价由 3价→0价,则还原剂为NH3,故答案为:NH3;
(6)相同温度和体积的A和B两容器,A容器中充满O2,B容器中充满O3,m=ρ·V,若密度相同,则质量相同,则氧气和臭氧的物质的量之比= ,故答案为:3:2。
【点睛】在写电离方程式时,强电解质完全电离,用等号表示,弱电解质部分电离,用可逆符号表示,此处为易错点。
24. Pb Pb-2e-+SO42-=PbSO4 降低 4.8 0.1
【分析】(1)从总反应Pb+PbO2+2H2SO42PbSO4+2H2O看,Pb化合价从0价升高到+2价,其为负极材料;在反应中,Pb最终转化为PbSO4,负极反应式为Pb-2e-+SO42-=PbSO4;正极PbO2也将转化为PbSO4,正极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,两电极都消耗H2SO4。
(2)电池放电时,可建立如下关系式:Pb——2e-——2H2SO4,由外电路通过0.1 mol电子,可求出负极板的质量增加和电池中消耗的硫酸物质的量。
【详解】(1)放电时,Pb化合价从0价升高到+2价,其为负极材料,该电极的电极反应式是Pb-2e-+SO42-=PbSO4。两电极都消耗H2SO4,所以电解液中H2SO4的浓度将降低。答案为:Pb;Pb-2e-+SO42-=PbSO4;降低;
(2)电池放电时,可建立如下关系式:Pb——2e-——2H2SO4,当外电路通过0.1 mol电子时,理论上负极板由Pb转化为PbSO4,质量增加=4.8g,电池中消耗的硫酸物质的量为0.1mol。答案为:4.8;0.1。
【点睛】一般来说,电池放电时,负极质量减轻,正极质量可能增加。但铅蓄电池放电时,正、负两个电极都消耗电解质,两电极的质量都增加,这是很少见的。
答案第1页,共2页
答案第1页,共2页
