广西钦州市第六中学2022-2023学年高二下学期第十次考试化学试卷(含答案)
文档属性
| 名称 | 广西钦州市第六中学2022-2023学年高二下学期第十次考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 768.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 16:11:27 | ||
图片预览


文档简介
钦州市第六中学2022-2023学年高二下学期第十次考试化学试卷
一、单选题(本大题共20小题,共40分)
1.一定温度下,可逆反应在体积固定的密闭容器中反应,达到平衡状态的标志是 ( )
单位时间内生成,同时生成
每消耗氧气,同时生成混合气体的压强不再改变
混合气体的颜色不再改变混合气体的平均相对分子质量不再改变混合气体的密度不再改变
A. B. C. D.
2.下列说法中正确的是 ( )
A. 因为是吸热反应,所以臭氧比氧气的化学性质更活泼
B. 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C. 吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多
D. 物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
3.日常生活常用的干电池构造示意图如图。下列说法错误的是
A. 电极为正极,发生氧化反应B. 电池使用过程中锌筒逐渐变薄
C. 负极的电极反应式为D. 电池工作时,得到电子被还原
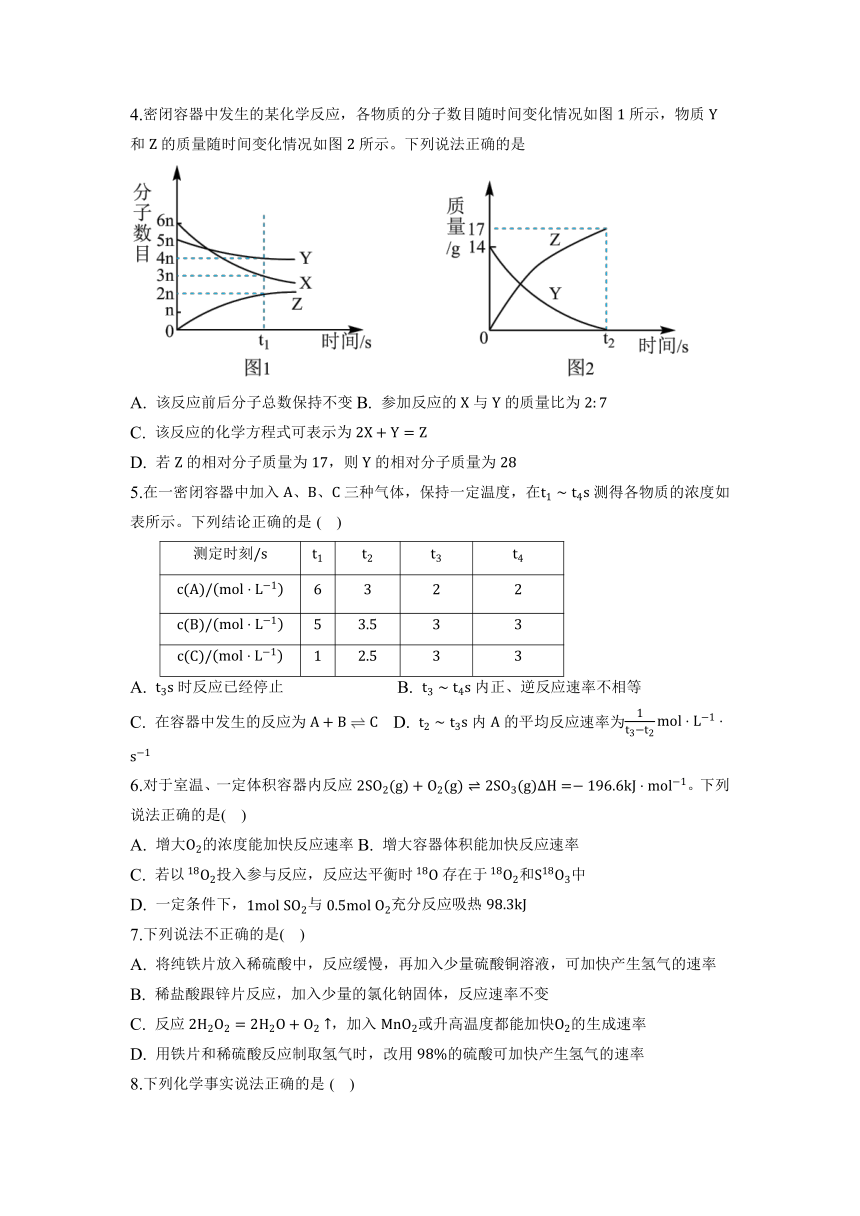
4.密闭容器中发生的某化学反应,各物质的分子数目随时间变化情况如图所示,物质和的质量随时间变化情况如图所示。下列说法正确的是
A. 该反应前后分子总数保持不变B. 参加反应的与的质量比为
C. 该反应的化学方程式可表示为
D. 若的相对分子质量为,则的相对分子质量为
5.在一密闭容器中加入、、三种气体,保持一定温度,在测得各物质的浓度如表所示。下列结论正确的是( )
测定时刻
A. 时反应已经停止 B. 内正、逆反应速率不相等
C. 在容器中发生的反应为 D. 内的平均反应速率为
6.对于室温、一定体积容器内反应。下列说法正确的是( )
A. 增大的浓度能加快反应速率B. 增大容器体积能加快反应速率
C. 若以投入参与反应,反应达平衡时存在于和中
D. 一定条件下,与充分反应吸热
7.下列说法不正确的是( )
A. 将纯铁片放入稀硫酸中,反应缓慢,再加入少量硫酸铜溶液,可加快产生氢气的速率
B. 稀盐酸跟锌片反应,加入少量的氯化钠固体,反应速率不变
C. 反应,加入或升高温度都能加快的生成速率
D. 用铁片和稀硫酸反应制取氢气时,改用的硫酸可加快产生氢气的速率
8.下列化学事实说法正确的是( )
A. 废旧电池应集中回收,并填埋处理B. 充电电池放电时,电能转变为化学能
C. 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
D. 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
9.反应的能量变化如图所示,下列说法正确的是( )
A. 图中为放热过程B. 理论上该反应可以设计成原电池
C. 升高温度,该反应的化学反应速率减慢D. 加入合适的催化剂,可使、的值均减小
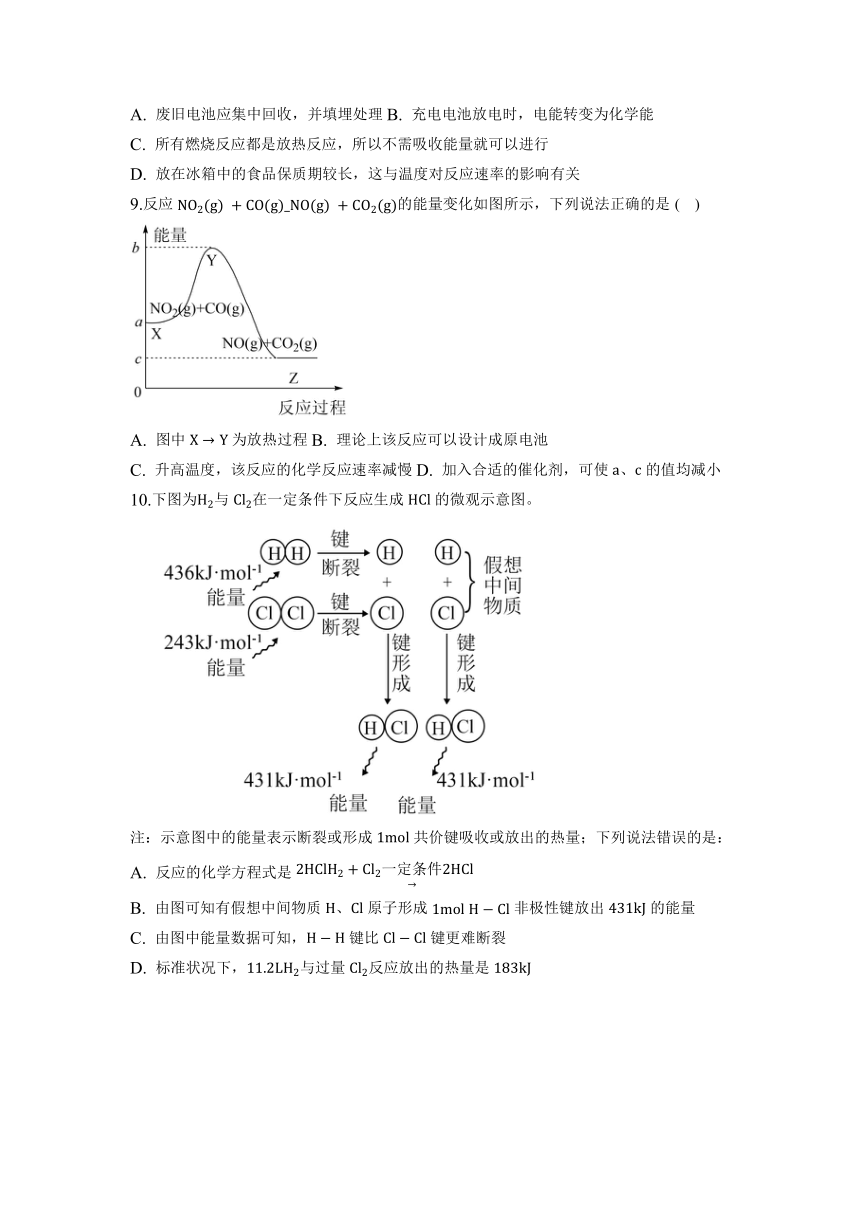
10.下图为与在一定条件下反应生成的微观示意图。
注:示意图中的能量表示断裂或形成共价键吸收或放出的热量;下列说法错误的是:
A. 反应的化学方程式是
B. 由图可知有假想中间物质、原子形成非极性键放出的能量
C. 由图中能量数据可知,键比键更难断裂
D. 标准状况下,与过量反应放出的热量是
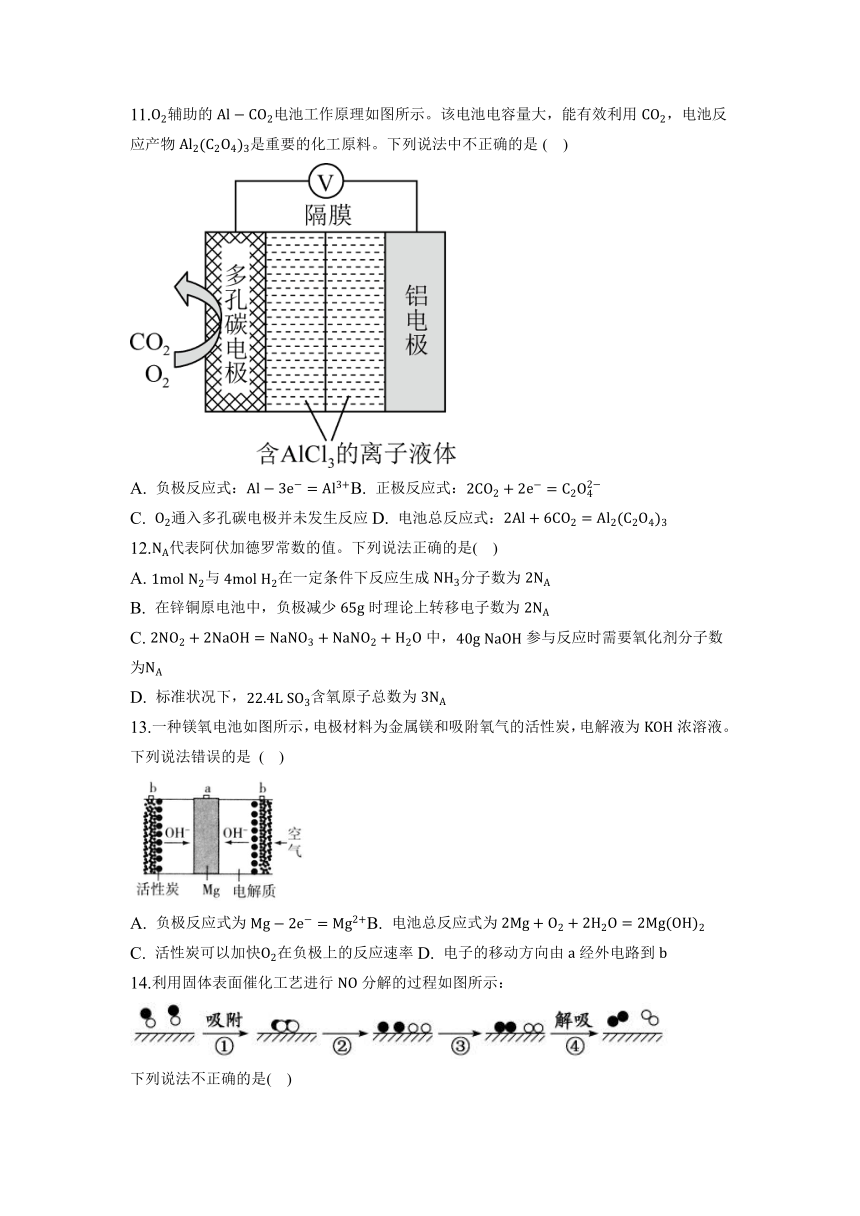
11.辅助的电池工作原理如图所示。该电池电容量大,能有效利用,电池反应产物是重要的化工原料。下列说法中不正确的是( )
A. 负极反应式:B. 正极反应式:
C. 通入多孔碳电极并未发生反应D. 电池总反应式:
12.代表阿伏加德罗常数的值。下列说法正确的是( )
A. 与在一定条件下反应生成分子数为
B. 在锌铜原电池中,负极减少时理论上转移电子数为
C. 中,参与反应时需要氧化剂分子数为
D. 标准状况下,含氧原子总数为
13.一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为浓溶液。下列说法错误的是 ( )
A. 负极反应式为B. 电池总反应式为
C. 活性炭可以加快在负极上的反应速率D. 电子的移动方向由经外电路到
14.利用固体表面催化工艺进行分解的过程如图所示:
下列说法不正确的是( )
A. 是有毒气体 B. 催化剂能改变的分解速率
C. 分解生成和 D. 过程释放能量,过程吸收能量
15.过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A. 升高温度B. 加入适量的水C. 加入少量溶液D. 加入浓度较大的盐酸
16.下列叙述不正确的是( )
A. 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
B. 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高
C. 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
D. 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管加蒸馏水至刻度线
17.用西红柿、电流计、铁或锌等金属进行“水果电池”的实验探究。实验如下。
资料:西红柿含矿物盐、有机酸、等。
实验 Ⅰ Ⅱ Ⅲ Ⅳ
示意图
现象 有微量气泡 无现象 片附近有气泡,且较快 电流计指针偏转,片附近有气泡
下列分析不正确的是
实验Ⅰ、Ⅱ说明能与反应而不能B. 实验Ⅲ说明在该条件下可与反应生成
C. 实验Ⅰ、Ⅲ说明发生原电池反应时会加快化学反应速率
D. 实验Ⅳ中为负极,电子由沿导线流向
18.如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,、均有剩余。下列说法正确的是
比活泼,故F始终作负极B. 在浓硝酸中钝化,故始终不溶解
C. 原电池停止工作时,溶液中有
D. 利用浓硝酸作电解质溶液不符合“绿色化学”的思想
19.已知升温、增大浓度、加大压强和使用催化剂均可以提高化学反应的速率。现把镁条投入盛有稀盐酸的试管中,试管外壁用手一摸感到发烫,而且产生氢气的速率变化情况和反应进行的时间的关系如图所示,则下列说法正确的是
A. 如果使用催化剂,反应结束后会产生更多质量的气体
B. 时刻的速率大于时刻的速率主要原因是反应物的量较多
C. 速率变化的主要原因是盐酸的浓度逐渐减小D. 时恰好完全反应
20.生活中处处有化学,下列措施的目的不是改变反应速率的是
A. 在冰箱或冰柜中冷藏食品 B. 将黄铁矿粉碎后再加入沸腾炉
C. 制作旋糕、面包等焙烤食品时加入膨松剂 D. 在食品包装袋内放置装有还原铁粉的小袋
二、填空题(本大题共5小题,共54分)
21.化学反应的快慢和限度对人类生产、生活有重要的意义。
如图所示,时、、三种气体在密闭容器中反应时的浓度变化,分析图象,回答问题:
该反应的方程式为 ______。
在其他条件下,测得的反应速率为,此时的反应与时相比,______填字母。
A.比时慢B.比时快C.和时速率一样
某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
序号 锌的质量 锌的形态 反应前溶液的温度 其他试剂
粒状 无
粉末 无
粒状 滴溶液
粉末 滴溶液
在此组实验中,速率最快的是 ______填实验序号;实验和表明 ______对反应速率有影响;实验和表明 ______对反应速率有影响。
22.图为铁在一定条件下的转化关系图。
请回答:
“曾青得铁则化为铜”的反应为,该反应的还原剂是_______填化学式。
工业上,向的铁屑中通入生产,向溶液中滴加溶液,观察到的现象是溶液变成______色。
图为原电池装置示意图,此装置可以把化学能转化为_____能,其中铁作____极。
中既有价又有价,则价和价的个数比为_____。
23.、甲醇既是重要的化工原料,又是未来重要的能源物质。
可用作燃料,的燃烧反应属于________填“放热,,或“吸热”反应,和还可以构成燃料电池,通入的一极是________填“正”或“负”极。
将和通入容积为的恒容反应室,在一定条件下发生反应。测得在时达到平衡,的物质的量为,的物质的量浓度为。内,用表示该反应的平均反应速率________,________。
在恒容条件下进行反应,、的物质的量随时间变化关系如图,该反应达到平衡的点是________。
24.铅蓄电池是常用的化学电源,其电极材料分别是和,电解液为稀硫酸。放电时,该电池总反应式为:。请根据上述情况判断:
该蓄电池的负极材料是__________,放电时发生__________填“氧化”或“还原”反应。
已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应__________用离子方程式表示。
氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为溶液,则氢氧燃料电池的负极反应式为__________。该电池工作时,外电路每流过,消耗标况下氧气_______。
25.锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质溶于混合有机溶剂中,通过电解质迁移入晶格中,生成。
回答下列问题:
外电路的电流方向是由__________极流向__________极填字母。
电池正极反应式为__________________________________________________________。
是否可用水代替电池中的混合有机溶剂?__________填“是”或“否”,原因是______________________________________________________________________________。
26.回答下列问题
甲、乙两位同学想探究铝电极在原电池中的作用,两人均用镁片和铝片作电极,但甲同学将电极放入稀硫酸中,乙同学将电极放入溶液中,实验装置如图所示。
写出甲中电池总反应的离子方程式:_______。
乙中铝为_______极,写出铝电极的电极反应式:_______。
甲同学后来继续按图丙进行实验,该装置_______产生电流。填“会”或“不会”。
硅太阳能电池中用到硅。三氯甲硅烷还原法是当前制备高纯硅的主要方法,生产过程示意图如图:
第步制备粗硅的化学方程式为:_______。
遇水剧烈反应生成、和另一种物质,写出遇水的化学反应方程式:_______。
铜的电极可以用稀硝酸来用溶解,写出其反应的离子方程式_______。
把盛有和混合气体的容器倒置于水中保持同温同压,待液面稳定后,容器内气体的体积变为,则原混合气中是_______。
27.某实验小组欲探究牺牲阳极保护法的原理,设计了如图所示实验装置:
实验Ⅰ:向烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流计连接后,再分别插入两个玻璃筒中,电流计指针发生偏转。
锌棒上发生的电极反应为______________,铁棒上发生的电极反应为______________。
向铁棒附近滴加溶液,无明显现象,这说明该实验中无______________产生。
实验Ⅱ:该小组的同学将锌棒换为铜棒,并用导线将其与电流计连接。一段时间后,向插入铁棒的玻璃筒内滴入几滴溶液,向插入铜棒的玻璃筒内滴入几滴酚酞试液。
实验Ⅱ中电流计指针的偏转方向与实验Ⅰ______________填“相同”或“相反”
在铁棒和铜棒附近可观察到的现象分别是______________、______________。
上述两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对_____填“活泼”或“不活泼”的金属被保护。
四、计算题(本大题共1小题,共6分)
28.甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
一定温度下,在一恒容的密闭容器中,由和合成甲醇:
下列情形不能说明该反应已达到平衡状态的是 _____ 填序号.
A.每消耗 的同时生成 B.混合气体总物质的量不变
C.生成的速率与消耗的速率相等 D.、、的浓度都不再发生变化
的平衡转化率与温度、压强的关系如图所示.、两点的平衡常数 ______ 填“”、“”或“”.
某温度下,将 和充入的密闭容器中,达到平衡时测得,的转化率 ______ ,此温度下的平衡常数 ______ 保留二位有效数字.
常温下,将 、氢氧化钠溶液逐滴加入到、甲酸溶液中,充分反应,溶液,此时 ______ 填“”、“”或“”;当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序 ______
温度的熔融盐燃料电池,用、作反应物,空气与的混合气体为正极反应物,镍作电极,用和混合物作电解质.该电池的正极反应式为 ______ .
参考答案
1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20.
21. 固体反应物的表面积 是否形成原电池
22.红电;负 :
23.放热 负
24.;氧化;
25.; 否;电极是活泼金属,能与水反应
26. 负极 会
27.; 相反
产生蓝色沉淀;溶液变红色 不活泼
28.;;;;;;
一、单选题(本大题共20小题,共40分)
1.一定温度下,可逆反应在体积固定的密闭容器中反应,达到平衡状态的标志是 ( )
单位时间内生成,同时生成
每消耗氧气,同时生成混合气体的压强不再改变
混合气体的颜色不再改变混合气体的平均相对分子质量不再改变混合气体的密度不再改变
A. B. C. D.
2.下列说法中正确的是 ( )
A. 因为是吸热反应,所以臭氧比氧气的化学性质更活泼
B. 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C. 吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多
D. 物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
3.日常生活常用的干电池构造示意图如图。下列说法错误的是
A. 电极为正极,发生氧化反应B. 电池使用过程中锌筒逐渐变薄
C. 负极的电极反应式为D. 电池工作时,得到电子被还原
4.密闭容器中发生的某化学反应,各物质的分子数目随时间变化情况如图所示,物质和的质量随时间变化情况如图所示。下列说法正确的是
A. 该反应前后分子总数保持不变B. 参加反应的与的质量比为
C. 该反应的化学方程式可表示为
D. 若的相对分子质量为,则的相对分子质量为
5.在一密闭容器中加入、、三种气体,保持一定温度,在测得各物质的浓度如表所示。下列结论正确的是( )
测定时刻
A. 时反应已经停止 B. 内正、逆反应速率不相等
C. 在容器中发生的反应为 D. 内的平均反应速率为
6.对于室温、一定体积容器内反应。下列说法正确的是( )
A. 增大的浓度能加快反应速率B. 增大容器体积能加快反应速率
C. 若以投入参与反应,反应达平衡时存在于和中
D. 一定条件下,与充分反应吸热
7.下列说法不正确的是( )
A. 将纯铁片放入稀硫酸中,反应缓慢,再加入少量硫酸铜溶液,可加快产生氢气的速率
B. 稀盐酸跟锌片反应,加入少量的氯化钠固体,反应速率不变
C. 反应,加入或升高温度都能加快的生成速率
D. 用铁片和稀硫酸反应制取氢气时,改用的硫酸可加快产生氢气的速率
8.下列化学事实说法正确的是( )
A. 废旧电池应集中回收,并填埋处理B. 充电电池放电时,电能转变为化学能
C. 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
D. 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
9.反应的能量变化如图所示,下列说法正确的是( )
A. 图中为放热过程B. 理论上该反应可以设计成原电池
C. 升高温度,该反应的化学反应速率减慢D. 加入合适的催化剂,可使、的值均减小
10.下图为与在一定条件下反应生成的微观示意图。
注:示意图中的能量表示断裂或形成共价键吸收或放出的热量;下列说法错误的是:
A. 反应的化学方程式是
B. 由图可知有假想中间物质、原子形成非极性键放出的能量
C. 由图中能量数据可知,键比键更难断裂
D. 标准状况下,与过量反应放出的热量是
11.辅助的电池工作原理如图所示。该电池电容量大,能有效利用,电池反应产物是重要的化工原料。下列说法中不正确的是( )
A. 负极反应式:B. 正极反应式:
C. 通入多孔碳电极并未发生反应D. 电池总反应式:
12.代表阿伏加德罗常数的值。下列说法正确的是( )
A. 与在一定条件下反应生成分子数为
B. 在锌铜原电池中,负极减少时理论上转移电子数为
C. 中,参与反应时需要氧化剂分子数为
D. 标准状况下,含氧原子总数为
13.一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为浓溶液。下列说法错误的是 ( )
A. 负极反应式为B. 电池总反应式为
C. 活性炭可以加快在负极上的反应速率D. 电子的移动方向由经外电路到
14.利用固体表面催化工艺进行分解的过程如图所示:
下列说法不正确的是( )
A. 是有毒气体 B. 催化剂能改变的分解速率
C. 分解生成和 D. 过程释放能量,过程吸收能量
15.过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A. 升高温度B. 加入适量的水C. 加入少量溶液D. 加入浓度较大的盐酸
16.下列叙述不正确的是( )
A. 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
B. 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高
C. 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
D. 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管加蒸馏水至刻度线
17.用西红柿、电流计、铁或锌等金属进行“水果电池”的实验探究。实验如下。
资料:西红柿含矿物盐、有机酸、等。
实验 Ⅰ Ⅱ Ⅲ Ⅳ
示意图
现象 有微量气泡 无现象 片附近有气泡,且较快 电流计指针偏转,片附近有气泡
下列分析不正确的是
实验Ⅰ、Ⅱ说明能与反应而不能B. 实验Ⅲ说明在该条件下可与反应生成
C. 实验Ⅰ、Ⅲ说明发生原电池反应时会加快化学反应速率
D. 实验Ⅳ中为负极,电子由沿导线流向
18.如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,、均有剩余。下列说法正确的是
比活泼,故F始终作负极B. 在浓硝酸中钝化,故始终不溶解
C. 原电池停止工作时,溶液中有
D. 利用浓硝酸作电解质溶液不符合“绿色化学”的思想
19.已知升温、增大浓度、加大压强和使用催化剂均可以提高化学反应的速率。现把镁条投入盛有稀盐酸的试管中,试管外壁用手一摸感到发烫,而且产生氢气的速率变化情况和反应进行的时间的关系如图所示,则下列说法正确的是
A. 如果使用催化剂,反应结束后会产生更多质量的气体
B. 时刻的速率大于时刻的速率主要原因是反应物的量较多
C. 速率变化的主要原因是盐酸的浓度逐渐减小D. 时恰好完全反应
20.生活中处处有化学,下列措施的目的不是改变反应速率的是
A. 在冰箱或冰柜中冷藏食品 B. 将黄铁矿粉碎后再加入沸腾炉
C. 制作旋糕、面包等焙烤食品时加入膨松剂 D. 在食品包装袋内放置装有还原铁粉的小袋
二、填空题(本大题共5小题,共54分)
21.化学反应的快慢和限度对人类生产、生活有重要的意义。
如图所示,时、、三种气体在密闭容器中反应时的浓度变化,分析图象,回答问题:
该反应的方程式为 ______。
在其他条件下,测得的反应速率为,此时的反应与时相比,______填字母。
A.比时慢B.比时快C.和时速率一样
某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
序号 锌的质量 锌的形态 反应前溶液的温度 其他试剂
粒状 无
粉末 无
粒状 滴溶液
粉末 滴溶液
在此组实验中,速率最快的是 ______填实验序号;实验和表明 ______对反应速率有影响;实验和表明 ______对反应速率有影响。
22.图为铁在一定条件下的转化关系图。
请回答:
“曾青得铁则化为铜”的反应为,该反应的还原剂是_______填化学式。
工业上,向的铁屑中通入生产,向溶液中滴加溶液,观察到的现象是溶液变成______色。
图为原电池装置示意图,此装置可以把化学能转化为_____能,其中铁作____极。
中既有价又有价,则价和价的个数比为_____。
23.、甲醇既是重要的化工原料,又是未来重要的能源物质。
可用作燃料,的燃烧反应属于________填“放热,,或“吸热”反应,和还可以构成燃料电池,通入的一极是________填“正”或“负”极。
将和通入容积为的恒容反应室,在一定条件下发生反应。测得在时达到平衡,的物质的量为,的物质的量浓度为。内,用表示该反应的平均反应速率________,________。
在恒容条件下进行反应,、的物质的量随时间变化关系如图,该反应达到平衡的点是________。
24.铅蓄电池是常用的化学电源,其电极材料分别是和,电解液为稀硫酸。放电时,该电池总反应式为:。请根据上述情况判断:
该蓄电池的负极材料是__________,放电时发生__________填“氧化”或“还原”反应。
已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应__________用离子方程式表示。
氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为溶液,则氢氧燃料电池的负极反应式为__________。该电池工作时,外电路每流过,消耗标况下氧气_______。
25.锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质溶于混合有机溶剂中,通过电解质迁移入晶格中,生成。
回答下列问题:
外电路的电流方向是由__________极流向__________极填字母。
电池正极反应式为__________________________________________________________。
是否可用水代替电池中的混合有机溶剂?__________填“是”或“否”,原因是______________________________________________________________________________。
26.回答下列问题
甲、乙两位同学想探究铝电极在原电池中的作用,两人均用镁片和铝片作电极,但甲同学将电极放入稀硫酸中,乙同学将电极放入溶液中,实验装置如图所示。
写出甲中电池总反应的离子方程式:_______。
乙中铝为_______极,写出铝电极的电极反应式:_______。
甲同学后来继续按图丙进行实验,该装置_______产生电流。填“会”或“不会”。
硅太阳能电池中用到硅。三氯甲硅烷还原法是当前制备高纯硅的主要方法,生产过程示意图如图:
第步制备粗硅的化学方程式为:_______。
遇水剧烈反应生成、和另一种物质,写出遇水的化学反应方程式:_______。
铜的电极可以用稀硝酸来用溶解,写出其反应的离子方程式_______。
把盛有和混合气体的容器倒置于水中保持同温同压,待液面稳定后,容器内气体的体积变为,则原混合气中是_______。
27.某实验小组欲探究牺牲阳极保护法的原理,设计了如图所示实验装置:
实验Ⅰ:向烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流计连接后,再分别插入两个玻璃筒中,电流计指针发生偏转。
锌棒上发生的电极反应为______________,铁棒上发生的电极反应为______________。
向铁棒附近滴加溶液,无明显现象,这说明该实验中无______________产生。
实验Ⅱ:该小组的同学将锌棒换为铜棒,并用导线将其与电流计连接。一段时间后,向插入铁棒的玻璃筒内滴入几滴溶液,向插入铜棒的玻璃筒内滴入几滴酚酞试液。
实验Ⅱ中电流计指针的偏转方向与实验Ⅰ______________填“相同”或“相反”
在铁棒和铜棒附近可观察到的现象分别是______________、______________。
上述两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对_____填“活泼”或“不活泼”的金属被保护。
四、计算题(本大题共1小题,共6分)
28.甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
一定温度下,在一恒容的密闭容器中,由和合成甲醇:
下列情形不能说明该反应已达到平衡状态的是 _____ 填序号.
A.每消耗 的同时生成 B.混合气体总物质的量不变
C.生成的速率与消耗的速率相等 D.、、的浓度都不再发生变化
的平衡转化率与温度、压强的关系如图所示.、两点的平衡常数 ______ 填“”、“”或“”.
某温度下,将 和充入的密闭容器中,达到平衡时测得,的转化率 ______ ,此温度下的平衡常数 ______ 保留二位有效数字.
常温下,将 、氢氧化钠溶液逐滴加入到、甲酸溶液中,充分反应,溶液,此时 ______ 填“”、“”或“”;当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序 ______
温度的熔融盐燃料电池,用、作反应物,空气与的混合气体为正极反应物,镍作电极,用和混合物作电解质.该电池的正极反应式为 ______ .
参考答案
1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20.
21. 固体反应物的表面积 是否形成原电池
22.红电;负 :
23.放热 负
24.;氧化;
25.; 否;电极是活泼金属,能与水反应
26. 负极 会
27.; 相反
产生蓝色沉淀;溶液变红色 不活泼
28.;;;;;;
同课章节目录
