2023届高考化学二轮复习专题 重点题空热练(二) 化工流程中方程式的书写 课件(共10张PPT)
文档属性
| 名称 | 2023届高考化学二轮复习专题 重点题空热练(二) 化工流程中方程式的书写 课件(共10张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 07:49:02 | ||
图片预览



文档简介
(共10张PPT)
重点题空热练(二) 化工流程中方
程式的书写
2023届高考化学二轮复习专题课件★★
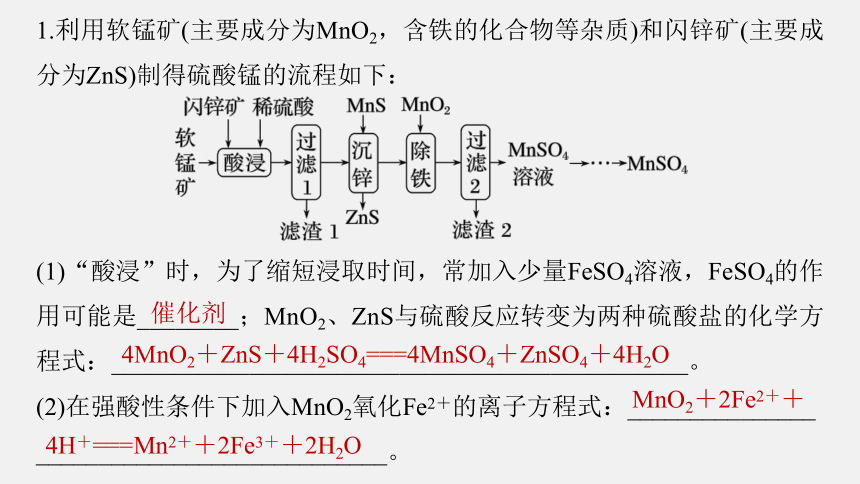
1.利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分为ZnS)制得硫酸锰的流程如下:
(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是________;MnO2、ZnS与硫酸反应转变为两种硫酸盐的化学方程式:______________________________________________。
(2)在强酸性条件下加入MnO2氧化Fe2+的离子方程式:_______________
____________________________。
催化剂
4MnO2+ZnS+4H2SO4===4MnSO4+ZnSO4+4H2O
MnO2+2Fe2++
4H+===Mn2++2Fe3++2H2O
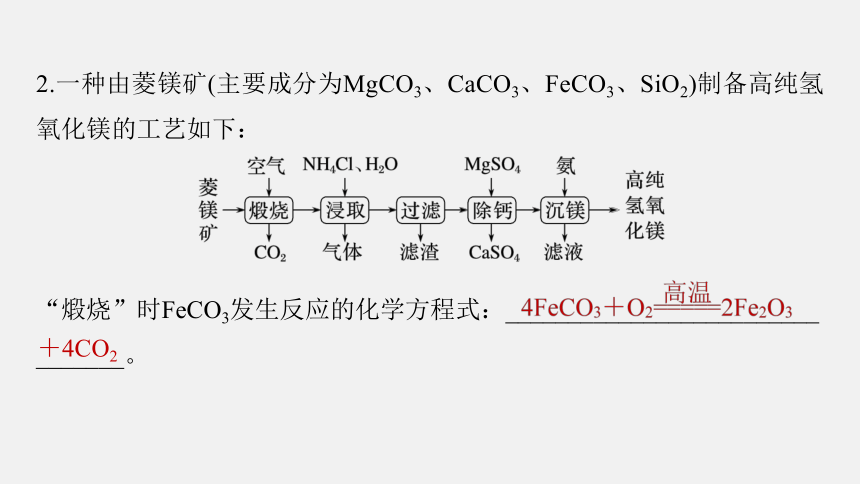
2.一种由菱镁矿(主要成分为MgCO3、CaCO3、FeCO3、SiO2)制备高纯氢氧化镁的工艺如下:
“煅烧”时FeCO3发生反应的化学方程式:_________________________
_______。
+4CO2
3.某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如下:
已知:Na2CO3+NO+NO2===2NaNO2+CO2。
按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2的物质的量之比恰好为1∶1,则“分解塔”中发生反应的化学方程式:________________________________________。
2HNO3+2SO2+H2O===NO+NO2+2H2SO4
4.FePO4是一种难溶于水,易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4·7H2O和H3PO4(第一级电离常数Ka1=7.5×10-3)制备FePO4的流程如下:
写出“反应”时总反应的离子方程式:____________________________
__________________________。
===2FePO4↓+Cl-+5H2O
2Fe2++ClO-+2H3PO4+4OH-
5.采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如下:
反应釜Ⅱ中CaSO3转化为CaSO4反应的化学方程式:_________________
_________________________________。
Ca(OH)2===CaSO4+Ca(NO2)2+H2O
2NO2+CaSO3+
6.以菱锰矿(主要成分为MnCO3,还含有FeCO3、CaCO3、MgCO3、SiO2、Al2O3、Fe2O3等杂质)为原料制备二氧化锰的工艺流程如下:
已知:草酸钙、草酸镁不溶于水。
写出“氧化”时发生反应的离子方程式:__________________________
_______________。
+2Fe3++2H2O
MnO2+2Fe2++4H+===Mn2+
7.利用硫酸渣(主要含Fe2O3、SiO2)制备纳米Fe3O4的工艺流程如下:
“还原”时FeS2被氧化为 ,该反应的离子方程式:_______________
_____________________________。
14Fe3++FeS2+
8.某实验小组采用刻蚀废液(主要含CuCl2、FeCl3、FeCl2、HCl)制取Cu和Cu2Cl2,实验流程如下:
已知:Cu2Cl2是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。
“还原Ⅱ”中,Cu2+参与反应的离子方程式:______________________
____________________________。
9.某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
沉铝后所得FeSO4溶液可用于吸收烟气中的NO,其原理为Fe2++2NO
[Fe(NO)2]2+。“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6
发生反应的离子方程式:________________________________________
_________________。
+6CO2↑+6H2O
重点题空热练(二) 化工流程中方
程式的书写
2023届高考化学二轮复习专题课件★★
1.利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分为ZnS)制得硫酸锰的流程如下:
(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是________;MnO2、ZnS与硫酸反应转变为两种硫酸盐的化学方程式:______________________________________________。
(2)在强酸性条件下加入MnO2氧化Fe2+的离子方程式:_______________
____________________________。
催化剂
4MnO2+ZnS+4H2SO4===4MnSO4+ZnSO4+4H2O
MnO2+2Fe2++
4H+===Mn2++2Fe3++2H2O
2.一种由菱镁矿(主要成分为MgCO3、CaCO3、FeCO3、SiO2)制备高纯氢氧化镁的工艺如下:
“煅烧”时FeCO3发生反应的化学方程式:_________________________
_______。
+4CO2
3.某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如下:
已知:Na2CO3+NO+NO2===2NaNO2+CO2。
按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2的物质的量之比恰好为1∶1,则“分解塔”中发生反应的化学方程式:________________________________________。
2HNO3+2SO2+H2O===NO+NO2+2H2SO4
4.FePO4是一种难溶于水,易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4·7H2O和H3PO4(第一级电离常数Ka1=7.5×10-3)制备FePO4的流程如下:
写出“反应”时总反应的离子方程式:____________________________
__________________________。
===2FePO4↓+Cl-+5H2O
2Fe2++ClO-+2H3PO4+4OH-
5.采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如下:
反应釜Ⅱ中CaSO3转化为CaSO4反应的化学方程式:_________________
_________________________________。
Ca(OH)2===CaSO4+Ca(NO2)2+H2O
2NO2+CaSO3+
6.以菱锰矿(主要成分为MnCO3,还含有FeCO3、CaCO3、MgCO3、SiO2、Al2O3、Fe2O3等杂质)为原料制备二氧化锰的工艺流程如下:
已知:草酸钙、草酸镁不溶于水。
写出“氧化”时发生反应的离子方程式:__________________________
_______________。
+2Fe3++2H2O
MnO2+2Fe2++4H+===Mn2+
7.利用硫酸渣(主要含Fe2O3、SiO2)制备纳米Fe3O4的工艺流程如下:
“还原”时FeS2被氧化为 ,该反应的离子方程式:_______________
_____________________________。
14Fe3++FeS2+
8.某实验小组采用刻蚀废液(主要含CuCl2、FeCl3、FeCl2、HCl)制取Cu和Cu2Cl2,实验流程如下:
已知:Cu2Cl2是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。
“还原Ⅱ”中,Cu2+参与反应的离子方程式:______________________
____________________________。
9.某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
沉铝后所得FeSO4溶液可用于吸收烟气中的NO,其原理为Fe2++2NO
[Fe(NO)2]2+。“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6
发生反应的离子方程式:________________________________________
_________________。
+6CO2↑+6H2O
同课章节目录
