河北省磁县一中苏教版化学必修二专题二第二单元 化学反应中的热量 课件(38张ppt)
文档属性
| 名称 | 河北省磁县一中苏教版化学必修二专题二第二单元 化学反应中的热量 课件(38张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1016.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-06-11 09:40:44 | ||
图片预览











文档简介
(共38张PPT)
镁条的燃烧
闪电时产生氮氧化物
你见过化学反应中伴随着的
能量转化吗?能举例说明吗?
专题2 化学反应与能量转化
第二单元 化学反应中的热量
学习目标
了解放热反应、吸热反应的定义及判断
掌握热化学方程式的书写
能够从宏观和微观两个角度分析化学反应中的能量变化并能够进行计算
A + B = C
所有化学反应均伴随着热量变化
反应物
生成物
反应物
生成物
E
反应进程
E
反应进程
放热反应
反应物
生成物
E
反应进程
反应物
生成物
E
反应进程
吸热反应
一、放热反应与吸热反应
1 概念:
放热反应:有热量放出的化学反应
吸热反应:吸收热量的化学反应
2 、 常见的放(吸)热反应
燃料的燃烧反应
2.金属与酸或水置换出H2的反应
3.酸碱中和反应
4.大部分化合反应(生石灰和水)
5.铝热反应
6.物质的缓慢氧化
放热反应
吸热反应
1.氢氧化钡与氯化铵晶体的反应
2. C(s) + CO2(g)== 2CO(g)
高温
3、大部分分解反应(CaCO3高温分解)
4、H2+CuO
C+H2O(g)
一、放热反应与吸热反应
判断下列反应是放热反应还是吸热反应:
(1)镁条的燃烧;
(2)高温下木炭与二氧化碳分生成一氧化碳;
(3)氧化钙与水反应。
(4)盐酸和氢氧化钠溶液反应
(5)高温煅烧石灰石
(6)浓硫酸稀释
需要加热才能进行的反应是否就是吸热反应
问题解决
从宏观角度分析
反应物的总能量高
生成物的总能量低
放热反应
生成物的总能量高
反应物的总能量低
吸热反应
化学反应中为什么会伴随着能量转化?
旧键断裂所吸收 的能量 新键形成所放出的能量
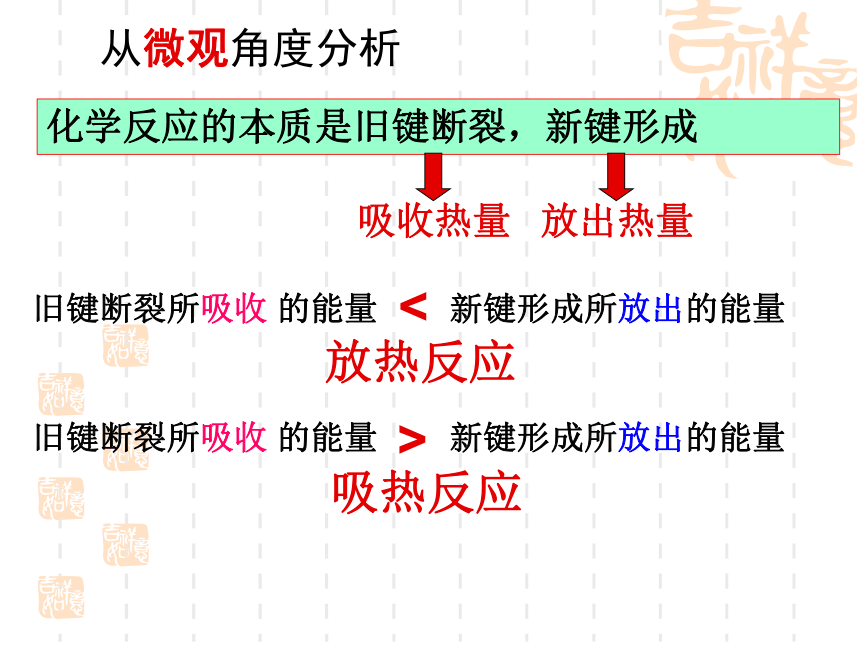
从微观角度分析
化学反应的本质是旧键断裂,新键形成
吸收热量
放出热量
放热反应
<
旧键断裂所吸收 的能量 新键形成所放出的能量
>
吸热反应
判断:
(1)需要加热才能发生的反应一定是吸热反应
(2)一个反应是吸热或放热与反应条件没有
直接联系,与反应物与生成物的总能量
的相对大小有关。
(3)化学反应中的能量变化都表现为热能变化.
(4) 任何放热反应在常温条件下一定能发生反应
(5 ) 吸热反应在加热条件下才能发生反应
二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式叫热化学方程式。
如何用化学用语表示放热反应和吸热反应?
观察与比较
氢气燃烧的化学方程式:2H2 + O2 == 2H2O
点燃
氢气燃烧的热化学方程式
① 2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ mol- 1
② H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ mol- 1
③ H2(g) +1/2 O2(g) =H2O(g) △H =-241.8 kJ mol-1
2、热化学方程式书写原则
b.必须标明物质的状态,用g、l、s、aq分别代表气、液、固、溶液。不需标“反应条件”、“ ” “ ”。
c .用△H 标明反应热,放热为“-”,吸热为“+”。
d.热量数值与系数要对应,系数表示各物质的物质的量。 △H(反应热)单位kJ mol-1
a.标明外界条件,常温常压不需标明
1molH2在空气中完全燃烧生成液态水,放出242kJ的能量,写出热化学方程式
练习1:
2、下列热化学方程式书写正确的是
A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+1/2O2(g)=== H2O (g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol
C
3、热化学方程式C(s)+H2O(g) = CO(g)+H2(g);
△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量 B.1mol碳和1mol水反应生成一氧化碳和氢 气,并吸收131.3kJ热量 C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
C
对热化学方程式H2(g)+ I2(g)=2HI(g);△H = +26kJ·mol-1的叙述中,正确的是 ( )
A.1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量
B.1个氢分子和1个碘分子完全反应需要吸收52kJ的热量
C.1molH2(g)与1molI2(g)完全反应生成2mol的HI气体需吸收52kJ的热量
D.1molH2(g)与1molI2(g)完全反应放出26kJ的热量
练习4:
A
(2005全国理综Ⅰ·13).已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是 ( )
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2b kJ/mol
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) ΔH=2b kJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-4b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=b kJ/mol
练习5:
C
6、已知. 2 H2(g)+ O2(g) =2H2O(g) △H=-483.6kJ/mol
H2O(l) =H2O(g) △H=+44 kJ/mol
写出氢气和氧气反应生成液态水的热化学方程式:
(2)通常状况下,若要得到857.4kJ的热量,需氢气的质量为
写出下列反应的热化学方程式。
(1)1mol硫粉完全燃烧生成二氧化硫气体,放出296kJ热量
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ
(3)10g CaCO3分解吸收热量17.56kJ
(4) 4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量
三、反应热的简单计算
ΔH =生成物的总能量-反应物的总能量
ΔH=反应物的总键能-生成物的总键能
在反应H2 + Cl2 =2HCl中,已知
H-H 键能为436kJ,Cl-Cl键能为247kJ,
H-Cl键能为431kJ,判断该反应是 反应
放热
练习1:
则(1)化学键断裂时需要吸收能量。吸收总能量为:436kJ+247kJ=683 kJ,
(2)化学键形成时需要释放能量。释放总能量为:431kJ+431kJ=862kJ,
(3)计算反应中热量的变化:
862kJ—683kJ=179kJ
写出热化学方程式
某些键的键能(kJ/mol)
键 键能 键 键能
H-H 436 C-H 415.0
Cl-Cl 242.7 O-H 462.8
Br-Br 193.7 N-H 390.8
I-I 152.7 H-Cl 431.8
C-C 347.7 H-I 298.7
对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?
键能越大
含该键的分子越稳定
化学键越牢固
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。
你能根据以上所给的数据判断反应:
2H2(g)+O2(g)=2H2O(g)
是放热反应吗?并通过计算得出 △H =?
H-O-H
△H =-484 kJ mol-1
△H=E(吸)—E(放)
二、燃料燃烧释放的热量
我们把同质量不同燃料,完全燃烧后放出的热量用热值来表示(表2-4)
为什么质量相同的不同燃料,完全燃烧放出的热量不一样
热值:表示单位质量燃料完全燃烧释放热量的大小
单位:kJ g-1
微观上看(同质量的燃料A和B)
燃料A燃烧放出的热量取决于形成化学键所放出 的热量与其断开化学键吸收的热量的差值EA
燃料B燃烧放出的热量取决于形成化学键所放出的热量与其断开化学键吸收的热量的差值EB
当EA>EB 时,A的热值比B的热值大
当EA① 现今用的燃料是什么?主要是什么?
② 燃料充分燃烧的条件有哪些?
③ 燃料燃烧时,空气不足或大大过量,分别会造成什么后果?
④ 导致酸雨的主要原因之一是什么?
⑤ 怎样高效、清洁地利用煤炭?
⑥ 怎样提高固体和液体燃料的燃烧效率?
提高燃料的使用效率
空气不足,燃烧就不完全,浪费资源,产生的大量CO危害人体健康;过量的空气会带走部分热量,同样造成浪费
将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面积
煤中所含硫在燃烧时会生成SO2
要有适当过量的空气;燃料与空气要有足够大的接触面积
练习:如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
(1)实验中观察到的现象是______。
(2)产生上述现象的原因是______。
(3)写出有关反应的离子方程式.
(4)由实验推知,MgCl2和H2的总能量 (填“大于、“小于”、“等于”)镁片和盐酸的总能量.
写出下列反应的热化学方程式。
(1)1mol硫粉完全燃烧生成二氧化硫气体,放出296kJ热量
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ
(3)10g CaCO3分解吸收热量17.56kJ
(4) 4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是两种原子间形成1mol化学键时释放的能量或断开1mol化学键时所吸收的能量。现提供以下化学键的键能(kJ/mol)P-P:198
P-O:360 O=O:498 P=O:585
试根据这些数据,计算该反应是——反应
P4(白磷)(g) + 5O2(g) = P4O10(g)
(提示:白磷是正四面体型的分子,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外每个磷原子又以双键结合一个氧原子)
练习2
则(1)化学键断裂时需要吸收能量。吸收总能量为:6×198kJ/mol+5×498kJ/mol=3678kJ,
(2)化学键形成时需要释放能量。释放总能量为:12×360kJ/mol+4×585kJ/mol=6660kJ,
(3)计算反应中热量的变化:
6660kJ-3678kJ=2982kJ
3、下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量的大小决定了化学反应是放热还是吸热
D.吸热反应在加热条件下才能发生反应
C
4、判断:
(1)加热的反应一定是吸热反应
(2)一个反应是吸热或放热与反应条件
没有直接联系,与反应物与生成物
的总能量的相对大小有关。
(3)化学反应中的能量变化都表现为热
能变化.
已知H-H 键能为436kJ/mol,Cl-Cl键能为247kJ/mol,H-Cl键能为431kJ/mol,
计算反应H2(g) + Cl2(g) =2HCl(g)的 △H
练习1:
△H=反应物的总键能-生成物的总键能
△H=(1×436kJ/mol+1×247kJ/mol)- 431kJ/mol×2
=—179kJ/mol
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是两种原子间形成1mol化学键时释放的能量或断开1mol化学键时所吸收的能量。现提供以下化学键的键能(kJ/mol)P-P:198
P-O:360 O=O:498 P=O:585
试根据这些数据,计算该反应是——反应
P4(白磷)(g) + 5O2(g) = P4O10(g)
(提示:白磷是正四面体型的分子,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外每个磷原子又以双键结合一个氧原子)
练习2
△H=反应物的总键能-生成物的总键能
△H=(6×198kJ/mol+5×498kJ/mol)-
(12×360kJ/mol+4×585kJ/mol)
△H=-2982kJ/mol
练习1
关于吸热反应和放热反应,下列说法错误的是( )
A.需要加热才能进行的化学反应一定是吸热反应
B.放热反应在常温下一定能发生
C.吸热反应在常温下不一定不能发生
D.反应物的总能量高于生成物的总能量时,发生放热反应
AB
作业、依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
_____________________________________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
(1) 4g硫粉在氧气中完全燃烧生成气体放出热量37kJ
(2) 9g铝和氯气完全反应生成固体放出热量274.2kJ
(3) 10g碳酸钙完全分解吸收热量17.56kJ
(4) 10g乙烷在氧气中完全燃烧生成液态水放出热量
520.3kJ
(5) 标况下2LCH4在空气中完全燃烧生成CO2和水放出热
量 79.5kJ
(6)0.3mol气态乙硼烷(B2H6)在氧气中完全燃烧生成固
态三氧化二硼和液态水放出热量649.5kJ
(7) 1molH2断键吸收436KJ热量,1mol Cl2断键吸收
243KJ热量,1moHCl断键吸收431KJ热量.
(8) 0.4mol液体肼(N2H4)与液体双氧水生成氮气和水蒸
气放出热量256.652kj
(9) mg甲烷完全燃烧生成液态水和0.5molCO2放出热量
445kJ
镁条的燃烧
闪电时产生氮氧化物
你见过化学反应中伴随着的
能量转化吗?能举例说明吗?
专题2 化学反应与能量转化
第二单元 化学反应中的热量
学习目标
了解放热反应、吸热反应的定义及判断
掌握热化学方程式的书写
能够从宏观和微观两个角度分析化学反应中的能量变化并能够进行计算
A + B = C
所有化学反应均伴随着热量变化
反应物
生成物
反应物
生成物
E
反应进程
E
反应进程
放热反应
反应物
生成物
E
反应进程
反应物
生成物
E
反应进程
吸热反应
一、放热反应与吸热反应
1 概念:
放热反应:有热量放出的化学反应
吸热反应:吸收热量的化学反应
2 、 常见的放(吸)热反应
燃料的燃烧反应
2.金属与酸或水置换出H2的反应
3.酸碱中和反应
4.大部分化合反应(生石灰和水)
5.铝热反应
6.物质的缓慢氧化
放热反应
吸热反应
1.氢氧化钡与氯化铵晶体的反应
2. C(s) + CO2(g)== 2CO(g)
高温
3、大部分分解反应(CaCO3高温分解)
4、H2+CuO
C+H2O(g)
一、放热反应与吸热反应
判断下列反应是放热反应还是吸热反应:
(1)镁条的燃烧;
(2)高温下木炭与二氧化碳分生成一氧化碳;
(3)氧化钙与水反应。
(4)盐酸和氢氧化钠溶液反应
(5)高温煅烧石灰石
(6)浓硫酸稀释
需要加热才能进行的反应是否就是吸热反应
问题解决
从宏观角度分析
反应物的总能量高
生成物的总能量低
放热反应
生成物的总能量高
反应物的总能量低
吸热反应
化学反应中为什么会伴随着能量转化?
旧键断裂所吸收 的能量 新键形成所放出的能量
从微观角度分析
化学反应的本质是旧键断裂,新键形成
吸收热量
放出热量
放热反应
<
旧键断裂所吸收 的能量 新键形成所放出的能量
>
吸热反应
判断:
(1)需要加热才能发生的反应一定是吸热反应
(2)一个反应是吸热或放热与反应条件没有
直接联系,与反应物与生成物的总能量
的相对大小有关。
(3)化学反应中的能量变化都表现为热能变化.
(4) 任何放热反应在常温条件下一定能发生反应
(5 ) 吸热反应在加热条件下才能发生反应
二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式叫热化学方程式。
如何用化学用语表示放热反应和吸热反应?
观察与比较
氢气燃烧的化学方程式:2H2 + O2 == 2H2O
点燃
氢气燃烧的热化学方程式
① 2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ mol- 1
② H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ mol- 1
③ H2(g) +1/2 O2(g) =H2O(g) △H =-241.8 kJ mol-1
2、热化学方程式书写原则
b.必须标明物质的状态,用g、l、s、aq分别代表气、液、固、溶液。不需标“反应条件”、“ ” “ ”。
c .用△H 标明反应热,放热为“-”,吸热为“+”。
d.热量数值与系数要对应,系数表示各物质的物质的量。 △H(反应热)单位kJ mol-1
a.标明外界条件,常温常压不需标明
1molH2在空气中完全燃烧生成液态水,放出242kJ的能量,写出热化学方程式
练习1:
2、下列热化学方程式书写正确的是
A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+1/2O2(g)=== H2O (g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol
C
3、热化学方程式C(s)+H2O(g) = CO(g)+H2(g);
△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量 B.1mol碳和1mol水反应生成一氧化碳和氢 气,并吸收131.3kJ热量 C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
C
对热化学方程式H2(g)+ I2(g)=2HI(g);△H = +26kJ·mol-1的叙述中,正确的是 ( )
A.1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量
B.1个氢分子和1个碘分子完全反应需要吸收52kJ的热量
C.1molH2(g)与1molI2(g)完全反应生成2mol的HI气体需吸收52kJ的热量
D.1molH2(g)与1molI2(g)完全反应放出26kJ的热量
练习4:
A
(2005全国理综Ⅰ·13).已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是 ( )
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2b kJ/mol
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) ΔH=2b kJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-4b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=b kJ/mol
练习5:
C
6、已知. 2 H2(g)+ O2(g) =2H2O(g) △H=-483.6kJ/mol
H2O(l) =H2O(g) △H=+44 kJ/mol
写出氢气和氧气反应生成液态水的热化学方程式:
(2)通常状况下,若要得到857.4kJ的热量,需氢气的质量为
写出下列反应的热化学方程式。
(1)1mol硫粉完全燃烧生成二氧化硫气体,放出296kJ热量
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ
(3)10g CaCO3分解吸收热量17.56kJ
(4) 4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量
三、反应热的简单计算
ΔH =生成物的总能量-反应物的总能量
ΔH=反应物的总键能-生成物的总键能
在反应H2 + Cl2 =2HCl中,已知
H-H 键能为436kJ,Cl-Cl键能为247kJ,
H-Cl键能为431kJ,判断该反应是 反应
放热
练习1:
则(1)化学键断裂时需要吸收能量。吸收总能量为:436kJ+247kJ=683 kJ,
(2)化学键形成时需要释放能量。释放总能量为:431kJ+431kJ=862kJ,
(3)计算反应中热量的变化:
862kJ—683kJ=179kJ
写出热化学方程式
某些键的键能(kJ/mol)
键 键能 键 键能
H-H 436 C-H 415.0
Cl-Cl 242.7 O-H 462.8
Br-Br 193.7 N-H 390.8
I-I 152.7 H-Cl 431.8
C-C 347.7 H-I 298.7
对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?
键能越大
含该键的分子越稳定
化学键越牢固
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。
你能根据以上所给的数据判断反应:
2H2(g)+O2(g)=2H2O(g)
是放热反应吗?并通过计算得出 △H =?
H-O-H
△H =-484 kJ mol-1
△H=E(吸)—E(放)
二、燃料燃烧释放的热量
我们把同质量不同燃料,完全燃烧后放出的热量用热值来表示(表2-4)
为什么质量相同的不同燃料,完全燃烧放出的热量不一样
热值:表示单位质量燃料完全燃烧释放热量的大小
单位:kJ g-1
微观上看(同质量的燃料A和B)
燃料A燃烧放出的热量取决于形成化学键所放出 的热量与其断开化学键吸收的热量的差值EA
燃料B燃烧放出的热量取决于形成化学键所放出的热量与其断开化学键吸收的热量的差值EB
当EA>EB 时,A的热值比B的热值大
当EA
② 燃料充分燃烧的条件有哪些?
③ 燃料燃烧时,空气不足或大大过量,分别会造成什么后果?
④ 导致酸雨的主要原因之一是什么?
⑤ 怎样高效、清洁地利用煤炭?
⑥ 怎样提高固体和液体燃料的燃烧效率?
提高燃料的使用效率
空气不足,燃烧就不完全,浪费资源,产生的大量CO危害人体健康;过量的空气会带走部分热量,同样造成浪费
将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面积
煤中所含硫在燃烧时会生成SO2
要有适当过量的空气;燃料与空气要有足够大的接触面积
练习:如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
(1)实验中观察到的现象是______。
(2)产生上述现象的原因是______。
(3)写出有关反应的离子方程式.
(4)由实验推知,MgCl2和H2的总能量 (填“大于、“小于”、“等于”)镁片和盐酸的总能量.
写出下列反应的热化学方程式。
(1)1mol硫粉完全燃烧生成二氧化硫气体,放出296kJ热量
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ
(3)10g CaCO3分解吸收热量17.56kJ
(4) 4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是两种原子间形成1mol化学键时释放的能量或断开1mol化学键时所吸收的能量。现提供以下化学键的键能(kJ/mol)P-P:198
P-O:360 O=O:498 P=O:585
试根据这些数据,计算该反应是——反应
P4(白磷)(g) + 5O2(g) = P4O10(g)
(提示:白磷是正四面体型的分子,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外每个磷原子又以双键结合一个氧原子)
练习2
则(1)化学键断裂时需要吸收能量。吸收总能量为:6×198kJ/mol+5×498kJ/mol=3678kJ,
(2)化学键形成时需要释放能量。释放总能量为:12×360kJ/mol+4×585kJ/mol=6660kJ,
(3)计算反应中热量的变化:
6660kJ-3678kJ=2982kJ
3、下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量的大小决定了化学反应是放热还是吸热
D.吸热反应在加热条件下才能发生反应
C
4、判断:
(1)加热的反应一定是吸热反应
(2)一个反应是吸热或放热与反应条件
没有直接联系,与反应物与生成物
的总能量的相对大小有关。
(3)化学反应中的能量变化都表现为热
能变化.
已知H-H 键能为436kJ/mol,Cl-Cl键能为247kJ/mol,H-Cl键能为431kJ/mol,
计算反应H2(g) + Cl2(g) =2HCl(g)的 △H
练习1:
△H=反应物的总键能-生成物的总键能
△H=(1×436kJ/mol+1×247kJ/mol)- 431kJ/mol×2
=—179kJ/mol
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是两种原子间形成1mol化学键时释放的能量或断开1mol化学键时所吸收的能量。现提供以下化学键的键能(kJ/mol)P-P:198
P-O:360 O=O:498 P=O:585
试根据这些数据,计算该反应是——反应
P4(白磷)(g) + 5O2(g) = P4O10(g)
(提示:白磷是正四面体型的分子,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外每个磷原子又以双键结合一个氧原子)
练习2
△H=反应物的总键能-生成物的总键能
△H=(6×198kJ/mol+5×498kJ/mol)-
(12×360kJ/mol+4×585kJ/mol)
△H=-2982kJ/mol
练习1
关于吸热反应和放热反应,下列说法错误的是( )
A.需要加热才能进行的化学反应一定是吸热反应
B.放热反应在常温下一定能发生
C.吸热反应在常温下不一定不能发生
D.反应物的总能量高于生成物的总能量时,发生放热反应
AB
作业、依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
_____________________________________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
(1) 4g硫粉在氧气中完全燃烧生成气体放出热量37kJ
(2) 9g铝和氯气完全反应生成固体放出热量274.2kJ
(3) 10g碳酸钙完全分解吸收热量17.56kJ
(4) 10g乙烷在氧气中完全燃烧生成液态水放出热量
520.3kJ
(5) 标况下2LCH4在空气中完全燃烧生成CO2和水放出热
量 79.5kJ
(6)0.3mol气态乙硼烷(B2H6)在氧气中完全燃烧生成固
态三氧化二硼和液态水放出热量649.5kJ
(7) 1molH2断键吸收436KJ热量,1mol Cl2断键吸收
243KJ热量,1moHCl断键吸收431KJ热量.
(8) 0.4mol液体肼(N2H4)与液体双氧水生成氮气和水蒸
气放出热量256.652kj
(9) mg甲烷完全燃烧生成液态水和0.5molCO2放出热量
445kJ
