河北省磁县一中苏教版化学必修二专题二第三单元 化学能与电能的转化 课件(33张ppt)
文档属性
| 名称 | 河北省磁县一中苏教版化学必修二专题二第三单元 化学能与电能的转化 课件(33张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-06-11 09:43:17 | ||
图片预览











文档简介
(共33张PPT)
电能
原电池
电解
化学能
(放电)
(充电)
氧化还原反应
氧化还原反应是电化学的基本反应原理
化学能 电能
原电池
生活中的电池
普通干电池
手机电池
钮扣电池
笔记本电脑
专用电池
摄像机
专用电池
“神六”用
太阳能电池
我国自主研发的燃料电池车
学习目标:
1.掌握原电池的工作原理
会书写电极反应式
2.掌握原电池的构成条件
会判断原电池及正负极
实验 现象 结论或解释
实验1
实验2
实验3
实验4
锌片上有气泡
锌与稀硫酸反应生成氢气
铜与硫酸不反应
铜片上无气泡
铜片上有气泡
电流计指针
偏转铜片上
有气泡
导线中有电流通过
同上
同上
问题探究
(1)铜片上的气体是什么?
(2)这种气体是怎么产生的吗?
( 3 )若你认为该气体是氢气,
氢离子转变为氢气时所需要的电子从何而来?
原电池实质:氧化还原反应。
这一现象早在1799年就被意大利物理学家伏打捕捉并加以研究,发明世界上第一个电池-----伏打电池,即Zn—Cu原电池(电解液用的是盐水)。后人沿着伏打的足迹继续前进,去发明各种电池,有人失败了,有人成功了,经过多少代人的努力,才有了今天我们使用的各种各样的电池。
Zn – 2e- == Zn2+
2H+ + 2e- == H2
Zn + 2H+ == Zn2+ + H2
负极:
正极:
总反应:
电极反应式:
*
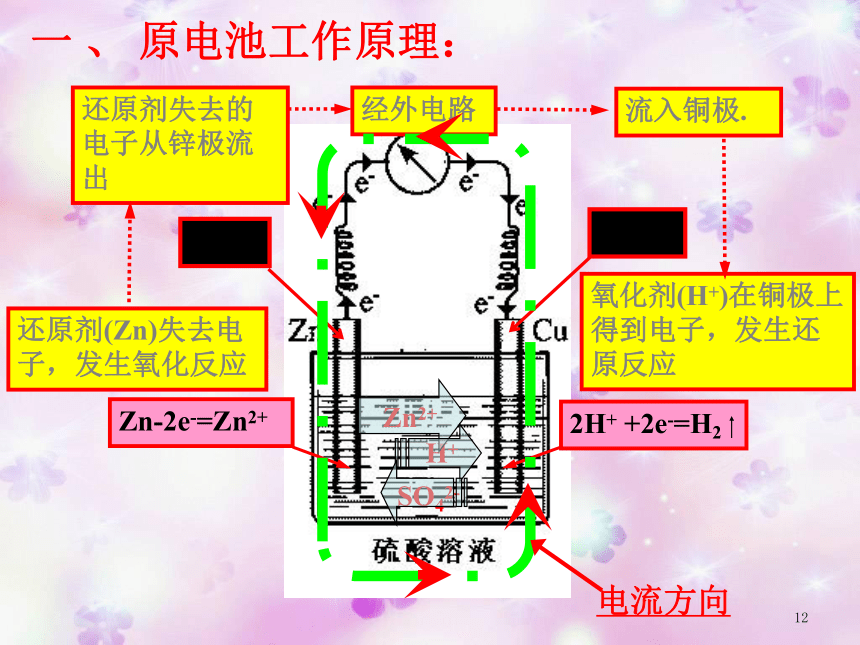
Zn-2e-=Zn2+
2H+ +2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
一 、 原电池工作原理:
较活泼的一极:
较不活泼的一极:
负极( )
正极( )
一般情况下:
负极:
正极:
电子流 的一极, 电子,发生 反应
电子流 的一极, 电子,发生 反应
失
氧化
出
得
还原
入
Zn
Cu
电子流向:电子由电池的___极沿导线流向___极
负
正
电解质溶液中离子移动方向: 阳离子定向移动到 __极,阴离子定向移动到__极
正
负
Cu
Zn
稀硫酸
稀硫酸
Zn
Zn + 2H+ == Zn2+ + H2
Zn + 2H+ == Zn2+ + H2
观察与比较
总:
原电池与普通的氧化还原反应最大不同是:
氧化反应(负极)、还原反应(正极)分开进行。(两个半反应)
其次,速率大
Cu
Zn
稀硫酸
Zn + 2H+ == Zn2+ + H2
Zn + 2H+ == Zn2+ + H2
观察与比较
总:
C
Zn
稀硫酸
总:
负
负
正
正
本质:
负极和电解质溶液发生氧化还原反应,正极被保护
实验探究
形成条件一:活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属或石墨等
二、 原电池的构成条件:
形成条件二:电极需插进电解质溶液中
实验探究
形成条件三:必须形成闭合回路
实验探究
形成条件四:必须存在自发的氧化还原反应
实验探究
(1) 有活泼性不同的两个电极(金属、石墨)
(2) 电解质溶液
(3)形成闭合回路
( 4 ) 自发进行的氧化还原反应。
二、 原电池的构成条件:
[回应故事情境] 思考:
讲的故事中贵妇人经常头痛的原因是什么?如何医治?
铁
棒
铜
棒
1、原电池的判断
2、正负极的判断
Zn
Fe
稀硫酸
Cu
Ag
稀硫酸
Cu
Zn
蔗糖溶液
Cu
Zn
稀硫酸
C
Zn
稀硫酸
Cu
Zn
稀硫酸
思考:下列哪些可以形成原电池
下列装置哪些可以形成原电池 ( )
A
A
A
A
A
A
Zn Cu
Fe C(石墨)
Zn Zn
Fe 陶瓷
Fe Cu
Si C(石墨)
CuSO4 溶液 稀H2SO4 稀H2SO4
A B C D
稀H2SO4 CuSO4溶液 酒精 稀H2SO4
E F G H
ABCD
浸有稀硫酸的棉花团
生铁
试一试
1、
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑤
④
(∨)
(∨)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e- =Zn2+
2H++2e- =H2↑
Zn+2H+=Zn2++H2↑
Fe-2e - =Fe2+
Cu2++2e- =Cu
Fe+Cu2+=Fe2++Cu
正负极的判断
负极
正极
失
e-
得
电流
阴离子
阳离子
发生氧化反应
发生还原反应
总结:原电池中正、负极的判断方法有哪些?
原理
(活泼性的金属一般为负极)、
电流的方向、
金属的活泼性
电子的流向、
阴阳离子的移动方向、
氧化还原反应、
现象
1、 X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A X>Y>Z B X>Z>Y
C Y>X>Z D Y>Z>X
C
2、 ① ② ③ ④ 四种金属, ① ②形成原电池时,外电路电流② ①; ① ③ 形成原电池时, ③为正极; ② ④形成原电池时, ②上有气泡冒出; ③ ④形成原电池时, ③的质量减小,四种金属活动性由大到小的是 ( )
① ③ ④ ②
请结合组成原电池的条件,将氧化还原反应:
Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。
1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: .
电能
原电池
电解
化学能
(放电)
(充电)
氧化还原反应
氧化还原反应是电化学的基本反应原理
化学能 电能
原电池
生活中的电池
普通干电池
手机电池
钮扣电池
笔记本电脑
专用电池
摄像机
专用电池
“神六”用
太阳能电池
我国自主研发的燃料电池车
学习目标:
1.掌握原电池的工作原理
会书写电极反应式
2.掌握原电池的构成条件
会判断原电池及正负极
实验 现象 结论或解释
实验1
实验2
实验3
实验4
锌片上有气泡
锌与稀硫酸反应生成氢气
铜与硫酸不反应
铜片上无气泡
铜片上有气泡
电流计指针
偏转铜片上
有气泡
导线中有电流通过
同上
同上
问题探究
(1)铜片上的气体是什么?
(2)这种气体是怎么产生的吗?
( 3 )若你认为该气体是氢气,
氢离子转变为氢气时所需要的电子从何而来?
原电池实质:氧化还原反应。
这一现象早在1799年就被意大利物理学家伏打捕捉并加以研究,发明世界上第一个电池-----伏打电池,即Zn—Cu原电池(电解液用的是盐水)。后人沿着伏打的足迹继续前进,去发明各种电池,有人失败了,有人成功了,经过多少代人的努力,才有了今天我们使用的各种各样的电池。
Zn – 2e- == Zn2+
2H+ + 2e- == H2
Zn + 2H+ == Zn2+ + H2
负极:
正极:
总反应:
电极反应式:
*
Zn-2e-=Zn2+
2H+ +2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
一 、 原电池工作原理:
较活泼的一极:
较不活泼的一极:
负极( )
正极( )
一般情况下:
负极:
正极:
电子流 的一极, 电子,发生 反应
电子流 的一极, 电子,发生 反应
失
氧化
出
得
还原
入
Zn
Cu
电子流向:电子由电池的___极沿导线流向___极
负
正
电解质溶液中离子移动方向: 阳离子定向移动到 __极,阴离子定向移动到__极
正
负
Cu
Zn
稀硫酸
稀硫酸
Zn
Zn + 2H+ == Zn2+ + H2
Zn + 2H+ == Zn2+ + H2
观察与比较
总:
原电池与普通的氧化还原反应最大不同是:
氧化反应(负极)、还原反应(正极)分开进行。(两个半反应)
其次,速率大
Cu
Zn
稀硫酸
Zn + 2H+ == Zn2+ + H2
Zn + 2H+ == Zn2+ + H2
观察与比较
总:
C
Zn
稀硫酸
总:
负
负
正
正
本质:
负极和电解质溶液发生氧化还原反应,正极被保护
实验探究
形成条件一:活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属或石墨等
二、 原电池的构成条件:
形成条件二:电极需插进电解质溶液中
实验探究
形成条件三:必须形成闭合回路
实验探究
形成条件四:必须存在自发的氧化还原反应
实验探究
(1) 有活泼性不同的两个电极(金属、石墨)
(2) 电解质溶液
(3)形成闭合回路
( 4 ) 自发进行的氧化还原反应。
二、 原电池的构成条件:
[回应故事情境] 思考:
讲的故事中贵妇人经常头痛的原因是什么?如何医治?
铁
棒
铜
棒
1、原电池的判断
2、正负极的判断
Zn
Fe
稀硫酸
Cu
Ag
稀硫酸
Cu
Zn
蔗糖溶液
Cu
Zn
稀硫酸
C
Zn
稀硫酸
Cu
Zn
稀硫酸
思考:下列哪些可以形成原电池
下列装置哪些可以形成原电池 ( )
A
A
A
A
A
A
Zn Cu
Fe C(石墨)
Zn Zn
Fe 陶瓷
Fe Cu
Si C(石墨)
CuSO4 溶液 稀H2SO4 稀H2SO4
A B C D
稀H2SO4 CuSO4溶液 酒精 稀H2SO4
E F G H
ABCD
浸有稀硫酸的棉花团
生铁
试一试
1、
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑤
④
(∨)
(∨)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e- =Zn2+
2H++2e- =H2↑
Zn+2H+=Zn2++H2↑
Fe-2e - =Fe2+
Cu2++2e- =Cu
Fe+Cu2+=Fe2++Cu
正负极的判断
负极
正极
失
e-
得
电流
阴离子
阳离子
发生氧化反应
发生还原反应
总结:原电池中正、负极的判断方法有哪些?
原理
(活泼性的金属一般为负极)、
电流的方向、
金属的活泼性
电子的流向、
阴阳离子的移动方向、
氧化还原反应、
现象
1、 X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A X>Y>Z B X>Z>Y
C Y>X>Z D Y>Z>X
C
2、 ① ② ③ ④ 四种金属, ① ②形成原电池时,外电路电流② ①; ① ③ 形成原电池时, ③为正极; ② ④形成原电池时, ②上有气泡冒出; ③ ④形成原电池时, ③的质量减小,四种金属活动性由大到小的是 ( )
① ③ ④ ②
请结合组成原电池的条件,将氧化还原反应:
Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。
1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: .
