6.1.3 常见化学电池 课件(共43张PPT含视频) 高中化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.3 常见化学电池 课件(共43张PPT含视频) 高中化学人教版(2019)必修第二册 |  | |
| 格式 | zip | ||
| 文件大小 | 16.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 08:16:54 | ||
图片预览










文档简介
(共43张PPT)
第3课时 常见化学电池
第六章 第一节 化学反应与能量变化
燃料电池
干电池
原电池
系列
锂离子电池
铅酸蓄电池
(一次电池)
(二次电池)
(二次电池)
一、化学电池的分类
一次电池(干电池):电池消耗到一定程度,就不能使用;
二次电池(充电电池或蓄电池):放电后可以再充电重新使用;
燃料电池:一种将燃料和氧化剂的化学能直接转换成电能的化学电池。
一、干电池(一次性电池)
电极:Zn为负极,碳棒为正极
电解液:NH4Cl、ZnCl2和淀粉糊
另有黑色的MnO2粉末,吸收正极产生的H2,
防止产生极化现象。
电极方程式:
负极(Zn):Zn-2e-=Zn2+
正极(C):2MnO2 + 2NH4+ + 2e- = Mn2O3+2NH3+H2O
1 (酸性)锌锰干电池中
特点:放电后不能充电,便于携带,价格低
总反应:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
2、碱性锌锰干电池
随着用电器朝着小型化、多
功能化发展的要求,对电池的发
展也提出了小型化、多功能化发
展的要求。
体积小、性能好的碱性锌-锰电池应运而生。
电解液: 酸性NH4Cl→碱性KOH(离子导电性更好)
负极:锌片→锌粉(反应面积成倍增长,使放电电流大幅度提高)
优点:比能量和储存时间有所提高,适用于大电流和连续放电
总反应:Zn+2MnO2+2H2O+2OH-=MnO(OH)+Zn(OH)2
负极(Zn):Zn-2e-+2OH-=Zn(OH)2
正极(2MnO2):2MnO2+2H2O+2e-=2MnO(OH)+2OH-
碱性电池是个人音响、照相机等地首选电源。
电极方程式:
练习.日常所用干电池的电极分别为石墨棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为Zn-2e-===Zn2+,2NH4++2e-===2NH3 +H2↑(NH3与Zn2+能反应生成一种稳定的物质)。根据上述判断,下列结论正确的是( )
①锌为负极,石墨为正极 ②干电池可以实现化学能向电能的转化和电能向化学能的转化 ③工作时,电子由石墨极经过外电路流向锌极 ④长时间连续使用时,内装糊状物可能流出而腐蚀用电器
A.①③ B.②③ C.③④ D.①④
D
解析 由负极失电子发生氧化反应,正极得电子发生还原反应,可判断出①正确;干电池只能实现化学能向电能的转化,②错误;在外电路中,电子从负极流向正极,③错误;长时间连续使用该电池,由于锌皮慢慢溶解而破损,且MnO2不断吸收H2而产生H2O,糊状物也越来越稀,容易流出而腐蚀用电器,④正确。
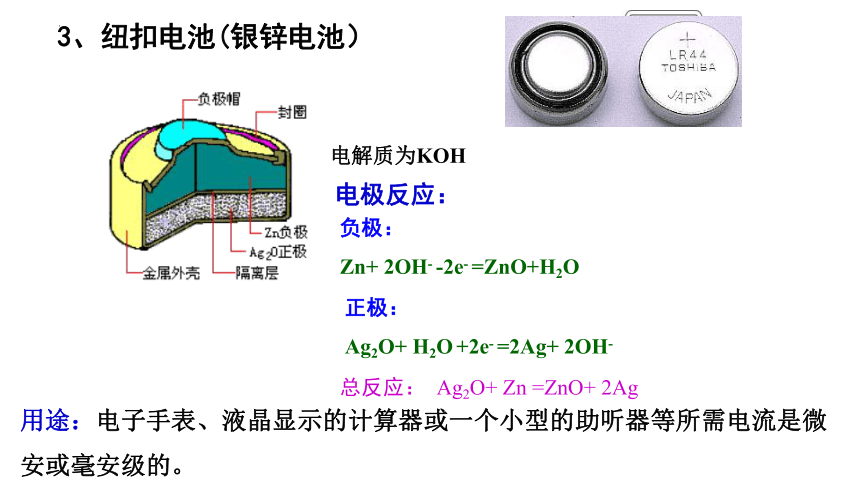
3、纽扣电池(银锌电池)
负极:
Zn+ 2OH- -2e- =ZnO+H2O
正极:
Ag2O+ H2O +2e- =2Ag+ 2OH-
总反应: Ag2O+ Zn =ZnO+ 2Ag
电极反应:
用途:电子手表、液晶显示的计算器或一个小型的助听器等所需电流是微安或毫安级的。
电解质为KOH
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O===2Ag+Zn(OH)2。下列说法中不正确的是( )
A.原电池放电时,负极上发生反应的物质是Zn
B.负极发生的反应是Zn+2OH--2e-===Zn(OH)2
C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强
D.溶液中的OH-向正极移动,K+、H+向负极移动
解析 根据总反应Ag2O+Zn+H2O===2Ag+Zn(OH)2,分析各物质化合价发生的变化可知,Zn在负极上反应,Ag2O在正极上反应,电解质溶液为KOH溶液,所以负极反应式为Zn+2OH--2e-===Zn(OH)2,正极反应式为Ag2O+2e-+H2O===2Ag+2OH-,这样,在负极区因OH-被消耗,碱性减弱,溶液的OH-定向移动到负极,正极区生成OH-,碱性增强。
D
4、锂二氧化锰电池
以锂为负极的非水电解质电池有几十种,其中性能最好、最有发展前途的是锂一二氧化锰非水电解质电池,这种电池以片状金属及为负极,电解活性MnO2作正极,高氯酸及溶于碳酸丙烯酯和二甲氧基乙烷的混合有机溶剂作为电解质溶液 :
负极:Li - e -= Li+
正极:MnO2 + e- + Li+ = LiMnO2
总反应: Li+ MnO2= LiMnO2
1.锂离子电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂离子电池,某种锂离子电池的总反应式为Li+MnO2===LiMnO2,下列说法正确的是( )
A.Li是正极,电极反应式为Li-e-===Li+
B.Li是负极,电极反应式为Li-e-===Li+
C.Li是负极,电极反应式为MnO2+e-===MnO2-
D.Li是负极,电极反应式为Li-2e-===Li2+
B
解析 根据总反应式可判断Li被氧化,为负极材料,其失电子成为
Li+,正极放电的为MnO2。
三、二次电池也叫充电电池
化学能
放电
充电
电能
用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还广泛用于国防、生产、生活等领域。
铅蓄电池:最早使用的充电电池。
1、铅蓄电池
特点:铅蓄电池的电压稳定,使用方便安全可靠,可再次充电使用。
铅蓄电池可放电亦可充电,它是用硬橡胶或透明塑料制成方形外壳,在正极板上有一层棕褐色的 ,负极板是海绵状的 ,两极均浸入 溶液中,且两极间用微孔橡胶或微孔塑料隔开。
PbO2
金属铅
硫酸
电极反应
负极:
正极:
总电极:
Pb+ -2e- SO42-=PbSO4
PbO2+2e-+4H++SO42- = PbSO4+2H2O
Pb+ PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
2、镍镉电池
特点:体积小,便于携带。可重复使用500
次以上。寿命比铅蓄电池长。
镉有致癌作用,有被镍氢电池取代的趋势。
镍
镉
电
池
电极反应(KOH为电解液)
用途:广泛用于收录机、无线对讲机、电子闪光灯、
电动剃须刀等。
负极: Cd - 2e- 2OH- = Cd(OH)2
正极: NiO(OH)+e-+ H2O = Ni(OH)2 + OH-
2NiO(OH) + 2H2O + Cd 2Ni(OH)2+ Cd(OH)2
放电
充电
H2+NiO(OH) Ni(OH)2
放电
充电
3、镍氢电池
总电极
负极:
正极:
H2 -2e-+2OH— = 2H2O
2NiO(OH) +2e- +2H2O = 2Ni(OH)2 +2OH-
锂电池
锂电池是新一代可充电的绿色电池,已成为笔记本电脑、可移动电话、摄象机等低功耗电器的主流电源。
H2 + 2NiO(OH) 2Ni(OH)2
放电
充电
锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
4、钴酸锂电池:
钴酸锂电池结构稳定、容量比高、综合性能突出、但是其安全性差、成本非常高,主要用于中小型号电芯,广泛应用于笔记本电脑、手机、MP3/4等小型电子设备中,标称电压3.7V。
层状LiCoO2中锂离子在CoO2原子密实层的层间进行二维运动
充电时,锂离子从LiCoO2晶胞中脱出,其中的离子CO3+氧化为CO4+;放电时,锂离子则嵌入LiCoO2晶胞中,其中的Co4+变成CO3+。
电池总反应:
LixCy + Li1-xCoO2 LiCoO2+Cy
负极上发生的反应为
LixCy -Xe- =xLi++Cy
正极上发生的反应为
Li1-xCoO2+xLi++Xe- = Li1-xCoO2
放电
充电
1.(2022春·云南曲靖·高二校考阶段练习)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e =3Li2S4B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 gC.石墨烯的作用主要是提高电极a的导电性D.电池充电时间越长,电池中Li2S2的量越多
D
2.(2016·四川·高考真题)某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是( )A.放电时,Li+在电解质中由负极向正极迁移B.放电时,负极的电极反应式为LixC6-xe-= xLi++ C6C.充电时,若转移1mole-,石墨C6电极将增重7xgD.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+
C
四、发展中的燃料电池
它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。
(例如:H2和O2的燃料电池,CH4和O2的燃料电池)
小型高性能燃料电池
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
知识讲授
1、氢氧燃料电池
氢氧燃料电池是一种高效低污染的新型电池,主要用于航天领域。它的电极材料一般为铂电极,活性炭电极,
①电解质溶液一般为40%的KOH溶液。
负极:
正极:
放电总反应式:
H2 -2e- 2OH- =2H2O
O2+ 4e- + 2H2O= 4OH-
2H2 + O2 = 2H2O
②若电解质溶液为稀H2SO4
负极:
正极:
放电总反应式:
H2 - 2e- = 2H+
O2+ 4e- +4H+ = 2H2O
2H2 + O2 = 2H2O
③固体燃料电池
介质 电池反应: 2H2 +O2 = 2H2O
负极
正极
负极
正极
H2 - 2e- = 2H+
O2 + 4e-+ 4H+ = 2H2O
2H2 - 4e- +2O2-= 2H2O
O2 + 4e-= 2O2-
碱性或者中性
酸性环境
2、甲烷氧气燃料电池
①该电池用铂片插入H2SO4溶液中作电极,在两极上分别通甲烷和氧气
负极:
正极:
放电总反应式:
O2+4e- +4H+ = 2H2O
CH4+ 2O2 =CO2 +2H2O
CH4- 8e- +2H2O =CO2 +8H+
②该电池用铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气
负极:
正极:
放电总反应式:
CH4-8e-+10OH- =CO32—+7H2O
O2+4e-+2H2O= 4OH—
CH4+ 2O2+2KOH =K2CO3 +3H2O
①酸性电解质(H2SO4溶液为例)
3 甲醇燃料电池
总反应: 2CH3OH+ 3O2 == 2CO2 + 4H2O
正极:O2+4e- +4H + == 2H 2O
负极:CH3OH– 6e-+H 2O == 6H+ +CO2
②碱性电解质(KOH溶液为例)
总反应式:2CH3OH+ 3O2 +4KOH== 2K2CO3 + 6H2O
正极的电极反应式为:O2+ 4e- + 2H2O==4OH–
负极的电极反应式为:CH3OH - 6e- + 8OH- == CO32-+6H2O
4、 空气海水电池(①铝为负极材料)
负极:
正极:
放电总反应式:
Al-3e- +3OH- = Al( OH)3
O2+4e- +2H2O= 4OH—
4Al + 3O2+6H2O= 4Al( OH)3
②铁为负极材料
负极:
正极:
放电总反应式:
Fe-2e- +2OH- = Fe( OH)2
O2+4e- +2H2O= 4OH—
2Fe +O2+2H2O= 2Fe( OH)2
但是氢氧化亚铁在空气中不稳定,会进一步被氧化为氢氧化铁
4Fe(OH)2 +O2 +2H2O==4Fe(OH)3
其他电池
空气电池
一节电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害!
一粒纽扣电池可污染60万升水,相当于一个人一生的饮水量 !
垃圾分类,电池回收,环境保护,从你我做起!
练习应用
1.氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是( )
2.下列说法中正确的是( )
①燃料电池的反应物可不储存在电池的内部 ②锌锰干电池是一次电池,铅蓄电池是二次电池 ③锂电池是新一代可充电电池 ④燃料电池作为汽车驱动能源已研制成功
A.②③④ B.①②③④ C.①②③ D.①③④
B
解析 燃料电池与干电池或蓄电池的主要差别就在于反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂等。
3.下列说法正确的是( )
A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极材料是Pb,负极材料是PbO2
解析 碱性锌锰干电池是一次电池,燃料电池是一种高效且不会污染环境的新型电池,铅蓄电池放电的时候正极材料是PbO2,负极材料是Pb。
C
发展中的化学电源
一次性电池——干电池
二次电池(充电电池)
燃料电池
普通锌锰电池
碱性锌锰电池
铅蓄电池
镍镉充电电池
锂电池
氢氧燃料
CH4燃料电池
小结
第3课时 常见化学电池
第六章 第一节 化学反应与能量变化
燃料电池
干电池
原电池
系列
锂离子电池
铅酸蓄电池
(一次电池)
(二次电池)
(二次电池)
一、化学电池的分类
一次电池(干电池):电池消耗到一定程度,就不能使用;
二次电池(充电电池或蓄电池):放电后可以再充电重新使用;
燃料电池:一种将燃料和氧化剂的化学能直接转换成电能的化学电池。
一、干电池(一次性电池)
电极:Zn为负极,碳棒为正极
电解液:NH4Cl、ZnCl2和淀粉糊
另有黑色的MnO2粉末,吸收正极产生的H2,
防止产生极化现象。
电极方程式:
负极(Zn):Zn-2e-=Zn2+
正极(C):2MnO2 + 2NH4+ + 2e- = Mn2O3+2NH3+H2O
1 (酸性)锌锰干电池中
特点:放电后不能充电,便于携带,价格低
总反应:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
2、碱性锌锰干电池
随着用电器朝着小型化、多
功能化发展的要求,对电池的发
展也提出了小型化、多功能化发
展的要求。
体积小、性能好的碱性锌-锰电池应运而生。
电解液: 酸性NH4Cl→碱性KOH(离子导电性更好)
负极:锌片→锌粉(反应面积成倍增长,使放电电流大幅度提高)
优点:比能量和储存时间有所提高,适用于大电流和连续放电
总反应:Zn+2MnO2+2H2O+2OH-=MnO(OH)+Zn(OH)2
负极(Zn):Zn-2e-+2OH-=Zn(OH)2
正极(2MnO2):2MnO2+2H2O+2e-=2MnO(OH)+2OH-
碱性电池是个人音响、照相机等地首选电源。
电极方程式:
练习.日常所用干电池的电极分别为石墨棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为Zn-2e-===Zn2+,2NH4++2e-===2NH3 +H2↑(NH3与Zn2+能反应生成一种稳定的物质)。根据上述判断,下列结论正确的是( )
①锌为负极,石墨为正极 ②干电池可以实现化学能向电能的转化和电能向化学能的转化 ③工作时,电子由石墨极经过外电路流向锌极 ④长时间连续使用时,内装糊状物可能流出而腐蚀用电器
A.①③ B.②③ C.③④ D.①④
D
解析 由负极失电子发生氧化反应,正极得电子发生还原反应,可判断出①正确;干电池只能实现化学能向电能的转化,②错误;在外电路中,电子从负极流向正极,③错误;长时间连续使用该电池,由于锌皮慢慢溶解而破损,且MnO2不断吸收H2而产生H2O,糊状物也越来越稀,容易流出而腐蚀用电器,④正确。
3、纽扣电池(银锌电池)
负极:
Zn+ 2OH- -2e- =ZnO+H2O
正极:
Ag2O+ H2O +2e- =2Ag+ 2OH-
总反应: Ag2O+ Zn =ZnO+ 2Ag
电极反应:
用途:电子手表、液晶显示的计算器或一个小型的助听器等所需电流是微安或毫安级的。
电解质为KOH
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O===2Ag+Zn(OH)2。下列说法中不正确的是( )
A.原电池放电时,负极上发生反应的物质是Zn
B.负极发生的反应是Zn+2OH--2e-===Zn(OH)2
C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强
D.溶液中的OH-向正极移动,K+、H+向负极移动
解析 根据总反应Ag2O+Zn+H2O===2Ag+Zn(OH)2,分析各物质化合价发生的变化可知,Zn在负极上反应,Ag2O在正极上反应,电解质溶液为KOH溶液,所以负极反应式为Zn+2OH--2e-===Zn(OH)2,正极反应式为Ag2O+2e-+H2O===2Ag+2OH-,这样,在负极区因OH-被消耗,碱性减弱,溶液的OH-定向移动到负极,正极区生成OH-,碱性增强。
D
4、锂二氧化锰电池
以锂为负极的非水电解质电池有几十种,其中性能最好、最有发展前途的是锂一二氧化锰非水电解质电池,这种电池以片状金属及为负极,电解活性MnO2作正极,高氯酸及溶于碳酸丙烯酯和二甲氧基乙烷的混合有机溶剂作为电解质溶液 :
负极:Li - e -= Li+
正极:MnO2 + e- + Li+ = LiMnO2
总反应: Li+ MnO2= LiMnO2
1.锂离子电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂离子电池,某种锂离子电池的总反应式为Li+MnO2===LiMnO2,下列说法正确的是( )
A.Li是正极,电极反应式为Li-e-===Li+
B.Li是负极,电极反应式为Li-e-===Li+
C.Li是负极,电极反应式为MnO2+e-===MnO2-
D.Li是负极,电极反应式为Li-2e-===Li2+
B
解析 根据总反应式可判断Li被氧化,为负极材料,其失电子成为
Li+,正极放电的为MnO2。
三、二次电池也叫充电电池
化学能
放电
充电
电能
用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还广泛用于国防、生产、生活等领域。
铅蓄电池:最早使用的充电电池。
1、铅蓄电池
特点:铅蓄电池的电压稳定,使用方便安全可靠,可再次充电使用。
铅蓄电池可放电亦可充电,它是用硬橡胶或透明塑料制成方形外壳,在正极板上有一层棕褐色的 ,负极板是海绵状的 ,两极均浸入 溶液中,且两极间用微孔橡胶或微孔塑料隔开。
PbO2
金属铅
硫酸
电极反应
负极:
正极:
总电极:
Pb+ -2e- SO42-=PbSO4
PbO2+2e-+4H++SO42- = PbSO4+2H2O
Pb+ PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
2、镍镉电池
特点:体积小,便于携带。可重复使用500
次以上。寿命比铅蓄电池长。
镉有致癌作用,有被镍氢电池取代的趋势。
镍
镉
电
池
电极反应(KOH为电解液)
用途:广泛用于收录机、无线对讲机、电子闪光灯、
电动剃须刀等。
负极: Cd - 2e- 2OH- = Cd(OH)2
正极: NiO(OH)+e-+ H2O = Ni(OH)2 + OH-
2NiO(OH) + 2H2O + Cd 2Ni(OH)2+ Cd(OH)2
放电
充电
H2+NiO(OH) Ni(OH)2
放电
充电
3、镍氢电池
总电极
负极:
正极:
H2 -2e-+2OH— = 2H2O
2NiO(OH) +2e- +2H2O = 2Ni(OH)2 +2OH-
锂电池
锂电池是新一代可充电的绿色电池,已成为笔记本电脑、可移动电话、摄象机等低功耗电器的主流电源。
H2 + 2NiO(OH) 2Ni(OH)2
放电
充电
锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
4、钴酸锂电池:
钴酸锂电池结构稳定、容量比高、综合性能突出、但是其安全性差、成本非常高,主要用于中小型号电芯,广泛应用于笔记本电脑、手机、MP3/4等小型电子设备中,标称电压3.7V。
层状LiCoO2中锂离子在CoO2原子密实层的层间进行二维运动
充电时,锂离子从LiCoO2晶胞中脱出,其中的离子CO3+氧化为CO4+;放电时,锂离子则嵌入LiCoO2晶胞中,其中的Co4+变成CO3+。
电池总反应:
LixCy + Li1-xCoO2 LiCoO2+Cy
负极上发生的反应为
LixCy -Xe- =xLi++Cy
正极上发生的反应为
Li1-xCoO2+xLi++Xe- = Li1-xCoO2
放电
充电
1.(2022春·云南曲靖·高二校考阶段练习)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e =3Li2S4B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 gC.石墨烯的作用主要是提高电极a的导电性D.电池充电时间越长,电池中Li2S2的量越多
D
2.(2016·四川·高考真题)某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是( )A.放电时,Li+在电解质中由负极向正极迁移B.放电时,负极的电极反应式为LixC6-xe-= xLi++ C6C.充电时,若转移1mole-,石墨C6电极将增重7xgD.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+
C
四、发展中的燃料电池
它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。
(例如:H2和O2的燃料电池,CH4和O2的燃料电池)
小型高性能燃料电池
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
知识讲授
1、氢氧燃料电池
氢氧燃料电池是一种高效低污染的新型电池,主要用于航天领域。它的电极材料一般为铂电极,活性炭电极,
①电解质溶液一般为40%的KOH溶液。
负极:
正极:
放电总反应式:
H2 -2e- 2OH- =2H2O
O2+ 4e- + 2H2O= 4OH-
2H2 + O2 = 2H2O
②若电解质溶液为稀H2SO4
负极:
正极:
放电总反应式:
H2 - 2e- = 2H+
O2+ 4e- +4H+ = 2H2O
2H2 + O2 = 2H2O
③固体燃料电池
介质 电池反应: 2H2 +O2 = 2H2O
负极
正极
负极
正极
H2 - 2e- = 2H+
O2 + 4e-+ 4H+ = 2H2O
2H2 - 4e- +2O2-= 2H2O
O2 + 4e-= 2O2-
碱性或者中性
酸性环境
2、甲烷氧气燃料电池
①该电池用铂片插入H2SO4溶液中作电极,在两极上分别通甲烷和氧气
负极:
正极:
放电总反应式:
O2+4e- +4H+ = 2H2O
CH4+ 2O2 =CO2 +2H2O
CH4- 8e- +2H2O =CO2 +8H+
②该电池用铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气
负极:
正极:
放电总反应式:
CH4-8e-+10OH- =CO32—+7H2O
O2+4e-+2H2O= 4OH—
CH4+ 2O2+2KOH =K2CO3 +3H2O
①酸性电解质(H2SO4溶液为例)
3 甲醇燃料电池
总反应: 2CH3OH+ 3O2 == 2CO2 + 4H2O
正极:O2+4e- +4H + == 2H 2O
负极:CH3OH– 6e-+H 2O == 6H+ +CO2
②碱性电解质(KOH溶液为例)
总反应式:2CH3OH+ 3O2 +4KOH== 2K2CO3 + 6H2O
正极的电极反应式为:O2+ 4e- + 2H2O==4OH–
负极的电极反应式为:CH3OH - 6e- + 8OH- == CO32-+6H2O
4、 空气海水电池(①铝为负极材料)
负极:
正极:
放电总反应式:
Al-3e- +3OH- = Al( OH)3
O2+4e- +2H2O= 4OH—
4Al + 3O2+6H2O= 4Al( OH)3
②铁为负极材料
负极:
正极:
放电总反应式:
Fe-2e- +2OH- = Fe( OH)2
O2+4e- +2H2O= 4OH—
2Fe +O2+2H2O= 2Fe( OH)2
但是氢氧化亚铁在空气中不稳定,会进一步被氧化为氢氧化铁
4Fe(OH)2 +O2 +2H2O==4Fe(OH)3
其他电池
空气电池
一节电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害!
一粒纽扣电池可污染60万升水,相当于一个人一生的饮水量 !
垃圾分类,电池回收,环境保护,从你我做起!
练习应用
1.氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是( )
2.下列说法中正确的是( )
①燃料电池的反应物可不储存在电池的内部 ②锌锰干电池是一次电池,铅蓄电池是二次电池 ③锂电池是新一代可充电电池 ④燃料电池作为汽车驱动能源已研制成功
A.②③④ B.①②③④ C.①②③ D.①③④
B
解析 燃料电池与干电池或蓄电池的主要差别就在于反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂等。
3.下列说法正确的是( )
A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极材料是Pb,负极材料是PbO2
解析 碱性锌锰干电池是一次电池,燃料电池是一种高效且不会污染环境的新型电池,铅蓄电池放电的时候正极材料是PbO2,负极材料是Pb。
C
发展中的化学电源
一次性电池——干电池
二次电池(充电电池)
燃料电池
普通锌锰电池
碱性锌锰电池
铅蓄电池
镍镉充电电池
锂电池
氢氧燃料
CH4燃料电池
小结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
