第6章 第1节 第1课时 化学反应与热能 课件(共41张PPT) 高中化学人教版(2019)必修第二册
文档属性
| 名称 | 第6章 第1节 第1课时 化学反应与热能 课件(共41张PPT) 高中化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 08:19:51 | ||
图片预览










文档简介
(共41张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
第1课时 化学反应与热能
学习目标 核心素养
1.通过实验探究,了解化学反应与热能的关系。能够辨析放热反应和吸热反应。 2.了解化学反应体系能量改变与化学键的断裂和形成有关,从化学键的角度认识和解释化学反应的热效应。 宏观辨识与微观探析:
能分析物质化学变化和伴随发生的能量转化与物质微观结构之间的关系。
变化观念与平衡思想:
能认识到物质运动和变化是永恒的,能认识化学变化伴随着能量变化。
科学态度与社会责任:
能主动关注与环境保护、资源开发等有关的社会热点问题,形成与环境和谐共处、合理利用自然资源的观念。
700多年前,著名的意大利旅行家马可·波罗到过中国,看见中国人烧煤炼铁,这是他生平第一次看到煤做燃料,马可·波罗在他的游记里记载了这件新鲜事。书中写到,中国有一种黑色石头,能燃烧,着起火来像木柴一样,而且终夜不灭。现代科学可以这样解释,煤中含有大量的碳,燃烧时放出热能。你一定想知道,这种能量从何而来?它与化学物质和化学反应有什么关系?请随我一起走进教材学习化学反应与热能。
新知预习
一、化学反应与能量
1.实验探究
实 验 操 作 试管中加入2 mL 2 mol·L-1盐酸,并用温度计测量其温度,再向试管中放入打磨过的镁条 将20 g Ba(OH)2·8H2O晶体研细后与10 g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,玻璃片盖上烧杯
镁条逐渐溶解,有气泡产
生,温度计的示数升高
变凉
木片黏在烧杯上
放出热量
吸收热量
热量的释放和吸收
2.放热反应和吸热反应
(1)含义
①放热反应:__________的化学反应。
②吸热反应:__________的化学反应。
(2)实例
①放热反应
a.镁条、铝片与盐酸的反应;
b.木炭、氢气、甲烷等在氧气中的燃烧;
c.氢气与氯气的化合。
释放热量
吸收热量
②吸热反应
a.氢氧化钡与氯化铵的反应;
b.盐酸与碳酸氢钠的反应;
c.灼热的炭与二氧化碳的反应。
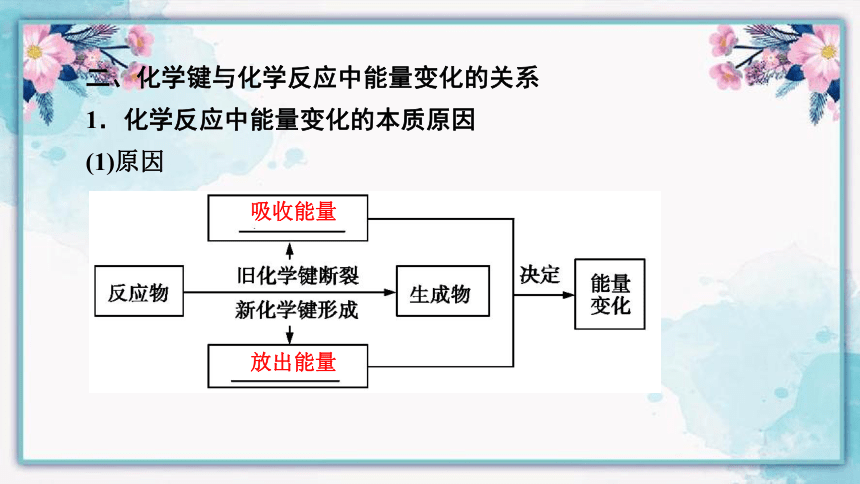
二、化学键与化学反应中能量变化的关系
1.化学反应中能量变化的本质原因
(1)原因
吸收能量
放出能量
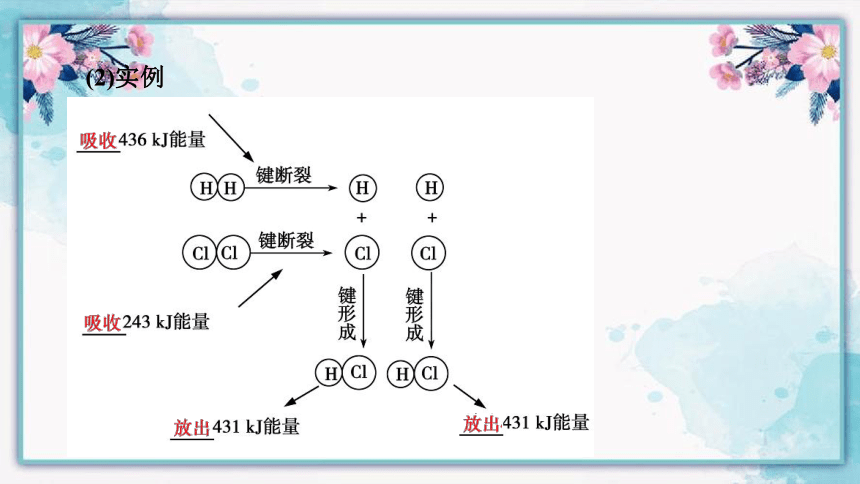
(2)实例
2.多角度分析化学反应的能量变化
分析角度 放热反应 吸热反应
微观 断键吸收的热量______成键放出的热量 断键吸收的热量______成键放出的热量
宏观 反应物的总能量______生成物的总能量 反应物的总能量______生成物的总能量
小于
大于
大于
小于
三、人类对能源的利用
1.利用的三个阶段
2.化石燃料利用过程中亟待解决的两方面问题
(1)其短期内不可再生,储量有限;
(2)煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
3.在燃料利用过程中,节能的主要环节
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能量利用率。
4.新能源
(1)特点:资源丰富、________________________。
(2)人们比较关注的新能源:______能、____能、地热能、海洋能和____能等。
可以再生,对环境无污染
太阳
风
氢
四、能源的多角度分类
分类依据 种类 举例
来源 来自太阳辐射的能量 太阳能、煤、石油、天然气、生物质能、风能
来自地球内部的能量 地热能、核能、水能
来自天体的引力能量 潮汐能
转换过程 一次能源 太阳能、煤、石油、天然气、生物质能、风能
二次能源 石油制品、煤气、电能
分类依据 种类 举例
利用历史 化石燃料 煤、石油、天然气
新能源 太阳能、风能、地热能、核能、氢能、生物质能
性质 可再生能源 太阳能、风能、水能、生物质能
不可再生能源 煤、石油、天然气、核能
应用体验
1.新能源的开发利用是人类社会可持续发展的重要课题。下列属于新能源的是( )
A.氢气 B.煤炭
C.天然气 D.风能
AD
2.下列变化过程符合如图所示能量变化的是( )
A.煅烧石灰石
B.水蒸气冷凝
C.烧碱固体溶于水
D.双氧水中加入少量二氧化锰
解析:根据图知该过程吸收能量,煅烧石灰石的过程吸收能量,A项正确;相同质量的物质具有的能量:水蒸气>水>冰,水蒸气冷凝放出能量,B项错误;烧碱固体溶于水放出能量,C项错误;双氧水分解生成H2O和O2,该过程放出能量,D项错误。
A
3.“节能和寻找清洁的新能源成为人类的必然选择。”下列说法不正确的是( )
A.化石燃料在短期内不可再生且其燃料会产生大气污染物,迫使人类节能和寻找新能源
B.提高燃料的燃烧效率是节能的措施之一
C.促进能源循环利用,有效提高能量利用率可达到节能的目的
D.太阳能、天然气、地热能、海洋能等都属于新能源
解析:天然气、煤、石油属于化石燃料,是不可再生的,不属于新能源,故D项错误。
D
要点归纳
知识点?
1.做实验时,吸热反应和放热反应都用到酒精灯,怎样判断该反应是吸热反应还是放热反应?放热反应加热的目的是什么?
提示:持续用酒精灯加热,撤掉酒精灯反应就停止的反应一般是吸热反应;开始用酒精灯加热,反应开始后,撤去酒精灯仍能继续反应的一般是放热反应。放热反应加热的目的一般是引发反应或加快反应速率。
放热反应与吸热反应的理解
问题探究
2.放热反应一定容易发生,吸热反应一定难发生吗?
提示:不一定。反应放热和吸热与反应的条件无关,有些放热反应必须加热才能发生,如木炭的燃烧;而有些吸热反应常温下就能发生,如Ba(OH)2·8H2O与NH4Cl的反应。
1.放热反应与吸热反应的比较
知识归纳总结
放热反应 吸热反应
定义 释放热量的化学反应 吸收热量的化学反应
形成 原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
与化学键强弱的关 系 生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
2.常见的放热反应和吸热反应
3.放热反应和吸热反应的判断方法
(1)根据反应物和生成物的总能量大小判断。
反应物的总能量大于生成物的总能量的反应为放热反应,反之为吸热反应。
(2)根据化学键断裂和形成时能量变化大小关系判断。
破坏反应物中化学键吸收的能量大于形成生成物中化学键放出的能量的反应为吸热反应,反之为放热反应。
(3)根据经验规律判断。
用常见吸热和放热的反应类型来判断。
4.化学反应遵循的两条基本规律
(1)质量守恒定律:自然界的物质发生转化时,总质量保持不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式的能量,但体系包含的总能量不变。
某反应的能量变化如图所示。则有关该反应的叙述正确的是( )
A.是吸热反应
B.生成物比反应物稳定
C.该反应一定是氧化还原反应
D.向外界放出的热量为(E2-E3)
典例1
典例剖析
B
解析:该反应的反应物能量高于生成物,是放热反应,故A错误;生成物能量低于反应物,所以生成物比反应物稳定,故B正确;该反应不一定是氧化还原反应,故C错误;向外界放出的热量为(E1-E3),故D错误。
1.对放热反应:A+B===C+D,以下说法一定正确的是(EA、EB、EC、ED分别表示物质A、B、C、D所具有的能量)( )
A.EA+EB>EC+ED
B.EA>EB+EC
C.EA>EB
D.EA+EB解析:反应物的总能量大于生成物的总能量的反应属放热反应,则有EA+EB>EC+ED,A正确。
A
素养应用
知识点?
利用化学键计算化学反应中的能量变化
问题探究
2.如图是1 mol氢气燃烧的能量变化图,试分析a、b表示的含义。
提示:化学反应发生时首先断裂反应物中的化学键,再形成生成物中的化学键,故a表示破坏1 mol H—H键、0.5 mol O===O键所吸收的能量,b表示形成2 mol H—O键所放出的能量。
1.化学键与能量变化的关系
知识归纳总结
根据如图所示的信息,下列叙述错误的是( )
典例2
典例剖析
B
解析:A项,对同一种化学键来说,断裂时吸收的能量与形成时放出的能量相等,正确;B项,H2在O2中燃烧为放热反应,错误;C项,ΔQ=Q(吸)-Q(放)=(436 kJ+249 kJ)-905 kJ=-220 kJ,说明该反应释放出220 kJ能量,正确;D项,放热反应的反应物总能量大于生成物总能量,正确。
2.SF6气体已有百年历史,它是法国两位化学家Moissan和Lebeau于1900年合成的人造惰性气体。六氟化硫具有良好的电气绝缘性能及优异的灭弧性能,国际上称为“气体绝缘开关设备”。SF6分子结构中只存在S—F键。已知:1 mol S(固体)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。
则S(s)+3F2(g)===SF6(g)(已知s表示固体,g表示气体)的能量变化为( )
A.放出1 780 kJ的能量
B.放出1 220 kJ的能量
C.放出450 kJ的能量
D.吸收430 kJ的能量
B
素养应用
解析:由题意得1 mol S(s)和3 mol F2(g)形成S原子和F原子共需要吸收能量=280 kJ+3×160 kJ=760 kJ,而生成1 mol SF6气体时需形成6 mol S—F键,共放出能量:6×330 kJ=1 980 kJ,因此该反应共放出的能量为1 980 kJ-760 kJ=1 220 kJ。
(5)已知H2和O2反应放热,且断开1 mol H—H键、1 mol O===O键、1 mol O—H键需吸收的能量分别为Q1 kJ、Q2 kJ、Q3 kJ,由此可以推知下列关系正确的是____(填编号)。
①Q1+Q2>Q3 ②Q1+Q2>2Q3
③2Q1+Q2<4Q3 ④2Q|+Q2<2Q3
③
第六章 化学反应与能量
第一节 化学反应与能量变化
第1课时 化学反应与热能
学习目标 核心素养
1.通过实验探究,了解化学反应与热能的关系。能够辨析放热反应和吸热反应。 2.了解化学反应体系能量改变与化学键的断裂和形成有关,从化学键的角度认识和解释化学反应的热效应。 宏观辨识与微观探析:
能分析物质化学变化和伴随发生的能量转化与物质微观结构之间的关系。
变化观念与平衡思想:
能认识到物质运动和变化是永恒的,能认识化学变化伴随着能量变化。
科学态度与社会责任:
能主动关注与环境保护、资源开发等有关的社会热点问题,形成与环境和谐共处、合理利用自然资源的观念。
700多年前,著名的意大利旅行家马可·波罗到过中国,看见中国人烧煤炼铁,这是他生平第一次看到煤做燃料,马可·波罗在他的游记里记载了这件新鲜事。书中写到,中国有一种黑色石头,能燃烧,着起火来像木柴一样,而且终夜不灭。现代科学可以这样解释,煤中含有大量的碳,燃烧时放出热能。你一定想知道,这种能量从何而来?它与化学物质和化学反应有什么关系?请随我一起走进教材学习化学反应与热能。
新知预习
一、化学反应与能量
1.实验探究
实 验 操 作 试管中加入2 mL 2 mol·L-1盐酸,并用温度计测量其温度,再向试管中放入打磨过的镁条 将20 g Ba(OH)2·8H2O晶体研细后与10 g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,玻璃片盖上烧杯
镁条逐渐溶解,有气泡产
生,温度计的示数升高
变凉
木片黏在烧杯上
放出热量
吸收热量
热量的释放和吸收
2.放热反应和吸热反应
(1)含义
①放热反应:__________的化学反应。
②吸热反应:__________的化学反应。
(2)实例
①放热反应
a.镁条、铝片与盐酸的反应;
b.木炭、氢气、甲烷等在氧气中的燃烧;
c.氢气与氯气的化合。
释放热量
吸收热量
②吸热反应
a.氢氧化钡与氯化铵的反应;
b.盐酸与碳酸氢钠的反应;
c.灼热的炭与二氧化碳的反应。
二、化学键与化学反应中能量变化的关系
1.化学反应中能量变化的本质原因
(1)原因
吸收能量
放出能量
(2)实例
2.多角度分析化学反应的能量变化
分析角度 放热反应 吸热反应
微观 断键吸收的热量______成键放出的热量 断键吸收的热量______成键放出的热量
宏观 反应物的总能量______生成物的总能量 反应物的总能量______生成物的总能量
小于
大于
大于
小于
三、人类对能源的利用
1.利用的三个阶段
2.化石燃料利用过程中亟待解决的两方面问题
(1)其短期内不可再生,储量有限;
(2)煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
3.在燃料利用过程中,节能的主要环节
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能量利用率。
4.新能源
(1)特点:资源丰富、________________________。
(2)人们比较关注的新能源:______能、____能、地热能、海洋能和____能等。
可以再生,对环境无污染
太阳
风
氢
四、能源的多角度分类
分类依据 种类 举例
来源 来自太阳辐射的能量 太阳能、煤、石油、天然气、生物质能、风能
来自地球内部的能量 地热能、核能、水能
来自天体的引力能量 潮汐能
转换过程 一次能源 太阳能、煤、石油、天然气、生物质能、风能
二次能源 石油制品、煤气、电能
分类依据 种类 举例
利用历史 化石燃料 煤、石油、天然气
新能源 太阳能、风能、地热能、核能、氢能、生物质能
性质 可再生能源 太阳能、风能、水能、生物质能
不可再生能源 煤、石油、天然气、核能
应用体验
1.新能源的开发利用是人类社会可持续发展的重要课题。下列属于新能源的是( )
A.氢气 B.煤炭
C.天然气 D.风能
AD
2.下列变化过程符合如图所示能量变化的是( )
A.煅烧石灰石
B.水蒸气冷凝
C.烧碱固体溶于水
D.双氧水中加入少量二氧化锰
解析:根据图知该过程吸收能量,煅烧石灰石的过程吸收能量,A项正确;相同质量的物质具有的能量:水蒸气>水>冰,水蒸气冷凝放出能量,B项错误;烧碱固体溶于水放出能量,C项错误;双氧水分解生成H2O和O2,该过程放出能量,D项错误。
A
3.“节能和寻找清洁的新能源成为人类的必然选择。”下列说法不正确的是( )
A.化石燃料在短期内不可再生且其燃料会产生大气污染物,迫使人类节能和寻找新能源
B.提高燃料的燃烧效率是节能的措施之一
C.促进能源循环利用,有效提高能量利用率可达到节能的目的
D.太阳能、天然气、地热能、海洋能等都属于新能源
解析:天然气、煤、石油属于化石燃料,是不可再生的,不属于新能源,故D项错误。
D
要点归纳
知识点?
1.做实验时,吸热反应和放热反应都用到酒精灯,怎样判断该反应是吸热反应还是放热反应?放热反应加热的目的是什么?
提示:持续用酒精灯加热,撤掉酒精灯反应就停止的反应一般是吸热反应;开始用酒精灯加热,反应开始后,撤去酒精灯仍能继续反应的一般是放热反应。放热反应加热的目的一般是引发反应或加快反应速率。
放热反应与吸热反应的理解
问题探究
2.放热反应一定容易发生,吸热反应一定难发生吗?
提示:不一定。反应放热和吸热与反应的条件无关,有些放热反应必须加热才能发生,如木炭的燃烧;而有些吸热反应常温下就能发生,如Ba(OH)2·8H2O与NH4Cl的反应。
1.放热反应与吸热反应的比较
知识归纳总结
放热反应 吸热反应
定义 释放热量的化学反应 吸收热量的化学反应
形成 原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
与化学键强弱的关 系 生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
2.常见的放热反应和吸热反应
3.放热反应和吸热反应的判断方法
(1)根据反应物和生成物的总能量大小判断。
反应物的总能量大于生成物的总能量的反应为放热反应,反之为吸热反应。
(2)根据化学键断裂和形成时能量变化大小关系判断。
破坏反应物中化学键吸收的能量大于形成生成物中化学键放出的能量的反应为吸热反应,反之为放热反应。
(3)根据经验规律判断。
用常见吸热和放热的反应类型来判断。
4.化学反应遵循的两条基本规律
(1)质量守恒定律:自然界的物质发生转化时,总质量保持不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式的能量,但体系包含的总能量不变。
某反应的能量变化如图所示。则有关该反应的叙述正确的是( )
A.是吸热反应
B.生成物比反应物稳定
C.该反应一定是氧化还原反应
D.向外界放出的热量为(E2-E3)
典例1
典例剖析
B
解析:该反应的反应物能量高于生成物,是放热反应,故A错误;生成物能量低于反应物,所以生成物比反应物稳定,故B正确;该反应不一定是氧化还原反应,故C错误;向外界放出的热量为(E1-E3),故D错误。
1.对放热反应:A+B===C+D,以下说法一定正确的是(EA、EB、EC、ED分别表示物质A、B、C、D所具有的能量)( )
A.EA+EB>EC+ED
B.EA>EB+EC
C.EA>EB
D.EA+EB
A
素养应用
知识点?
利用化学键计算化学反应中的能量变化
问题探究
2.如图是1 mol氢气燃烧的能量变化图,试分析a、b表示的含义。
提示:化学反应发生时首先断裂反应物中的化学键,再形成生成物中的化学键,故a表示破坏1 mol H—H键、0.5 mol O===O键所吸收的能量,b表示形成2 mol H—O键所放出的能量。
1.化学键与能量变化的关系
知识归纳总结
根据如图所示的信息,下列叙述错误的是( )
典例2
典例剖析
B
解析:A项,对同一种化学键来说,断裂时吸收的能量与形成时放出的能量相等,正确;B项,H2在O2中燃烧为放热反应,错误;C项,ΔQ=Q(吸)-Q(放)=(436 kJ+249 kJ)-905 kJ=-220 kJ,说明该反应释放出220 kJ能量,正确;D项,放热反应的反应物总能量大于生成物总能量,正确。
2.SF6气体已有百年历史,它是法国两位化学家Moissan和Lebeau于1900年合成的人造惰性气体。六氟化硫具有良好的电气绝缘性能及优异的灭弧性能,国际上称为“气体绝缘开关设备”。SF6分子结构中只存在S—F键。已知:1 mol S(固体)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。
则S(s)+3F2(g)===SF6(g)(已知s表示固体,g表示气体)的能量变化为( )
A.放出1 780 kJ的能量
B.放出1 220 kJ的能量
C.放出450 kJ的能量
D.吸收430 kJ的能量
B
素养应用
解析:由题意得1 mol S(s)和3 mol F2(g)形成S原子和F原子共需要吸收能量=280 kJ+3×160 kJ=760 kJ,而生成1 mol SF6气体时需形成6 mol S—F键,共放出能量:6×330 kJ=1 980 kJ,因此该反应共放出的能量为1 980 kJ-760 kJ=1 220 kJ。
(5)已知H2和O2反应放热,且断开1 mol H—H键、1 mol O===O键、1 mol O—H键需吸收的能量分别为Q1 kJ、Q2 kJ、Q3 kJ,由此可以推知下列关系正确的是____(填编号)。
①Q1+Q2>Q3 ②Q1+Q2>2Q3
③2Q1+Q2<4Q3 ④2Q|+Q2<2Q3
③
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
